Botanical Research
Vol.06 No.06(2017), Article ID:22630,8
pages
10.12677/BR.2017.66050
Identification and Control of Neurospora crassa Causing High Rate of Pollution in Tissue Culture of Rubber Tree
Ting Guo1, Danqi Zeng1, Chaorong Tang2, Jing Cheng2, Yunxia Qin2*
1Institute of Tropical Agriculture and Forestry, Hainan University, Haikou Hainan
2Ministry of Agriculture Key Laboratory of Biology and Genetic Resources of Rubber Tree, Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Danzhou Hainan
Received: Oct. 19th, 2017; accepted: Nov. 2nd, 2017; published: Nov. 10th, 2017

ABSTRACT
Tissue culture technology is a major skill in fast promotion of new cultivars of rubber tree. However, fungi contamination has been a main cause which wasted more money in amount of seedling production. In this study, a fungus was identified as a super pollutant agent which rendered high rate of pollution in tissue culture of rubber tree. After morphology and molecular identification analysis, this fungus was confirmed to be Neurospora crassa, (N. crassa, for short). N. crassa was a highly aerobic fungi, grew fast and produced a large amount of spores, therefore fastened pollution in culture room. It rose to be an urgent issue to seek efficient fungicide. Here, six fungicides were compared with their abilities of inhibiting growth of N. crassa with indoor growth rate analysis. The independent regression equation and the EC50 value of inhibitory concentration were obtained. The results showed that 40% Fuxing EC had the best inhibitory effect on N. crassa, with the lowest EC50, followed by 70% Thiophanate-Methylwettable powder, 50% Rovral fluttering wettable powder, 99% hymexazol wettable Powder and 50% sodium sulfonate wettable powder with moderate effects. Unexpectedly, 50% carbendazim wettable powder was invalid at all. The survival rate of contaminated rubber seedlings was up to 94% after treated with 500 times diluted solution of sodium sulfonate.
Keywords:Neurospora crassa, Tissue Culture, Contamination, Pharmacy Screening
橡胶苗组培生产中一种污染菌粗糙脉孢霉的 鉴定及防治
郭婷1,曾丹琦1,唐朝荣2,成镜2,秦云霞2*
1海南大学热带农林学院,海南 海口
2中国热带农业科学院橡胶研究所,农业部橡胶树生物学与遗传资源利用重点实验室,海南 儋州
收稿日期:2017年10月19日;录用日期:2017年11月2日;发布日期:2017年11月10日

摘 要
组培技术应用是加快推广橡胶树良种化育苗的技术革命,具有显著降低育苗成本和改良橡胶树农艺性状等优点。然而,组培生产过程中杂菌污染是造成生产成本高的主要原因之一。本研究通过形态学和分子鉴定,发现在橡胶树组织培养生产中一种具有超强污染能力菌是粗糙脉孢霉。该真菌是一种很强的好氧菌,孢子萌发和菌丝生长速度极快,产孢能力强可以借助空气的传播,迅速扩大污染率,因而迫切需要筛选快速杀死它的菌剂。我们采用室内生长速率法测定了六种农药对粗糙脉孢霉的毒力,得到相关的独立回归方程及抑制中浓度。结果表明,40%福星乳油对粗糙脉孢霉菌的抑制效果最好,其EC50最小;其次为70%甲基托布津可湿性粉剂;50%扑海因可湿性粉剂,99%恶霉灵可湿性粉剂,50%敌磺钠可湿性粉剂对其的杀菌效果均一般,50%多菌灵可湿性粉剂无效。我们用500倍的敌磺钠处理污染橡胶苗后,发现挽救成功率可达94%。
关键词 :粗糙脉孢霉,组织培养,污染,药剂筛选

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
近年来,植物组织培养技术在提高农作物产量、培育农作物新品种等方面都具有广阔的应用前景 [1] [2] 。据不完全统计,橡胶树自根无性系组培苗比芽接苗生长速度快10%~20%,抗风能力强,具有再一次提高产量10%~30%的潜力,所以是橡胶生产种植材料上的一次革命 [3] 。然而,由于该技术自身的一些特点又使它的应用受到了限制,其中培养材料易被污染是该技术面临的重要问题之一 [4] 。培养材料被污染后会导致:1) 生产成本大幅度提高;2) 对植株造成伤害;3) 增加种植风险。正确识别组织培养中污染源,掌握防治污染的方法是组培中的关键 [5] ,所以应寻找稳定、能耐高温高压的抑菌剂,或有效杀菌剂以减少组培中的污染源,才能降低成本和提高经济效益 [6] 。本文作者通过收集污染平板和污染的试管苗,根据表型及外观分类,将一些污染严重的污染源进行分离培养和tef1序列分子鉴定,发现粗糙脉孢霉是一种超强的污染源 [7] ,它严重影响了橡胶苗的生长和快繁,造成人力物力浪费。为寻找防除粗糙脉孢霉的有效方法,我们采用室内生长速率法测定了多种农药对粗糙脉孢霉的毒力并且进行相关的结果分析,为该污染源的综合防治提供了依据。
扑海因、甲基托布津和恶霉灵等具有低廉的价格和广谱的杀菌效果,是安全、低毒无残留的绿色环保杀菌剂,成为防治多种农作物病害的首选药剂。薛应钰等研究发现4种杀菌单剂对镰刀菌的EC50由低到高依次为40%福星乳油、70%甲基托布津可湿性粉剂、50%扑海因可湿性粉剂、50%多菌灵可湿性粉剂,以40%福星乳油的抑制作用最好 [8] ;刘钊等研究表明不同稀释倍数的多菌灵对链孢霉菌丝体生长均有抑菌作用 [9] ;恶霉灵对各种植物土传病害如腐霉菌,镰刀菌和根壳菌等都有明显高于其它杀菌剂的防治效果 [10] 。然而,国内有关橡胶树组培苗粗糙脉孢霉的室内药剂毒力测定报导甚少,本研究为了能够寻找到更高效、安全、低成本的橡胶树组培苗粗糙脉孢霉的防治药剂,我们测定了6种杀菌剂原药对橡胶树组培苗粗糙脉孢霉的室内毒力,了解不同杀菌剂对粗糙脉孢霉的敏感性,分析不同药剂浓度对菌株菌落生长速度的影响,以便为生产上更好地预防、防治该病害提供科学的理论依据 [11] 。
2. 试验材料和方法
2.1. 试验材料
70%甲基托布津(Thiophanate-methyl) [12] 可湿性粉剂(西安喷得绿农化有限公司生产)、50%扑海因(RovraL) [13] 可湿性粉剂(安万特作物科学公司生产)、50%多菌灵(Carbendazim)可湿性粉剂(山东华阳科技股份有限公司生产)、40%福星乳油(Fuxing EC) (上海农乐生物制品有限公司生产)、恶霉灵(hymexazol) (吉林省延边西爱斯开化学农药厂生产)和敌磺钠 [14] (Sodium sulfonate) (山东华齐生物科技有限公司)。
粗糙脉孢霉是我们从污染的平板上分离并进行形态和测序鉴定。污染平板及污染的热研73397自根无性系的组培试管苗来自于本单位组培苗生产工作室。
2.2. 试验方法
2.2.1. 真菌基因组DNA提取方法及ITS序列扩增
除了进行形态鉴定外,我们克隆所分离污染菌的tef1序列,系统进化分析从而鉴定其类别。以CTAB法提取病菌的基因组DNA,以真菌通用引物Ef728 (5'-CATCGAGAAGTTCGAGAAGG-3')和Tefla (5'-GCCATCCTTGGGAGATACCAGC-3')为引物进行PCR扩增。经过PCR产物回收、连接、转化及菌落PCR鉴定后送公司测序。登录NCBI,将所得序列进行序列相似性比对,并下载相应基因序列,用Clusta lX软件进行对位排列,构建分子系统树。
2.2.2. 菌液制备
取经28℃培养4天的粗糙脉孢霉,加5 ml无菌水洗下霉菌孢子,依次10倍稀释为10−3,使孢子数约为103个/ml。
2.2.3. 六种杀菌单剂不同浓度对粗糙脉孢霉的毒力影响
先将供试杀菌剂50%多菌灵可湿性粉剂稀释成250、400、500倍液,50%扑海因可湿性粉剂稀释成1000、1200、1500倍液,70%甲基托布津可湿性粉剂稀释成5000、10,000、20,000倍液,40%福星乳油稀释成20,000、40,000、60,000和80,000倍液,恶霉灵可湿性粉剂稀释成3000、3500、4000倍液,敌磺钠可湿性粉剂稀释成500、800、1000倍液。待培养基高压蒸汽灭菌(121℃,20分钟)后,分别用移液管吸取不同浓度的药液10 ml注入50 ml培养基(1/2孟加拉红培养基 + 1/2PDA)中,得到60 ml带药培养基溶液,将其立即趁热摇匀,倒入直径为7.5 cm的灭菌培养皿中,每皿倒入的培养基药液不宜太多,使其形成薄厚均匀的带药培养基平板,然后重复以上做法依次制备6种杀菌单剂不同浓度的培养基,每个浓度3次重复,同时以无菌水代替农药设一个对照。在无菌条件下,将平板培养的供试菌种用直径为8 mm的灭菌枪头打取菌饼,然后将菌饼用接种针接入带药的培养基与对照不带药培养基正中央(菌丝面向下,紧贴在培养基上面),每个培养皿放菌饼1个,置于28℃的恒温箱内培养。培养72 h后用十字交叉法测量菌落直径,每一个水平取菌落直径(mm)的平均值,分析比较不同杀菌剂对粗糙脉孢霉的抑菌效果 [15] 。同时计算供试药剂不同浓度对粗糙脉孢霉的抑制率,求回归方程和EC50。
计算公式如下:
以农药浓度取以10为底的对数为横坐标,通过查生物统计机率值换算表,以各个浓度时抑制率对应的几率值作为纵坐标,求出每个试验浓度的回归方程和相关系数R和EC50值。
2.2.4. 六种杀菌单剂的抑菌作用
抑菌效果的评价方法有两种:一是测量真菌菌丝生长速度受抑制率来判断;二是取0.1 ml稀释好的浓度为103个/ml分生孢子稀释液加入抑菌培养基平皿中,涂板,于28℃培养,第2~3天观察和统计孢子萌发生长情况。
2.2.5. 污染的组培橡胶苗处理方法
为了考察敌磺钠农药处理是否能够挽救被污染的橡胶组培苗,分别于2017年7月和2017年8月处理两次。我们选用生长势相对一致的被污染的热研73397橡胶组培苗100株于同一时间进行了敌磺钠处理试验。处理组每一个试管内加入500稀释倍液敌磺钠10 ml,对照组的每一个试管内加入等量不添加敌磺钠的ddH2O。16 h后将组培苗的菌液接种于1/2孟加拉红培养基+1/2PDA培养基,24 h后观察培养基中病菌及橡胶苗的存活情况,试验结果为两次平均值。
3. 结果与分析
3.1. 粗糙脉孢霉棉兰染色的显微观察结果
通过棉兰染色的方法,在显微镜下我们观察得到粗糙脉孢霉的菌丝体分支成网状,菌丝内有隔、多核;分生孢子梗直接从菌丝上长出,与菌丝无明显差异,梗顶端形成分生孢子。分生孢子卵形或近球形,成串悬挂在气生菌丝上,呈橘红色 [16] (图1)。将粗糙脉孢霉分生孢子大小在放大400倍下,平均长度分别为8.0~8.2微米。

Figure 1. Effects of Neurospora crassa on Rubber Seedlings and morphology of Neurospora crassa with cotton blue stain. (a) Seedlings polluted or not by Neurospora crassa; (b) Morphology of Neurospora crassa stained by cotton blue, bar = 10 μm, 400 times
图1. 粗糙脉孢霉影响橡胶苗生长及用棉兰染色显示粗糙脉孢霉形态特征。(a) 污染和没有污染粗糙脉孢霉的橡胶苗生长对比情况;(b) 用棉兰染色显示粗糙脉孢霉形态特征bar = 10 μm,放大400倍
3.2. 分离及鉴定橡胶树组培的超强污染源
根据污染源出现的频率和污染源在培养基上的表型,挑取了感染力最强的污染源进行分离接种,命名为Y。它的tef1扩增片段大小约为581 bp,利用NCBI blast进行序列比较,发现序列相似性为98%~100%。下载同源基因的fasta序列,利用软件ClustaX (1.81版本)进行序列比对分析,采用Neighbor-Joining方法进行聚类分析,进行1000次bootstrap统计学检验(图2),得到结果。Y与Neurospora crassa粗糙脉孢霉归为一类。
3.3. 粗糙脉孢霉温度及PH适应特性
已有的报道表明粗糙脉孢霉菌丝在4℃~44℃均能生长,25℃~36℃生长最快,4℃以下停止生长,4℃~24℃生长缓慢。我们的试验结果表明在31℃~40℃条件下,粗糙脉孢霉菌只需8小时菌丝就能长满整个平板,65℃以上菌丝和分生孢子停止生长。孢子在15℃~30℃萌发率最高,低于10℃萌发率低。粗糙脉孢霉培养基的pH = 3~9范围内都能生长,最适为pH = 5~7.5。在1/2孟加拉红+1/2PDA混合培养基上粗糙脉孢霉能迅速生长,且pH较高有利于粗糙脉孢霉生长。由此可见,粗糙脉孢霉菌是在夏季组培生产中需要严防的一个污染菌。
3.4. 六种单剂杀菌剂对粗糙脉孢霉的毒力影响
对粗糙脉孢霉抑制作用的测定结果(表1)表明,40%福星乳油对粗糙脉孢霉菌有较好的抑制效果,其 EC50最小,为0.0064 μg/ml;其次为70%甲基托布津可湿性粉剂,EC50值为0.0316 μg/ml;99%恶霉灵可湿性粉剂和50%扑海因可湿性粉剂的EC50值分别为0.3544、0.7247 μg/ml,50%敌磺钠可湿性粉剂的杀菌效果杀菌效果一般;50%多菌灵可湿性粉剂无效。实验结果表明,在稀释20,000~80,000倍的福星乳油平板上,粗糙脉孢霉生长显著被抑制,80000倍时才能缓慢生长(图3(a));而在添加有50%多菌灵可湿性粉剂的平板上,粗糙脉孢霉菌丝生长比不加多菌灵的对照平板生长的还要好,因此该菌剂对其无效(图3(b));粗糙脉孢霉在稀释500倍的敌磺钠平板上不能存活(图3(c))。
Table 1. The toxicity of 6 kinds of single-agent fungicides on the Neurospora crassa
表1. 6种单剂杀菌剂对粗糙脉孢霉的毒力测定结果
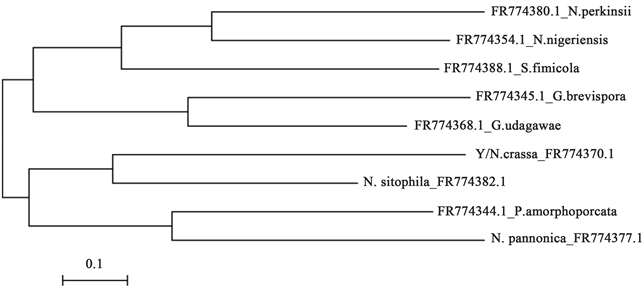 N. perkinsii FR774380.1脉络膜孢霉;N. nigeriensis FR774354.1为黑夜孢霉;N. fimicola FR774388.1为脉孢链霉菌;G. brevispora FR774345.1麻孢壳霉;G. udagawae FR774368.1为宇田川麻孢菌;N. crassa FR774370.1为粗糙脉孢霉;N. sitophila FR774382.1为好食脉孢菌;P. amorphoporcata FR774344.1为假单孢菌;N. pannonica FR774377.1为脉孢霉
N. perkinsii FR774380.1脉络膜孢霉;N. nigeriensis FR774354.1为黑夜孢霉;N. fimicola FR774388.1为脉孢链霉菌;G. brevispora FR774345.1麻孢壳霉;G. udagawae FR774368.1为宇田川麻孢菌;N. crassa FR774370.1为粗糙脉孢霉;N. sitophila FR774382.1为好食脉孢菌;P. amorphoporcata FR774344.1为假单孢菌;N. pannonica FR774377.1为脉孢霉
Figure 2. Minimum evolution tree based on tef1 sequence
图2. 所分离菌株Y的最小进化分析,根据tef1基因序列信息构建

Figure 3. Effect of fungicides on the growth of Neurospora crassa. (a) Effect of different Fuxing EC on growth of N. crassa with 20,000 - 80,000 times of diluted solution; (b) No effect of Carbendazim on growth of N. crassa; (c) Effect of Fenaminosulf on growth of N. crassa with 500 - 1000 times of diluted solution
图3. 多种杀菌剂对粗糙脉孢霉的抑制作用。(a) 稀释20,000~80,000倍的福星乳油对粗糙脉孢霉生长的影响;(b) 多菌灵可湿性粉剂对粗糙脉孢霉生长无影响;(c) 稀释500~1000倍的敌磺钠对粗糙脉孢霉生长的影响
3.5. 敌磺钠农药处理被污染的橡胶组培苗情况
选用污染的热研7-33-97组培试管苗于同一时间按照方法2.2.5所述用敌磺钠处理,16 h后将组培苗的菌液接种于1/2孟加拉红培养基+1/2PDA培养基,培养24 h后统计结果如表2所示。经过500倍稀释敌磺钠处理后,敌磺钠对粗糙脉孢霉的致死率达到94% (表2),少数(6%)没有死,究其原因可能在于因为个别污染试管苗污染严重,菌孢子量过于多,相对处理时间还不够长引起的。
4. 结论和讨论
本文通过形态学和分子生物学方法鉴定得出:粗糙脉孢霉是热带地区橡胶树组织培养过程中遇到的一种超强新污染源。虽然该菌温度适应性广 [17] ,生活力强、分生孢子多、易传播又具有广泛的酸碱适应性(pH3-9),尤其适应是高温环境,因而该菌是橡胶树组培中需要特别小心的污染菌。
Table 2. Results of polluted tissue culture seedlings treated by 500 times dilluted solution of sodium sulfonate
表 2. 污染组培苗用500倍液敌磺钠处理后结果
注:试验重复两次,数据为两次结果平均值
另外,毒力测定是室内快速分析不同杀菌剂对靶标病原菌抑菌活性的主要方法。本文通过对六种常用杀菌剂对粗糙脉孢霉的毒力测定分析,筛选最有效的防治药剂。本研究结果表明,除了多菌灵外、扑海因、甲基托布津、福星乳油、恶霉灵和敌磺钠五种杀菌剂对粗糙脉孢霉均有一定的抑制作用,但不同杀菌剂之间的抑制作用存在明显差异。5种杀菌剂对粗糙脉孢霉的毒力大小顺序为:40%福星乳油 > 70%甲基托布津可湿性粉剂 > 99%恶霉灵可湿性粉剂 > 50%扑海因可湿性粉剂 > 50%敌磺钠可湿性粉剂,其中70%甲基托布津可湿性粉剂5000倍稀释液平板培养基中已基本上无粗糙脉孢霉菌落长出,并且在价格上70%甲基托布津可湿性粉剂比40%福星乳油便宜,因此,在实际的橡胶苗生产中,用化学药剂防治粗糙脉孢霉时,在5种杀菌剂中首选药剂为70%甲基托布津可湿性粉剂。另外,我们在用敌磺钠处理污染橡胶苗的实验中发现,在实际生产中,用70%甲基托布津可湿性粉剂辅以50%敌磺钠可湿性粉剂处理粗糙脉孢霉可以达到良好的效果。
由于粗糙脉孢霉特殊的分子生物学特性如生活周期短,主要靠气流传播,扩散蔓延快,传播力极强 [7] ,氧气充足时,其分生孢子形成更快,又耐高温,因而是高温季节发生的重要杂菌。7~8月是其盛发高峰期,一旦污染,对橡胶苗具有致病性和毁灭性。因此橡胶树组培苗生产中不容忽视,需要加强监测和巡视,一旦发现及时处理。同时我们可以依据其生物学特性更加有的放矢地改进生产中的操作方法比如严格执行无菌操作,定期用甲醛及高锰酸钾熏蒸对组织培养室进行消毒;利用粗糙脉孢霉需氧的特性,用土埋法制造厌氧环境,快速处理被粗糙脉孢霉严重污染的材料。另外,利用福星乳油对幼嫩的材料生长不会有影响的特征,在发现污染的初期,可以直接用福星乳油20,000倍处理。利用多种农药的搭配使用,增加防治效果。总之,在实际生产中,我们要合理地利用有效的方法,因地制宜、因时制宜,才能达到预期的防除效果。
基金项目
该研究得到海南省自然科学基金项目(20153213)的支持,国家橡胶树种质资源圃提供材料。
文章引用
郭 婷,曾丹琦,唐朝荣,成 镜,秦云霞. 橡胶苗组培生产中一种污染菌粗糙脉孢霉的鉴定及防治
Identification and Control of Neurospora crassa Causing High Rate of Pollution in Tissue Culture of Rubber Tree[J]. 植物学研究, 2017, 06(06): 385-392. http://dx.doi.org/10.12677/BR.2017.66050
参考文献 (References)
- 1. 郭龙芳, 薛福东, 郭九峰, 那日. 植物组织培养: 最新进展和潜在的应用(英文) [J]. Agricultural Science & amp Technology, 2014, 15(12): 2088-2095, 2099.
- 2. 汤雪燕, 赵统利, 邵小斌, 朱朋波, 刘兴满, 孙明伟, 徐燕. 植物组织培养的污染防治[J]. 江苏农业科学, 2014, 42(1): 50-52.
- 3. “试管橡胶苗”攻克世界难题橡胶组培苗有望产业化生产[J]. 中国西部科技, 2011, 10(33): 69.
- 4. 黄作喜, 邱超, 曾桢迦, 植爽, 张杨, 李芳. 植物组织培养中消毒剂的应用研究进展[J]. 内江师范学院学报, 2013, 28(6): 26-30.
- 5. 杨国泰, 李亮, 张冬敏, 钟凤林. 克服植物组织培养中内生菌污染的研究[J]. 中国园艺文摘, 2011, 27(12): 180-182.
- 6. 周俊辉, 周厚高, 刘花全. 植物组织培养中的内生细菌污染问题[J]. 广西植物, 2003(1): 41-47.
- 7. 朱富春. 食用菌链孢霉的发生特点、原因与综合防治方法[J]. 食药用菌, 2013, 21(2): 126-128.
- 8. 薛应钰, 徐秉良, 齐旭先. 6种杀菌剂对镰刀菌的室内毒力测定[J]. 甘肃农业科技, 2006(8): 34-36.
- 9. 刘钊, 邹乐, 秦秀丽. 链孢霉抑菌效果试验研究[J]. 中国园艺文摘, 2017, 33(7): 9-11, 22.
- 10. 贺春萍, 李锐, 吴伟怀, 吴海理, 郑肖兰, 梁艳琼, 郑金龙, 易克贤, 习金根. 10种杀菌剂对橡胶树白根病菌的毒力测定[J]. 热带农业科学, 2016, 36(2): 69-72.
- 11. 蔡志英, 李加智, 王进强, 张春霞, 何明霞, 贺丽琼. 橡胶胶孢炭疽菌和尖孢炭疽菌对杀菌剂的敏感性测定[J]. 云南农业大学学报, 2008(6): 787-790.
- 12. 孟昭赫. 介绍一种新的杀菌剂——扑海因(RovraL) [J]. 国外医学(卫生学分册), 1986(2): 89-90.
- 13. 应荣, 崔海峰, 倪方群, 俞晓平, 叶子弘. 杀菌剂敌磺钠及植物生长调节剂对茭白孕茭的影响[J]. 植物生理学报, 2014, 50(7): 946-952.
- 14. 曹雪梅. 甘草根腐病病原学研究及室内药剂筛选[D]: [硕士学位论文]. 咸阳: 西北农林科技大学, 2013.
- 15. 辛颖. 食用菌链孢霉发生与防治[J]. 西北园艺(蔬菜), 2016(2): 36-37.
- 16. 史磊. 食用菌链孢霉防治[J]. 中国林副特产, 2010(3): 74-75.
- 17. 张艳国. 链孢霉土埋防治法[J]. 河北农业科技, 2002(3): 21.
NOTES
*通讯作者。
