Advances in Microbiology
Vol.
09
No.
03
(
2020
), Article ID:
37623
,
11
pages
10.12677/AMB.2020.93017
多粘类芽孢杆菌绿色制备纳米银及其 抑菌活性
范月圆,唐晨,季逸,马骥昌,褚衍亮*
江苏科技大学,生物技术学院,江苏 镇江

收稿日期:2020年8月19日;录用日期:2020年9月9日;发布日期:2020年9月16日

摘要
本文利用一株桑叶内生菌——多粘类芽孢杆菌381的无细胞发酵液进行纳米银的胞外合成。微生物合成的纳米银溶液呈现红棕色,紫外全波长扫描结果显示在418 nm处有典型吸收峰。对纳米银合成的条件进行优选,结果表明,以内生菌株的LB培养液为还原剂和稳定剂,在与0.01 M硝酸银溶液以1:1体积比条件下37℃避光反应72 h,可以获得分散性良好的纳米银颗粒溶液。偏碱性条件有利于菌株发酵液还原制备纳米银,以pH 9时效果最好。平板打孔法实验表明,纳米银溶液随剂量增加,对桑青枯菌和金黄色葡萄球菌的抑制作用均可增强,但对桑疫病菌的抑制效果不明显。液体培养法表明,合成的纳米银溶液对两株病原菌的最小抑菌浓度分别为50和30 ug/mL。
关键词
内生菌,多粘类芽孢杆菌,纳米银,生物合成,抑菌作用
Green Preparation of Silver Nanoparticles by Paenibacillus polymyxa 381 and its Antibacterial Activity
Yueyuan Fan, Chen Tang, Yi Ji, Jichang Ma, Yanliang Chu*
College of Biotechnology, Jiangsu University of Science and Technology, Zhenjiang Jiangsu

Received: Aug. 19th, 2020; accepted: Sep. 9th, 2020; published: Sep. 16th, 2020

ABSTRACT
In this paper, the extracellular synthesis of silver nanoparticles was carried out in a cell-free fermentation broth of an endophyte of mulberry leaves, Paenibacillus polymyxa 381. The silver nanoparticles solution synthesized by microorganism showed a reddish brown color, and the ultraviolet full-wavelength scanning results showed a typical absorption peak at 418 nm. The conditions for the synthesis of silver nanoparticles were optimized, and the results showed that using the LB culture broth of the inoculant strain as reduced agent and stabilizer, the silver nanoparticles with good dispersion could be obtained by reacting with silver nitrate solution at a 1:1 volume ratio at 37˚C for 72 h. The alkaline condition was favorable for the preparation of silver nanoparticles with the fermentation broth, with the best effect at pH9. The experimental results showed that the inhibition effect of nano silver solution on Ralstonia solanacearum and Staphylococcus aureus could be enhanced with the increase of the dose, but the inhibition effect on Pseudomonas syringae pv. mori was not obvious. The liquid culture method showed that the minimum inhibitory concentration of the synthesized silver nanoparticles to the two pathogens was 50 and 30 ug/mL respectively.
Keywords:Endophytic Bacteria, Paenibacillus polymyxa 381, Silver Nanoparticles, Biosynthesis, Bacteriostasis

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
细菌耐药性是疾病预防与治疗中面临的重大问题之一。经典抗生素作用范围和效果的持续缩小与减弱促使科学家不断探究新的抗菌药物,因此以纳米银为代表的无机抗菌制剂又一次引起学者们的广泛关注 [1] [2] [3]。纳米颗粒(silver nanoparticles, AgNPs)是指单维尺度在1~100 nm范围内的颗粒 [4] [5],具有很高的表面积与体积比,有良好的小尺寸效应与隧道效应 [6] [7],被广泛应用于生物抗菌领域 [8] [9]、生物传感器 [10]、环保材料制备及水污染物处理 [7] [11] [12] 等领域,是当前纳米技术的重要发展方向之一。纳米颗粒的制备有物理、化学及生物还原法,前两种方法需要高温、高压条件或使用有毒性的还原剂、稳定剂,具有生产能耗高及毒性试剂残留等缺点,生产的纳米颗粒易产生团聚导致分散性不好 [13] [14]。采用生物方法,尤其是微生物进行金属离子的还原而制备纳米金属颗粒,其合成过程以生物体自身的代谢产物为还原剂,在常温下即可完成,合成的纳米颗粒可与某些生物分子结合从而具有良好的稳定性和分散性,因此逐渐受到学者们的重视 [11] [12] [13] [14]。研究发现,采用生物学方法制备的纳米银颗粒具有良好的分散均一性,具有抗菌、抗肿瘤及抗氧化等多种生物活性,其对病原菌的抑制效果优于银块状金属,且不易产生抗药性,并且可增幅抗生素的活性作用,在医药领域具有广泛的应用前景 [13] [14] [15] [16]。细菌是最早被用于纳米银合成的微生物 [15]。细菌广泛分布于不同环境,种类多,生长速度快,人工培养条件简单可控,已经成为纳米银合成的重要菌株来源,目前已报道利用土壤、水体及植物内生菌中的大肠杆菌 [17]、希瓦氏菌 [7]、北极副球菌 [18] 及乳酪短杆菌、假单胞杆菌等菌株成功合成纳米银 [11] - [16]。并对纳米银的安全性进行了比较分析 [19]。
类芽孢杆菌广泛分布于自然界多种环境中,是植物微生态的优势种群之一。类芽孢杆菌在生长过程中可产生脂肽、多烯等抗生素物质,还具有很强的蛋白酶、淀粉酶及脂肪酶等活性,在医疗、植物病原菌防治及环境等方面具有很大的应用价值 [20] [21] [22]。本实验室从健康桑叶中分离得到一株内生类芽孢杆菌,经生理生化及分子生物学方法鉴定为多粘类芽孢杆菌,其对桑叶病原菌青枯菌和疫病病原菌M4-13均有一定的抑制作用,植化分析表明其中含有生物碱、黄酮及萜类产物 [23]。初期的筛选结果表明菌株381可以进行纳米银的绿色合成。本文对纳米银生物制备的条件进行研究,并进一步检验合成纳米银的抑菌活性,一方面可丰富内生细菌的生物功能及作用,另一方面也为纳米银的生物合成研究提供参考数据。
2. 材料与方法
2.1. 实验材料
2.1.1. 实验菌株
桑叶内生细菌381由本实验室分离并保存,经分子生物学方法鉴定为多粘类芽孢杆菌Paenibacillus polymyxa 381 [23]。病原细菌:桑青枯菌Ralstonia solanacearum、桑疫病病原菌Pseudomonas syringae pv. Mori M4-13和金黄色葡萄球菌Staphylococcus aureus均为本实验室保存菌株。
2.1.2. 实验仪器与试剂
主要实验仪器:UV9600紫外可见分光光度计(北京瑞丽),(ALLEGRA 64R)高速冷冻离心机(美国贝克曼),DHZ-052D型双层恒温摇床(常州朗越仪器制造有限公司),CXZ智能型光照培养箱(宁波江南仪器厂),UV-2450紫外可见分光光度计(日本岛津),SW-CJ-1F单人双面净化工作台(上海苏达实验仪器有限公司)。
主要试剂:葡萄糖、硝酸银、氢氧化钠、硝酸等为分析纯试剂,琼脂粉、酵母浸膏、胰蛋白胨等为CP级。以上试剂购自国药化学试剂公司。
2.2. 实验方法
2.2.1. 内生细菌的发酵和无菌滤液制备
将多粘类芽孢杆菌381菌株划线接种到马铃薯葡萄糖琼脂固体(PDA)培养基中,35℃培养24 h,无菌水冲洗菌苔,调整菌液OD600为1.0,取0.5 mL菌液接种到无菌的LB液体培养基(不含氯化钠)中,150 rpm,37℃,震荡培养3 d。
无菌体发酵液的制备:取培养3 d的细菌发酵液,在8000 rpm,4℃条件下离心20 min,收集上清液即为无细胞发酵液,保存于4℃冰箱中备用。
2.2.2. 纳米银的生物合成
配置0.01 M的硝酸银水溶液,按一定体积比与制备的无细胞发酵液混合,置于摇床中,在150 rpm,37℃避光条件下震荡反应进行纳米银的生物合成。
2.2.3. 生物合成纳米银的检测
颜色变化:混合溶液反应后,间隔不同时间观测反应溶液的颜色变化,分别以纯无细胞发酵液和硝酸银溶液为对照。
紫外全波长波谱扫描:间隔不同时间取0.5 mL上述混合溶液,加2.0 mL去离子水稀释5倍,用紫外可见光分光光度计在300~800 nm范围内进行波谱扫描,波长间隔1 nm。
2.2.4. 生物合成纳米银的条件选择
菌液与硝酸银溶液的体积比将内生细菌的无细胞上清液,分别与10 mM AgNO3溶液按照1:9、3:7、1:1、7:3和9:1的体积比混合,按照2.2.2中的方法进行纳米银颗粒的合成。反应开始后,每间隔1 h取样进行波谱扫描,取样6次后间隔12 h再取样测定,连续检测72 h,观察反应溶液的特征吸收峰变化。
AgNO3溶液的浓度分别配制2,4,6,8和10 mM的AgNO3溶液,以优选体积比例与无细胞发酵液混合进行纳米银颗粒的合成,反应起始后每间隔12 h进行一次吸收光谱扫描,选择合成纳米银所需的硝酸银浓度。
无细胞发酵液的pH值分别采用2 M的硝酸溶液和氢氧化钠溶液将内生菌株的无细胞上清液的pH值分别调至5,6,7,8,9,再与适当浓度的AgNO3溶液按适合比例混合,从反应起始至结束,每间隔12 h进行一次全波长吸收峰扫描,以确定纳米银生成的适当pH。
2.3. 生物合成纳米银的抑菌活性
平板打孔抑制试验:将青枯菌、桑疫病菌M4-13和金黄色葡萄球菌分别划线接种到PDA平板上,35℃活化培养24 h。以无菌水冲洗培养平板上的菌苔,调整菌液OD600 = 0.6,取0.1 mL菌液,均匀涂布到新的LB (金黄色葡萄球菌和青枯菌)和PDA平板(M4-13)。用直径5.96 mm的打孔器于涂菌平板上均匀打出6个孔,分别吸取10 mM AgNO3溶液20 μL、内生菌无细胞发酵液20 μL,合成的纳米银液20、40、60 μL,以1 mg/mL的氨苄青霉素溶液为阳性对照,在35℃下恒温培养24 h后,测量各孔周围的抑菌圈大小,重复3次,计算抑菌圈的平均值。
最小抑菌浓度测定:离心分离合成的纳米银溶液,低温烘干后得到纳米银粉末,以无菌去离子水分别配置10~100 μg/mL的纳米银溶液,分别接0.5 mL到装有5 mL病原菌LB培养液的试管中,37℃ 150 rpm培养24 h后,观察菌液的浑浊度和生长情况,澄清且无菌生长的试管所对应的最小纳米银添加浓度作为最小抑菌浓度。实验重复3次。
实验结果以Excel进行绘图,数据分析采用SPSS 22.0软件进行。
3. 结果
3.1. 纳米银的生物合成检测
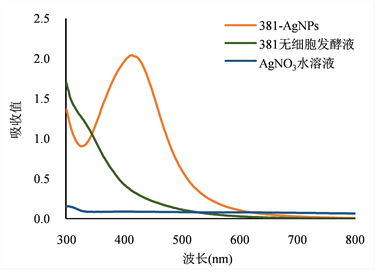
多粘类芽孢杆菌菌株381发酵后制备的无细胞发酵液与10 mM的AgNO3溶液避光反应72 h后,可见混合溶液由初始的浅黄色变为红棕色,全波长光谱扫描结果显示反应后溶液在418 nm有明显的吸收峰,纯硝酸银溶液和无细胞发酵液扫描结果均没有此特征吸收峰(图1(a)和图1(b))。银离子被还原成单质纳米银后,在不同光波频率激发下,纳米银结构可产生专一性的表面等离子体共振效应(surface plasmon resonance, SPR),并对特定频率光波(400~460 nm)有显著吸收,这是纳米银颗粒的典型特征,其峰值与颗粒的密度成正相关,这已经在微生物及植物提取物合成纳米银的实验中被证实 [6] [8] [9] [15] [24] [25] [26]。因此本实验结果表明菌株381可在细胞外进行纳米银颗粒的生物合成。
3.2. 纳米银颗粒生物合成的条件选择
3.2.1. 反应时间对纳米银颗粒合成的影响
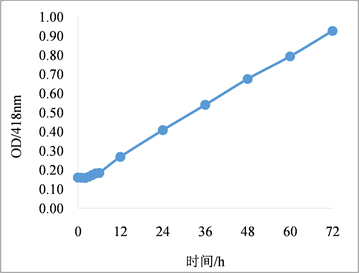
10 mM AgNO3溶液与381菌株的无细胞发酵液按1:1 (v:v)的比例混合后,初期(0~6 h内)溶液并无明显的颜色变化,12 h后反应溶液在450 nm附近开始出现微弱的吸收峰,24 h后扫描吸收峰逐渐偏向短波长(见图2(a)),溶液颜色逐渐加深,但底部无沉淀物生成。72 h后溶液吸收峰稳定在418 nm,表明有纳米银颗粒的持续生成。反应期间典型吸收峰的光吸收值随反应时间延长持续增大(见图2(b)),表明菌液的还原力可在较长时间内保持活性,其中的代谢产物可使纳米颗粒趋向稳定,并能保持良好的分散性,溶液颜色均一。因此选择72 h作为菌株381胞外合成纳米银的反应时间。
 (a)
(a)
 (b)
(b)
Figure 1. UV-Vis spectrum and color change of silver nanoparticles synthesized by Paenibacillus polymyxa 381
图1. 多粘类芽孢杆菌381合成纳米银溶液的吸收光谱及颜色变化
 (a)
(a)
 (b)
(b)
Figure 2. Effects of reaction time on the synthesis of silver nanoparticles. (a) UV-Vis spectrum of AgNPs at different reaction time; (b) absorbance value at 418 nm
图2. 反应时间对纳米银生成的影响。(a) 不同反应时间的吸收光谱;(b) 418 nm的光吸收值变化
3.2.2. 混合体积比对纳米银合成的影响
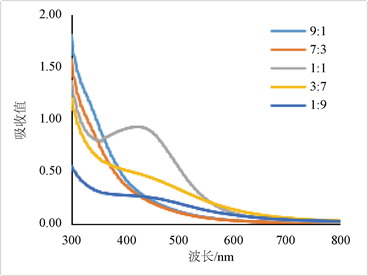
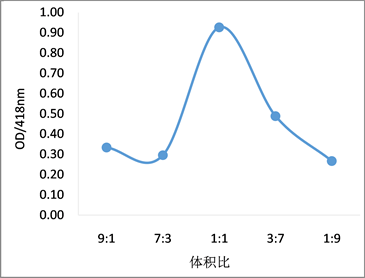
将381菌株的无细胞发酵液分别与10 mM AgNO3溶液按不同的比例混合,反应72 h,对反应溶液的全波长扫描结果见图3(a)。菌液增多,硝酸银含量过少,纳米银的生产量少,无明显吸收峰。硝酸银过多,菌液的还原力不足,纳米银的生成量也少,典型吸收峰降低(见图3(b))。当菌液和硝酸银比例在1:1时,纳米银的合成效率最好,反应72 h后吸收值达到最大,明显好于其他比例条件,因此选择1:1作为后续实验配比。
3.2.3. 硝酸银浓度对纳米银颗粒合成的影响
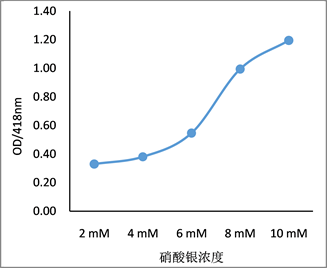
381菌株的无细胞发酵液分别与2~10 mM的硝酸银溶液按1:1比例混合,反应72 h后,反应溶液的吸收光谱结果见图4。硝酸银作为银离子供体,在浓度较低(2~4 mM)时,溶液基本没有吸收峰,当银离子浓度增加到6 mM后,特征吸收峰开始出现,OD418也随银离子浓度升高而明显增大,在10 mM时达到最高值(图4(a)和图4(b))。但在浓度为8 mM时,溶液在560 nm附近出现第二个吸收峰,表明生成的纳米颗粒粒径不均一,可能是由于某些菌液成分导致部分纳米银颗粒团聚,颗粒变大进而其吸收峰红移。硝酸银浓度再增大,菌液成分更多参与到纳米颗粒的生成反应中,OD418持续增大,560 nm吸收峰消失,表明此时颗粒分散均匀,因此选择10 mmol/L的硝酸银溶液用于细菌纳米银的绿色合成反应。
 (a)
(a)
 (b)
(b)
Figure 3. Effects of different ratios of cell-free fermentation broth and silver nitrate on the synthesis of AgNPs. (a) UV-Vis spectrum of AgNPs at different ratios; (b) absorbance value at 418 nm
图3. 菌株无细胞发酵液与硝酸银不同配比对纳米银合成的影响。(a) 纳米银的吸收光谱;(b) 418 nm的光吸收值变化
 (a)
(a)
 (b)
(b)
Figure 4. Effects of different concentrations of silver nitrate on the synthesis of silver nanoparticles. (a) UV-Vis spectrum of synthesized AgNPs; (b) absorbance value at 418 nm
图4. 不同浓度的AgNO3对纳米银颗粒合成的影响。(a) 合成纳米银的吸收光谱;(b) 418 nm的光吸收值变化
3.2.4. 菌液pH对纳米银合成的影响
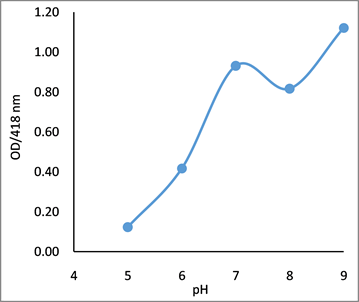
无细胞发酵液的pH对纳米银的生成有显著的影响。在同等供体浓度及配比条件下,酸化处理的无细胞发酵液不能有效还原银离子生成纳米银,表现为特征吸收峰较低。在pH 7时,纳米银的生成量达到第一个峰值,吸收峰在418 nm附近(见图5(a))。随溶液变为碱性(pH 8),OD418峰值降低,最大吸收峰偏向450 nm,表明此时生成的纳米银粒径增大。溶液pH达到9时,纳米银溶液的吸收峰恢复到418 nm,峰值增大(见图5(b)),表明此时合成的纳米银颗粒较小,生产量加大,这与高pH条件提高了菌液中还原剂物质的活性有关 [24],同时碱性环境也使纳米银颗粒彼此间的斥力增强,阻止了小颗粒纳米粒子的团聚 [25],因此pH 9更有利于381的菌液进行纳米银的合成,与文献中的结果类似 [26] [27]。
 (a)
(a)
 (b)
(b)
Figure 5. Effects of different pH values on the synthesis of silver nanoparticles. (a) UV-Vis spectrum of synthesized AgNPs; (b) absorbance value at 418 nm
图5. 无细胞发酵液的pH对纳米银颗粒合成的影响。(a) 合成纳米银的吸收光谱;(b) 418 nm的光吸收值变化
3.3. 生物合成纳米银颗粒的抑菌性能
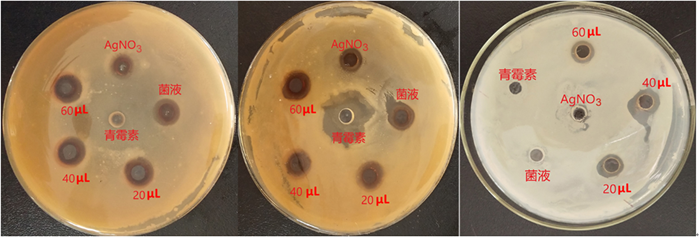
选择10 mM硝酸银为底物,以1:1比例与菌株的无细胞发酵液混合,在pH 9条件下避光反应72 h,最终得到生物合成的纳米银溶液。采用平板打孔法测试不同用量纳米银溶液对三种细菌的抑制效果(见图6),结果发现在涂菌平板小孔中添加60 μL的纳米银,对金黄色葡萄球菌和桑青枯菌的抑菌圈分别可达到18.43 mm和10.95 mm (见表1),均显著高于20 μL使用量时的抑菌作用,表明纳米银用量的增加可以增强溶液的生物活性。对桑疫病菌M4-13的抑菌作用不明显,不同使用量之间无显著差异。通过液体培养法进一步测定不同浓度纳米银水溶液对两株细菌的抑菌作用,发现其对金黄色葡萄球菌和青枯菌的最小抑制浓度分别为50 μg/mL和30 μg/mL (见表2)。
 金黄色葡萄球菌 青枯菌 M4-13
金黄色葡萄球菌 青枯菌 M4-13
Figure 6. The antibacterial activity of synthetic AgNPs
图6. 合成纳米银的抑菌作用
Table 1. Antibacterial activity of AgNPs synthesized by strain 381
表1. 菌株381合成纳米银颗粒的抑菌活性
注:不同字母表示不同处理组数据间差异显著(P < 0.05)。
Table 2. The minimum inhibitory concentration of synthetic AgNPs to pathogenic bacteria
表2. 菌株合成纳米银颗粒对病原菌的最小抑菌浓度
注:+表示有菌生长;−表示无菌生长。
3.4. 讨论
细菌可通过菌体及菌体浸泡液或发酵液在细胞内和细胞外两种途径进行纳米金属颗粒的生物合成 [14] [15] [18]。细菌生长过程中产生的酶及还原性物质可将溶液中的银离子还原成单质纳米银,后者可吸附于细胞壁或分散于细胞外液中,经细胞破碎和分离后得到纳米银产物。利用细菌的发酵液进行纳米银的胞外合成,无细胞参与还原过程,更易于进行纳米银的分离和收集 [4] [5] [6]。利用细菌、真菌、植物提取物等进行纳米银的生物合成,得到的纳米银溶液均呈现橙红到棕红色的颜色变化,并在410~460 nm波长范围内显示特征吸收峰,这是由于纳米银粒子所具有的等离子体共振效应所致,可以作为纳米银合成的判定标准 [28] - [38]。本实验我们利用一株桑叶内生菌,多粘类芽孢杆菌菌株381的无细胞发酵液经避光反应合成纳米银,反应后溶液颜色由浅黄色变为橙红色,紫外可见光光谱扫描显示在418 nm处出现典型吸收峰,因此可以判断该菌株可以进行纳米银的胞外合成。
纳米银的生物合成受到反应时间、温度、银离子浓度、溶液pH等因素的影响。利用微生物进行纳米银的合成所需时间长短不一,从几分钟到数十小时不等,一方面与微生物代谢产物中还原性物质的浓度与活性有关,另一方面也与纳米银在溶液中的分散性和稳定性有关。大肠杆菌可在反应1 h后得到均一的纳米银颗粒 [17],来源于植物的内生真菌,如人参内生镰刀菌和白屈菜内生烟曲霉则在分别在反应后的6 h和24 h得到纳米银产物 [32] [33]。反应温度可影响还原反应的速度,一般在接近菌株的适宜生长温度时,纳米银的合成效率较高。如同属真菌的烟曲霉/镰刀菌及黒附球菌与硝酸银的最适反应温度均在25℃~33℃之间 [32] [33] [34],符合真菌的生长温度,而大肠杆菌/北极副球菌(Paracoccus sp. Arc7-R13)/流感嗜血杆菌Haemophilus influenzae等细菌合成纳米银的温度则在35℃~37℃ [17] [18] [35]。溶液酸碱性的变化可以影响菌液中还原性物质的分子结构,继而影响金属银离子的还原过程,同时也影响纳米银与保护性分子的结合作用 [24] [25] [27],因此不同微生物发酵产物对酸碱的敏感性不同,适应进行纳米银合成的pH条件也有区别,一般在中性及碱性条件下合成效率较好 [32] [33] [34]。综合以上影响因素,可以获得菌株胞外合成纳米银的适宜条件,如烟曲霉的发酵液在pH = 7、25℃、反应24 h合成纳米银的效率最高,其合成的纳米银的吸收峰在424 nm [33]。黑附球菌生物合成纳米银的工艺,为硝酸银浓度为1.0 mM、pH为7及温度为33℃时可快速进行纳米银的合成,且产物的稳定性良好 [34]。人参内生尖孢镰刀菌,在硝酸银浓度为1 mM、p H为7、25℃条件下反应6 h可获得纳米银的最高产率 [32]。北极海域菌株Arc7-R13进行银纳米颗粒合成的优化条件为AgNO3浓度为4 mmol/L,在37℃,pH = 7时利于纳米银的生成 [18]。本实验表明,来源于桑叶的内生类芽孢杆菌381在37℃,与10 mmol/L的硝酸银1:1 (v/v)反应72 h后,合成的产物381-AgNPs在418 nm处达到吸收峰的最高值,无细胞菌液在碱性条件性更适合进行纳米银的合成。381-AgNPs在合成120 h后仍可保持良好的分散性,溶液的光谱吸收峰无明显变化。
生物合成的纳米银可通过释放银离子作用于细菌的细胞膜、呼吸链以及形成自由基等方式起到抗菌作用 [2] [9] [16] [18] [25] [30],纳米银粒子的抑菌能力与其粒径大小、浓度及形貌等因素有关,也与合成方法有一定关系 [18] [19] [32] [34]。实验表明生物合成的纳米银具有更好的生物活性,某些生物分子还可以覆盖在纳米粒子表面,增加其稳定性。张杰等以钩状木霉为微生物材料合成纳米银粒子,产物对枯草芽孢杆菌的MBC为5 mg/L,MIC为4 mg/L,致死效果好于对大肠杆菌的致死效果 [9]。北极副球菌合成的银纳米颗粒对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌均具有良好的抑制作用 [18]。Baker Syed等利用分离自大戟科植物Euphorbia hirta L.的内生细菌EH419合成了纳米银,其对大肠杆菌、芽孢杆菌等四种病原菌的抑菌圈均大于10 mm,其机制可能是通过破坏细胞壁导致细胞内容物泄露,并可结合到胞内的硫醇基团从而破坏DNA的结构抑制其复制功能 [29]。Ghasem Rahimi等利用白色念珠菌制备的纳米银对大肠杆菌和金黄色葡萄球菌具有良好的抗菌作用 [30]。Eun-Young Jang等利用弯曲假单胞杆菌Pseudomonas geniculata H10制备纳米银,表现出良好的抗氧化作用 [31]。Ajah HA等利用流感嗜血杆菌胞外合成纳米银,其对绿脓假单胞菌Pseudomonas aeruginosa,链球菌Streptococcus spp.,克雷伯氏菌Klebsiella spp.,金黄色葡萄球菌Staphylococcus aureus,大肠杆菌Escherichia coli,沙雷氏菌Serratia spp.和白色念珠菌Candida albicans等病原菌的抑菌圈在10~33 mm [35]。Baker Syed等利用内生荧光假单胞菌CA417合成纳米银,其对肺炎杆菌Klebsiella pneumoniae (MTCC 7407)和黄单胞菌Xanthomonas campestris具有良好的抗性,并能增强卡那霉素对肺炎杆菌(MTCC 7407)的作用,具有良好的抗生素协同作用 [36]。纳米银还具有抗病毒及肿瘤活性,在生物学和医学领域有着广泛的应用前景。烟曲霉合成的纳米银对人卵巢癌细胞A2780具有较好的抑制效果 [33],分离自人参的尖孢镰刀菌,其合成纳米银产物对对肿瘤细胞有明显抑制生长作用,并随纳米银浓度的增大促进细胞凋亡作用 [32]。本实验室利用多粘类芽孢杆菌菌株381合成的纳米银溶液对桑青枯菌和金黄色葡萄球菌均表现出较好的抑菌活性,其最小抑菌浓度分别为50 μg/mL和30 μg/mL (见表2)。
纳米银的生物合成与微生物的代谢产物密切相关,已有实验表明菌株发酵产物中的蛋白、多酚类、多糖类等组分在纳米银的还原及颗粒稳定等方面起到重要作用。张杰等人发现,解淀粉芽孢杆菌(Bacillus amyqueciens)在进行纳米银合成过程中产生了两种新的蛋白质,有效促进了纳米银的合成和稳定性的提高 [37]。Bhainsa等人发现 [38] 烟曲霉菌(Aspergillus fumigatus)培养滤液中的蛋白成分对金属银离子的还原起到了关键作用,两者混合后,在短短数分钟内便可以得到银纳米粒子(5~25 nm)。桑叶内生菌株381,其代谢产物中含有黄酮类/多酚类等化学成分 [23],可能在纳米银的生物合成过程中发挥一定作用,但对其纳米银的具体合成机制还需要进一步的实验研究进行解释。
致谢
本项目为江苏省2019年本科生创新创业训练计划项目。
文章引用
范月圆,唐 晨,季 逸,马骥昌,褚衍亮. 多粘类芽孢杆菌绿色制备纳米银及其抑菌活性
Green Preparation of Silver Nanoparticles by Paenibacillus polymyxa 381 and its Antibacterial Activity[J]. 微生物前沿, 2020, 09(03): 114-124. https://doi.org/10.12677/AMB.2020.93017
参考文献
- 1. 孙马钰, 金裕鹏, 许恒毅. 常见金属抗菌机制的研究进展[J]. 中国药理学与毒理学杂志, 2016, 30(4): 415-420.
- 2. 陈学情, 蒋家璇, 任志鸿, 等. 纳米银的抗菌特性及对多重耐药菌株的抗菌作用[J]. 微生物学报, 2017, 57(4): 539-549.
- 3. 陈美婉, 彭新生, 吴琳娜, 等. 纳米银抗菌剂的研究和应用[J]. 中国消毒学杂志, 2009, 26(4): 424-426.
- 4. 张曼莹, 刘姿铔, 邬艳君. 纳米银的生物合成及应用进展[J]. 科技创新导报, 2017, 14(23): 122-124.
- 5. Pantidos, N. and Horsfall, L.E. (2014) Biological Synthesis of Metallic Nanoparticles by Bacteria, Fungi and Plants. Journal of Biomedical Nanotechnology, 5, Article ID: 100233. https://doi.org/10.4172/2157-7439.1000233
- 6. 吴盛美, 苏义龙, 马丽雅, 等. 基于微生物生物合成纳米颗粒机制的研究进展[J]. 微生物学通报, 2014, 41(12): 2516-2524.
- 7. 马晓波, 雷育斌, 王明娜, 等. 希瓦氏菌介导纳米材料生物合成及其环境应用[J]. 环境科学与技术, 2014, 37(12): 253-257.
- 8. 李琴琴, 赵英虎, 高莉, 等. 纳米银对小麦赤霉病菌的抑制[J]. 生物工程学报, 2017, 33(4): 620-629.
- 9. 张杰, 张映, 郭瑞, 等. 钩状木霉生物合成纳米银及其杀菌性能[J]. 微生物学通报, 2016, 43(2): 386-393.
- 10. 潘玉宁, 颜春荣, 张蕾, 等. 基于纳米材料的生物传感技术在食品安全检测中的应用[J]. 生物加工过程, 2018, 16(2): 17-23.
- 11. 张青山, 岳秀萍. 纳米银粒子的生物制备及应用研究进展[J]. 材料导报A: 综述篇 2014, 28(1): 53-58.
- 12. Salunke, B.K. and Kim, B.S. (2018) Biosynthesis and Applications of Silver Nanoparticles. In: Chang, H.N., Ed., Emerging Areas in Bioengineering, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 579-590. https://doi.org/10.1002/9783527803293.ch32
- 13. Chaudhari, S.P., Ankita, D. and Kumbhar, P. (2016) Silver Nanoparticles—A Review with Focus on Green Synthesis. International Journal of Pharma Research & Review, 5, 14-28.
- 14. Singh, P., Kim, Y.J., Zhang, D.B. and Yang, D.-C. (2016) Biological Synthesis of Nanoparticles from Plants and Microorganisms. Trends in Biotechnology, 34, 588-599. https://doi.org/10.1016/j.tibtech.2016.02.006
- 15. Hulkoti, N.I. and Taranath, T.C. (2014) Biosynthesis of Nanoparticles Using Microbes—A Review. Colloids and Surfaces B: Biointerfaces, 121, 474-483. https://doi.org/10.1016/j.colsurfb.2014.05.027
- 16. Agrawal, S., Bhatt, M., Rai, S.K., et al. (2018) Silver Nanoparticles and Its Potential Applications: A Review. Journal of Pharmacognosy and Phytochemistry, 7, 930-937.
- 17. 陈国宝, 苟德海, 杨洪英. 大肠杆菌还原制备金、银纳米粒子的研究[J]. 化工新型材料, 2016, 44(11): 193-195.
- 18. 张政. 北极副球菌(Paracoccus sp. Arc7-R13)发酵液介导合成纳米颗粒及特性研究[D]: [硕士学位论文]. 青岛: 自然资源部第一海洋研究所, 2019.
- 19. 孙倩, 李明春, 马守栋. 纳米银抗菌活性及生物安全性研究进展[J]. 药学研究, 2013, 32(2): 103-106.
- 20. 花榜清, 刘振民, 吴正钧, 等. 类芽孢杆菌抗菌物质的研究进展[J]. 应用化工, 2017, 47(7): 1462-1467.
- 21. 杨少波, 刘训理. 多粘类芽孢杆菌及其产生的生物活性物质研究进展[J]. 微生物通报, 2008, 35(10): 1621-1625.
- 22. 鲁红学, 周炎炎. 类芽孢杆菌在植物病害防治和环境治理中的应用研究进展[J]. 安徽农业科学, 2008, 36(30): 13244-13247.
- 23. 王彪, 潘英豪, 侯佳蓝, 等. 一种桑树细菌性病原内生拮抗细菌的筛选、鉴定及其生防活性[J]. 微生物前沿, 2019, 8(3): 110-120.
- 24. Qin, Y.Q., Ji, X.H., Jing, J., Liu, H., Wu, H. and Yang, W.S. (2010) Size Control over Spherical Silver Nanoparticles by Ascorbic acid Reduction. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 372, 172-176. https://doi.org/10.1016/j.colsurfa.2010.10.013
- 25. Sathishkumar, M., Sneha, K., Won, S.W., Cho, C.-W., Kim, S. and Yun, Y.-S. (2009) Cinnamon Zeylanicum Bark Extract and Powder Mediated Green Synthesis of Nano-Crystalline Silver Particles and Its Bactericidal Activity. Colloids and Surfaces B: Biointerfaces, 73, 332-338. https://doi.org/10.1016/j.colsurfb.2009.06.005
- 26. Shenya, D.S., Mathewa, J. and Philip, D. (2011) Phytosynthesis of Au, Ag and Au-Ag Bimetallic Nanoparticles Using Aqueous Extract and Dried Leaf of Anacardiurn occidentale. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 79, 254-262. https://doi.org/10.1016/j.saa.2011.02.051
- 27. Lee, G.-J., Shin, S.-I., Kim, Y.-C. and Oh, S.-O.(2004) Preparation of Silver Nanorods through the Control of Temperature and pH of Reaction Medium. Materials Chemistry and Physics, 84, 197-204. https://doi.org/10.1016/j.matchemphys.2003.11.024
- 28. 黄玲, 石磊, 龚盛昭. 纳米银生物制备的研究进展[J]. 广州化工, 2017, 45(20): 10-12.
- 29. Syed, B., Yashavantha Rao, H.C., Nagendra-Prasad, M.N., Prasad, A., Harini, B.P., Azmath, P., Rakshith, D. and Satish, S. (2016) Biomimetic Synthesis of Silver Nanoparticles Using Endosymbiotic Bacterium Inhabiting Euphorbia hirta L. and Their Bactericidal Potential. Scientifica, 2016, Article ID: 9020239.
- 30. Ghasem, R., Fahimeh, A. and Alireza, K. (2016) Mycosynthesis of Silver Nanoparticles from Candida albicans and its Antibacterial Activity against Escherichia coli and Staphylococcus aureus. Tropical Journal of Pharmaceutical Research, 1, 371-375. https://doi.org/10.4314/tjpr.v15i2.21
- 31. Jang, E.Y., Son Y.J., Park, S.Y., et al. (2018) Biological Synthesis and Characterisation of Silver Nanoparticles Using Pseudomonas geniculata H10 for Pharmaceutical Activity. IET Nanobiotechnology, 12, 828-835.
- 32. 包京姗. 人参内生菌分离鉴定及合成纳米银活性分析[D]: [博士学位论文]. 长春: 吉林农业大学, 2015.
- 33. 王宁宁, 刘璐, 刘园园, 等. 白屈菜内生菌合成纳米银的活性及抗肿瘤分析[J]. 吉林医学, 2017, 38(11): 2003-2005.
- 34. 钱永清. 植物内生真菌生物合成纳米材料及其代谢产物抗真菌研究[D]: [硕士学位论文]. 长春: 吉林大学, 2012.
- 35. Ajah, H.A., Khalaf, K.J., Hassan, A.S., et al. (2018) Extracellular Biosynthesis of Silver Nanoparticles by Haemophilus influenzae and Their Antimicrobial Activity. Journal of Pharmaceutical Ences and Research, 10, 175-179.
- 36. Syed, B., Prasad, M.N.N., Dhananjaya, B.L., et al. (2016) Synthesis of Silver Nanoparticles by Endosymbiont Pseudomonas fluorescens CA 417 and Their Bactericidal Activity. Enzyme and Microbial Technology, 95, 128-136. https://doi.org/10.1016/j.enzmictec.2016.10.004
- 37. 张杰, 熊文, 张映, 等. 一株还原制备纳米银的细菌菌株zxw01的分离鉴定[J]. 湖南农业大学学报(自然科学版), 2015, 41(4): 423-427.
- 38. Bhainsa, K.C. and D’Souza, S.F. (2006) Extracellular Biosynthesis of Silver Nanoparticles Using the Fungus Aspergillus fumigatus. Colloids and Surfaces B: Biointerfaces, 47, 160-164. https://doi.org/10.1016/j.colsurfb.2005.11.026
NOTES
*通讯作者。
