Advances in Clinical Medicine
Vol.
13
No.
05
(
2023
), Article ID:
65244
,
8
pages
10.12677/ACM.2023.1351047
富血小板血浆可减轻膝骨性关节炎神经病理性疼痛并下调ATF3表达
闫笑,叶银霜,滕兆伟,李铁山*
青岛大学附属医院康复医学科,山东 青岛
收稿日期:2023年4月11日;录用日期:2023年5月6日;发布日期:2023年5月15日

摘要
目的:本研究旨在观察富血小板血浆(PRP)对单碘乙酸钠(MIA)诱导的膝骨关节炎(KOA)神经病理性疼痛大鼠镇痛疗效,并对其镇痛机制进行初步探讨。方法:向大鼠左膝关节注射60 µL MIA (80 mg/mL)诱导关节退变,造模前1天及造模后第1、3、7、14天对大鼠机械痛撤足阈值、热痛撤足阈值进行测定,在造模后15、17、19天MIA + PRP组连续3天予以膝关节PRP注射治疗,MIA + NS组予以等量生理盐水注射治疗,造模后21、28天对大鼠机械痛撤足阈值、热痛撤足阈值再次进行测定,使用免疫组化染色测定背根神经节激活转录因子3 (ATF3)表达。结果:MIA造模后大鼠机械痛撤足阈值、热痛撤足阈值显著降低,予以PRP注射治疗后,MIA + PRP组机械痛撤足阈值、热痛撤足阈值显著高于MIA + NS组。造模后28天,MIA + PRP组背根神经节中ATF3蛋白表达较MIA + NS组显著降低。结论:PRP可以减轻膝骨性关节炎大鼠神经病理性痛,这一作用可能是通过减轻神经损伤实现的。
关键词
膝骨关节炎,富血小板血浆,背根神经节,激活转录因子3,疼痛

Platelet-Rich Plasma Can Alleviate Neuropathic Pain and Down-Regulate ATF3 Expression in Knee Osteoarthritis
Xiao Yan, Yinshuang Ye, Zhaowei Teng, Tieshan Li*
Department of Rehabilitation Medicine, The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Apr. 11th, 2023; accepted: May 6th, 2023; published: May 15th, 2023

ABSTRACT
Objective: To observe the analgesic effect of platelet-rich plasma (PRP) on neuropathic pain in rats with knee osteoarthritis (KOA) induced by monosodium iodoacetate (MIA), and to explore its analgesic mechanism. Methods: 60 µl MIA (80 mg/mL) was injected into the left knee joint of rats to induce joint degeneration. Mechanical and thermal pain thresholds were measured at 1 day before modeling and 1, 3, 7, and 14 days after modeling. At 15, 17 and 19 days after modeling, the knee joints in MIA + PRP group were injected with PRP, and the knee joints in MIA + NS group were injected with the same amount of normal saline. The paw withdrawal threshold (PWT) and paw withdrawal latency (PWL) were measured again 21 and 28 days after modeling, and the expression of activating transcription factor 3 (ATF3) in dorsal root ganglion (DRG) was detected by immunohistochemical staining. Results: The mechanical pain threshold and thermal pain threshold of MIA rats were significantly decreased after modeling. After PRP injection, the PWT and PWL of MIA + PRP group were significantly higher than those of MIA + NS group. 28 days after modeling, the expression of ATF3 in the dorsal root ganglia of the MIA + PRP group was significantly lower than that of the MIA + NS group. Conclusion: PRP can alleviate NP in rats with knee OA possibly by reducing nerve injury.
Keywords:Knee Osteoarthritis, Platelet-Rich Plasma, Dorsal Root Ganglion, Activating Transcription Factor 3, Pain

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
膝关节骨性关节炎(KOA)是一种常见的慢性退行性疾病,可导致关节疼痛、活动受限。膝关节骨性关节炎在所有类型关节炎中患病率最高,影响着全球约15%的人口 [1] ,其发病随着年龄增加,膝关节疼痛是患者就医的重要原因,因此疼痛管理在膝关节炎的治疗中是至关重要的 [2] [3] 。
目前,能够阻碍膝关节炎损伤进展的治疗方法有限。保守治疗方法包括口服药物(非甾体类抗炎、麻醉药等)、关节内注射、物理治疗等,但这些治疗方法只能暂时缓解症状,且长期应用存在药物不良反应等问题 [4] 。对于较严重的KOA,只能采取关节置换手术治疗,尽管关节置换手术临床疗效较好,但是关节置换术后部分患者仍有膝关节疼痛 [5] ,并且术后需要复杂的维护,再加上有一定的使用年限,不适合活动量较大的年轻患者。因此,在科学研究和临床实践中,寻找更有效和更安全的治疗KOA神经病理性痛的方法都仍然是当务之急。
近年膝关节疼痛特征及其病理生理机制已成为研究的热点领域并取得一定进展。Orita S等人发现向大鼠膝关节内注射 ≥ 2 mg单碘乙酸钠(MIA)可逐渐引起局部炎症和神经损伤,最终诱发神经病理性疼痛状态 [6] ;Morgan M等人研究表明在MIA诱发的OA中,早期疼痛涉及支配关节囊神经的激活和敏化,而在MIA诱发的膝关节炎晚期的疼痛涉及支配软骨下骨的神经损伤 [7] ;以上研究表明,膝关节内注射高剂量MIA (≥2 mg)可诱导神经病理性疼痛 [8] 。激活转录因子3 (ATF3)是神经损伤后细胞损伤的选择性标志物。其中神经损伤被认为是主要周围神经损伤后,三磷酸腺苷(ATP)在脊髓中的表达显著增加 [9] ,然后通过P2X4和P2X7受体促进脊髓小胶质细胞活化 [10] ,小胶质细胞活化后可上调促炎细胞因子 [11] ,导致神经炎症进一步扩大和神经病理性痛加重。
在过去的十年中,人们对使用自体生长因子,如关节内注射富血小板血浆(PRP)治疗膝关节骨性关节炎越来越感兴趣 [12] 。PRP是含有浓缩血小板、生长因子和细胞因子的自体血清,PRP具有治疗效果较好、来源自体、安全性较好的优点;因此,其在治疗KOA方面具有广阔的应用前景。此前大量研究证实了PRP在KOA治疗中的有益作用,一项纳入14项随机对照实验的meta分析表明,与其他注射疗法(包括生理盐水、透明质酸、臭氧和皮质类固醇)相比,关节内PRP注射治疗膝关节骨性关节炎在疼痛缓解和功能改善方面可能更有效 [13] 。基础研究表明,关节内注射PRP可减轻疼痛相关行为,抑制滑膜炎症,促进软骨修复 [14] 。Bohren Y等人研究表明,当PRP应用于软组织和神经损伤部位时,可促进组织愈合并消除糖尿病神经痛或腕管综合征的神经病理性痛,其机制可能与促进雪旺细胞迁移和轴突生长、促进髓鞘形成,从而促进神经修复有关 [15] 。
但目前为止,尚未见探讨PRP对伴神经病理性痛的膝关节炎疗效的相关研究。本研究通过建立伴有神经病理性痛的膝骨性关节炎大鼠模型,研究PRP对膝关节所致神经病理性疼痛的镇痛效果观察,并对其机制进行初步探讨。
2. 方法
2.1. 实验动物
选取清洁健康雄性Sprague Dawley (SD)大鼠17只体质量(180 ± 20) g,由青岛大学实验动物中心提供。大鼠分笼饲养,饲养环境温度保持在(23 ± 1)℃,白天(12 h)~黑夜(12 h)循环照明,大鼠自由摄食、饮水。实验前对大鼠进行适应性饲养7天,本研究经青岛大学动物保护和使用委员会批准(批准号:No. 20210924SD6420211112099),所有手术均在异氟烷气体麻醉下进行,并尽一切努力最大限度地减少实验动物的疼痛、痛苦和死亡。
2.2. PRP制备及保存
术前经腹主动脉穿刺抽取2只雄性SD大鼠全血,注入含3.8%枸橼酸钠的导管。在25℃下以800 rpm离心15 min,从抗凝血液中获得PRP。采用全自动血细胞分析仪计数全血和PRP中的血小板;PRP达到的血小板浓度是基线水平的3~4倍。PRP在−80℃冷冻24 h活化,37℃孵育1 h。在孵育后,将活化的PRPs在12,000 g下离心2分钟以分离碎片。收集上清液−80℃保存直至使用。
2.3. 膝骨性关节炎的诱导和治疗
本实验随机选取10只雄性SD大鼠在左膝关节注射60 µL 80 mg/mL碘乙酸单钠(MIA, Sigma, I2512)诱导大鼠关节退变,按随机数字表法随机分为MIA + PRP组和MIA + NS组(n = 5),另选5只SD大鼠在左膝关节注射等体积生理盐水作为Sham组,并分别于建模前1天及建模后第1、3、7、14天对大鼠进行机械痛撤足阈值、热痛撤足阈值进行测定,评估MIA造模情况。在造模后第15、17和19天将PRP (每次60 µL)注射至MIA + PRP组大鼠左膝关节,Sham组和MIA + NS组注射等体积生理盐水,所有注射均在异氟烷麻醉下进行。于MIA造模后21、28天行疼痛行为学测试,并于MIA注射后28天处死大鼠,取左侧背根神经节。
2.4. 行为学测试
分别于造模前1天及造模后第1、3、7、14、21、28天从各组中随机抽取5只大鼠进行行为学测定,采用Von Frey细丝实验检测大鼠机械痛撤足阈值,采用Hargreaves实验检测大鼠热痛撤足阈值,测试均采用盲法,即测试者对测试组具体干预措施不清楚。在进行任何疼痛行为学测定之前,大鼠需适应环境15分钟。
2.4.1. 机械痛撤足阈值(PWT)的测定
采用Von Frey纤维(North Coast, USA)按up-down法测定机械痛撤足阈值,以评估机械性痛觉过敏(25)。在Von Frey纤维丝行为学测试前,将大鼠置于特制的有机玻璃网格平台上,使其适应测试环境20 min。将一系列Von Frey纤维丝(0.16、0.4、0.6、1.4、2.0、4.0、6.0、8.0、15.0、26 g),均以2.0 g纤维丝为起点,将其垂直刺激大鼠造模侧的足底皮肤,持续刺激5秒左右,记录下大鼠的缩足反应(“O”为阳性:出现缩足、舔足反应,“X”为阴性:无反应),有缩足反应则换用相邻的小一级纤维丝重复上述测试,无反应则更换相邻大一级的纤维丝重复上述测试,直至出现一次“OX”或“XO”。按上述原则再测4次,每次测试间隔5分钟,最终得到一串以“X”和“O”组成的序列,按以下公式代入相应数据最终得到大鼠的机械痛PWT:
2.4.2. 热痛撤足阈值(PWL)的测定
采用热平台评估大鼠的热痛撤足阈值,测试前为了避免大鼠的探索行为影响最终的测定结果,遂将其置于热板仪器上适应环境,等待大鼠适应环境后再测试,热板测试温度为55℃,对大鼠出现舔足及跳跃的时间进行记录,共记录3次,每次测试时间之间停歇5 min,将3次测试的结果取平均值,计算大鼠的热痛撤足阈值。
2.5. 免疫组织化学染色
大鼠(n = 5/组)深度麻醉后,依次灌注生理盐水和4%多聚甲醛,取L3-L5节段背根神经节立即置于4%多聚甲醛中浸泡固定24小时,将浸泡后的组织逐级乙醇梯度脱水,随后依次放入二甲苯中洗去酒精,再放在石蜡和二甲苯混合液中浸泡1 h,石蜡融化液浸泡2 h进行包埋,将脊髓的石蜡包埋切片切成5 μm厚度。用0.3% Triton X-100和3%过氧化氢磷酸盐缓冲液(PBS)处理1 h,在5%正常山羊血清中处理2 h,然后在室温下用一抗——兔抗活化转录因子3 (ATF3)抗体(1:100,Immunoway,中国)染色过夜。第二天取出,切片用PBS冲洗后,再将二抗(HRP标记山羊抗兔IgG,1:1000,Bioss,中国)滴加在组织切片上37℃烘箱孵育1 h。孵育结束后同样用PBS洗3次,每次5 min。最后使用尼康正向荧光显微镜拍摄图像。
2.6. 统计
采用GraphPad Prism 8.0软件(GraphPad software, CA, USA)进行数据分析。采用两因素重复测量方差分析(RMANOVA)评价疼痛阈值,免疫组织化学染色采用单因素方差分析组间差异。以P < 0.05为差异有统计学意义。
3. 结果
3.1. PRP对MIA大鼠机械痛撤足阈值及热痛撤足阈值的影响
造模前各组大鼠机械痛PWT和热痛PWL组间差异无统计学意义(P > 0.05);与Sham组相比,MIA + NS组、MIA + PRP组造模后1天PWT和PWL明显降低,持续至造模后14天(****P < 0.0001),表明疼痛模型制备成功;在造模后15,17,19天予以PRP注射治疗后,造模后21天(即治疗后2天)与MIA + NS组相比MIA + PRP组PWT和PWL提高,至造模后28天MIA + PRP组PWT和PWL仍高于MIA + NS组(图1、图2)。上述结果表明PRP能提高大鼠的机械痛撤足阈值、热痛撤足阈值。
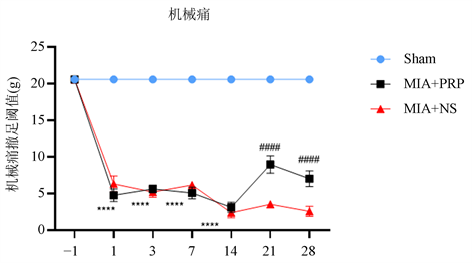 注:****P < 0.0001代表MIA + NS组、MIA + PRP组与Sham组相比,####P < 0.0001代表MIA + NS组与MIA + PRP组相比。
注:****P < 0.0001代表MIA + NS组、MIA + PRP组与Sham组相比,####P < 0.0001代表MIA + NS组与MIA + PRP组相比。
Figure 1. Mechanical allodynia presented by PWT
图1. 机械痛撤足阈值
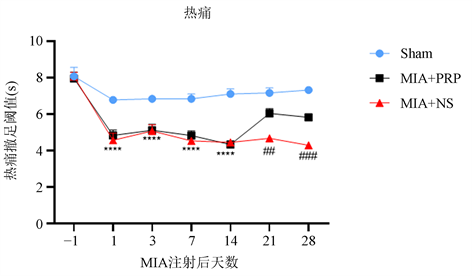 注:****P < 0.0001代表MIA + NS组、MIA + PRP组与Sham组相比,##P < 0.01,###P < 0.001,代表MIA + NS组与MIA + PRP组相比。
注:****P < 0.0001代表MIA + NS组、MIA + PRP组与Sham组相比,##P < 0.01,###P < 0.001,代表MIA + NS组与MIA + PRP组相比。
Figure 2. Thermal allodynia presented by PWL
图2. 热痛撤足阈值
3.2. PRP膝关节注射治疗降低ATF3表达
与Sham组相比,MIA + NS组的大鼠背根神经节中ATF3表达量在第28天显著上调(P < 0.0001),此外,与MIA + NS组相比,MIA + PRP组背根神经节ATF3表达量显著降低(P < 0.05)。详见图3。
4. 讨论
疼痛是膝关节骨性关节炎的主要症状,也是患者寻求诊疗的主要原因。膝关节炎的疼痛通常在使用关节时加重,休息时缓解,在疾病的早期阶段,包括疼痛在内的症状通常是间歇性的,随着疾病的进展变得更加频繁和严重。Hochman等人调查研究发现,34%的KOA患者有神经病理性痛表现,然而迄今为止,对于膝关节炎所致神经病理性痛仍缺乏有效的治疗方法 [16] 。本研究通过建立大鼠膝关节炎模型,对大鼠患侧膝关节机械痛撤足阈值、热痛撤足阈值以及患侧背根神经节ATF3测定,来观察PRP对膝关节炎所致神经病理疼痛的镇痛作用并对其机制进行初步探讨。

Figure 3. The expression level of ATF3 in dorsal root ganglion of rats in each group after treatment
图3. 治疗后各组大鼠背根神经节内ATF3蛋白表达
目前有许多的动物模型被开发应用于骨关节炎的基础研究中,本研究采用建模方法是在啮齿类动物的膝关节内注射MIA,MIA是一种甘油醛-3-磷酸酶抑制剂,能不可逆的抑制软骨细胞的糖酵解,最终导致细胞死亡,引起软骨变性和随后的软骨下骨改变,已被证明可以诱发类似于OA的病理改变 [8] 和显著的疼痛相关行为 [7] 。既往研究报道,向膝关节内注射高剂量MIA (≥2.0 mg/关节)会引起不可逆的结构改变、神经损伤和持续性疼痛,而低剂量MIA (<1.0 mg/关节)则不会引起这些改变 [17] ,Orita,S.等人将MIA及FG逆行神经示踪剂注入大鼠右侧膝关节,左膝注入生理盐水及FG作为对照,发现右侧膝关节出现痛觉过敏的行为学表现,DRG中FG标记的ATF3-ir显著升高,且呈时间依赖性 [6] 。在我们的研究中,通过在膝关节内注射4.8 mg MIA至2周建立稳定的NP模型,使用von Frey纤维丝试验和Hargreaves试验 [18] 测定了关节炎疼痛的症状,包括痛觉过敏、痛觉超敏和自发痛。我们的行为学测试结果显示,与Sham组相比较,关节腔内注射高剂量MIA后可引起大鼠持续性机械痛觉过敏和热痛觉过敏,表明膝关节炎所致神经病理性疼痛模型造模成功,这与既往研究的结果一致 [9] 。经治疗后,在MIA造模后21天,MIA + PRP治疗组的机械痛阈和热痛阈显著高于MIA + NS组,并且这种作用持续到造模后28天,提示PRP注射对膝骨性关节炎所致神经病理性痛有治疗作用。
膝关节由滑膜、外半月板、软骨下骨和副韧带中的感觉神经高度支配 [19] 。这些关节传入神经包括传递伤害性信息的小直径有髓神经Αδ和无髓神经C纤维,以及负责编码非伤害性感觉信息的大直径Αβ纤维。随着膝骨性关节炎疾病进展、病期延长,关节损伤导致软骨下骨逐渐暴露,而软骨下骨内含有丰富的感觉神经末梢,逐渐暴露的神经元末梢可能会因此受损,此外,长时间的炎症也可引起神经元损伤和凋亡 [9] 。已有研究表明,在组织和神经损伤持续存在的情况下,外周感觉传入神经长时间兴奋会导致脊髓突触后神经元的过度兴奋,进而引起中枢敏化和慢性神经病理性疼痛状态 [20] 。
ATF3是一种转录因子,外周神经损伤后在背根神经节中表达升高,且在炎症过程中不表达,被认为是神经元损伤的标志 [21] 。既往研究表明,在MIA诱导的大鼠OA模型中,DRG神经元的ATF3表达增加和免疫反应性增强。Joana等人使用2 mg MIA进行膝关节炎造模后,免疫荧光检测发现神经元损伤标志物ATF-3和NPY的表达以及GAP-43表达的上调,提示该OA模型中可能发生轴突损伤 [17] 。为了评估背根神经节中ATF3蛋白表达,我们应用免疫组化染色进行观察,我们的实验观察到在造模后28天,MIA + PRP组背根神经节ATF3蛋白表达量较MIA + NS组降低(P < 0.05)。提示PRP应用于伴神经病理性疼痛KOA的大鼠时,可减轻大鼠神经损伤,这可能是其缓解KOA所致神经病理性疼痛的机制。
本实验的有限性在于使用了MIA来诱发关节炎疼痛,虽然注射MIA的关节表现出稳定的、可复制的伤害性行为和病理改变,但MIA膝关节炎模型并不能完全重现KOA的所有临床特征,因而需要进一步的临床试验来具体观察PRP对KOA所致神经病理性痛的镇痛作用,不过尽管如此,这项研究还是加深了我们对膝关节炎病理机制的认识,丰富了PRP应用于临床的理论依据。
5. 总结
综上所述,在本研究中,我们发现关节内注射PRP可以降低大鼠膝关节炎所致神经病理性痛,此外,注射PRP的大鼠DRG中ATF3蛋白表达显著减少,提示PRP可能通过减轻感觉系统神经损伤来减轻神经病理性疼痛。
致谢
感谢所有参与研究的人员提供的宝贵数据,感谢李铁山教授的严格指导。
文章引用
闫 笑,叶银霜,滕兆伟,李铁山. 富血小板血浆可减轻膝骨性关节炎神经病理性疼痛并下调ATF3表达
Platelet-Rich Plasma Can Alleviate Neuropathic Pain and Down-Regulate ATF3 Expression in Knee Osteoarthritis[J]. 临床医学进展, 2023, 13(05): 7498-7505. https://doi.org/10.12677/ACM.2023.1351047
参考文献
- 1. Safiri, S., et al. (2020) Global, Regional and National Burden of Osteoarthritis 1990-2017: A Systematic Analysis of the Global Burden of Disease Study 2017. Annals of Rheumatic Diseases, 79, 819-828. https://doi.org/10.1136/annrheumdis-2019-216515
- 2. Kraus, V.B., Blanco, F.J., Englund, M., Karsdal, M.A. and Lohmander, L.S. (2015) Call for Standardized Definitions of Osteoarthritis and Risk Stratification for Clinical Trials and Clinical Use. Osteoarthritis Cartilage, 23, 1233-1241. https://doi.org/10.1016/j.joca.2015.03.036
- 3. Schaible, H.G. (2012) Mechanisms of Chronic Pain in Osteoarthri-tis. Current Rheumatology Reports, 14, 549-556. https://doi.org/10.1007/s11926-012-0279-x
- 4. Katz, J.N., Arant, K.R. and Loeser, R.F. (2021) Diagnosis and Treatment of Hip and Knee Osteoarthritis: A Review. JAMA, 325, 568-578. https://doi.org/10.1001/jama.2020.22171
- 5. Hasegawa, M., Tone, S., Naito, Y. and Sudo, A. (2021) Possible Neuropathic Pain in Patients with Osteoarthritis of the Knee before and after Total Knee Arthroplasty. Journal of Pain Research, 14, 3011-3015. https://doi.org/10.21203/rs.3.rs-190757/v1
- 6. Orita, S., et al. (2011) Pain-Related Sensory Innervation in Mo-noiodoacetate-Induced Osteoarthritis in Rat Knees That Gradually Develops Neuronal Injury in Addition to Inflammatory Pain. BMC Musculoskeletal Disorders, 12, Article No. 134. https://doi.org/10.1186/1471-2474-12-134
- 7. Morgan, M., Thai, J., Nazemian, V., Song, R. and Ivanusic, J.J. (2022) Changes to the Activity and Sensitivity of Nerves Innervating Subchondral Bone Contribute to Pain in Late-Stage Osteoarthritis. Pain, 163, 390-402. https://doi.org/10.1097/j.pain.0000000000002355
- 8. Ivanavicius, S.P., et al. (2007) Structural Pathology in a Rodent Model of Osteoarthritis Is Associated with Neuropathic Pain: Increased Expression of ATF-3 and Pharmacolog-ical Characterisation. Pain, 128, 272-282. https://doi.org/10.1016/j.pain.2006.12.022
- 9. Masuda, T., et al. (2016) Dorsal Horn Neurons Release Extracellu-lar ATP in a VNUT-Dependent Manner That Underlies Neuropathic Pain. Nature Communications, 7, Article No. 12529. https://doi.org/10.1038/ncomms12529
- 10. Kobayashi, K., et al. (2011) Induction of the P2X7 Receptor in Spinal Microglia in a Neuropathic Pain Model. Neuroscience Letters, 504, 57-61. https://doi.org/10.1016/j.neulet.2011.08.058
- 11. Zhou, Z., et al. (2010) A Novel Cell-Cell Signaling by Microglial Transmembrane TNFα with Implications for Neuropathic Pain. Pain, 151, 296-306. https://doi.org/10.1016/j.pain.2010.06.017
- 12. Cugat, R., et al. (2015) Biologic Enhancement of Cartilage Repair: The Role of Platelet-Rich Plasma and Other Commercially Available Growth Factors. Arthroscopy, 31, 777-783. https://doi.org/10.1016/j.arthro.2014.11.031
- 13. Shen, L., Yuan, T., Chen, S.B., Xie, X.T. and Zhang, C.Q. (2017) The Temporal Effect of Platelet-Rich Plasma on Pain and Physical Function in the Treatment of Knee Osteoarthritis: Sys-tematic Review and Meta-Analysis of Randomized Controlled Trials. Journal of Orthopaedic Surgery and Research, 12, 16. https://doi.org/10.1186/s13018-017-0521-3
- 14. Zhu, Y., et al. (2013) Basic Science and Clinical Application of Platelet-Rich Plasma for Cartilage Defects and Osteoarthritis: A Review. Osteoarthritis Cartilage, 21, 1627-1637. https://doi.org/10.1016/j.joca.2013.07.017
- 15. Bohren, Y., et al. (2022) Platelet-Rich Plasma and Cytokines in Neuropathic Pain: A Narrative Review and a Clinical Perspective. European Journal of Pain, 26, 43-60. https://doi.org/10.1002/ejp.1846
- 16. Hochman, J.R., et al. (2010) The Nerve of Osteoarthritis Pain. Arthritis Care & Research (Hoboken), 62, 1019-1023. https://doi.org/10.1002/acr.20142
- 17. Ferreira-Gomes, J., et al. (2012) Dose-Dependent Expression of Neuronal Injury Markers during Experimental Osteoarthritis Induced by Monoiodoacetate in the Rat. Molecular Pain, 8, 50. https://doi.org/10.1186/1744-8069-8-50
- 18. Hargreaves, K., et al. (1988) A New and Sensitive Method for Meas-uring Thermal Nociception in Cutaneous Hyperalgesia. Pain, 32, 77-88. https://doi.org/10.1016/0304-3959(88)90026-7
- 19. Witt, K.L. and Vilensky, J.A. (2014) The Anatomy of Osteo-arthritic Joint Pain. Clinical Anatomy, 27, 451-454. https://doi.org/10.1002/ca.22120
- 20. Kwok, C.H.T., Kohro, Y., et al. (2021) Role of Primary Afferents in Arthri-tis Induced Spinal Microglial Reactivity. Frontiers in Immunology, 12, Article ID: 626884. https://doi.org/10.3389/fimmu.2021.626884
- 21. Averill, S., et al. (2004) NGF and GDNF Ameliorate the Increase in ATF3 Expression Which Occurs in Dorsal Root Ganglion Cells in Response to Peripheral Nerve Injury. European Journal of Neuroscience, 19, 1437-1445. https://doi.org/10.1111/j.1460-9568.2004.03241.x
NOTES
*通讯作者Email: tieshanli@qdu.edu.cn