Advances in Clinical Medicine
Vol.
10
No.
12
(
2020
), Article ID:
39606
,
7
pages
10.12677/ACM.2020.1012498
肺孢子菌肺炎在HIV与非HIV中的影像学特征
刘珍慧,万甜甜,何雪琨,栾琳慧,王志强*
青岛大学附属医院,呼吸与危重症医学科,山东 青岛

收稿日期:2020年11月27日;录用日期:2020年12月24日;发布日期:2020年12月31日

摘要
目的:探讨卡氏肺孢子菌肺炎发生在艾滋病与非艾滋病患者中的影像学特点。方法:对确诊的26例患者,以入院首次肺部影像作为研究资料进行回顾性分析。结果:26例患者中,HIV患者呈现磨玻璃阴影、肺气肿影及月弓征居多,分别占比为21例(87.5%),8例(88.9%)和5例(83.3%),双轨征及铺路石征较少;非HIV患者,双轨征及铺路石征居多,分别为5例(71.4%)和3例(100%)。结论:PCP患者的胸部CT影像学表现复杂多样,多呈双肺弥漫对称性分布,磨玻璃影、肺囊肿和月弓征在HIV/ARDS患者占比较多,而双轨征及铺路石征在非HIV患者中占比较多。
关键词
肺孢子菌肺炎,获得性免疫缺陷综合征,磨玻璃影,气囊影,月弓征

Imaging Features of Pneumocystis Pneumoniae in HIV and Non-HIV Patients
Zhenhui Liu, Tiantian Wan, Xuekun He, Linhui Luan, Zhiqiang Wang*
Department of Respiratory and Critical Care Medicine, The Affiliated Hospital of Qingdao University, Qingdao Shandong

Received: Nov. 27th, 2020; accepted: Dec. 24th, 2020; published: Dec. 31st, 2020

ABSTRACT
Objective: To investigate the imaging characteristics of pneumocystis carina pneumonia in HIV and non-HIV patients. Methods: The 26 confirmed patients were retrospectively analyzed with the first lung imaging of admission as the research data. Results: Among 26 patients, HIV patients present ground glass shadow, lung sac and lunate sign, respectively accounting for 21 cases (87.5%), 8 cases (88.9%) and 5 cases (83.3%), the double-track sign and crazy paving signs are less. Among the non-HIV patients, the double-track sign and the crazy paving signs were in the majority 5 cases (71.4%) and 3 cases (100%), respectively. Conclusion: The chest CT imaging findings of PCP patients are complex and diverse, and most of them show symmetrical distribution of both lungs. The ground-glass opacity, lung sac and lunate sign are more common in HIV/ARDS patients, while the double-track sign and crazy paving signs are more common in non-HIV patients.
Keywords:Pneumocystis Pneumoniae, Acquired Immunodeficiency Syndrome, Ground Glass Shadow, Lung Sac, Lunate Sign

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肺孢子菌肺炎(Pneumocystis pneumonia, PCP),又称卡氏肺孢子虫肺炎,卡氏肺囊虫肺炎,是由肺孢子菌引起的间质性浆细胞性肺炎,为条件性肺部感染性疾病。常常归属于真菌机会性肺部感染的一类。过去曾经认为肺孢子菌具有原虫的形态学特征而被学界认为是一类新型的锥体型原虫。直到1988年,对肺孢子菌rRNA亚型充分分析确定了该病原体属真菌类,此后相继众多学者行基因检测也证实此病原体确属于真菌中的子囊菌类 [1]。肺孢子菌本身具备特定的生物遗传特性和宿主特异性,学术界将引起人类肺孢子菌肺炎的菌属称为P. jirovecii [1]。
自身获得性免疫缺陷综合征(acquired immunodeficiency syndrome, AIDS)合并PCP的病例报道逐年增多,越来越多的被临床重视。对AIDS患者的急性发病率及死亡率分析,合并PCP的患者占比较高。但近年来随着科学技术水平的突飞猛进,尤其是器官移植的广泛实施,人类免疫缺陷病毒(human immunodeficiency virus, HIV)阴性的普通患者及免疫抑制患者病例层出不穷,如结缔组织疾病(尤其是胶原血管病)、皮质类固醇长期使用、糖尿病、恶性肿瘤(尤其实体及血液系统恶性肿瘤)等等。综合分析,上述两类群体不仅造成PCP的原因有异,而且在两类人群的发病率和病死率方面亦有所不同,参考报道的相关统计数字,AIDS并发PCP的患者急性加重住院比例明显升高,重症患者死亡率进行性升高,可达29%~62%;比较而言,非AIDS并发PCP患者的病死率更加严峻,可达48%~67% [2]。PCP一经诊断,病情迅速进展,早期恰当治疗可显著降低病死率。此外肺孢子菌在免疫功能正常人群中常常存在定植现象,可能合并呼吸道传播的可能 [3]。就呼吸科常见病而言,存在免疫功能缺陷患者肺孢子菌定植的比例较高,另一方面最常见的肺孢子菌病传染源是具有免疫功能正常、无症状的健康人群。
2. 资料与方法
2.1. 入选标准
选取研究对象为青岛大学第一附属医院从2010年3月至2020年3月确诊的PCP (肺孢子菌肺炎)的26例门诊及住院患者,PCP诊断符合下列标准第1项或2~7中任何4项。① 支气管镜活检或支气管肺泡灌洗检测PC阳性;② ARDS诊断标准成立 [3];③ 血清淋巴细胞亚群检测CD4 + T淋巴细胞计数 < 200个/µl [3];④ 伴有咳嗽,以干咳为主、可伴呼吸困难、发热、胸痛及体重下降等症状,但查体无阳性胸部体征;⑤ 胸部影像学可见典型征象;⑥ 给予经验性抗PCP治疗临床症状有效;⑦ 反复3次血清乳酸脱氢酶检测均升高 [4]。要求ARDS诊断以符合2011年中华医学会感染病学会所修订的诊断为准 [3]。
2.2. 一般资料
入组患者共26例均诊断为PCP,男性21例,女性5例,男女之比为4.2:1。年龄22~68岁,平均42.3岁。HIV感染途径包括:性传播16例(61.5%),其中异性传播12例,同性性传播4例;血液传播2例(7.7%);感染途径不确定8例(30.8%)。
临床表现:发热首诊患者23例(88.5%),活动性呼吸困难19例(73.1%),静息憋喘4例(15.4%),干咳21例(80.8%),紫绀6例(23.1%),肺喘鸣音9例(34.6%)。
2.3. 方法
对过去10年间符合PCP诊断的患者初始确诊时的胸部CT影像作为研究资料进行病例对照研究分析,内容包括影像征象及病变具体部位。在分析时以肺叶为单位,双肺均按照上叶/上中叶、下叶、全肺来统计描述。
3. 结果
3.1. 全部PCP患者胸部CT影像分布特征
在入组的26例病例中,弥漫性磨玻璃影占比最大,共计24例(92.3%),其他影像依次为网格影12例(46.2%),肺气肿影9例(24.6%),双轨征7例(26.9%),斑片影8例(30.8%),弓月征6例(23.1%),铺路石征3例(11.5%) (如图1~6)。具体分布中肺气肿以上肺叶分布为主,磨玻璃阴影以全肺叶居多,月弓征及斑片阴影以肺下叶为主,未见合并胸腔积液。与文献报道基本一致,见表1。

Figure 1. Both lungs show ground glass density shadows with symmetrical and diffuse distribution
图1. 双肺呈磨玻璃密度影,伴对称、弥漫性分布
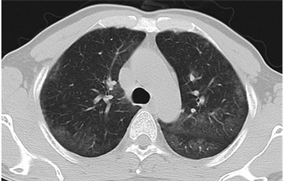
Figure 2. Scattered shadows of ground glass in both lungs
图2. 双肺磨玻璃影散在分
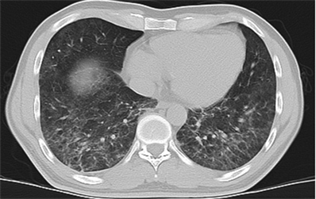
Figure 3. Density shadow of ground glass in both lungs with cord and grid shadows
图3. 双肺磨玻璃密度影伴条索状影、网格影

Figure 4. Density shadow of ground glass in both lungs, with patch consolidation shadow in the upper lobe of the left lung
图4. 双肺磨玻璃密度影,左肺上叶见斑片实变影
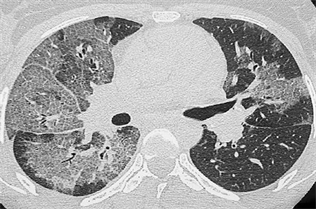
Figure 5. Multiple lobules are thickened and paving stone signs are changed
图5. 多发小叶间隔增厚,铺路石征改变

Figure 6. Ground glass shadow of both lungs with emphysema of the upper right lung
图6. 双肺磨玻璃影,伴右上肺气肿影
Table 1. The distribution of chest CT imaging in 26 PCP patients [cases (%)]
表1. 26例PCP患者胸部CT影像学分布[例(%)]
注:“—”表示此肺叶无相关影像学征象。
3.2. PCP患者原发疾病谱特征分析
对26例诊断为PCP的患者通过病史询问及既往病历统计,确诊为HIV/ARDS的患者为19例(73.1%),非HIV患者7例(26.9%),其中肾移植患者1例(3.8%),淋巴瘤患者1例(3.8%),干燥综合征患者1例(3.8%),嗜酸细胞性肉芽肿性多血管炎(EGPA) 1例(3.8%),2型糖尿病患者1例(3.8%),2例非HIV患者未明确原发病因。见表2。
Table 2. Etiology distribution of 26 PCP patients [cases (%)]
表2. 26例PCP患者病因分布[例(%)]
3.3. HIV及非HIV中PCP患者胸部CT影像分布特征
26例患者中,HIV患者呈磨玻璃影及肺气肿居多,分别占比为18例(94.7%)和8例(42.1%),月弓征及斑片影各5例(26.3%),双轨征及铺路石征较少,分别占比为2例(28.6%)和0例(0%)。对非HIV患者影像分析中双轨征及铺路石征居多,分别为5例(71.4%)和3例(100%),而磨玻璃阴影、肺气肿影及月弓征占比较少,分别为3例(12.5%)、1例(11.1%)和1例(16.7%)。对于网格影及斑片影无明显特征性分布人群。其中,磨玻璃影、网格、双轨征、铺路石征差异有统计学意义(表3)。
Table 3. The distribution of chest CT images of PCP patients in HIV and non-HIV [cases (%)]
表3. HIV及非HIV中PCP患者胸部CT影像分布[例(%)]
4. 讨论
1. PCP在临床属相对少见病,是免疫抑制患者严重的感染性疾病之一,常常伴有很高的病死率,据统计HIV继发PCP的病死率为10%~20%,而非HIV患者继发PCP的病死率可达30%~60% [1]。过去PCP的报道主要源于HIV/AIDS患者,分布于各年龄阶段。但随着临床技能和科研水平的进步,越来越多的PCP患者来自于其他免疫功能抑制患者(如器官移植者、恶性肿瘤、长期应用激素、糖尿病及血液病等),曾有文献报道诊断为PCP的2587例患者,其中HIV/AIDS相关PCP 2061例(79.7%),器官移植术后相关PCP 316例(12.3%),恶性肿瘤相关PCP 78例(3.0%),自身免疫性疾病相关PCP 11例(0.4%) [5]。
2. 鉴别诊断:1) 弥漫性肺泡出血:胸部X线检查表现为斑片影,实变影及磨玻璃影,中下肺野多见,HRCT影像可见腺泡填充影弥漫均匀分布,初期主要表现为磨玻璃阴影,中后期表现为结节影,当出血量较大时可表现为大片浸润影或实变影。在DAH (弥漫性肺泡出血)复发病例中,多数以间质性病变为主,最常见的是肺纤维化 [6]。2) 肺泡蛋白沉积症:常规胸部X线平片表现为多种多样,最常见的是磨玻璃样密度影,从模糊结节影到大片实变影,病变呈中央或周边分布均可见,上下肺分布未见明显差异。高分辨CT影像表现为磨玻璃密度影合并网格状影或斑片状影,病变与周围肺组织边界清晰呈地图样改变。可显示肺间质改变,部分肺泡实变,小叶间隔增厚呈铺路石征或铺路石征。典型的支气管肺泡灌洗呈“牛奶样”或“泥浆样”改变,静置后出现沉淀 [7]。3) 特发性肺纤维化:典型的IPF双肺病灶多位于胸膜下或基底部,伴有异常的网格状影,同时可见蜂窝样改变,伴或不伴有牵拉性支气管扩张,最后应当除外不符合UIP型改变① 双肺病灶主要出现于中,上肺野;② 病变主要延支气管血管束分布;③ 广泛磨玻璃样影;④ 大量微结节(双侧,上肺野分布为主);⑤ 散在囊状病变;⑥ 弥漫性马赛克征/气体陷闭;⑦ 支气管肺段/肺叶实变影 [8]。
3. 查阅相关文献HIV/AIDS合并PCP的胸部HRCT影像包括① 两肺弥漫磨玻璃阴影:早期以弥漫浸润的实质病变为主,随着病情加重逐步出现多发磨玻璃阴影,磨玻璃影作为在其最具特征性的CT影像。此时双肺出现透亮度降低,病变以肺门周围及两肺中、下部分布为主,以间质改变为主 [9];② 肺气肿:大多早期见于肺上叶,后期中叶及下叶也可见,肺气肿影源于肺泡与肺间质炎性改变和成纤维细胞增殖导致气道重塑,当肺气肿不断扩大扩大甚至发生破裂,破裂时可伴有自发性气胸形成;肺实质多发的囊性改变,提示肺间质的终末期样改变,常常是一种不可逆的表现 [10] [11];③ “月弓征”影像:常常出现在发病早期或进展期,主要为胸膜下可见的正常肺组织形成的类似新月形样或弓形样豁免区域,表示该区域为尚未因病变受累的肺组织,目前学界部分专家认为“月弓征”与HIV继发PCP有着较高的相关性 [9]。
同时结合文献及本次回顾性研究数据分析非HIV合并PCP的胸部螺旋CT表现主要有① 双轨征:该征象可见于双上肺,或全肺受累,本研究患者中出现双轨征者共7例(26.9%),非HIV占有5例(71.4%),根据患者基础病史及部分病理提示双轨征即支气管扩张所致,与患者局部起到慢性炎症导致官腔渗出物增多及气道壁水肿相关。治疗中除了积极治疗PCP外还应覆盖结构性肺病的基础治疗。因此在一些文献中提出非HIV患者继发PCP临床症状及死亡率均高于HIV相关性PCP患者。② 铺路石征:本研究铺路石征有3例(11.5%),铺路石征在HRCT上表现为地图状分布,重叠有网状的光滑的细线磨玻璃影,细线影多为小叶间隔水肿及慢性炎症增厚,该征象可见于很多疾病。
综上所述,无论是HIV/ARDS还是非HIV患者,若在随诊或近期出现肺部感染性病变时,HRCT扫描可见前述双肺间质性病变、如弥漫性磨玻璃影、新发肺气肿,月弓征,双轨征及铺路石征等表现应高度警惕PCP感染的可能,尽可能做到早期诊断PCP,早期治疗,从而改善预后;同时可以通过不同的螺旋CT影像来提示HIV及非HIV疾病的早期筛查 [12]。
文章引用
刘珍慧,万甜甜,何雪琨,栾琳慧,王志强. 肺孢子菌肺炎在HIV与非HIV中的影像学特征
Imaging Features of Pneumocystis Pneumoniae in HIV and Non-HIV Patients[J]. 临床医学进展, 2020, 10(12): 3331-3337. https://doi.org/10.12677/ACM.2020.1012498
参考文献
- 1. Thomas Jr., C.F. and Limper, A.H. (1998) Pneumocystis Pneumonia: Clinical Presentation and Diagnosis in Patients with and without Acquired Immune Deficiency Syndrome. Seminars in Respiratory Infections, 13, 289-295.
- 2. 丘金铭, 吴仁华. 肺孢子菌肺炎的影像学表现[J]. 新发传染病电子杂志, 2019, 4(4): 235-239.
- 3. 陈龙华, 史东立. 艾滋病合并卡式肺孢子菌肺炎的CT特点及与预后的关系[J]. 放射学实践, 2016(7): 634-637.
- 4. 郭艳, 刘挨师. 艾滋病合并卡氏肺孢子菌肺炎的CT影像学分析[J]. 中华实验和临床感染病杂志(电子版), 2013(1): 24-27.
- 5. 王晶. 肺炎的临床特点及诊治第4讲: 肺孢子菌肺炎的诊治[J]. 中国临床医生, 2011, 39(7): 26-28.
- 6. 钟南山, 刘又宁. 呼吸病学[M]. 第2版. 北京: 人民卫生出版社, 2012.
- 7. 吕铭, 张洪标, 曾维余, 等. 艾滋病合并卡氏肺孢子菌肺炎的CT表现[J]. 牡丹江医学院学报, 2016(4): 101-102.
- 8. Raghu, G., Collard, H.R., Egan, J.J., et al. (2011) Idiopathic Pulmonary Fibrosis: Evidence-Based Guidelines for Diagnosis and Management. American Journal of Respiratory & Critical Care Medicine, 183, 788-824. https://doi.org/10.1164/rccm.2009-040GL
- 9. 马胜江, 郭学军. 艾滋病合并卡氏肺孢子菌肺炎的CT诊断[J]. 中国CT和MRI杂志, 2019(7): 74-75+106.
- 10. Fujii, T., Nakamura, T. and Iwamoto, A. (2007) Pneumocystis Pneumonia in Patients with HIV Infection: Clinical Manifestations, Laboratory Findings, and Radiological Features. Journal of Infection & Chemotherapy, 13, 1-7. https://doi.org/10.1007/s10156-006-0484-5
- 11. Crans Jr., C.A. and Boiselle, P.M. (1999) Imaging Features of Pneumocystis carinii Pneumonia. Critical Reviews in Diagnostic Imaging, 40, 251-284. https://doi.org/10.3109/10408379991249194
- 12. Lu, P.X., Deng, Y.Y., Liu, S.T., et al. (2012) Correlation between Imaging Features of Pneumocystis jiroveci Pneumonitis (PCP), CD(4) (+) T Lymphocyte Count, and Plasma HIV Viral Load: A Study in 50 Consecutive AIDS Patients. Quantitative Imaging in Medicine and Surgery, 2, 124-129.
NOTES
*通讯作者。
