 Bioprocess 生物过程, 2012, 2, 89-97 http://dx.doi.org/10.12677/bp.2012.22015 Published Online June 2012 (http://www.hanspub.org/journal/bp) The Study of Biotechnological Production of 2-Phenylethanol* Mingle Cao2, Xinglin Jiang1, Haibo Zhang1, Mo Xian1, Feng Huang2 1Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 2State Key Laboratory of Microbial Technology, Shandong University, Ji’nan Email: zhanghb@qibebt.ac.cn Received: Feb. 21st, 2012; revised: Mar. 14th, 2012; accepted: Mar. 24th, 2012 Abstract: 2-Phenylethanol (β-Phenylethanol) is aromatic flavour and fragrance compound with an elegant, fine, endure, rose-like odour. It can be used as additives in perfume, cosmetic, food industries. It also can be used as pharmaceutical intermediates and fine chemicals. So far, 2-PE is mainly produced chemically. The biosynthesis of 2-PE is receiving more attentions, because of its low energy consumption, environmentally friendly, and the demand for the “natural” 2-PE. This review introduces the production of 2-PE especially the biosynthesis method, metabolic pathway, and fer- mentation method. Keywords: 2-Phenylethanol; Spices; Bio-Catalytic; Ehrlich Pathway; ISPR 生物催化法生产 2-苯乙醇的研究现状* 曹明乐 2,姜兴林 1,张海波 1,咸 漠1,黄 峰2 1中国科学院青岛生物能源与过程研究所,青岛 2山东大学微生物技术国家重点实验室,济南 Email: zhanghb@qibebt.ac.cn 收稿日期:2012 年2月21 日;修回日期:2012年3月14日;录用日期:2012年3月24日 摘 要:2-苯乙醇(2-Phenylethanol)也叫 β-苯乙醇,英文简称 2-PE,具有淡雅、细腻、持久、玫瑰香味的芳香族 香气物质。2-苯乙醇可以作为香料广泛应用于香水、化妆品、食品等行业,此外 2-苯乙醇在医药中间体及精细 化工等行业也有重要的开发价值。目前2-苯乙醇主要是通过化学方法合成,生物催化法具有能耗低、环境污染 小及人们对“天然”产品的要求也越来越高使得生物催化法来合成“天然”的 2-苯乙醇受到越来越多的重视。 本综述主要介绍了 2-苯乙醇的合成现状,并且着重对生物合成方法、代谢途径及当前发酵方法优缺点进行了论 述。 关键词:2-苯乙醇;香料;生物催化;艾利氏途径;原位萃取 1. 引言 2-苯乙醇是一种 具有玫瑰花香 味的芳香醇[1],中 文名称有:β-苯乙醇,苯乙醇,苄基甲醇,β-苯基乙 醇,2- 苯基乙醇;英文名称有:Phenethyl alcohol, Benzeneethanol ,2-Phenylethanol ,2-Phenylethyl al- cohol,β-Phenylethanol,β-Phenylethyl alcohol,Benzyl -carbinol,β-Hydroxyethylbenzene。2-苯乙醇最早是作 为玫瑰花中特征性的香气化合物被发现的[2]。在大马 士革玫瑰的香精油中,2- 苯乙醇占到其总挥 发物含 量 的60%以上[3]。2-苯乙醇由于具有玫瑰花的芳香而备 受人们欢迎和喜爱,使 2-苯乙醇成为在香水和化妆品 行业中应用最广泛的香料化合物[4]。此外,2- 苯乙 醇 还作为香精广泛应用在食品行业中,如饮料、面包、 饼干、口香糖等。 *基金项目:Y112131105,Y2008B43。 Copyright © 2012 Hanspub 89  生物催化法生产 2-苯乙醇的研究现状 据估计在 1990 年全球市场对 2-苯乙醇的销售量 大约为 7000 t·a−1[5]。目前市场上的 2-苯乙醇主要是靠 化学合成方法生产的,但由于2-苯乙醇的应用领域而 使人们更倾向于使用“天然”来源的 2-苯乙醇;而且 利用标记为“天然”的原材料来合成的 2-苯乙醇价格 要远高于化学法合成的2- 苯乙醇。其差别在于生产方 法不同,在欧美国家标记为“天然”的香料在生产时 必须利用天然原材料通过物理方法,酶催化方法及微 生物转化法来生产[6]。在 2002 年全球“天然”2-苯乙 醇的全球市场销售只有0.5 t,其价格在US $1000 kg−1 左右[1,7]。这篇综述将从2-苯乙醇的生产方法、生物合 成、生理学作用以及应用等方面对 2-苯乙醇进行详细 的总结。 2. 苯乙醇的性质及化学合成法 2.1. 2-苯乙醇的性质 2-苯乙醇的分子式为C8H10O,分 子 量122.17,外 观呈无色至淡黄色液体,色泽不超过 4号色标。具有 新鲜面包香、清甜的玫瑰样花香,易溶于醇、醚,一 升水中大约能够溶解 19 g 苯乙醇。其在空气中的嗅觉 阀值为 12~24 ng/L,在水中时嗅觉阀值在1000 µg/L 左右。 2.2. 化学法合成 2-苯乙醇 化学法合成 2-苯乙醇主要有三条路线。第一条是 以苯乙烯为原料合成 2-苯乙醇。首先是将苯乙烯氧化 为环氧苯乙烷,然后环氧苯乙烷在铂等催化剂催化下 加氢生成2-苯乙醇[8]。第二条是以苯为原料的Friedel- Craft 反应。苯和环氧乙烷在以氯化铝为催化剂条件下 反应,最后反应产物水解生成 2-苯乙醇。这个反应 在1925 年最先由Schaarschmidt 发现[9]。这两条路线 图如图 1所示。第三种方法是回收氧化丙烯的副产物。 在低于环境压力下,于 150℃~250℃之间时用无机强 酸对氧化丙烯的残余副产物进行脱水,可以产生苯乙 烯并回收得到2-苯乙醇[1]。 化学法合成的2-苯乙醇产品纯度较低,纯化难度 较大,产物中往往混合一些难以除去的副产物以及有 毒有害的重金属催化剂等杂质,达不到食品级的要 求。如果进行进一步的分离纯化又会大大增加生产成 本,而且往往效果很不理想。而且化学催化底物转化 率低,常需要高温高压等苛刻的工业条件,对设备的 要求较高。化学法合成的 2-苯乙醇达不到欧洲和美国 食品药品管理局的“天然”标准,因此产品售价低廉, 市场竞争力弱。2008 年1月份化学合成的 2-苯乙醇国 际市场价格为5.5 美元[11],价格不到“天然”2-苯乙 醇的百分之一。 3. 苯乙醇的天然来源及生理学作用 3.1. 2-苯乙醇的天然来源 天然 2-苯乙醇主要存在于花类和一些植物的香 精油中,比如玫瑰、康乃馨、风信子、苹果、香蕉、 杏仁、桃、梨、草莓、可可、茉莉花、阿勒颇松树、 水仙花、橙花、铃兰、天竺葵、百合花、茶叶和烟草 等,在蜂蜜中也含有 2-苯乙醇。但是天然 2-苯乙醇在 植物中含量极少,只有在玫瑰花的玫瑰精油中含量较 高,在一些品种的玫瑰花中,2-苯乙醇的含量甚至可 以达到玫瑰精油总量的一半以上。目前生产“天然” 2-苯乙醇主要有两种方法,一 种是较 古老的 方法, 即 直接从植物的香精油中提取;另一种是以细胞为生物 化剂,在生物反应器中生产。其中,前者必须从 催 (styrene oxide,环氧苯乙烷;2-phenylethanol,2-苯乙醇;1-phenylethanol,1-苯乙醇;phenylacetaldehyde,苯乙醛)[10] Figure 1. Styrene oxide reduction for 2-PE synthesis and the main produ ct. Friedel-Craft reaction for 2-PE synthesis[1] 图1. 环氧苯乙烷催化加氢反应的主要产物。合成 2-苯乙醇的 Friedel-Craft 反应[1] Copyright © 2012 Hanspub 90  生物催化法生产 2-苯乙醇的研究现状 玫瑰花植物体内提取,受到原材料供给和价格的影 响,产品生产呈现季节性特点而导致较高的成本,并 且产品产量很低远远满足不了市场需求。而使用微生 物催化法来替代从植物中直接提取可以大大的降低 生产的成本。后者主要有两种生物细胞催化法,目前 最常用的就是以酵母细胞为生物催化剂,通过 Ehrlich 途径以 L-苯丙氨酸为底物来生产 2-苯乙醇[12];另一条 在日本相关文献中报道较多的途径是以玫瑰花植物 原生质体通过莽草酸途径来合成2-苯乙醇[13]。 3.2. 2-苯乙醇的生理学作用 3.2.1. 抗菌活性 在1962 年Berrah 等人就已经发现 0.25%浓度的 2-苯乙醇就能明显抑 制革 兰 氏阴性 菌的 生 长,抑 制机 制是 2-苯乙醇能够抑制菌体中 DNA 的合成[14]。1967 年Silver 等人对 E. coli进行的研究表明,2-苯乙醇抑 制机制是能够使细胞的渗透性屏障崩溃,首先是使细 胞膜崩解,改变细胞膜功能,随后才是抑制核酸合成 和其它的细胞功能[15]。1982 年Sasser等人的实验表明, 1.024 g/L 以上浓度的 2-苯乙醇可以明显抑制烟草中 Pseudomonas pisi 的菌体活性[16]。2003 年Fraud 更进一 步研究了 2-苯乙醇对革兰氏阴性菌,球菌和杆菌的抑 制[17]。2- 苯乙醇植物果实、鲜花等有保护作用,机制 是2-苯乙醇能抑制植物中病害菌的生长,随后 Mo 等 人的研究证实了 2-苯乙醇在草莓保藏中的抗菌保鲜机 制[18]。总结出 2-苯乙醇的抗菌机制是首先使细胞的渗 透性屏障细胞膜崩解,使细胞质外流,丧失细胞活力, 然后进一步影响胞内功能,抑制核酸合成等,最终导 致细胞裂解死亡。2- 苯乙醇对许多 病害 菌 都能进 行有 效的抑制,这些特性可以使其应用在医药等行业中作 为抗菌物质来取代人工合成的杀菌剂和消毒剂等。 3.2.2. 植物生长发育中作用 近年来发现,2-苯乙醇在植物的生长发育过程中 还具有促进繁殖、抗菌、保护植物等生物学功能[2]。 目前已经对玫瑰花中以 L-苯丙氨酸为原料合成2-苯 乙醇的两个关键酶,PLP 依赖的脱羧酶和苯乙醛脱氢 酶进行了研究[19]。对玫瑰中通过莽草酸途径合成 2- 苯乙醇的机制也进行了阐明[13]。在玫瑰花和许多其它 花类以及成熟的果实中的 2-苯乙醇散发的香味能够 吸引昆虫,其作用于其传粉和传播种子有关[20]。 玫瑰等花类合成的2-苯乙醇一方面能作为抗菌 等物质来提高自身的免疫力,抵抗病虫害等,提高其 生存能力。另一方面,2- 苯乙醇所具有的香 味能够 引 诱昆虫来帮助植物完成授粉和传播种子,促进其繁殖 后代。两方面的作用都能增加植物的生存能力,表明 2-苯乙醇不仅是人们所需要的香料物 质,在 自然界 中 也是扮演着和重要的角色。 3.2.3. 药理学作用 2-苯乙醇不仅具有抗菌活 性, 而且 其衍 生物 苯 乙 醇苷具有药用价值,近年来许多研究表明,该类化合 物具有抗菌、抗炎、抗病毒、抗肿瘤、抗氧化、免疫 调节、增强记忆、保肝、强心等作用,尤其以抗菌活 性最为显著[21]。李刚等人的研究表明苯乙醇苷有助于 小鼠精子的体外抗氧化作用[22]。人体内的致病菌主要 为原核生物,2-苯乙醇的抑菌活力也 主要限 制于革 兰 氏阴性菌,因此可以有选择的作用于致病菌,应用于 医药行业来替代部分抗生素,解决细菌的耐药性问 题。在许多药物中都含有 2-苯乙醇衍生物的有效成 分,其它种类的衍生物的药用价值也在不断的发现。 随着 2-苯乙醇在医学中生理功能研究的深入,以及药 理学机制的阐明,其在医药行业也将发挥更大的作 用,更好的造福人类。 4. 苯乙醇生物合成的研究现状 4.1. 从玫瑰精油中直接提取 2-苯乙醇最早是从玫瑰花 的精 油中 发现 的, 因 此 最简单的方法就是直接从玫瑰花的精油中直接提取。 然而玫瑰花的产量有限,例如1993 年全国年产玫瑰 花100 多万 Kg,可提供玫瑰油 40 Kg,但是上海日化 公司一家年需要玫瑰油就达50 Kg以上[23]。从玫瑰 花 等植物中直接提取 2-苯乙醇的原料价格非常高昂。提 取天然 2-苯乙醇的原料玫瑰精油国际市场的价格就 已高达 3500~6000 美元/Kg[24]。从玫瑰精油中直接提 取受原材料供应的限制。利用玫瑰为原材料直接提取 先天不足,产量低,原料来源困难以及生产无法实现 可持续。从玫瑰精油中直接提取 2-苯乙醇无法进行大 规模的产业化生产,无法满足日益增长的市场需求, 因此必须寻找其它替代途径。利用微生物催化法生产 成本较低,可以实现小规模的可持续发酵生产,而且 发酵周期短,产品产量高。 Copyright © 2012 Hanspub 91  生物催化法生产 2-苯乙醇的研究现状 4.2. 由植物细胞合成 2-苯乙醇 2-苯乙醇在玫瑰花中含量 较高 ,因 此可 以利 用 玫 瑰的植物细胞培养来合成 2-苯乙醇,但是产量一般非 常低,而且培养周期较长,限制了其工业化应用。 Banthorpe 等人用大马士革玫瑰培养来合成 2-苯乙醇 的产量只有 0.013 mg/kg[25]。利用植物细胞作为生物催 化剂来合成 2-苯乙醇的方法在日本研究较多,主要利 用玫瑰花的细胞为催化剂来合成2-苯乙醇[13,19]。植物 细胞的培养条件更加苛刻,应用时使用其原生质体, 植物细胞的培养难以做到无菌培养,生产周期较长。 而且由于2-苯乙醇是植物细胞的副产物,因此产量低 代谢活力不高,以植物细胞的原生质体来合成2-苯乙 醇目前还处于实验探索阶段,距离工业化应用尚需时 日。必须寻找更为有效的转化方法。 使用微生物催化合成法可以同时克服从玫瑰精 油中直接提取时成本高昂、受原材料产量影响等原因 不能满足广大的市场需求和化学法合成时产品含有 毒杂质、价格低廉的缺点。微生物法合成的 2-苯乙醇 香味纯正,不含各种受到限制的杂质,产量高,有利 于进行工业化生产,成本低廉,利润空间巨大。 4.3. 微生物法合成 2-苯乙醇 生物法合成的 2-苯乙醇被欧洲和美国的食品管 理局标记为“天然”产品,使其具有了很强的市场竞 争力[26]。利用微生物合成的产品生产成本低,产量高, 所获得的产品纯度较高以及不含有有毒有害杂质,而 且生产不受天气和原料供应的影响和符合“天然”的 规定,因此利用微生物法来合成 2-苯乙醇是当今国际 国内发展趋势。微生物在合成主产物 2-苯乙醇时,一 些副产物如苯乙醛等也是重要的香料[27]。能够合成2- 苯乙醇的微生物主要是酵母属,但是也有细菌如肠杆 菌属等能利用葡萄糖从头合成2-苯乙醇。 通过生物技术来生产 2-苯乙醇比较常用的技术 是通过与菌体生长相关联的生物催化法,即使用酵母 菌经由 Ehrlich 途径利用 L-苯丙氨酸(L-Phe)来合成 2- 苯乙醇[28-30]。然而,酵母利用 L-苯丙氨酸来生产 2- 苯乙醇时,2-苯乙醇在浓度较 高时可 能对细 胞产生 抑 制作用而降低其产量[31,32]。据文献报道在以酵母催化 合成 2-苯乙醇时,2.5 g/L的2-苯乙醇就能抑制75% 的酵母生长,3 g/L的2-苯乙醇几乎可以抑制全部酵 母的生长[33],产物对菌株的抑制作用限制了产物产量 的进一步提高。Fabre等人用 Kluyveromyces marxianus 通过分批培养生产 2-苯乙醇时最高浓度达到 1.4 g/L[4]。Albertazzi 等人利用 Hansenula anomala 菌株生 产2-苯乙醇最高产量达到了 1.73 g/L[34]。Seward 和 Stark 等人用不同的 Saccharomyces cerevisiae菌株分批 发酵产 2-苯乙醇最高达2.6 g/L[35,36]。Stark 用S. cere- visiae 通过流加葡萄糖分批–补料培养 来抑 制产 生乙 醇并获得了 3.8 g/L的2-苯乙醇浓度。通过普通的发 酵手段已经很难再提高2- 苯乙醇的产量,因为乙醇和 苯乙醇具有协同抑制效应而降低2-苯乙醇的产量[37]。 文献中报道的2-苯乙醇的产量基本在 3 g/L左右,原 因是此浓度以上的产物对菌体的抑制作用非常强烈; 要想使菌体继续合成产物,首先应该解除产物对菌体 的这种抑制作用。要解除 2-苯乙醇对细胞的抑制作用 主要有两种方法:第一是用原位产物分离技术(In situ product removal,即ISPR)将产物实时分离出来,这种 方法可以使 2-苯乙醇的最终浓度和转化效率都有所 提高[37,38];第二是筛选耐 2-苯乙醇的菌株来提高其产 量。崔志峰等人通过紫外诱变获得了对 2-苯乙醇耐受 性提高 50%,产量提高9.1%的突变株[39]。 原位分离技术已经比较成熟,在工业化应用中较 为常见,其特点是工艺简单,成本可控适宜于规模化 生产。目前获得高产菌株的方法主要是从自然界筛选 以及对已有生产菌株进行诱变等,然而由于自然菌株 的枯竭,很难筛选到更高产量的菌株,而且菌株诱变 负突变多,突变株性能易退化,效果并不理想。因此 必须考虑更为可靠的高产菌株获取方法,可以利用目 前较为成熟的分子生物学手段,对已有菌株进行定向 改造,例如通过过表达合成途径的关键酶,抑制分支 途径以减少代谢流损失等都可以有效的提高菌株的 生产性能。分子克隆技术是微生物合成中广泛应用的 技术,其中部分产品已经进行工业化应用。改造后的 工程菌生产性能稳定,比野生菌具有更高的效率,可 以有效的降低生产成本,提高生产效率,是今后发展 趋势。 4.4. 2-苯乙醇发酵生产技术 由于细胞产生的2-苯乙醇对其自身有抑制作用, 为了获得更高的产物浓度,必须解除这种抑制,将产 Copyright © 2012 Hanspub 92  生物催化法生产 2-苯乙醇的研究现状 物从发酵液中提取出来降低其浓度以解除抑制。为了 适合工业化生产,必须采用经济有效的萃取技术。从 发酵液中实时萃取出 2-苯乙醇的方法主要有:第一, 液–液萃取,其成本比较低、操作简便、而且提取量 比较大,缺点是有机溶剂可能对细胞有毒性、溶剂的 选择有限制、有时两相的分离可能会有困难[36,40]。刘 国等人用油酸作为萃取剂 2-苯乙醇的最终浓度达到 4.55 g/L[41];梅建凤等人以油酸为 萃取剂, 最终获得 有机相和水相中2-苯乙醇的浓度分别为 14.9 g/L 和 1.74 g/L[42];Stark 等人用油酸作为萃取剂时发酵罐中 2-苯乙醇的最终浓度为 12.6 g/L,有机相中 2-苯乙醇 的浓度达到了24 g/L,平均转化速率达到了 0.26 g/L·h 和最大转化速率为 0.47 g/L·h[43]。Etschmann 等人用 Kluyveromyces marxianus CBS 600以油醇为萃取剂进 行两相发酵获得了 3 g/L的2-苯乙醇[44],使用遗传算 法将培养基优化后获得了 5.6 g/L的2-苯乙醇[45]。而 利用分批补料技术可以获得更高的2-苯乙醇产量, 2006 年Etschmann等人用 Kluyveromyces marxianus CBS 600 菌株以聚丙二醇 1200 为萃取剂,最终在有机 相中获得了 26.5 g/L的2-苯乙醇和6.1 g/L的2-苯乙 醛[46]。第二,利用水–固相分隔生物反应器(TPPB) 作为产物原位分离技术。这种系统使用高聚小球作为 隔离不相混和相来隔离2-苯乙醇,并将水相中的 2- 苯乙醇浓度降低到非抑制水平;利用这种系统Fang Gao 等人的最终2-苯乙醇产量为 20.4 g/L,水相中浓 度为 1.4 g/L,聚合物相中的浓度为 97 g/L[47]。第三, 超临界流体二氧化碳(SCCO2)萃取;超临界流体二氧 化碳(SCCO2)萃取,其萃取能力比较强,但是可能会 对细胞造成损害以及需要将细胞进行分离开[31]。需要 首先将菌体除去然后再用超临界流体二氧化碳萃取。 Cathy E. Fabre(1999)等人利用此技术对 2-苯乙醇的回 收率在 90%以上,萃取的 2-苯乙醇的回收率在 97%以 上,纯度也达到了 91%[31]。第四,离子液体。2010 年Sendovski 等人研究了不相容离子液体(ILs)在两相 体系中提取 2-苯乙醇的效果,通过对九种离子液体的 研究发现[Tf2N]型阴离子相对于[PF6]和[BF4]阴离子 来说是生物相容性最好的,吡啶和铵阳离子比咪唑阳 离子要好;在大于六个碳原子后,烃链越长生物相容 性越差;2-苯乙醇在 BMIM[Tf2N]中的分配系数(KD) 达到了 17.6,用MPPyr[Tf2N],OMA[Tf2N],和BMIM [Tf2N]三种离子液体处理后,2-苯乙醇浓度可以增加 3~5 倍[48]。离子液体可重复回收利用,其缺点是成本 较高而且部分离子液体毒性较大,对生产“天然”产 物产生限制。第五,吸附剂进行吸附,其选择的特异 性比较强,但是分离能力较低,如果不是将吸附剂直 接加入发酵液中而是实行在线萃取的话还需要将细 胞分离出来以防止柱子堵塞[40,49,50]。2009年关昂等人 利用大孔吸附树脂 FD0816 作为原位转移产物的介 质,使 2-苯乙醇的最终浓度达到了 12.80 g/L,随 后 用 乙醇进行洗脱时,2-苯乙醇的洗脱率在 95%以上,洗 脱液中 2-苯乙醇的浓度达到了60 g/L[51]。第六,溶剂 固定化,其操作简单、萃取量较大,但是需要额外的 溶剂固定化步骤[36]。第七,渗透蒸发,其选择性较强、 能将 2-苯乙醇直接浓缩至很高的浓度而且灭菌比较 容易,但是其分离量可能较低[52]。第八,渗透萃取, 不需要将细胞分离出来,萃取量大,但是 2-苯乙醇的 最终浓度在有机溶剂中被高度稀释,而且溶剂的选择 受到限制和对细胞可能产生毒性[40]。 原位萃取技术多种多样,然而其原理都是根据萃 取剂对 2-苯乙醇的选择性吸附作用,或者是选择性分 离作用将产物从发酵液中分离出来。在选择萃取剂时 需要考虑产物在发酵液和萃取剂中的分配系数,选择 在萃取剂中分配系数高的;其次要萃取剂和发酵液应 易于分离,便于回收萃取剂;第三,萃取剂不应该对 菌体产生抑制作用;第四,选择对人体无毒或毒性较 低的萃取剂;第五,萃取剂应价格低廉,便于大规模 应用。 利用细胞固定化技术可以有效的提高菌体的利 用效率,固定化菌体可以多次重复利用,有利于降低 生产成本,固定化可以明显减少乙醇和 2-苯乙醇对细 胞的抑制作用。目前常用的固定化技术主要有吸附、 包埋、交联、共价结合等。利用固定化技术将 Acetobacter sp.菌固定在海藻酸微胶囊中,可以利用 4 g/L 的2-苯乙醇产1.92 g/L的苯乙醛,而且转化速率 比非固定化细胞要快,原因是固定化技术使细胞免除 了底物和产物对细胞的毒害作用[27]。细胞固定化技术 可以通过分批补料发酵,实现可持续发酵,固定化细 胞的活力较高,生产时间较长,可以延长发酵时间, 提高设备的利用率。通过固定化增加了细胞的抗逆性 能力,可以忍受更高的产物浓度。菌体分离简单,便 于利用原位萃取技术将产物快速分离出来,简化和纯 化工艺。 Copyright © 2012 Hanspub 93 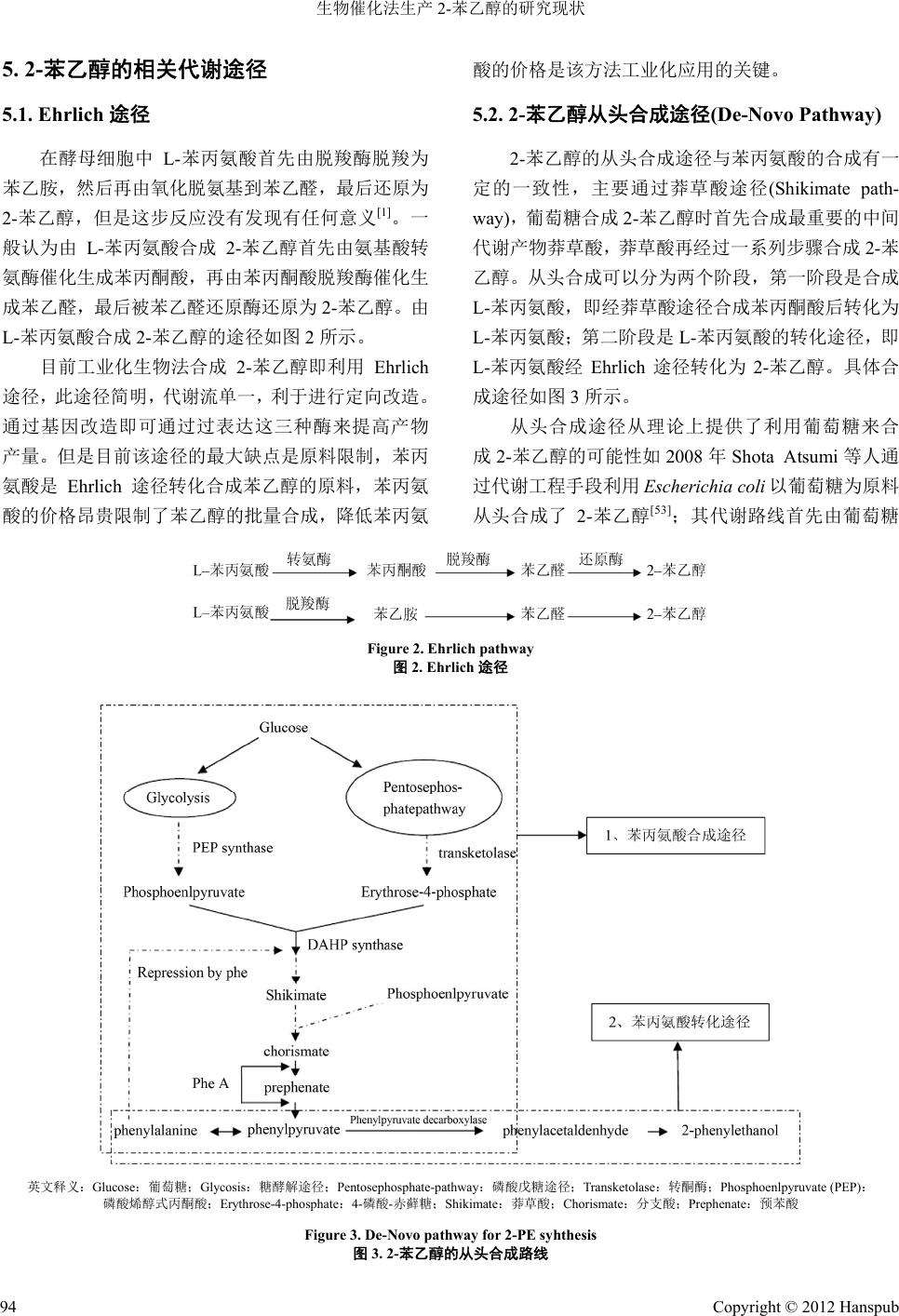 生物催化法生产 2-苯乙醇的研究现状 Copyright © 2012 Hanspub 94 5. 2-苯乙醇的相关代谢途径 5.1. Ehrlich途径 在酵母细胞中 L-苯丙氨酸首先由脱羧酶脱羧为 苯乙胺,然后再由氧化脱氨基到苯乙醛,最后还原为 2-苯乙醇,但是这 步反应没有发现有任何意义[1]。一 般认为由 L-苯丙氨酸合成 2-苯乙醇首先由氨基酸转 氨酶催化生成苯丙酮酸,再由苯丙酮酸脱羧酶催化生 成苯乙醛,最后被苯乙醛还原酶还原为 2-苯乙醇。由 L-苯丙氨酸合成2-苯乙醇的途径如图 2所示。 目前工业化生物法合成 2-苯乙醇即利用 Ehrlich 途径,此途径简明,代谢流单一,利于进行定向改造。 通过基因改造即可通过过表达这三种酶来提高产物 产量。但是目前该途径的最大缺点是原料限制,苯丙 氨酸是 Ehrlich 途径转化合成苯乙醇的原料,苯丙氨 酸的价格昂贵限制了苯乙醇的批量合成,降低苯丙氨 酸的价格是该方法工业化应用的关键。 5.2. 2-苯乙醇从头合成途径(De-Novo Pathway) 2-苯乙醇的从头合成途径 与苯 丙氨 酸的 合成 有 一 定的一致性,主要通过莽草酸途径(Shikimate path- way),葡萄糖合成 2-苯乙醇时首先合成最重要的中间 代谢产物莽草酸,莽草酸再经过一系列步骤合成2-苯 乙醇。从头合成可以分为两个阶段,第一阶段是合成 L-苯丙氨酸,即经莽草酸途径合成苯丙酮酸后转化为 L-苯丙氨酸;第二阶段是L- 苯丙氨酸的转化途径,即 L-苯丙氨酸经 Ehrlich 途径转化为 2-苯乙醇。具体合 成途径如图 3所示。 从头合成途径从理论上提供了利用葡萄糖来合 成2-苯乙醇的可能性如 2008年Shota Atsumi等人通 过代谢工程手段利用 Escherichia coli以葡萄糖为原料 从头合成了 2-苯乙醇[53];其代谢路线首先由葡萄糖 Figure 2. Ehrlich pathway 图2. Ehrlich途径 英文释义:Glucose:葡萄糖;Glycosis:糖酵解途径;Pentosephosph at e-pathway:磷酸戊糖途径;Transketolase:转酮酶;Phosphoenlpyruvate (PEP): 磷酸烯醇式丙酮酸;Erythrose-4 - pho sph a te :4-磷酸-赤藓糖;Shikimate:莽草酸;Chorismate:分支酸;Prephenate:预苯酸 Figure 3. De-Novo pathway for 2-PE syhthesis 图3. 2-苯乙醇的从头合成路线  生物催化法生产 2-苯乙醇的研究现状 合成苯丙酮酸,再由苯丙酮酸脱羧酶和苯乙醛还原酶 催化生产 2-苯乙醇,其中酮脱羧酶在细菌中分布较 少;向 E. coli 细胞中导入不同外源酮脱羧酶基因后, 最高 2-苯乙醇产量为469 μM,向菌体提供苯丙酮酸 底物时苯乙醇产量提供了 15 倍达到7269 μM。 目前该方法是最有建立低成本大量生产苯乙醇 的方法,而且本途径以可再生生物质糖基化产物葡萄 糖为原料,具有可持续的特点,使得该方法具有更好 的竞争性。 6. 2-苯乙醇的应用 最早的 2-苯乙醇的市场数据可以追踪到 1990 年 [1]。当时,全球每年生产 2-苯乙醇的产量估计在 7000 t[5,54],其用途如下:6000 t 用于香水行业,10 t 用于香 味调味应用和剩下的990 t用于合成反应产物如酯类 等[1]。随着 2-苯乙醇生产工艺的成熟,其应用领域也 在不断拓展,未来全球的市场需求也会不断增加。 2-苯乙醇除了主要用做香料,2- 苯乙醇的最大用 途就是以香料成分添加进香水化妆品以及洗涤行业 中,源于其淡雅、细腻而 持 久的香 型。2- 苯乙醇 在许 多食品中也作为特征香味化合物来满足其香味要求, 尤其在发酵食品中广泛存在,如白酒、啤酒、巧克力 饮料、咖啡、面包、果汁和酱类[27]。2-苯乙醇是酒精 饮料中重要的高沸点香气成分,广泛存在于各种酒精 饮料中[55,56];比如黄酒、啤酒、白酒。2-苯乙醇是稻 米黄酒的特有成分[57],是黄酒中香气物质的重要成分, Tao Luo等人利用气象色谱–质谱法(GC-MS)对大约 十种中国米酒进行检测分析其中的挥发性和半挥发性 物质,发现在所有检测到 的 芳香族 化合 物 中,2- 苯乙 醇的浓度最高,其含量从最低的 1.333 mg到最高的 16.711 mg 不等[56]。2-苯乙醇不仅存在于黄酒中,在白 酒中也广泛存在,也是白酒风味的重要组成部分。 苯乙醇还是一种重要的医药中间体,由 2-苯乙醇 合成其它重要的医药产品,例如苯乙醇苷、羟基苯乙 醇等是许多药物的有效成分[22,58-60]。 此外,2-苯乙醇还广泛应用于精细化工行业来生 产其衍生物。虽然当期苯乙醇价格高于苯乙烯的价 格,随着石油化石资源的短缺,利用可再生资源合成 的苯乙醇合成苯乙烯在材料行业中具有重要的应用 前景。 7. 总结和展望 苯乙醇由于其良好的特性而受到广泛的欢迎,但 是“天然”2-苯乙醇价 格依然 昂贵。 在未来 如果能 找 到合适降低其生产成本的方法,则其全球市场需求及 应用范围将进一步扩大。目前利用酵母以 L-苯丙氨酸 来生产 2-苯乙醇仍然是主流,未来可以通过工程菌株 以葡萄糖为原料从头合成 2-苯乙醇以降低其生产成 本,因此构建合适的工程菌是关键。利用植物细胞来 合成 2-苯乙醇在国外如日本、德国、以色列等研究的 较多,利用植物细胞来合成天然 2-苯乙醇也可能是一 条较好的途径。 2-苯乙醇对菌体具有强烈 的产 物抑 制效 应, 解 除 这种抑制有两种方法:其一是筛选耐高浓度2-苯乙醇 的菌株;其二是利用原位萃取(ISPR)技术实时将其分 离出来及将两者的有机结合。 合成 2-苯乙醇的关键酶及基因在不断发现和研 究,未来相关方面的研究可能更加偏向于利用分子生 物学手段对合成2-苯乙醇代谢途径进行定向改造。 参考文献 (References) [1] M. M. Etschmann, et al. Biotechnological production of 2-phenyl- ethanol. Applied Microbiology and Biotechnology, 2002, 59(1): 1-8. [2] 杨晓, 陈芳, 李景明. 植物中 2-苯乙醇的合成研究进展[J]. 园 艺学报, 2010, 37: 1690-1694. [3] K. Rusanov, et al. Microsatellite analysis of Rosa damascena Mill. Accessions reveals genetic similarity between genotypes used for rose oil production and old Damask rose varieties. TAG Theoretical and Applied Genetics, 2005, 111(4): 804-809. [4] C. E. Fabre, P. J. Blanc and G. Goma. Production of 2-phenyl- ethyl alcohol by Kluyveromyces marxianus. Biotechnology Pro- gress, 1998, 14(2): 270-274. [5] G. S. Clark. Phenethyl alcohol. Perfum Flavor, 1990, 15: 37-44. [6] US Food and Drug Administration. 2001 in Code of Federal Regulations 21CFR101.22, 2001. [7] J. Schrader, et al. Applied biocatalysis for the synthesis of natu- ral flavour compounds—Current industrial processes and future prospects. Biotechnology Letters, 2004, 26(6): 463-472. [8] K. Yamaguchi, K. Ebitani and K. Kaneda. Hydrotalcite-cata- lyzed epoxidation of olefins using hydrogen peroxide and amide compounds. The Journal of Organic Chemistry, 1999, 64(8): 2966- 2968. [9] P. Bedoukian. Phenylethyl alcohol. Perfumery and flavoring synthetics. Wheaton: Allured, 1986: 370-383. [10] I. Kirm, et al. Hydrogenation of styrene oxide in the presence of supported platinum catalysts to produce 2-phenylethanol. Jour- nal of Molecular Catalysis A: Chemical, 2007, 261(1): 98-103. [11] 2008 年1月世界香料精油类产品市场报告[J]. 国内外香化信 息, 2008, 23(2): 1-3. [12] J. Y. Hwang, et al. Simultaneous synthesis of 2-phenylethanol and L-homophenylalanine using aromatic transaminase with yeast Ehrlich pathway. Biotechnology and Bioengineering, 2009, 102(5): 1323-1329. Copyright © 2012 Hanspub 95  生物催化法生产 2-苯乙醇的研究现状 [13] Z. Yang, et al. Elucidation of the biochemical pathway of 2-phenylethanol from shikimic acid using isolated protoplasts of rose flowers. Journal of Plant Physiology, 2009, 166(8): 887- 891. [14] G. Berrah, W. A. Konetzka. Selective and reversible inhibition of the synthesis of bacterial deoxyribonucleic acid by phenethyl alcohol. Journal of Bacteriology, 1962, 83: 738. [15] S. Silver, L. Wendt. Mechanism of action of phenethyl alcohol: Breakdown of the cellular permeability barrier. Journal of Bac- teriology, 1967, 93: 560. [16] M. Sasser. Inhibition by antibacterial compounds of the hyper- sensitive reaction induced by Pseudomonas pisi in tobacco. Phytopathology, 1982, 72: 1513-1517. [17] S. Fraud, et al. Aromatic alcohols and their effect on Gram- negative bacteria, cocci and mycobacteria. Journal of Antim- icrobial Chemotherapy, 2003, 51(6): 1435-1436. [18] E. K. Mo, C. K. Sung. Phenylethyl alcohol (PEA) application slows fungal growth and maintains aroma in strawberry. Post- harvest Biology and Technology, 2007, 45(2): 234-239. [19] M. Sakai, et al. Production of 2-phenylethanol in roses as the dominant floral scent compound from L-phenylalanine by two key enzymes, a PLP-dependent decarboxylase and a phenylacet- aldehyde reductase. Bioscience, Biotechnology, and Biochemis- try, 2007, 71(10): 2408-2419. [20] D. Tieman, et al. Tomato aromatic amino acid decarboxylases participate in synthesis of the flavor volatiles 2-phenylethanol and 2-phenylacetaldehyde. Washington DC: National Academy of Sciences, 2006. [21] 靖会, 佐建锋, 李教社. 苯乙醇苷类化合物的药理研究进展 [J]. 时珍国医国药, 2006, 17(3): 440-441. [22] 李刚, 朱文斌, 牛飞等. 肉苁蓉苯乙醇苷对大鼠精子体外氧 化损伤的保护作用研究[J]. 时珍国医国药, 2010, 21(9): 2205- 2207. [23] 刘兆荣, 刘宗歧. β-苯乙醇的合成方法与提纯[J]. 北京化工, 1993, 23(3): 33-38. [24] 梅建凤. 利用酵母细胞生物转化法合成天然 2-苯乙醇的研究 [D]. 浙江大学, 2009. [25] D. V. Banthorpe, et al. Accumulation of 2-phenylethanol by callus derived from leaf-bud of Rosa damascena. Phytochemistry, 1988, 27(3): 795-801. [26] U. Krings, R. Berger. Biotechnological production of flavors and fragrances. Applied Microbiology and Biotechnology, 1998, 49(1): 1-8. [27] J. Schrader. Microbial flavour production. Flavours and Fra- grances, 2007: 507-574. [28] P. S. J. Cheetham. The use of biotransformations for the produc- tion of flavors and fragrances. Trends in Biotechnology, 1993, 11(11): 478-488. [29] F. Ehrlich. Uber die bedingungen der fuselolbildung und uber ihren zusammenhang mit dem eiweißaufbau der Hefe. Berichte der Deutschen Chemischen Gesellschaft, 1907, 40(1): 1027- 1047. [30] D. Vollbrecht, F. Radler. Formation of higher alcohols by amino acid deficient mutants of Saccharomyces cerevisiae. I. The de- composition of amino acids to higher alcohols. Archives of Mi- krobiology, 1973, 94(4): 351-358. [31] C. E. Fabre, J. S. Condoret and A. Marty. Extractive fermenta- tion of aroma with supercritical CO2. Biotechnology and Bioen- gineering, 1999, 64(4): 392-400. [32] D. Wilkie, N. Maroudas. Induction of cytoplasmic respiratory deficiency in yeast by phenethyl alcohol. Genetical Research, 1969, 13(1): 107-111. [33] D. Stark, et al. Inhibition aspects of the bioconversion of-phenyl- alanine to 2-phenylethanol by Saccharomyces cerevisiae. En- zyme and Microbial Technology, 2003, 32(2): 212-223. [34] E. Albertazzi, et al. Biogeneration of 2-phenylethanol and 2-phenyl- ethylacetate important aroma components. Biotechnology Let- ters, 1994, 16(5): 491-496. [35] R. Seward, et al. The effects of ethanol, hexan-1-ol, and 2-phenylethanol on cider yeast growth, viability, and energy status; synergistic inhibition. Journal of the Institute of Brewing, 1996, 102: 439-444. [36] D. Stark, et al. Extractive bioconversion of 2-phenylethanol from L-phenylalanine by Saccharomy cescerevisiae. Biotech- nology Progress, 2002, 18(3): 514-523. [37] D. Stark, et al. Novel type of in situ extraction: Use of solvent containing microcapsules for the bioconversion of 2-phenyl- ethanol from L-phenylalanine by Saccharomyces cerevisiae. Biotechnology and Bioengineering, 2003, 83(4): 376-385. [38] A. Freeman, J. M. Woodley and M. D. Lilly. In situ product removal as a tool for bioprocessing. Nature Biotechnology, 1993, 11: 1007-1012. [39] 崔志峰, 车智博, 杨霄等. 2-苯乙醇耐受性高产酵母菌株的选 育[J]. 浙江工业大学学报, 2008, 36(4): 427-430. [40] C. Fabre, et al. Extraction of 2-phenylethyl alcohol: By tech- niques such as adsorption, inclusion, supercritical CO2, liq- uid-liquid and membrane separations. Perfumer & Flavorist, 1996, 21: 27-40. [41] 刘国, 陆军, 张伟国. 两相体系中菌体转化法制备 2-苯乙醇 的研究[J]. 生物技术, 2009, 19(3): 67-70. [42] 梅建凤, 陈虹, 王鸿等. 水/有机溶剂两相体系中生物转化合 成2-苯乙醇[J]. 化学反应工程与工艺, 2009, 25(1): 69-73. [43] D. Stark, et al. Extractive bioconversion of 2-phenylethanol from L-phenylalanine by Saccharomyces cerevisiae. Biotech- nology Progress, 2002, 18(3): 514-523. [44] M. Etschmann, D. Sell and J. Schrader. Screening of yeasts for the production of the aroma compound 2-phenylethanol in a molasses-based medium. Biotechnology Letters, 2003, 25(7): 531-536. [45] M. Etschmann. Medium optimization for the production of the aroma compound 2-phenylethanol using a genetic algorithm. Journal of Molecular Catalysis B: Enzymatic, 2004, 29(1-6): 187-193. [46] M. M. Etschmann, J. Schrader. An aqueous-organic two-phase bioprocess for efficient production of the natural aroma chemi- cals 2-phenylethanol and 2-phenylethylacetate with yeast. Ap- plied Microbiology and Biotechnology, 2006, 71(4): 440-443. [47] F. Gao, A. J. Daugulis. Bioproduction of the aroma compound 2- phenylethanol in a solid-liquid two-phase partitioning bioreactor system by Kluyveromyces marxianus. Biotechnology and Bio- engineering, 2009, 104(2): 332-339. [48] M. Sendovski, N. Nir and A. Fishman. Bioproduction of 2-phenylethanol in a biphasic ionic liquid aqueous system. Journal of Agricultural and Food Chemistry, 2010, 58(4): 2260- 2265. [49] A. Klingenberg, H. Hanssen. Enhanced production of volatile flavour compounds from yeasts by adsorber techniques. I. Mod- el investigations. Chemical and Biochemical Engineering, 1988, 2: 222-224. [50] R. G. Berger. Aroma biotechnology. Berlin: Springer, 1995. [51] 关昂, 王航, 孟春等. 原位转移技术用于酵母合成 2-苯乙醇 [J]. 过程工程学报, 2009, 9(1): 128-132. [52] W. Bluemke. Enhanced production of natural aroma compounds through process-integrated pervaporation. Book of Abstracts: 3rd European Symposium on Biochemical Engineering Science, 2000: 285. [53] S. Atsumi, T. Hanai and J. C. Liao. Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels. Na- ture, 2008, 451: 86-89. [54] L. P. Somogyi. The flavour and fragrance industry: Serving a global market. Chemical Industries, 1996: 170-173. [55] K. Fukuda, et al. Breeding of brewing yeast producing a large amount of β-phenylethyl alcohol and β-phenylethyl acetate. Ag- ricultural and Biological Chemistry, 1990, 54(1): 269-271. [56] T. Luo, W. Fan and Y. Xu. Characterization of volatile and semi-volatile compounds in Chinese rice wines by headspace solid phase microextraction followed by gas chromatogra- phy-mass spectrometry. Journal of the Institute of Brewing, 2008, 114(2): 172-179. [57] 陈双, 罗涛, 徐岩等. 我国黄酒酵母和酿酒原料对黄酒中 β- Copyright © 2012 Hanspub 96  生物催化法生产 2-苯乙醇的研究现状 Copyright © 2012 Hanspub 97 苯乙醇含量的影响[J]. 中国酿造, 2009, 28(4): 23-26. [58] 李丽, 刘春明, 刘志强等. 肉苁蓉中苯乙醇苷类化合物的分 离提取及电喷雾质谱研究[J]. 质谱学报, 2006, 27(4): 232- 236. [ 59] 张树军, 张军锋, 王金兰. 紫丁香树皮的化学成分研究[J]. 中草药, 2006, 37(11): 1624-1626. [60] 王健, 李锦, 郭俊华等. HPLC测定退热颗粒中连翘酯苷含量 [J]. 中国中药杂志, 2007, 32(9): 860. |