 Bioprocess 生物过程, 2012, 2, 98-104 http://dx.doi.org/10.12677/bp.2012.22016 Published Online June 2012 (http://www.hanspub.org/journal/bp) Advances in Isolating of Isoflavone Biotransforming Bacteria and Cloning of Genes Encoding Relative Biotransforming Enzymes Honglei Zhang, Xiumei Yu, Xiuling Wang* College of Life Sciences, Agricultural University of Hebei, Baoding Email: *wxling2000@hebau.edu.cn Received: Apr. 24th, 2012; revised: May 7th, 2012; accepted: May 19th, 2012 Abstract: Ep idemiological studies have shown that soy isoflav ones have many important physiological activities, such as anticarcinogenic, antiox idant, antiin flammation, protection of card iov ascular d iseases, p r even tio n o f os teopo rosis etc. Isoflavones can be converted to different metabolites, including dihydrodaidzein (DHD), dihydrogenistein (DHG), O-desmethylangolensin (O-Dma), equol etc., by gastrointestinal microflora of humans and other mammals. Both in vitro and in vivo studies have indicated that isoflavone metabolites are of stronger and wider bioactivity than that of isoflavones themselves. To date, many specific bacterial strains capable of biotransforming isoflavones have been iso- lated from the microflora living in gastrointestinal tract of different animals. At present, researchers are focusing on cloning of genes encoding different biotransforming enzymes from isolated bacterial strains responsible for biotrans- forming isoflavones. This paper will review the iso lated bacterial strains for biotransforming iso flavones and cloning of genes encoding for relative biotransforming enzymes. Keywords: Soy Isoflavones; Microbial Biotransformation; Bacteria Isolation; Gene Cloning 大豆异黄酮转化菌株的分离及相关转化酶基因克隆研究进展 张红蕾,于秀梅,王秀伶* 河北农业大学生命科学学院,保定 Email: *wxling2000@hebau.edu.cn 收稿日期:2012年4月24日;修回日期:2012年5月7日;录用日期:2012年5月19日 摘 要:大量流行病学研究表明,大豆异黄酮具有明显的抗癌、抗氧化、抗炎、防护心脑血管以及预防骨质疏 松等多种生理功能。被人和其他哺乳动物摄入体内的大豆异黄酮在胃肠道菌群作用下可被降解为二氢黄豆苷原、 二氢染料木素、去氧甲基安哥拉紫檀素、雌马酚等不同代谢产物。体内及体外研究结果均表明,大豆异黄酮代 谢产物具有比大豆异黄酮更高、更广的生物学活性。迄今,已有大量大豆异黄酮代谢产物产生菌从不同动物胃 肠道微生物菌群中被分离出来。目前,人们正专注于从已分离的大豆异黄酮转化菌株中克隆相关转化酶基因。 本文将对大豆异黄酮转化菌株分离及相关转化酶基因克隆现状作一综述。 关键词:大豆异黄酮;微生物转化;菌株分离;基因克隆 1. 引言 异黄酮(Isoflavones)虽是黄酮化合物中的一类,但 分布范围较窄,常见的食用植物中仅大豆、葛根、苜 蓿和三叶草中含有异黄酮,人体摄入的异黄酮几乎全 部来自大豆[1,2]。迄今,从大豆中分离的异黄酮有 12 种,分为游离型苷元(Aglycone) 和结合型糖苷 *通讯作者。 Copyright © 2012 Hanspub 98  大豆异黄酮转化菌株的分离及相关转化酶基因克隆研究进展 (Glucoside)两大类。天然大豆中的异黄酮绝大部分以 葡萄糖苷、乙酰基葡萄糖苷和丙二酰基葡萄糖苷等结 合型糖苷存在,以游离型苷元存在的大豆异黄酮共有 3种,即黄豆苷原(Daidzein)、染料 木素(Genistein)和 6-甲氧黄豆苷原(Glycitein),其中黄豆苷原和染料木素 占大豆异黄酮总苷元的95%~97%,为大豆异黄酮苷 元的主要成分。流行病学和实验室研究结果均表明, 大豆异黄酮具有明显的抗氧化[3]、抗 肿瘤[4,5]、缓解妇 女更年期症状[6]、防治骨质疏松[7]和降低心脑血管发 病率[8]等功效,有关大豆异黄酮的生理功能目前已引 起社会和学术界的普遍关注。 被摄入机体的结合型大豆异黄酮糖苷在肠道和肝 组织中的 β-葡萄糖苷酶作用下首先被水解为游离型苷 元,进而被胃肠道内的微生物菌群降解为各种不同代 谢产物。大豆异黄酮的不同代谢产物具有不同的生理 活性,这主要取决于代谢产物的化学结构。在目前已 知的大豆异黄酮的所有代谢产物中,雌马酚被认为是 活性最高的成分,其抗氧化活性比亲本化合物黄豆苷 原高出 100 多倍[9]。此外,Chin-Dusting 等[10]和Jiang 等[11]分别分析比较了化学合成的黄豆苷原代谢产物对 心血管的保护作用。研究发现,供试不同化合物作用 由强到弱的顺序为:雌马酚(Equol) > 四氢黄豆苷原 (Tetrahydrodaidzein ,简称 THD) > 二氢黄豆苷原 (Dihydrodaidzein,简称 DHD) > 黄豆苷原。此外, 我 们曾对大豆异黄酮黄豆苷原、染料木素及生物合成的 DHD、二氢染料木素(Dihydrogenistein,简称 DHG)、 去氧甲基安哥拉紫檀素(O-desmethylangolensin,简称 O-Dma)和雌马酚的体外清除自由基能力进行对比分 析,结果发现,相同浓度下雌马酚清除超氧阴离子和 二苯代苦味酰基自由基(1,1-Diphenyl-2-Picrylhydrazyl, 简称 DPPH)能力远高于黄豆苷原、染料木素及 DHD、 DHG 和O-Dma 等代谢产物[12]。因此,大豆异黄酮对 人和其他动物的有益调节作用大小并不简单地取决于 机体从外界摄入大豆异黄酮的净含量多少,更关键地 在于被摄入的大豆异黄酮在机体内将 如何被代谢。 由于受饮食、胃肠疾病以及长期心理压力等众多 因素影响,不同动物种类以及同种动物的不同类群或 个体的肠道微生物菌群在代谢大豆异黄酮上存在较 大差异,如人群中只有 30%~50%的个体能将摄入体 内的黄豆苷原转化为雌马酚。从上世纪 90 年代末, 国内外学者开始从不同动物胃肠道微生物菌群中分 离对大豆异黄酮具有转化作用的单一微生物菌株,目 前已有大量大豆异黄酮转化菌株被分离和鉴定。从已 报道的大豆异黄酮转化菌株的耐氧性来看,除两株细 菌菌株被提及能在有空气氧条件下生长外,其他大豆 异黄酮转化菌株则全部为严格厌氧细菌菌株。日本学 者Uchiyama 等[13]于2007年曾报道一株在厌氧条件下 能将黄豆苷原转化为雌马酚的乳酸球菌 20-92 (AY699289),该菌株于 2010 年被报道能在有空气氧 条件下生长,但其转化作用却只能在严格厌氧条件下 才能进行[14]。此外,作者所在实验室于 2008 年报道 了一株从褐马鸡粪样中分离的能将黄豆苷原开环转 化为 O-Dma 的海氏肠球菌 AUH-HM195 (EU919863), 该菌株能在有空气氧条件下正常生长,但也只能在严 格厌氧条件下才表现转化活性[15]。由于长期维持严格 厌氧环境成本极高,目前,大豆异黄酮转化菌株的严 格厌氧特性已成为其开发利用的瓶颈。 从大豆异黄酮转化菌株中克隆相关转化酶基因 并在大肠杆菌中进行表达,可以实现大豆异黄酮代谢 产物在有氧条件下的高效合成。近些年,人们开始从 大豆异黄酮转化菌株,尤其是具有较强抗癌活性的雌 马酚产生菌中克隆相关转化酶合成基因。本文将对大 豆异黄酮转化菌株分离及相关功能基因克隆现状作 一综述。 2. 大豆异黄酮转化菌株的分离与鉴定 自上世纪 90 年代末,国内外学者开始从不同动 物胃肠道微生物菌群中分离能将大豆异黄酮进行转 化的特定微生物菌株。Hur 等[16]2000 年从人粪样中分 离出一株对大豆异黄酮具有还原作用的梭菌菌株 HGH6,该菌株在厌氧条件下能将黄豆苷原和染料木 素分别还原为 DHD 和DHG,这也是最早报道的大豆 异黄酮还原菌株。后来,Wang 等[17]于2004 年和 Tamura 等[18]于2007 年先后报道了具有相同转化功能 的与已知菌 Lactobacillus catenaformis 的16S rRNA 基因序列相似性较高(91.4%)的牛瘤胃细菌菌株 Niu-O16(AY263505)和人肠道粪芽孢菌株 Clostridium sp. TM-40(AB249652)。国内外最早报道的雌马酚产生 菌是由 Wang 等[19]于2004年从人粪样中分离的细菌菌 株Eggerthella sp. SNU-Julong732(AY310748),该菌株 在严格厌氧条件下能将黄豆苷原的代谢产物DHD 转 Copyright © 2012 Hanspub 99  大豆异黄酮转化菌株的分离及相关转化酶基因克隆研究进展 Copyright © 2012 Hanspub 100 化为雌马酚,通过手性柱分析,首次证明所生成的雌 马酚为 100% S-型雌马酚。此后,国内外学者陆续报 道了一些能直接将底物黄豆苷原转化为雌马酚的细 菌菌株,如日本学者 Minamida[20]于2006 年报道的细 菌菌株 Asaccharobacter celatus do03(AB266102)和 Uchiyama 等[13]于2007 年报道的乳酸球菌 Lactococcus garvieae 20-92等。有关 O-Dma 产生菌的报道最早出 现于 2002 年,韩国学者 Hur 等[21]和德国学者 Schoefer 等[22]分别报道了从人粪样中分离的能将大豆异黄酮 开环转化的梭菌属和真细菌属菌株,这些具有开环转 化功能的菌株在厌氧条件下能将大豆异黄酮黄豆苷 原和染料木素分别转化为 O-Dma 和4-羟苯基-2-丙酸 (4-Hydroxyphenyl-2-propionic acid, 简称 2-HPPA)。 经过十余年的努力,国内外学者已从不同动物胃 肠道微生物菌群中分离了近20株大豆异黄酮转化菌 株,这些转化菌株主要集中在红蝽菌科 (Coriobacteriaceae)的真杆菌属(Eubacterium)、梭菌属 (Clostridium)、肠球菌属(Enterococcus)、乳球菌属 (Lactococcus)和乳杆菌属(Lactobacillus)等几个属。此 外,还有一些大豆异黄酮转化菌株被鉴定为新的分类 单元,这些新分类单元被赋予了新的属名或种名,如 Adlercreutzia equolifaciens[23]和Slackia equolifaciens[24] 等。根据目前已报道的大豆异黄酮转化菌株的转化功 能,可将大豆异黄酮转化菌株分为开环、加氢还原和 去酮基三类,具体见表 1。 3. 大豆异黄酮代谢产物种类及合成途径 早在 20 世纪 60 年代末和 70 年代初,人们就分 别以反刍动物牛和羊为研究对象,对黄豆苷原和染料 木素在动物体内的代谢进行了研究,检测到DHD、 O-Dma、雌马酚和DHG等不同代谢产物。进入20 世 纪90 年代,随着化学检测手段的不断提高,又从人 及小鼠等的尿液和粪便中检测到 THD、6’-羟基-雌马 酚(6’-OH-Equol)、6’-羟基-去氧甲基安哥拉紫檀素 (6’-OH-O-Dma)、2,3-不饱和-去氧甲基安哥拉紫檀素 (2-Dehydro-O-Dma)、2-HPPA和4-乙基苯酚(4-Ethyl- phenol) 等多种异 黄酮代谢产物[32-34]。澳大利亚学者 Joannou 等[35]通过分析从人尿液中检测到的各种不同 代谢产物的化学结构,首次对大豆异黄酮黄豆苷原和 染料木素在人体内的代谢途径进行了推测,这也是目 前普遍受到公认的异黄酮在人体内的代谢途径(图1)。 后来,英国学者 Coldham 等[36]利用同位素对染料木素 分子中的第 4位碳原子进行了标定,并对染料木素在 大鼠体内的代谢进行了跟踪研究,指出 6’-OH -O-Dma 并非染料木素的最终代谢产物,而是继续被代谢为 -HPPA和4-乙基苯酚(图2)。 2 Table 1. List of isolated isoflavone biotransforming bacteria with different biotransforming activities 表1. 已分离的具有不同转化功能的大豆异黄酮转化菌株 转化功能 菌株名称 文献出处 开环 Clostridium sp. HGH 136 Eubacterium ramulus Eubacterium ramulus Julong 601 Enterococcus hirae AUH-HM195 Hur et al., 2002, 178: 8-12. [21] Schoefer et al., 2002, 208: 197-202. [22] Wang et al., 2004, 14: 766-771. [25] Yu et al., 2009, 49: 479-484. [15] 还原 Clostridium sp. HGH6 Lactobacillus sp. Niu-O16 Clostridium-like bacterium Hur et al., 2000, 174: 422-428. [16] Wang et al., 2005, 115: 261-269. [17] Tamura et al., 2007, 13: 32-35. [18] 去酮基 Eggerthella sp. Julong 732 Asaccharobacter celatus do03 Lactococcus garvieae 20-92 Coriobacteriaceae sp. MT1B9 Eubacterium sp. D1 and D2 Eggerthella sp. YY7918 Adlercreutzia equolifaciens Asaccharobacter celatus Slackia sp. HE8 Slackia equolifaciens DZE Wang et al., 2005, 71: 214-219. [19] Minamida et al., 2006, 102: 247-250. [20] Uchiyama et al., 2007, 21: 217-220. [13] Matthies et al., 2008, 74: 4847-4852. [26] Yu et al., 2008, 282: 73-80. [27] Yokoyama, 2008, 72: 2660-2666. [28] Maruo et al., 2008, 58: 1221-1227. [23] Minamida et al, 2008, 58: 1238-1240. [29] Matthies et al., 2009, 75: 1740-1744. [30] Jin et al., 2008, 31: 1621-1625. [31] 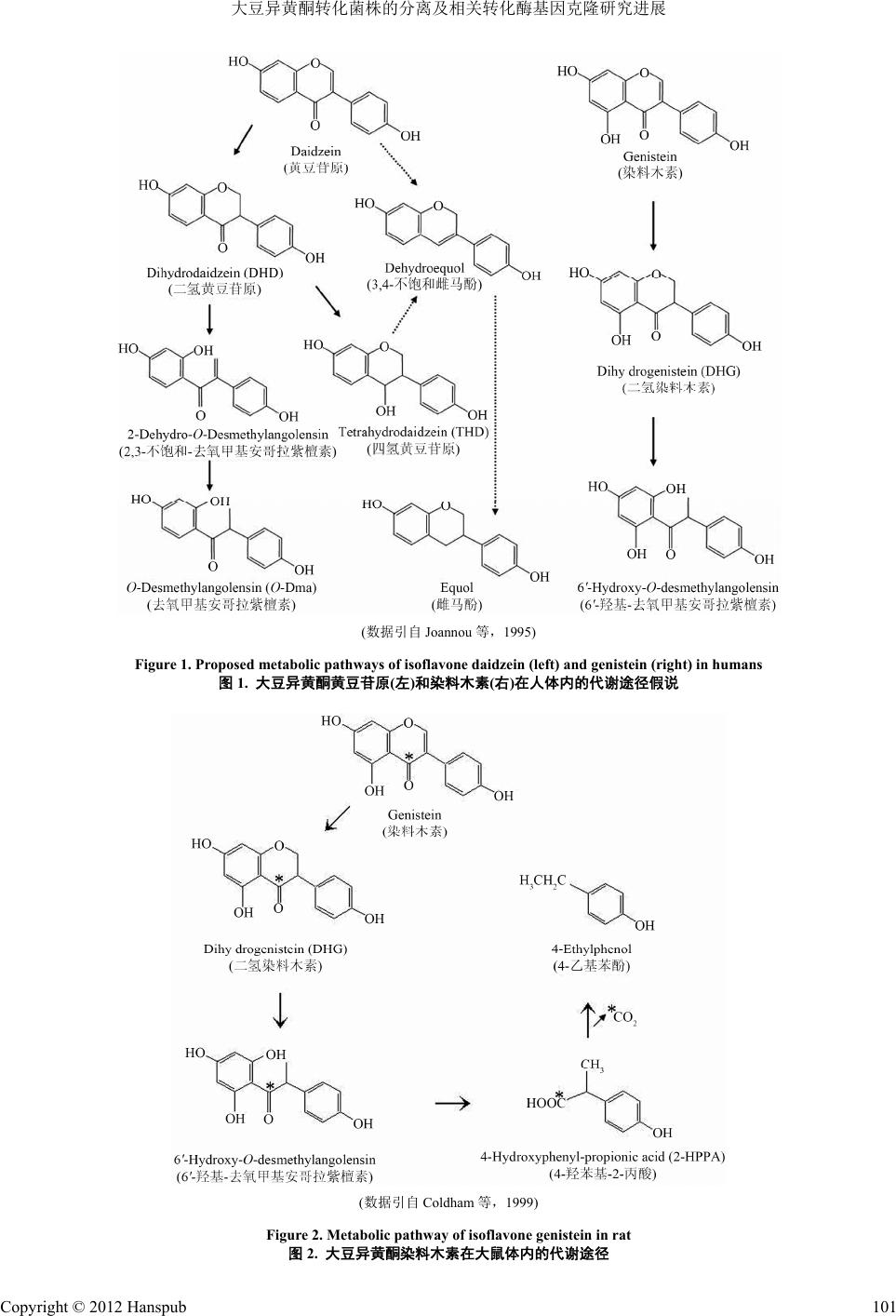 大豆异黄酮转化菌株的分离及相关转化酶基因克隆研究进展 (数据引自 Joannou 等,1995) Figure 1. Proposed metabolic pathways of isoflavone daidzein (left) and genistein (right) in humans 图1. 大豆异黄酮黄豆苷原(左)和染料木素(右)在人体内的代谢途径假说 (数据引自 Coldham 等,1999) Figure 2. Metabolic pathway of isoflavone genistein in rat 图2. 大豆异黄酮染料木素在大鼠体内的代谢途径 Copyright © 2012 Hanspub 101  大豆异黄酮转化菌株的分离及相关转化酶基因克隆研究进展 Copyright © 2012 Hanspub 102 4. 大豆异黄酮转化菌株相关转化酶基因 克隆现状 为实现大豆异黄酮代谢产物的高效有氧生物合 成,近几年人们开始对大豆异黄酮转化菌株中的转化 酶基因进行克隆研究,目前已从不同雌马酚产生菌中 分别克隆了黄豆苷原还原酶、DHD 还原酶和 THD 还 原酶等大豆异黄酮转化酶基因。从能查找的文献来 看,大豆异黄酮转化酶基因克隆方法主要包括功能克 隆法、反向 PCR 法、文库筛选法以及全基因组测序法, 现将大豆异黄酮转化酶基因克隆方法以及克隆出的 相关转化酶基因加以综述。 1) 功能克隆法 功能克隆法又称多肽氨基末端序列指导的 PCR 引物合成法,即对目的蛋白进行高度纯化后对其 N- 端氨基酸序列进行测定,根据氨基酸序列反推出相应 的基因序列,进而设计引物进行功能基因克隆。该基 因克隆方法是借助于基因表达的产物即蛋白质将该 功能基因克隆出来,成败的关键在于能否得到纯度极 高的目的蛋白。日本学者 Shimada 等[14]于2010 年首 次采用功能克隆法对菌株 20-92 的相关转化酶基因进 行了克隆研究,此前国际上无任何有关大豆异黄酮转 化酶基因克隆的报道。Shimada 等首先对收集的乳酸 球菌 20-92 的菌体进行破碎后收集粗酶,并对粗酶进 行分离纯化,然后将纯化出的单峰与底物黄豆苷原和 辅酶 NADH或NADPH等在厌氧条件下共同培养后用 乙酸乙酯进行萃取,最后用高效液相色谱法(High Performance Liquid Chromatography,简称HPLC)检测 底物能否被纯化出的单峰转化。单峰被检测出有转化 活性后再用 SDS-PAGE 检测蛋白纯度,并对高度纯化 后的多肽分子作 N-端氨基酸序列分析。根据氨基酸序 列反推出相应的基因序列,设计引物后利用 RT-PCR 技术获得部分基因片段,再利用 RACE技术进行序列 延伸,获得黄豆苷原还原酶的全长基因序列。Shimada 等利用该项基因克隆技术于2010 年报道了国际上第 一个黄豆苷原转化酶基因,即依赖于 NADP(H)的黄豆 苷原还原酶基因(L-DZNR)。 2) 反向 PCR 法 当大豆异黄酮代谢途径中的某个关键酶基因已 知时,可运用反向 PCR 法直接扩增该基因上游和下游 的部分基因,这是功能基因克隆中最为简便和直接的 方法。当 Shimada 等从乳酸球菌 20-92 中成功克隆了 黄豆苷原还原酶基因 L-DZNR 后,他们继续对黄豆苷 原还原酶 L-DZNR 上下游基因序列进行了克隆分析, 结果又发现了 6个新基因,即 orf-US4,orf-US3, orf-US2,orf-US1,orf-DS1和orf-DS2。通过构建重 组体,并对重组蛋白进行活性分析发现,两个上游基 因orf-US2 和orf-US3 与雌马酚生物合成相关。基因 orf-US2编码的蛋白质在厌氧条件下能将底物 DHD还 原为 cis/trans THD,编码该蛋白的基因被命名为 DHD 还原酶(L-DHDR);基因 orf-US3 编码的蛋白质在厌氧 条件下则能将底物 cis/trans THD还原为雌马酚,编码 该蛋白的基因被命名为 THD还原酶(L-THDR),而其 余四个基因的功能目前尚不能确定[37]。 3) 文库筛选法 通过构建基因组文库也可筛选到大豆异黄酮转 化菌株的转化酶基因。Tsuji 等[38]用限制性内切酶部分 消化雌马酚产生菌 Slackia sp. NATTS的基因组 DNA, 然后与限制性内切酶彻底消化的载体 pUC19 相连,并 转化大肠杆菌 JM109,构建菌株 Slackia sp. NATTS的 基因组文库。将文库中全部重组子分别与底物黄豆苷 原或 DHD在厌氧条件下共同培养 24小时后,用 HPLC 检测底物被重组子转化情况。结果从8424 个重组子 中筛选得到 5个阳性克隆,其中 3个阳性克隆能将底 物黄豆苷原转化为 DHD,另外 2个阳性克隆能将底物 DHD 转化为雌马酚。通过对阳性克隆进行测序和活性 验证,发现所有阳性克隆均编码 3个开放阅读框,即 orf-1,orf-2 和orf-3。其中,orf-1 由1458 个碱基对构 成,编码一条由 486 个氨基酸组成的多肽;orf-2由 846 个碱基对构成,编码一条由 282 个氨基酸组成的 多肽;orf-3 由1935 个碱基对构成,编码一条由644 个氨基酸组成的多肽。经 HPLC 检测发现,基因 orf-1 编码的蛋白质能在厌氧环境中将cis/trans THD 转化 为雌马酚;基因 orf-2 编码的蛋白质能在厌氧环境中 将DHD 转化为 cis/trans THD;基 因orf-3 编码的蛋白 质具有黄豆苷原还原酶活性,即在厌氧环境中能将底 物黄豆苷原还原为 DHD。 4) 全基因组测序法 对菌体全基因组进行测序后,运用功能基因组学 进行对比分析也是获得功能基因的重要手段。日本学 者Yokoyama等于 2012年采用全基因组鸟枪法分别对  大豆异黄酮转化菌株的分离及相关转化酶基因克隆研究进展 两个大豆异黄酮转化菌株的全基因组进行了测序,其 中一个菌株为能在厌氧条件下将黄豆苷原转化为雌 马酚的细菌菌株 Eggerthella sp. YY7918(AB379693), 其基因组全序列长度为 3,123,671 bp,预测包括 2680 个蛋白质编码序列(CDS),该菌株的基因组全序列 目 前已存放在GenBank/DDBJ/EMBL 基因数据库中 (AP012211)[39]。此外,该课题组用同样的方法对能将 黄豆苷原转化为 O-Dma 梭菌属菌株 Clostridium sp. SY8519(AB477431)的基因组全序列进行了测定,其基 因组全序列长度为 2,835,737 bp,预测包括 2619 个 CDS。该菌株的基因组全序列也已存放在 GenBank/ DDBJ/EMBL 基因数据库中(AP012212)[40]。有了基因 组全序,便可通过与已知功能基因序列进行对比来获 取有关基因功能的信息,也可通过基因表达序列分析 或DNA芯片等方法进行功能基因分析,并通过基因 功能验证最终得到相关的转化酶基因。 5. 展望 大豆异黄酮代谢产物具有比大豆异黄酮更高、更 广的生物学活性,然而,在大豆异黄酮代谢产物中, 目前只有 DHD 和雌马酚可利用化学加氢法进行人工 合成。大豆异黄酮转化菌株的成功分离虽为大豆异黄 酮代谢产物的生物合成提供了可能,但长期维持严格 厌氧环境成本极高。近年来人们开始对雌马酚产生菌 的相关转化酶基因进行克隆,试图利用功能基因的异 源表达来实现雌马酚的高效有氧合成。目前人们只是 对雌马酚产生菌的转化酶基因进行了克隆。通过对比 分析来自不同雌马酚产生菌的相同功能的基因序列, 发现其基因序列存在较大差异,如从菌株 Slackia sp. NATTS 中克隆的黄豆苷原还原酶基因 orf-3 与从乳酸 球菌 20-92 中克隆的黄豆苷原还原酶 L-DZNR的基因 序列相似性仅为 42%[38]。因而,有必要对不同菌株, 特别是来自不同属的具有相同转化功能菌株的转化 酶基因进行克隆分析。此外,还应对雌马酚产生菌之 外的其他大豆异黄酮转化菌株(如分别将黄豆苷原和 染料木素转化为 DHD和DHG的还原菌株以及分别将 黄豆苷原和染料木素转化为 O-Dma和2-HPPA的开环 菌株)的转化酶基因进行克隆。通过大豆异黄酮转化酶 基因的克隆及功能验证不仅有利于确定大豆异黄酮 在人体和其他哺乳动物体内的真实代谢途径,还可通 过转化功能的对比分析寻找高活性转化酶基因,通过 在大肠杆菌中异源表达,构建大豆异黄酮不同代谢产 物的高效有氧合成体系,尽早实现大豆异黄酮代谢产 物的规模化生产。 6. 致谢 本研究得到国家自然科学基金(No.31170058)和 河北省百名优秀创新人才支持计划(CPRC027)资助, 在此深表谢意。 参考文献 (References) [1] J. B. Harborne, C. A. Williams. Advances in flavonoid research since 1992. Phytochemistry, 2000, 55(6): 481-504. [2] K. D. Setchell, S. P. Borriello, P. Hulme, et al. Nonsteroidal estrogens of dietary origin: Possible roles in hormone-dependent disease. American Journal of Clinical Nutrition, 1984, 40(3): 569-578. [3] A. Arora, M. G. Nair and G. M. Strasburg. Antioxidant activities of isoflavones and their biological metabolites in a liposomal system. Archives of Biochemistry and Biophysics, 1998, 356(2): 133-141. [4] P. J. Magee, I. R. Rowland. Phyto-oestrogens, their mechanism of action: Current evidence for a role in breast and prostate can- cer. British Journal of Nutrition, 2004, 91(4): 513-531. [5] H. Adlercreutz, Y. Mousavi, J. Clark, et al. Dietary phytoestro- gens and cancer: In vitro and in vivo studies. Journal of Steroid Biochemistry and Molecular Biology, 1992, 41(3-8): 331-337. [6] V. Beck, U. Rohr and A. Jungbauer. Phytoestrogens derived from red clover: An alternative to estrogen replacement therapy? Journal of Steroid Biochemistry and Molecular Biology, 2005, 94(5): 499-518. [7] J. J. B. Anderson, S. C. Garner. The effects of phytoestrogens on bone. Nutrition Research, 1997, 17(10): 1617-1632. [8] J. Hwang, J. Wang, P. Morazzoni, et al. The phytoestrogen equol increases nitric oxide availability by inhibiting superoxide pro- duction: An antioxidant mechanism for cell-mediated LDL mo- dification. Free Radical Biology and Medicine, 2003, 34(10): 1271-1282. [9] N. Sathyamoorthy, T. T. Wang. Differential effects of dietary phytooestrogens daidzein and equol on human breast cancer MCF-7 cells. European Journal of Cancer, 1997, 33(14): 2384- 2389. [10] J. P. Chin-Dusting, L. J. Fisher, T. V. Lewis, et al. The vascular activity of some isoflavone metabolites: Implications for a car- dioprotective role. British Journal of Pharmacology, 2001, 133(4): 595-605. [11] F. Jiang, G. T. Jones, A. J. Husband, et al. Cardiovascular protec- tive effects of synthetic isoflavones derivatives in apolipoprotein E-deficient mice. Journal of Vascular Research, 2003, 40(3): 276-284. [12] X. L. Liang, X. L. Wang, Z. Li, et al. Improved in vitro assays of superoxide anion and 1,1-Diphenyl-2-picrylhydrazyl (DPPH) radical-scavenging activity of isoflavones and isoflavone me- tabolites. Journal of Agricultural and Food Chemistry, 2010, 58(22): 11548-11552. [13] S. Uchiyama, U. Tomomi and T. Suzuki. Identification of a newly isolated equol-producing lactic acid bacterium from the human feces. Journal of Enteric Bacteria, 2007, 21: 217-220. [14] Y. Shimada, S. Yasuda, M. Takahashi, et al. Cloning and expres- sion of a novel NADP(H)-dependent daidzein reductase, an en- zyme involved in the metabolism of daidzein, from Copyright © 2012 Hanspub 103  大豆异黄酮转化菌株的分离及相关转化酶基因克隆研究进展 Copyright © 2012 Hanspub 104 equol-producing Lactococcus strain 20-92. Applied and Envi- ronmental Microbiology, 2010, 76(17): 5892-5901. [15] 于飞, 王世英, 李佳等. 兼性肠球菌 Enterococcus hirae AUH-HM195 对黄豆苷原的开环转化[J]. 微生物 学报, 2009, 49(4): 479-484. [16] H. G. Hur, J. J. Lay, F. Rafii, et al. Isolation of human intestinal bacteria metabolizing the natural isoflavone glycosides daidzin and genistin. Archives of Microbiology, 2000, 174(6): 422-428. [17] X. L. Wang, K. H. Shin, H. G. Hur, et al. Enhanced biosynthesis of dihydrodaidzein and dihydrogenistein by a newly isolated bo- vin e rumen anaerobic bacteriu m. Journal of Biotechnology, 2005, 115(3): 261-269. [18] M. Tamura, T. Tsushida and K. Shinohara. Isolation of an isof- lavone-metabolizing, clostridium-like bacterium, strain TM-40, from human faeces. Anaerobe, 2007, 13(1): 32-35. [19] X. L. Wang, H. G. Hur, J. H. Lee, et al. Enantioselective synthe- sis of S-equol from dihydrodaidzein by a newly isolated anaero- bic human intestinal bacterium. Applied and Environmental Mi- crobiology, 2005, 71(1): 214-219. [20] K. Minamida, M. Tanaka and A. Abe. Production of equol from daidzein by gram-positive rod-shaped bacterium isolated from rat intestine. Journal of Bioscience and Bioengineering, 2006, 102(3): 247-250. [21] H. G. Hur, R. D. Beger, F. Rafii, et al. Isolation of an anaerobic intestinal bacterium capable of cleaving the C-ring of the isofla- vonoid daidzein. Archives of Microbiology, 2002, 178(1): 8-12. [22] L. Schoefer, R. Mohan, A. Braune, et al. Anaerobic C-ring clea- vage of genistein and daidzein by Eubacterium ramulus. FEMS Microbiology Letters, 2002, 208(2): 197-202. [23] T. Maruo, M. Sakamoto, C. Ito, et al. Adlercreutzia equolifaciens gen. nov., sp. nov., an equol-producing bacterium isolated from human faeces, and emended description of the genus Eggerthella. International Journal of Systematic and Evolutionary Microbi- ology, 2008, 58(5): 1221-1227. [24] J. S. Jin, M. Kitahara, M. Sakamoto, et al. Slackia equolifaciens sp. nov., a human intestinal bacterium capable of producing equol. International Journal of Systematic and Evolutionary Mi- crobiology, 2010, 60(8): 1721-1724. [25] X. L. Wang, K. T. Kim, J. H. Lee, et al. C-ring cleavage of isof- lavones daidzein and genistein by a newly isolated human intes- tinal bacterium Eubacterium ramulus Julong 601. Journal of Microbiology and Biotechnology, 2004, 14(4): 766-771. [26] A. Matthies, T. Clavel, M. Gütschow, et al. Conversion of daidzein and genistein by an anaerobic bacterium newly isolated from the mouse intestine. Applied and Environmental Microbi- ology, 2008, 74(15): 4847-4852. [27] Z. T. Yu, W. Yao and W. Y. Zhu. Isolation and identification of equol-producing bacterial strains from cultures of pig faeces. FEMS Microbiology Letters, 2008, 282(1): 73-80. [28] S. Yokoyama, T. Suzuki. Isolation and characterization of a novel equol-producing bacterium from human feces. Bioscience, Biotechnology, and Biochemistry, 2008, 72(10): 2660-2666. [29] K. Minamida, K. Ota, M. Nishimukai, et al. Asaccharobacter celatus gen. nov., sp. nov., isolated from rat caecum. Interna- tional Journal of Systematic and Evolutionary Microbiology, 2008, 58(5): 1238-1240. [30] A. Matthies, M. Blaut and A. Braune. Isolation of a human in- testinal bacterium capable of daidzein and genistein conversion. Applied and Environmental Microbiology, 2009, 75(6): 1740- 1744. [31] J. S. Jin, T. Nishihata, N. Kakiuchi, et al. Biotransformation of C-glucosylisoflavone puerar into estrogenic (3S)-equol in co- culture of two human intestinal bacteria. Biological and Phar- maceutical Bulletin, 2008, 31(8): 1621-1625. [32] I. Rowland, H. Wiseman, T. Sanders, et al. Metabolism of oes- trogens and phytoestrogens: Role of the gut microflora. Bio- chemical Society Transactions, 1999, 27(2): 304-308. [33] S. Heinonen, K. Wahala and H. Adlercreutz. Identification of isoflavone metabolites dihydrodaidzein, dihydrogenistein, 6’-OH- O-dma and cis-4-OH-equol in human urine by gas chromatog- raphy mass spectroscopy using authentic reference compounds. Analytical Biochemistry, 1999, 274(2): 211-219. [34] Y. C. Chang, M. G. Nair. Metabolism of daidzein and genistein by intestinal bacteria. Journal of Natural Products, 1995, 58(12): 1892-1896. [35] G. E. Joannou, G. E. Kelly, A. Y. Reeder, et al. A urinary profile study of dietary phytoestrogens. The identification and mode of metabolism of new isoflavonoids. Journal of Steroid Biochemis- try and Molecular Biology, 1995, 54(3-4): 167-184. [36] N. G. Coldham, L. C. Howells, A. Santi, et al. Biotransformation of genistein in the rat: Elucidation of metabolite structure by product ion mass fragmentology. Journal of Steroid Biochemis- try and Molecular Biology, 1999, 70(4-6): 169-184. [37] Y. Shimada, M. Takahashi, N. Miyazawa, et al. Identification of two novel reductases involved in equol biosynthesis in Lacto- coccus strain 20-92. Journal of Molecular Microbiology and Biotechnology, 2011, 21(3-4): 160-172. [38] H. Tsuji, K. Moriyama, K. Nomoto, et al. Identification of an enzyme system for daidzein-to-equol conversion in Slackia sp. strain NATTS. Applied and Environmental Microbiology, 2012, 78(4): 1228-1236. [39] S. Yokoyama, K. Oshima, I. Nomura, et al. Complete genomic sequence of the Equol-producing bacterium Eggerthella sp. strain YY7918, isolated from adult human intestine. Journal of Bacteriology, 2011, 193(19): 5570-5571. [40] S. Yokoyama, K. Oshima, I. Nomura, et al. Complete genomic sequence of the O-desmethylangolensin-producing bacterium Clostridium rRNA cluster XIVa strain SY8519, isolated from adult human intestine. Journal of Bacteriology, 2011, 193(19): 5568-5569. |