Material Sciences
Vol.4 No.03(2014), Article
ID:13578,7
pages
DOI:10.12677/MS.2014.43017
Preparation of Spherical FePO4·2H2O and LiFePO4/C Electrode Materials by Controlled Solution pH during Oxidation of Fe2+ Ions
Key Laboratory of the Ministry of Education for Advanced Catalysis Materials, Zhejiang Key Laboratory for Chemistry on Solid Surfaces, Institute of Physical Chemistry, Zhejiang Normal University, Jinhua
Email: *nzjiang@zjnu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Apr. 3rd, 2014; revised: May 4th, 2014; accepted: May 10th, 2014
ABSTRACT
FePO4∙2H2O powders with various morphologies and structures were prepared in a solution of 1.0 mol/L FeSO4 and 1.0 mol/L H3PO4 without any additives, by adjusting pH of the solutions during oxidation of Fe2+ ions. LiFePO4/C electrode materials were synthesized using the FePO4·2H2O precursor, Li2CO3 and sucrose by the carbothermic reduction method at 700˚C for 10 h. The powders were analyzed with X-ray diffraction (XRD), scanning electron microscope (SEM), thermogravimetric-differential thermal analysis (TG-DTA) and cyclic voltammetry (CV) methods. The results show that the spherical FePO4·2H2O agglomerates of primary particles about 200 nm can be obtained in the solution of pH controlled within 1.6 - 2.0 when adding H2O2 for oxidation of Fe2+ ions. The spherical LiFePO4/C materials with particles size about 1 μm were synthesized from the nanostructural FePO4 precursors. The LiFePO4/C materials show favorable electrochemical performance in 1.0 mol/L Li2SO4 aqueous solution.
Keywords:Ferrous Iron, Oxidation, Solution pH, FePO4∙2H2O, LiFePO4/C

控制溶液pH值氧化Fe2+离子制备球状FePO4∙2H2O及LiFePO4/C电极材料
邵 辰,范旭良,罗晶晶,马荣伟,张 南,牛振江*
浙江师范大学物理化学研究所,固体表面反应化学浙江省重点实验室,先进催化材料教育部重点实验室,金华
Email: *nzjiang@zjnu.cn
收稿日期:2014年4月3日;修回日期:2014年5月4日;录用日期:2014年5月10日

摘 要
在1.0 mol/L FeSO4和H3PO4溶液中,通过调节氧化Fe2+时溶液的pH值,在无任何添加剂的条件下制备出不同形貌和结构的FePO4·2H2O沉淀。以FePO4前驱体、Li2CO3和蔗糖为原料,经700℃碳热反应10 h后得LiFePO4/C电极材料。运用X-射线衍射(XRD)、扫描电子显微镜(SEM)、热重-差热(TG-DTA)和循环伏安(CV)等方法对样品进行了表征。结果显示,当加入H2O2时溶液的pH在1.6~2.0之间,可得到由200 nm左右的一次颗粒构成的球状FePO4∙2H2O粉末。由纳米结构FePO4前驱体合成得到粒径为1 μm左右的球形LiFePO4/C,其在1.0 mol/L Li2SO4水溶液中显示良好的电化学性能。
关键词
亚铁离子,氧化,pH,FePO4·2H2O,LiFePO4/C

1. 引言
橄榄石结构的LiFePO4具有锂离子循环性能好、安全性能高且成本低廉、资源丰富等优点[1] -[8] ,通过掺杂、纳米化及碳包覆等方法可改善其电子电导率和锂离子扩散速率[9] [10] ,LiFePO4材料在动力电源、储能电源等方面将有更多的应用。
LiFePO4的性能和形貌依赖于合成条件。共沉淀、水热、高温固相等方法均能制备得到LiFePO4材料。FePO4是高温固相合成LiFePO4的主要铁源前驱体,因为FePO4中包含了等摩尔比值的[Fe3+]和[PO43-],LiFePO4的形成更容易[11] 。国内外已有大量涉及FePO4合成方法和条件的研究报道[12] -[20] 。其中一种方法是通过氧化Fe2+和H3PO4混合溶液中的Fe2+,再调节溶液pH得到FePO4∙2H2O沉淀,进而脱水得到FePO4[15] -[18] 。这种先氧化再沉淀的方法,由于Fe3+的水解难以避免,水解产物完全转变为FePO4需要很长的时间。更重要的是需要加入各种有机添加剂来控制FePO4∙2H2O沉淀的晶粒尺寸和形貌。彭忠东[19] 等在均相沉淀法制备前驱体FePO4∙xH2O时,采用表面活性剂PEG来改变前驱体晶体形貌,减少一次颗粒的团聚。罗国恩[20] 等则通过吡咯的原位聚合来控制FePO4的结晶过程,得到粒径小且分布均匀的介孔FePO4/PPy前躯体。
本文采用两步调节反应溶液pH值的方法制备FePO4∙xH2O前驱体。通过调节H2O2氧化Fe2+时混合溶液的pH值(pH(1)),利用此条件下自发形成的可溶性Fe(II)-Fe(III)多核络合物[21] 来控制FePO4·2H2O的结晶过程,在不加入任何有机添加剂的条件下,制备出类球状FePO4∙2H2O粉末。进而通过碳热还原制备出球状的LiFePO4/C材料。考察了pH(1)对前驱体的结构和形貌的影响,测试了LiFePO4/C在Li2SO4水溶液中的循环伏安(CV)性能。
2. 实验部分
2.1. FePO4·2H2O和LiFePO4的制备
在250 mL五颈烧瓶中,依次加入15 g FeSO4∙7H2O固体,3.7 mL 85%的H3PO4 (ρ = 1.70 g/mL)和50 mL蒸馏水,反应浓度均为1.0 mol/L。在转速500 rpm机械搅拌下,溶液升温至45℃,首先用2.5 mol/L的NaOH溶液调节反应液的pH(1)在1.2~2.2之间。溶液的pH使用BANTE220携带型pH计测量。然后滴加30%的H2O2,即有白色沉淀产生,同时溶液会转变为深绿色,溶液的pH值也会逐渐降低。通过α-α¢-联吡啶显色(红色)法检测溶液中无Fe2+后,沉淀呈灰白色。再次用NaOH调pH至2.0,并升高溶液温度至80℃,搅拌陈化2 h。反应结束后,抽滤、洗涤、烘干,得到白色粉末样品。所有的实验试剂均为分析纯试剂。
白色沉淀经500℃加热脱水4 h后,按照FePO4:Li2CO3:蔗糖摩尔比为1:052:0.1的比例混合,并加入适量蒸馏水作为球磨介质,在500 r/min转速下球磨2 h后,在氮气保护下700℃煅烧10 h得到黑色LiFePO4/C。
2.2. 材料的表征
样品结构采用荷兰Phillips公司生产的PW 3040/60型X-射线衍射仪进行分析,X光源为Cu Kα射线、工作电40 kV、工作电流40 mA;形貌用日本Hitachi公司的S-4800型高分辨场发射扫描电镜和日本电子公司的JEM-2100F透射电子显微镜表征;热分析用德国Netzsch公司的STA449C型热分析仪记录TG-DTA曲线,氮气气氛、温度范围30℃~800℃、升温速率为10℃/min。
2.3. 电化学测试
将活性物质LiFePO4/C、乙炔黑和PVDF按照75:15:10的质量比例混合均匀,充分研磨烘干后,滴加NMP超声处理,涂布在0.2 cm2的金电极上制成工作电极。铂为对电极,饱和甘汞为参比电极。参照文献[22] [23] ,在室温下通过CHI660C电化学工作站测试LiFePO4/C材料在1.0 mol/L Li2SO4水溶液中的循环伏安曲线。测试的电位范围为−0.6 V~0.9 V,扫描速率范围为1.0~50 mV/s。
3. 结果与讨论
3.1. pH(1)对FePO4前驱体结构和形貌的影响
1.0 mol/L的FeSO4·7H2O和H3PO4的初始混合溶液的pH为0.8。滴加NaOH溶液调节pH(1)在1.2~2.2之间,再经H2O2进行氧化、调节pH(2)到2.0,80℃下搅拌陈化后,均能得到白色的沉淀。图1和图2给出了不同pH(1)下制备的样品的XRD和SEM分析结果,图1(1)表明在pH(1)1.2~2.0范围内,白色沉淀都是纯相的FePO4∙xH2O。而pH(1)2.2时的沉淀产物,XRD曲线中没有出现特征的衍射峰,表明该产物为无定型状态。经加热除去结晶水后,所有沉淀产物均转变为无水的FePO4(图1(2))。
图2的SEM分析结果表明,不同pH(1)值条件下制备的产物形貌发生了变化。随着pH(1)由1.2升高至2.0,产物的一次颗粒的粒径逐步变得更加均匀,大小在200纳米左右。而且在pH(1)在1.6~2.0范围内时,小颗粒聚集形成的二次颗粒呈类球形。但pH(1)为2.2时,颗粒形貌又变得大小不均匀,形貌无规则。
热分析表明在pH(1)1.2~2.0下制备的前驱体都有相同的热分解性质。图3给出了pH(1) 2.0制备的样品的TG-DTA曲线。在升温过程中,TG曲线表明在30℃~200℃之间有一个由于脱去结晶水的失重过程。总失重量为20%,与FePO4∙2H2O的理论含水量相符。DTA曲线在90℃和195℃有两个明显的吸热峰,对应于前驱体的脱水过程。而在670℃处出现一个放热峰,但没有伴随质量的变化,可能对应于FePO4从非晶态转变为纯晶态的结晶过程[24] 。
实验结果表明,通过控制Fe2+氧化时的pH(1),在不加入表面活性剂等添加剂的情况下,可制备出由亚微米一次颗粒构成的类球状FePO4∙2H2O前驱体。其基本原理是,根据25℃时H3PO4的逐级电离常数 (Ka1 = 7.6 × 10−3、Ka2 = 6.3 × 10−8和Ka3 = 4.4 × 10−13[25] ),可计算出pH为2.0时1.0 mol/L的H3PO4溶
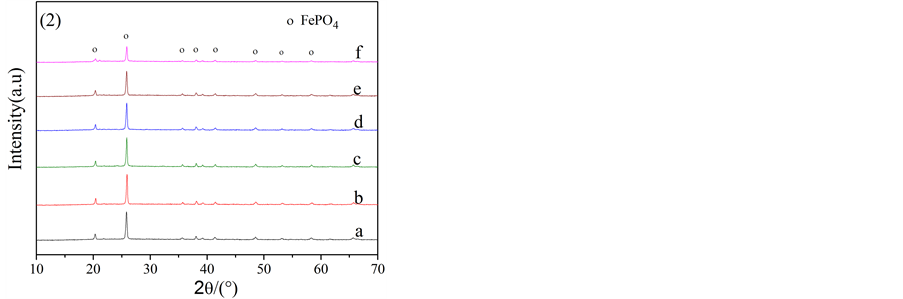
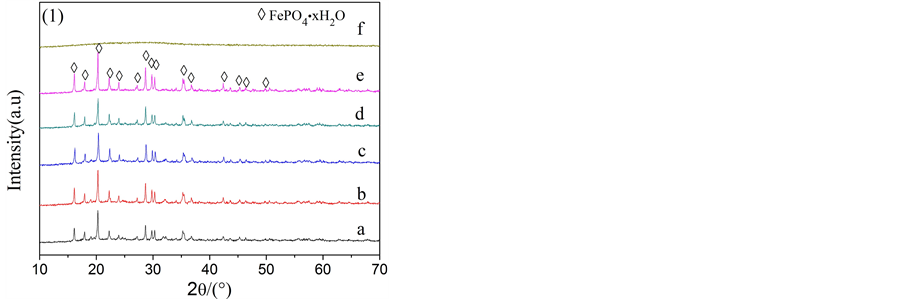
Figure 1. XRD patterns of iron phosphate prepared at various pH values: (a) pH = 1.2; (b) pH = 1.4; (c) pH = 1.6; (d) pH = 1.8; (e) pH = 2.0; (f) pH = 2.2
图1. 不同pH值下合成磷酸铁的XRD图:(a) pH = 1.2;(b) pH = 1.4;(c) pH = 1.6;(d) pH = 1.8;(e) pH = 2.0;(f) pH = 2.2






Figure 2. SEM of FePO4·xH2O prepared at various pH(1) values: (a) pH = 1.2; (b) pH = 1.4; (c) pH = 1.6; (d) pH = 1.8; (e) pH = 2.0; (f) pH = 2.2
图2. 不同pH(1)下合成FePO4·xH2O的SEM图:(a) pH = 1.2;(b) pH = 1.4;(c) pH = 1.6;(d) pH = 1.8;(e) pH = 2.0;(f) pH = 2.2
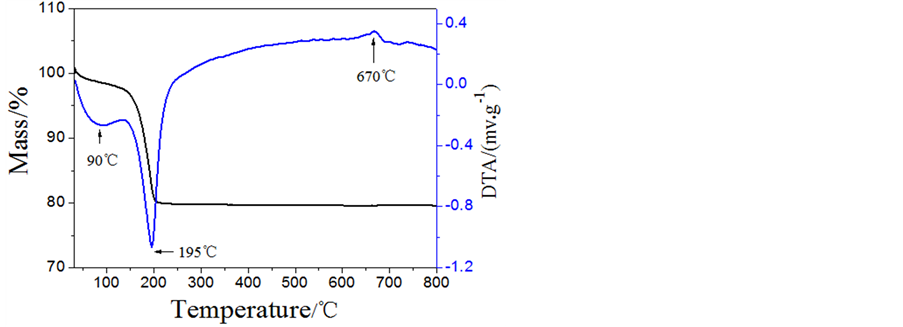
Figure 3. TG-DTA curves of FePO4·2H2O
图3. FePO4·2H2O的热分析图谱
液中PO43−的浓度约为2.1 × 10−16 mol/L,溶液中存在的主要物种是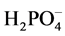 。Fe3(PO4)2和Fe(OH)2的Ksp值分别为1.0 × 10−36[26] 和8.0×10−16[25] ,因此Fe3(PO4)2和Fe(OH)2沉淀都很难形成。而FePO4和Fe(OH)3的Ksp分别为1.3 × 10−22和4.0 × 10−38[25] ,加入H2O2氧化Fe2+生成的Fe3+,将优先与
。Fe3(PO4)2和Fe(OH)2的Ksp值分别为1.0 × 10−36[26] 和8.0×10−16[25] ,因此Fe3(PO4)2和Fe(OH)2沉淀都很难形成。而FePO4和Fe(OH)3的Ksp分别为1.3 × 10−22和4.0 × 10−38[25] ,加入H2O2氧化Fe2+生成的Fe3+,将优先与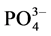 形成FePO4沉淀。在生成FePO4沉淀的同时,
形成FePO4沉淀。在生成FePO4沉淀的同时,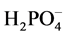 和
和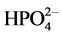 的电离平衡将向右移动,导致溶液的pH稍有降低,溶液pH降低有利于进一步减缓Fe3+的水解。更重要的是,在滴加H2O2的过程中,溶液颜色逐渐变为深绿色,显示有可溶性的Fe(II)-Fe(III)络合物的形成[21] ,这种可溶性绿色络合物是由氧桥和羟桥相连的多核络合物。在中性或弱碱性溶液中,可溶性多核络合物将逐渐聚合成Fe(II)-Fe(III)层状氢氧硫酸盐沉淀(绿锈II),并能自发地转变为Fe3O4[27] 。绿色络合物和绿锈都具有较高的化学反应活性。如绿锈能够吸附
的电离平衡将向右移动,导致溶液的pH稍有降低,溶液pH降低有利于进一步减缓Fe3+的水解。更重要的是,在滴加H2O2的过程中,溶液颜色逐渐变为深绿色,显示有可溶性的Fe(II)-Fe(III)络合物的形成[21] ,这种可溶性绿色络合物是由氧桥和羟桥相连的多核络合物。在中性或弱碱性溶液中,可溶性多核络合物将逐渐聚合成Fe(II)-Fe(III)层状氢氧硫酸盐沉淀(绿锈II),并能自发地转变为Fe3O4[27] 。绿色络合物和绿锈都具有较高的化学反应活性。如绿锈能够吸附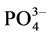 [28] 、还原NO3−[29] 和Ag、Au、Cu离子[30] 。在本文选择的pH(1)在1.2~2.0条件下,这种可溶性的Fe(II)-Fe(III)多核络合物可能与溶液中共存的
[28] 、还原NO3−[29] 和Ag、Au、Cu离子[30] 。在本文选择的pH(1)在1.2~2.0条件下,这种可溶性的Fe(II)-Fe(III)多核络合物可能与溶液中共存的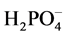 、
、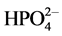 、
、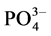 和新生成的FePO4晶核相互作用,影响了FePO4晶粒的生长过程,使晶粒的大小和形貌都较为均匀,还在一定条件下有利于一次晶粒聚集成类球形的二次颗粒。但溶液的pH(1)值和温度都不宜太高,因为较高的pH和温度有利于Fe3+的水解反应,也有利于绿锈的生成。都会导致沉淀的颗粒尺寸和产物纯度难以控制。
和新生成的FePO4晶核相互作用,影响了FePO4晶粒的生长过程,使晶粒的大小和形貌都较为均匀,还在一定条件下有利于一次晶粒聚集成类球形的二次颗粒。但溶液的pH(1)值和温度都不宜太高,因为较高的pH和温度有利于Fe3+的水解反应,也有利于绿锈的生成。都会导致沉淀的颗粒尺寸和产物纯度难以控制。
若按常规的方法,在含1:1的FeSO4∙7H2O和H3PO4溶液中,先加H2O2将Fe2+氧化为Fe3+,再用NaOH调pH到2.0,由于氧化时溶液的pH过低,不能形成FePO4沉淀。在加NaOH调节溶液pH的过程中,溶液中的Fe3+离子的水解反应与生成FePO4的反应同时发生,体系中会生成大量的深褐色沉淀,水解产物转化为白色FePO4需要更长的时间。而且若不加入表面活性剂等有机添加剂,得到的产物颗粒尺寸都不均匀。
因此,通过调节氧化Fe2+时的pH,控制FePO4沉淀生成的条件,可在不添加有机添加剂的条件下制备出颗粒尺寸均匀的FePO4·2H2O前驱体。有利于降低LiFePO4的生产成本,提高生产效益。
3.2. LiFePO4的制备和表征影响
以pH(1)2.0制备的FePO4∙2H2O为前驱体,经过脱水、混合球磨和高温煅烧,制备得LiFePO4/C。图4是所得LiFePO4样品的XRD、SEM和TEM分析结果。

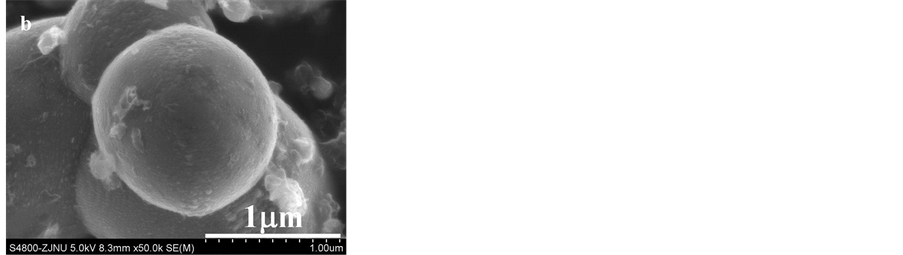

Figure 4. XRD (a), SEM (b) and TEM (c) images of LiFePO4
图4. LiFePO4的XRD (a)、SEM (b)和TEM (c)图
图4(a)和4(b)表明经高温固相反应后,生成了纯相的LiFePO4。产物呈表面较为光滑的球形,粒径约1 μm,说明前驱物在固相高温碳还原时,可能存在反应融合的过程。图4(c)则揭示在颗粒表面存在较明显的、厚度约为10~15 nm的包覆层。包覆层下呈良好的晶体结构,晶面距0.45 nm,与LiFePO4的(101)晶面间距相符[26] [31] 。包覆层则无晶格条纹,可推测为无定形碳层[31] 。LiFePO4表面的碳包覆层将有利于增强材料的导电性,提高材料的电化学性能。
由于LiFePO4处于水的电位稳定区间,锂离子在水溶液电解液中能可逆地脱嵌,水系电解液代替有机电解液可提高锂离子电池的安全性能。但因水分解电压(1.23 V)的限制,水溶液Li+电池的最高电压只能在2.0 V左右。LiFePO4在水系电解液中的电化学行为已有一些研究报道。如Manickam等[32] 研究了LiFePO4在饱和LiOH水溶液中的电化学可逆性。发现在氧化过程,锂离子从LiFePO4中脱出,但随后进行还原反应时,除了生成LiFePO4还有Fe3O4,反应不可逆。黄可龙[33] 等的研究表明,LiFePO4在饱和LiNO3电解液中具有良好的电化学可逆性。Mi[23] 等研究了LiFePO4材料在Li2SO4水溶液中的CV性能,测得Li+的扩散系数为10−11数量级。He[22] 等对比了LiFePO4正极材料在Li2SO4水溶液和LiFP6-PC有机电解液中的锂离子扩散情况。他们的结果表明,作为电解液,1.0 mol/L Li2SO4比1.0 mol/L的LiPF6-PC有机溶液更适合锂离子的电荷转移。显示在水系电解液中进行CV测试是表征LiFePO4材料电化学性能的一种简便方法。
本文自制的LiFePO4/C材料在1.0 mol/L的Li2SO4水溶液中CV曲线见图5(a)。可见随着电位扫描速率增加,氧化还原峰电流(ipa和ipc)也增加,同时氧化还原峰电位(Epa和Epc)分别向正、负方向偏移,峰电位的间距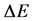 增大。图5(b)给出了іp-v1/2的关系图,显示两条基本对称的直线。表明在1.0 mol/L的Li2SO4水溶液中,Li+的扩散过程是整个反应的控制步骤。对于扩散控制的电极反应,峰电流与电位扫描速率有如下的关系[34] :
增大。图5(b)给出了іp-v1/2的关系图,显示两条基本对称的直线。表明在1.0 mol/L的Li2SO4水溶液中,Li+的扩散过程是整个反应的控制步骤。对于扩散控制的电极反应,峰电流与电位扫描速率有如下的关系[34] :
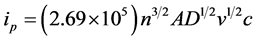 (1)
(1)
式中n为反应过程中的得失电子数(LiFePO4体系中n = 1),A为工作电极的面积,D为锂离子的扩散系数,v为电位扫描速率,c为锂离子的体相浓度。在LiFePO4中每个单晶晶胞中有4个锂离子,单晶体积为2.929 × 10−28[1] ,则晶胞中锂离子的体相浓度c = 2.28 × 10−2 mol·cm−3。根据图5(b)中直线的斜率,可求得Li+在电极氧化还原过程中的扩散系数,分别为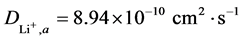 和
和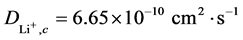 。比相关文献报道过[23] 的LiFePO4在相同浓度的Li2SO4水溶液中的10−11的扩散系数略高。表明由本文方法制备的FePO4前驱体合成的LiFePO4具有良好的电化学性能。
。比相关文献报道过[23] 的LiFePO4在相同浓度的Li2SO4水溶液中的10−11的扩散系数略高。表明由本文方法制备的FePO4前驱体合成的LiFePO4具有良好的电化学性能。
4. 结论
1) 以FeSO4和H3PO4为原料,通过控制氧化Fe2+时溶液的pH(1)为1.6~2.0,在不添加任何有机添加
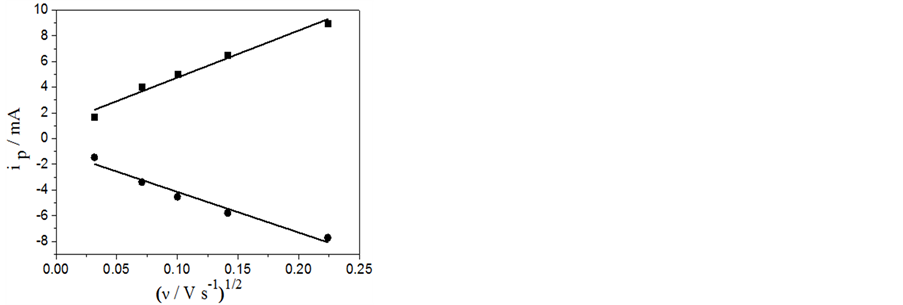
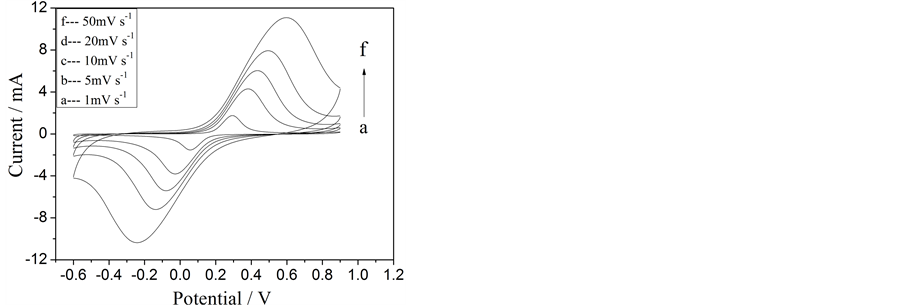
Figure 5. (a) Cyclic voltammograms of LiFePO4/C in 1.0 mol/L Li2SO4·H2O at various scan rates; (b) Plots of ip vs n 1/2
图5. (a) 不同扫描速度下LiFePO4/C在1.0 mol/L Li2SO4·H2O溶液中的循环伏安曲线;(b) ip-v1/2关系图
剂的条件下,合成了类球形貌的FePO4∙2H2O前驱体。类球形二次颗粒由200 nm左右且晶粒尺寸较为均匀的一次颗粒构成。
2) 以自制的FePO4前驱体合成得粒径为1 mm的球形LiFePO4/C正极材料。在1.0 mol/L的Li2SO4∙H2O水溶液中,球形LiFePO4/C显示良好的Li+嵌脱性能。
致 谢
感谢国家自然科学基金(21173196)和浙江振华新能源材料有限公司对本研究工作的资助。
参考文献 (References)
- [1] Padhi, A.K., Nanjundaswamy, K.S. and Goodenough, J.B. (1997) Phospho-olivines as positive-electrode materials for rechargeable lithium batteries. Journal of the Electrochemical Society, 144, 1188-1194.
- [2] Amine, K., Liu, J., Belharouak, I., Kang, S.H., Bloom, I., Vissers, D. and Henriksen, G. (2005) Advanced cathode materials for high-power applications. Journal of Power Sources, 146, 111-115.
- [3] Liao, X.Z., Ma, Z.F., He, Y.S., Zhang, X.M., Wang, L. and Jiang, Y. (2005) Elecchemical Behavior of LiFePO4/C Cathode Material for Rechargeable Lithium Batteries. Journal of the Electrochemical Society, 152, A1969-A1973.
- [4] Tarascon, J.M., Grugeon, S., Morcrette, M., Laruelle, S., Rozier, P. and Poizot, P. (2005) New concepts for the search of better electrode materials for rechargeable lithium batteries. Comptes Rendus Chimie, 8, 9-15.
- [5] Dodd, J.L., Yazami, R. and Fultz, B. (2006) Phase Diagram of LixFePO4. Electrochemical and Solid-State Letters, 9, A151-A155.
- [6] Anna, S.A., Beata, K., Lennart, H. and John, O.T. (2000) Lithium extraction/insertion in LiFePO4: An X-ray diffraction and Mossbauer spectroscopy study. Solid State Ionics, 130, 41-52.
- [7] Macneil, D.D., Lu, Z., Chen, Z. and Dahn, J.R. (2002) A comparison of electrode/electrolyte reaction at elevated temperature for various Li-ion battery cathodes. Journal of Power Sources, 108, 8-14.
- [8] Franger, S., Bourbon, C. and Le Cras, F. (2004) Optimized lithium iron phosphate for high-rate electrochemical applications. Journal of the Electrochemical Society, 151, A1024-A1027.
- [9] Chung, S.Y., Bloking, J.T. and Chiang, Y.M. (2002) Electronically conductive phospho-olivines as lithium storage electrodes. Nature Materials, 1, 123-128.
- [10] Hu, Y.S., Guo, Y.G., Dominko, R., Dominko, R., Gaberscek, M., Jamnik, J. and Maier, J. (2007) Improved electrode performance of porous LiFePO4 using RuO2 as an oxidic nanoscale interconnect. Advanced Materials, 19, 1963-1966.
- [11] Gao, J., Li, J. and He, X. (2011) Synthesis and electrochemical characteristics of LiFePO4/C cathode materials from different precursors. International Journal of Electrochemical Science, 6, 2819-2825.
- [12] 王志兴, 伍凌, 李新海, 胡启明, 郭华军, 彭文杰, 张云河 (2008) LiFePO4的前驱体制备与性能. 功能材料, 4, 614-617.
- [13] 胡国荣, 周玉琳, 彭忠东, 高旭光 (2007) LiFePO4前驱体FePO4的制备及性能.电池, 5, 339-341.
- [14] 叶焕英, 郑典模, 陈骏驰, 李会芹 (2012) 超细二水磷酸铁的制备研究. 无机盐工业, 4, 59-61.
- [15] Scaccia, S., Carewska, M., Bartolomeo, A.D. and Prosini, P.P. (2002) Thermoanalytical investigation of iron phosphate obtained by spontaneous precipitation from aqueous solutions. Thermochimica Acta, 383, 145-152.
- [16] Boonchom, B. and Danvirutai, C. (2007) Thermal decomposition kinetics of FePO4·3H2O precursor to synthetize spherical nanoparticles FePO4. Industrial and Engineering Chemistry Research, 46, 9071-9076.
- [17] Boonchom, B. and Puttawong, S. (2010) Thermodynamics and kinetics of the dehydration reaction of FePO4·2H2O. Physica B: Condensed Matter, 405, 2350-2355.
- [18] Pierri, E., Tsamouras, D. and Dalas, E. (2000) Ferric phosphate precipitation in aqueous media. Journal of Crystal Growth, 213, 93-98.
- [19] 彭忠东, 唐代春, 胡国荣, 杜柯, 曹雁冰 (2012) 均匀沉淀法制备LiFePO4/C及其电化学性能. 中国有色金属学报, 5, 1319-1325.
- [20] Luo, G., Liu, W.J. and Yu, X.Y. (2013) Effect of pyrrole additive on structure and properties of LiFePO4/C cathode materials prepared by in situ polymerization restriction method. Journal of the Chinese Ceramic Society, 41, 19-23.
- [21] Misawa, T., Hashimoto, K. and Shimodaira, S. (1973) Formation of Fe(II)-Fe(III) intermediate green complex on oxidation of ferrous ion in neutral and slightly alkaline sulphate solutions. Journal of Inorganic and Nuclear Chemistry, 35, 4167-4174.
- [22] He, P., Zhang, X., Wang, Y.G., Cheng, L. and Xia, Y.Y. (2008) Lithium-ion intercalation behavior of LiFePO4 in aqueous and nonaqueous electrolyte solutions. Journal of the Electrochemical Society, 155, A144-A150.
- [23] Mi, C.H., Zhang, X.G. and Li, H.L. (2007) Electrochemical behaviors of solid LiFePO4 and Li0.99Nb0.01FePO4 in Li2SO4 aqueous electrolyte. Journal of Electrochemical Chemistry, 602, 245 -254.
- [24] Scaccia, S., Carewska, M., Bartolomeo, A.D. and Prosini, P.P. (2002) Thermoanalytical investigation of iron phosphate obtained by spontaneous precipitation from aqueous solutions. Thermochimica Acta, 383, 145-152.
- [25] 武汉大学 (2010) 分析化学(第五版)上册. 高等教育出版社, 武汉.
- [26] Lee, M.H., Kim, J.Y. and Song, H.K. (2010) A hollow sphere secondary structure of LiFePO4 nanoparticles. Chemical Communications, 46, 6795-6797.
- [27] Yutaka, T., Takashi, Y. and Takashi, K. (1984) The synthesis of green rust II (FeIIIu1 – FeIIu2) and its spontaneous transformation into Fe3O4. Bulletin of the Chemical Society of Japan A, 57, 2411-2416.
- [28] Bocher, F., Gehin, A., Ruby, C., Ghanbaja, J., Abdelmoula, M. and Genin, J.M. (2004) Coprecipitation of Fe(II-III) hydroxycarbonate green rust stabilised by phosphate adsorption. Solid State Sciences, 6, 117-124.
- [29] Choi, J., Batchelor, B., Won, C. and Chung, J. (2012) Nitrate reduction by green rusts modified with trace metals. Chemosphere, 86, 860-865.
- [30] O’Loughlin, E.J., Kelly, S.D., Kemner, K.M., Roseann, C. and Russell, E. (2003) Reduction of AgI, AuIII, CuII, and HgII by FeII/FeIII hydroxysulfate green rust. Chemosphere, 53, 437-446.
- [31] Wu, W.M., Wen, Z.H. and Li, J.H. (2011) Hierarchical carbon-coated LiFePO4 nanoplate microspheres with high electrochemical performance. Advanced Materials, 23, 1126-1129.
- [32] Manickam, M., Singh, P., Thurgate, S. and Prince, K. (2006) Redox behavior and surface characterization of LiFePO4 in lithium hydroxide electrolyte. Journal of Power Sources, 158, 646-649.
- [33] 黄可龙, 杨赛, 刘素琴, 王海波 (2007) 磷酸铁锂在水溶液中的循环伏安研究. 电源技术, 131, 386-388.

NOTES
*通讯作者。