Material Sciences
Vol.
09
No.
06
(
2019
), Article ID:
30967
,
12
pages
10.12677/MS.2019.96076
Electrochemical Polymerization and Its Electrochromic Properties of Polymers Containing 3-Pyridinyl-2,5-Dithiathiophene in the Main Chain
Patigul Aisan1, Abdukaiyum Abdurashid2, Tunsagul Awut2*
1Key Laboratory of Petroleum and Gas Fine Chemicals, Educational Ministry of China, School of Chemistry and Chemical Engineering, Xinjiang University, Urumqi Xinjiang
2Key Laboratory of Functional Polymers, Xinjiang University, Urumqi Xinjiang
Received: Jun. 5th, 2019; accepted: Jun. 19th, 2019; published: Jun. 26th, 2019

ABSTRACT
The poly[3-pyridyl-2,5-bis-octyl thiophene]film (P1) and the copolymers of poly[3-pyridyl-2,5-bis-octyl thiophene-co-alt-3, 4-ethylenedioxythiophene] P2 (1:1), P3 (1:3) and P4 (3:1) films were obtained by electrochemical polymerization in equal proportions with the pure monomer of 3-pyridyl-2,5-bis-octyl thiophene (M3) and 3,4-ethylenedioxythiophene (EDOT) (M3:EDOT = 6:0/ 1:1/1:3/3:1, c/c, (mmoL/L)) in a solvent of dichloromethane:acetonitrile (V:V = 1:19) with tetrabutylammonium hexafluorophosphate (TBAPF6) as a supporting electrolyte, respectively. The M3 was characterized by 1H-NMR, FT-IR and the optical properties of the polymers P1, P2, P3 and P4 films were observed by UV-Vis. Then the optical energy gap values of the homopolymer (P1) flim and the three copolymers (P2, P3, P4) films according to UV-Vis and cyclic voltammetry (CV) were 2.05 eV, 2.02 eV, 1.89 eV and 2.06 eV, and the electrochemical energy gap values were 3.56 eV, 3.39 eV, 3.77 eV, and 3.22 eV, respectively. The polymers of P1, P2, P3, and P4 films had p-type doping and n-type doping behavior. Spectroelectrochemical analysis showed that the polymer films showed electrochromic conversion of P1, P3, and P4 from dark brown (reduced) to light gray (oxidized) (P4 was light yellowish brown) except that P2 exhibited (dark purple). The polymer P2 has a good electrochromic behavior and its optical contrast at 440 nm is 42.9%, the response time is 1.1 s.
Keywords:Pyridyl Thiophene, Electropolymerization, Spectroelectrochemistry, Electrochromic Performance
主链含3-吡啶基-2,5-二噻基噻吩的电化学聚合及其电致变色性能研究
帕提古丽·艾散1,阿布都克尤木·阿布都热西提2,吐尼莎古丽·阿吾提2*
1新疆大学化学化工学院,石油天然气教育部重点实验室,新疆 乌鲁木齐
2新疆大学功能高分子重点实验室,新疆 乌鲁木齐
收稿日期:2019年6月5日;录用日期:2019年6月19日;发布日期:2019年6月26日

摘 要
本文以四丁基六氟磷酸铵(TBAPF6)为支持电解质,在二氯甲烷:乙腈(V:V = 1:19)溶剂中对单体3-吡啶基-2,5-二噻基噻吩(M3)进行电化学聚合获得了聚(2,5-二噻基-3-吡啶基噻吩)均聚物薄膜(P1),并且分别以纯单体(M3)与3,4-乙撑二氧噻吩(EDOT)单体按照以(M3:EDOT = 1:1/1:3/3:1, c/c, (mmoL/L))为比例通过电化学聚合制备了聚(2,5-二噻基-3-吡啶基噻吩-3,4-乙撑二氧噻吩) P2 (1:1)、P3 (1:3)和P4 (3:1)等共聚物薄膜。使用核磁共振氢谱(1H-NMR)和傅里叶变换红外光谱(FT-IR)对单体M3进行了表征测试以及利用紫外-可见光谱(UV-Vis)对聚合物P1、P2、P3、P4薄膜的光学性能进行了研究。根据(UV-Vis)和(CV)分析所得的均聚物P1和共聚物P2、P3和P4的薄膜光学能隙依次为2.05 eV、2.02 eV、1.89 eV和2.06 eV,电化学能隙分别为3.56 eV、3.39 eV、3.77 eV和3.22eV。电化学均聚物P1薄膜和共轭聚合物P2、P3、P4薄膜均具有p-型掺杂和n-型掺杂行为。聚合物薄膜除了P2表现出(深紫灰色)以外P1、P3、P4由深棕色(还原)到浅灰色(氧化) (而P4为浅黄棕色)的电致变色转换。P2在440 nm处的光学对比度为42.9%,响应时间为1.1 s,具有良好的电致变色性能。
关键词 :吡啶基噻吩,电聚合,光谱电化学,电致变色性能

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
过去20年中,因为噻吩及其衍生物在环境中的稳定性、高导电性以及易于形成独立的、高强度的薄膜性等显著的特点而引起了人们广泛的关注 [1] [2] [3] [4] [5] 。为了使共轭聚合物实现高效率性,需要拓宽其光谱吸收的范围和提高空穴迁移率 [6] 。因为有些共轭聚合物在高电位下,其材料在沉积过程中会发生过度氧化导致聚合物膜难溶和难处理 [7] [8] ,有文献记载,噻吩类的电化学聚合性良好,在多联噻吩的电化学聚合电位较低,避免了过度氧化现象的发生 [3] 。低氧化电位化合物可在电化学聚合过程中产生高质量的聚合物薄膜 [9] 。为了提高聚合物薄膜的n-型掺杂态的稳定性需要在聚合物主链中加入给体–受体(D-A)性的EDOT共聚单体,使降低聚合物薄膜的氧化电位 [10] 。主链含缺电子芳环的聚3,4-乙撑二氧噻吩(EDOT)和聚噻吩类共轭聚合物已被报道 [11] [12] ,但是侧链含缺电子芳环的噻吩类共轭聚合物的研究尚未报道或报道极少 [13] ,需要更进一步研究并设计结构规整和共轭程度高的噻吩类聚合物,发现其潜在的应用价值 [14] 。
基于以上思路本文报道了用Stille交叉偶联反应合成D-A-D共单体3-吡啶基-2,5-二噻基噻吩(M3)。纯单体M3在0.1 M四丁基六氟磷酸铵(Bu4PNF6)作为电解质的混合溶液中进行(混合溶液为乙腈:二氯甲烷 = 19:1 V:V)电聚合法获得均聚物以及M3和3,4-乙撑二氧噻吩(EDOT)按比例(M3:EDOT = 3:1, 1:1, 1:3 c/c (mmoL/L))进行共聚得到聚合物薄膜P1、P2、P3、P4,并且研究聚合物薄膜的光、电性能和电致变色敏感性变化。所得的这类聚合物薄膜在双掺杂电致变色器件设计中具有很大的吸引力。
2. 实验部分
2.1. 主要试剂与测试仪器
3-溴吡啶:(99%),上海毕得医药科技有限公司;三丁基锡基噻吩,阿达玛斯试剂有限公司;3-噻吩硼酸:98%,麦克林;3,4-乙撑二氧噻吩,Alfa Aesar;乙腈(ACN)和二氯甲烷(DCM):分析纯,使用通过除氧和除水处理;
核磁共振测试(1H-NMR):采用美国Varian公司(Inova-400 MHz型核磁共振波谱仪) (内标为Me4Si,溶剂为DMSO);红外光谱分析:采用KBr压片,使用德国BRUKER公司(EQUINOX-55型红外光谱仪),扫描波数范围为400 cm−1~4000 cm−1;紫外–可见吸收光谱分析(UV-Vis):日本岛津,UV-1800分光光度计;循环伏安分析(CV):上海辰华公司CHI660C电化学工作站,(0.1 mol/L Bu4NPF6的乙腈溶液作为电解质,ITO玻璃为工作电极,甘汞电极(SCE)为参比电极,铂电极为辅助电极),N2保护,扫描范围为−2~2 V,扫描速度为50 mV/s。
2.2. 单体的合成
2.2.1. 3-吡啶基噻吩(M1)的合成
在室温,N2气保护下,于100 mL三口瓶中先加入12.15 g (94.95 mmol)3-硼酸噻吩,10 g (63.29 mmol) 3-溴吡啶,150 mL的无水THF,搅拌,后将13.1 g无水(K2CO3)和33 mL蒸馏水加入该反应体系里,抽真空后,将2.74 g自制的四(三苯基膦)钯[Pd(PPh3)2Cl2]催化剂倒入到上述反应体系中,90℃时反应20 h以上。反应结束后,液冷却至室温,放入碎冰里,二氯甲烷和水萃取,无水MgSO4干燥,用柱层析分离纯化(乙酸乙酯:石油醚 = 1:4 V:V)。浓缩,得9.6 g白色产品(略带黄色),产率为94%。FT-IR (KBr, cm−1): 3079, 3025, 1568, 1476, 1430, 1325, 867, 778, 697; 1H-NMR (400 MHz, DMSO): δ (ppm): 8.925 (Py-H, 1H), 8.492 (Py-H, 1H), 8.119 (Py-H, 1H), 8.033 (Th-H, 1H), 7.702 (Py-H, 1H), 7.647 (Th-H, 1H), 7.435 (Th-H, 1H)。
2.2.2. 2,5-二溴-3-吡啶基噻吩的(M2)的合成
在N2气保护和冰浴条件下,称取3-吡啶基噻吩(M1) (3.5 g, 21.73 mmol)加入到盛有40 mL (CHCl3:CH2COOH = 1:1)混合溶液的150 mL的双口瓶中,电磁搅拌,抽真空后,将N-溴代丁二酰亚胺(8.12 g, 45.61 mmol)分批加入到上述反应体系里,反应4~6 h。反应液置于碎冰中,用(Na2CO3)溶液中和,二氯甲烷和水洗涤,(MgSO4)干燥,用硅胶柱层析分离纯化(乙酸乙酯:石油醚 = 1:3.5 V:V),得2.26 g白色固体。FT-IR (KBr, cm−1): 3086, 3029, 1572, 1483, 1426, 1322, 983, 882, 805, 701; 1H-NMR (400 MHz, DMSO): δ (ppm): 8.732 (Py-H, 1 H), δ 8.567 (Py-H, 1 H), δ 7.960 (Py-H, 1 H), δ 7.495 (Py-H, 1 H), δ 7.474 (Th-H, 1 H)。
2.2.3. 3-吡啶基-2,5-二噻基噻吩(M3)的合成
在N2气保护下,称取2,5-二溴-3-吡啶基噻吩(M2) (3.92 g, 12.37 mmol)和三丁锡基噻吩(11.80 g、31.54 mmol)加入到盛有90 mL甲苯溶液的250 mL的双口瓶中,搅拌条件下,抽真空后,将二(三苯基膦)二氯化钯(1.32 g, 1.88 mmol)分批加入到上述反应体系里,在反应温度110℃~120℃范围内回流反应14 h。最终产物通过柱层析硅胶分离纯化(乙酸乙酯:石油醚 = 3:5 V:V),得深棕色液体。FT-IR (KBr, cm−1): 3071, 3036, 2952, 2921, 1572, 1483, 1422, 1229, 1079, 1048, 898, 840, 713,624; 1H-NMR (400 MHz, DMSO): δ (ppm): 8.891 (Py-H, 1H), δ 8.874~8.866 (Py-H, 1H), δ 7.839~7.819 (Py-H, 1H), δ 7.458 (Py-H, 1H), δ 7.432~7.420 (Th-H, 1H), δ 7.182~7.150 (Th-H, 1H), δ 7.152~7.111 (Th-H, 2H), δ 7.067~7.045 (Th-H, 2H)。
2.3. 聚合物的合成
2.3.1. 聚[2,5-二噻基-3-吡啶基噻吩]的薄膜(P1)的制备
P1聚合物薄膜在CH166C电化学三电极系统中,以工作电极由ITO玻璃制成,铂电极用作对电极,饱和甘汞电极用作参比电极来,在室温下DCM:ACN (V:V = 1:19)作为溶剂,四丁基铵六氟磷酸盐(TBAPF6)作为支持电解质,单体浓度(6 mM),在−0.5~1.25 v电位区间内,扫速为20 mV/s下,通过30次扫描使用电化学法聚合获得了ITO上堆积的聚合物膜记为P1 (6:0),并依次用乙腈、丙酮冲洗数次。
2.3.2. 聚含[2,5-二噻基-3-吡啶基噻吩-3,4-乙撑二氧噻吩]薄膜(P2, P3, P4)的制备
按照与2.3.1相同的制备条件和方法,以单体M3与EDOT的物质的量比分别为1:1、1:3、3:1共聚获得三种类型的聚合物薄膜,分别记为P2(1:1)、P3 (1:3)、P4 (3:1) (图1)。
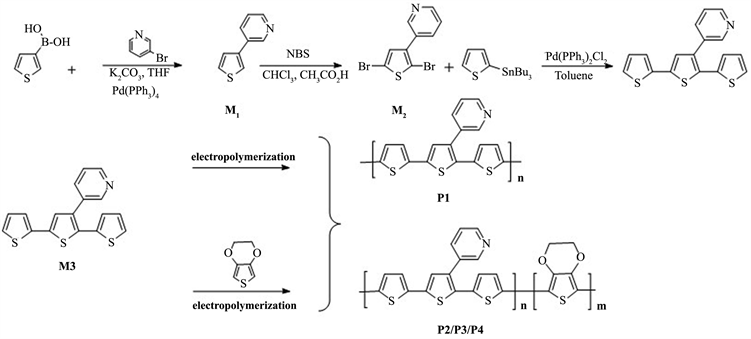
Figure 1. Synthesis routes of target monomers and polymers
图1. 目标单体和目标聚合的合成路线
3. 结果分析与讨论
3.1. 单体的红外光谱与核磁共振氢谱分析
图2为单体(M1, M2, M3)的红外光谱图。由图2可见,M1的噻吩环和吡啶环上的-CH-峰分别在3079 cm−1, 3025 cm−1处出现,而在1568 cm−1, 1476 cm−1处的峰是C=C的伸缩振动峰,在1430 cm−1处的是-C=N-的伸缩振动峰,其他M2中分别在3086 cm−1, 3029 cm−1, 1572 cm−1, 1483 cm−1, 1426 cm−1, 1322 cm−1处分别出现了-CH-,C=C和-C=N-的伸缩振动峰以及在983 cm−1处的是C-Br峰。根据单体M6的红外光谱图数据可见,吡啶环上C=CH的拉伸振动峰分别为3071 cm−1和3036 cm−1,而在1572 cm−1, 1483 cm−1, 1422 cm−1处的化学位移是C=C-C和C=N的伸缩振动峰值,在898~624 cm−1处也出现了噻吩环C-H上的振动吸收峰 [15] 。因此可以判断单体合成正确。
图3为单体M1、M2和M3在氘代氯仿(DMSO)中的1H-NMR谱。从图3可见,单体M2中有两种不同的氢,其中噻吩环单元上的氢信号处于化学位移在δ (ppm) 8.732, 8.567, 7.960, 7.495处出现;在δ = 7.474处是吡啶环上的一个氢的信号;对M3谱图中分析可以看出,M3中有三种不同环境的氢,苯环上

Figure 2. FT-IR spectra of monomers (M1, M2, M3)
图2. 单体的红外光谱图(M1, M2, M3)
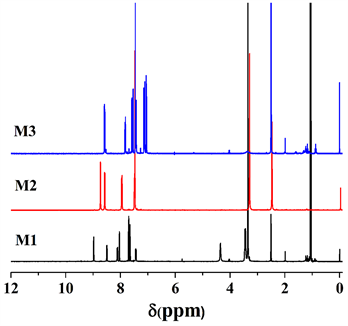
Figure 3. 1H-NMR spectrum of monomers (M1, M2, M3)
图3. 单体的核磁共振氢谱图(M1, M2, M3)
的氢在δ = 6.99 (s, 2H)出现吸收峰而在δ: 3.98 (t, 4H), 3.34 (s, 2H), 1.80~1.26 (m, 24H)和0.88 (t, 6H)处出现的吸收峰分别在烷氧基链接亚甲基-OCH2-、在乙炔基-CH3和辛烷基链-CH2-和烷基末端-CH3-上的吸收峰。综合红外光谱图和核磁共振氢谱图结果分析可知,中间单体和目标单体已成功的合成。
3.2. 聚合物的紫外-可见光谱分析
图4 为目标单体M3和聚合物P1、P2、P3、P4薄膜在氯仿溶液中和薄膜状态下的紫外–可见(UV-Vis)吸收光谱图,由其紫外吸收所得相关的光谱数据汇总在表1中。从图4中可以得出,单体M3和聚合物P1, P2, P3, P4分别在351 nm, 411 nm, 424 nm, 442 nm和468 nm处。与单体M3相比,聚合物薄膜P4的紫外–可见最大吸收波长红移约117 nm,表明聚合物主链中缺电子吡啶环单元与一定比例的高活性和高稳定性的3,4-乙撑二氧噻吩(EDOT)单元共处在共平面,并实现了较好的电荷移动,使聚合物共轭程度增加 [9] 。P4与其他聚合物薄膜相比,P4的紫外–可见吸收出现明显出红移的现象,其是由于分子主链结构是平面结构的芳香噻吩环组成和侧链吸电子能力的吡啶环组成,随着EDOT比例的提高,增加了聚合物共轭程度,使得紫外吸收红移 [12] 。
Table 1. Electrochemical data of polymers (P1, P2, P3, P4)
表1. 聚合物薄膜(P1, P2, P3, P4)的电化学数据
aEox and Ered were onset potential of reduction and oxidation, respectively. bHOMO and LUMO were calculated from the empirical formula HOMO = −(Eox + 4.8), LUMO = −(Ered + 4.8). cElectrochemical band gap (Egel) were estimated using Egel = Eox - Ered. dOptical band gap energies (Egopt) were calculated from the onset edge absorption wavelength in film state. (based on the empirical formula Egopt = 1240/λ).

Figure 4. UV-vis spectra of monomer (M3) and polymers (P1, P2, P3, P4) in CHCl3
图4. 单体(M3)和聚合物(P1, P2, P3, P4)在溶液状态下的的紫外–可见光谱图
通过均聚物和共聚物薄膜(P1, P2, P3, P4)紫外-可见光谱的起峰位置(分别为603 nm, 612 nm, 653 nm, 600 nm)来计算出P1、P2、P3、P4的光学带隙,且其光学带隙依次分别为2.05 eV, 2.02 eV, 1.89 eV, 2.06 eV。
3.3. 聚合物电化学行为分析
将(ACN/DCM = V:V = 19:1)作为为溶剂,TBAPF6作为电解质,聚合物P1、P2和P4薄膜以扫描电位为−0.5~1.45 V而P3以扫描电位−1.0~1.45 V的情况下,通过电化学聚合获得目标聚合物薄膜,结果参见图5。从图中获得的数据表明,四种比例的聚合物都出现氧化还原峰,并且其中P4具有比较低的能带隙,表示通过适当比例加入给电子基团EDOT与电子吸引基团吡啶环联系起来使得共轭结构硬化,以改善平面性和减少键长交替。表明该单体主链含的噻吩环平面环提供更广泛的共轭条件 [12] 。
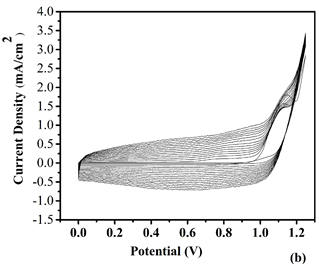
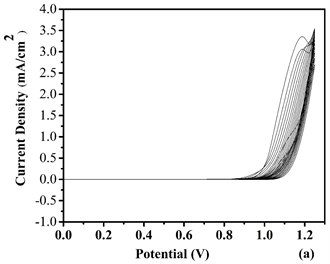
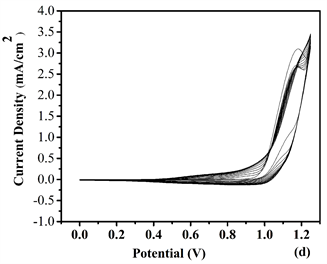
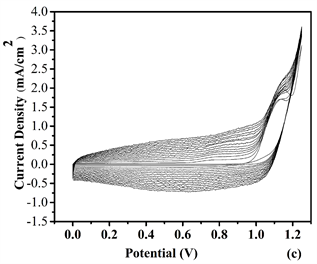
Figure 5. Repeated potential scan electrochemical polymerization of (a) P1, (b) P2, (c) P3 and (d) P4 at 20 mV/s in ACN/DCM (19:1, v:v) solution containing 0.1 M TBAPF6 on ITO electrode
图5. 在20 mV/s下,0.1 M TBAPF6的ACN/DCM (19:1, v:v)溶液中,在ITO玻璃上对纯单体M6与不同浓度的EDOT进行循环伏安电化学聚合:(a) P1, (b) P2, (c) P3和 (d) P4
图6是聚合物P1、P2、P3、P4薄膜在含0.1 M的TBAPF6的纯乙腈溶液中的CV图,其在三电极体系下与2.3.1同,正负电压扫描范围为−2~2 V (扫描速率为50 mVs−1)。根据均聚物P1薄膜的循环伏安图
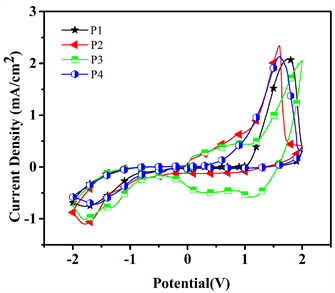
Figure 6. Cyclic voltammograms of the polymer films of P1, P2, P3, P4 in 0.1 M TBAPF6 of ACN solution at scan rate of 50 mV/s
图6. 聚合物薄膜P1,P2,P3,P4在0.1 mol/L Bu4NPF6ACN中的循环伏安曲线图
可知,在1.74 V处的是有一个氧化波,而其在−1.82 V处出现的是还原波。同理均聚物P2、P3、P4的氧化掺杂峰分别为1.60 V、1.96 V、1.61 V而其还原掺杂峰−1.79 V、−1.81 V、−1.61 V。P3与P1、P2和P4具有较大的氧化掺杂峰和去掺杂峰。并且P3在阴极电位处具有两对峰,分别在−0.48 V和−0.56 V。可能是因为聚合物单元中的3,4-乙撑二氧噻吩(EDOT)和吡啶环单元分别参与阴极反应 [12] 。
通过n-掺杂和p-掺杂循环伏安曲线获得数据,参考文献方法 [16] 计算出聚合物薄膜的HOMO能级和LUMO能级,还有根据该图数据可知其电化学能隙和长波长处的起始吸收波长处聚合物薄膜的一系列光学能隙,并将所有相关数据都汇总在表1中。
3.4. 光谱电化学分析
通过改变共聚物组成中EDOT与单体M3的含量,并且分析了所获得的聚合物P1、P2、P3、P4薄膜的电致变色性能。
使用UV-2450紫外-可见光谱仪与CHI660电化学工作站联用,通过三电极系统(0.1 mol/L TBAPF6乙腈作为溶剂电解质溶液) P1、P4同样在0~1.5 V条件下测试,而P2在0~0.8 V和 P3在0~0.5 V范围内获得的光谱电化学的变化。ITO上聚合物膜的光谱电化学如图7所示,所有的紫外吸收光谱都与其刚性共轭骨架一致。从吸收边带,可以计算出聚合物膜P1、P2、P3、P4在ACN中的带隙(OPT = 1240/λ)分别为2.05 eV、2.02 eV、1.89 eV和2.06 eV。

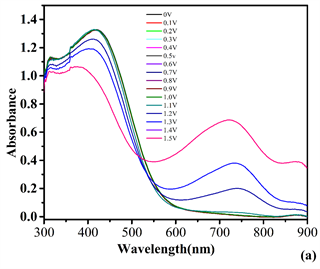

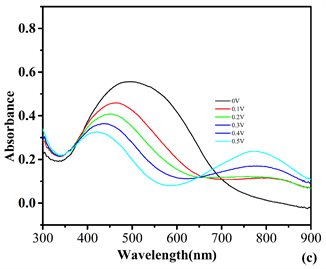
Figure 7. Electronic absorption spectra of P1 (a), P2 (b), P3 (c) and P4 (d) on ITO in 0.1 M TBAPF6 of ACN solution at various applied potentials between 0 and 1.5 V for P1, P4 and between 0 and 0.7 V for P2 and P3 is between 0 and 0.4 V
图7. 修饰ITO玻璃上的聚合物薄膜P1 (a)、P2 (b)、P3 (c)和P4 (d)在0.1 MTBAPF6/ACN溶液中,在不同电压下:P1和P4在0 V~1.5 V,P2在0 V~0.7 V和P3在0 V~0.4 V范围的紫外吸收光谱图
表1显示了聚合物薄膜的电化学和光学数据。一般说来,聚合物P1、P2、P3、P4薄膜的π-π共轭吸收带随着应用电位的增加而减小,同时均在650~850 nm范围内形成新的吸收带,这表明电荷载流子的形成以及属于聚合物薄膜的双极子带 [17] [18] 。在这个电化学过程中,其颜色在中性状态下,P1、P2、P3、P4分别为显深棕色,深紫灰色,深棕色,深棕色,而在掺杂状态下分为浅灰色,浅灰色,浅灰色,浅黄棕色。
3.5. 聚合物薄膜的扫描速度依赖性分析
图8是在25~500 mV−1的条件下分别测得的聚合物P2、P3、P4薄膜在不同扫速和电流密度下的依赖


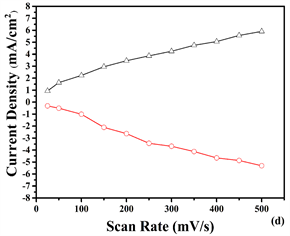

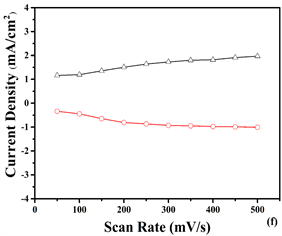
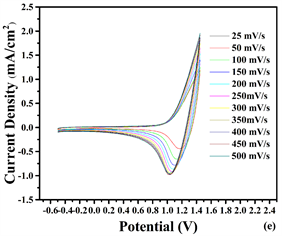
Figure 8. Scanning rates of dependence of (a) P2, (c) P3 and (e) P4 in monomer free ACN/DCM (19/1) solution with 0.1M TBAPF6 at scan rates of 25, 50, 100,150, 200, 250, 300, 350, 400, 450 and 500 mV/s. Relationship between anodic (O) and cathodic (D) current peaks as a function of scan rate for (b) P2, (d) P3 and, (f) P4 films
图8. (a) P2, (c) P3, (e) P4在0.1 MTBAPF6的乙腈(ACN):二氯甲烷(DCM)溶液中,扫速为25, 50, 100, 150, 200, 250, 300, 350, 400, 450, 500 mV/s时,聚合物薄膜的扫描速度依赖性;(b) P2, (d) P3, (f) P4阳极(O)和阴极(D)电流密度峰与不同扫描速率变化的关系图
性曲线,从图可以看到,电流响应随扫描速率的增加而均匀增加,均表现出良好的电活性,从图谱分析得聚合物薄膜具有一定的扫描速度依赖性。沉积在ITO玻璃上的薄膜,在ACN中存在两个不同的还原峰和氧化峰。按照图8中的信息,(a)-(f)表示峰值电流密度和扫描速率之间的线性关系,共聚物膜的扫描速率随扫描速率的增加而线性增加。这种现象观归因于非扩散限制氧化还原过程和在电极上形成良好粘附的电活性聚合物膜的原因 [19] 。
3.6. 聚合物薄膜的电致变色响应时间及对比度分析
通过对聚合物薄膜进行电致变色响应时间测试来确定其变色灵敏度。其中达到90%的对比度(ΔT%)变化所需要的时间就是响应时间,本测试过程的仪器与3.5相同,仪器采用紫外–可见(UV-vis)光谱仪器,设定方法:动力学测试方法,电化学工作站,方法:计时电流法,P1、P3、P4的时间都设置为4 s而P2的时间设为3 s。图8是对制备出来的目标聚合物聚合物薄膜P1、P4的电压分别为在0 V(中性态)~1.5 V (完全氧化态),而P2的电压分在0 V (中性态)~0.7 V (完全氧化态),P3的电压在0 V (中性态)~0.5 V (完全氧化态)时,聚合物薄膜P1 (a)、P2 (b)、P3 (c)、P4 (d)的透光率-时间曲线图。从图中数据可知,三种聚合物薄膜(P1、P3和P4):波长(P1) 730 nm,(P3) 778 nm,(P4) 747 nm,光学对比度:20%,另一种共聚物(P2):波长440 nm,光学对比度:42.9%。颜色透射率达到稳定态状态(一般90%)时,聚合物薄膜P1、P3、P4的响应时间均为1.7 s而P2的响应时间为1.1 s。P2的光学对比度相比其他文献报道的含EDOT与噻吩环的共聚物薄膜(431 nm, DT = 28%),含吡啶环与EDOT的聚合物薄膜(391 nm, DT = 26%)的光学对比度高 [20] [21] (图9)。
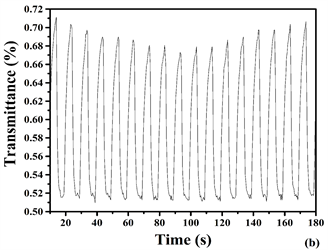


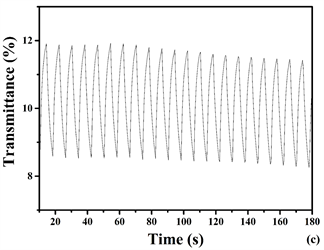
Figure 9. Optical transmitting changes for P1 (a), P4 (d) at 730 nm and 747 nm (0 V - 1.5 V); P2 (b) at 440 nm (0 V - 0.7 V) and P3 (c) at 778 nm (0 V - 0.5 V) 0.1 MTBAPF6 in ACN solution was used for electrolyte from 0v to 0.5 v with a residence of 4 s (P1, P3, P4) and (P2) with 5 s
图9. 在0.1 M TBAPF6的乙腈电解质溶液中的透光率的变化图:P1 (a), P4 (d)在730 nm和747 nm处(4 s),0 V~1.5 V,而P2 (b)在440 nm (5 s),0 V~0.7 V; P3 (c)在778 nm处,0 V~0.5 V
4. 结论
本文通过Stille偶联反应合成了一种新型单体,含有吡啶基三噻吩的M3,单体M3与EDOT的比例为6:0、1:1、1:3、3:1通过电化学聚合得四种类型聚合物薄膜,分别记为P1 (6:0)、P2 (1:1)、P3 (1:3)、P4 (3:1),并通过UV-Vis与CV图计算它们的光学能隙分别为2.05 eV、2.02 eV、1.89 eV和2.06 eV,电化学能隙分别为3.56 eV、3.39 eV、3.77 eV和3.22 eV。聚合物薄膜具有较好的p-型和n-型掺杂行为。其光谱电化学分析可知,聚合物薄膜除了P2(显示深紫灰色)以外其他薄膜P1、P3、P4表现出由深棕色(还原)到浅灰色(氧化) (其中,P4的氧化为浅黄棕色)的电致变色转换。根据实验紫外可见分光度计测量聚合物P2薄膜的透光率(%T)显示,共聚物P2在440 nm处的光学对比度为42.9%,响应时间为1.1 s,并且具有良好的电致变色性能,所得的这类材料在电子和光电器件中具有很高的潜在应用性。
基金项目
感谢国家自然科学基金(Nos. 21164011),新疆大学博士启动基金(Nos. BS150233)对本工作的支持。
文章引用
帕提古丽•艾散,阿布都克尤木•阿布都热西提,吐尼莎古丽•阿吾提. 主链含3-吡啶基-2,5-二噻基噻吩的电化学聚合及其电致变色性能研究
Electrochemical Polymerization and Its Electrochromic Properties of Polymers Containing 3-Pyridinyl-2,5-Dithiathiophene in the Main Chain[J]. 材料科学, 2019, 09(06): 600-611. https://doi.org/10.12677/MS.2019.96076
参考文献
- 1. Waltman, R.J., Bargon, J. and Diaz, A.F. (1983) Electrochemical Studies of Some Conducting Polythiophene Films. The Journal of Physical Chemistry, 8, 1459-1463. https://doi.org/10.1021/j100231a035
- 2. Pouwer, K.L., Vries, T.R., Havinga, E.E., Meijer, E.W. and Wynberg, H. (1988) Poly-1,4-diketones Obtained by the Stetter Reaction: A New Route to Conducting Heterocyclic Poly-mers. Journal of the Chemical Society, Chemical Communications, 21, 1432. https://doi.org/10.1039/c39880001432
- 3. Roncali, J., Garreau, R. and Lemaire, M. (1990) Electrosynthesis of Conducting Poly-Pseudo-Crown Ethers from Substituted Thiophenes. Journal of Electroanalytical Chemistry, 278, 373-378. https://doi.org/10.1016/0022-0728(90)85147-W
- 4. Lee, K. and Sotzing, G.A. (2001) Poly(thieno[3,4-b]thiophene) a New Stable Low Band Gap Conducting Polymer. Macromolecules, 34, 5746-5747. https://doi.org/10.1021/ma0106245
- 5. Kumar, S.R.C. (1998) Advances in Conductive Polymers. European Polymer Journal, 34, 1053-1060. https://doi.org/10.1016/S0014-3057(97)00204-8
- 6. Li, Y. and Zou, Y. (2010) Conjugated Polymer Photovoltaic Materials with Broad Absorption Band and High Charge Carrier Mobility. Advanced Materials, 20, 2952-2958. https://doi.org/10.1002/adma.200800606
- 7. Groenendaal, L., Zotti, G., Aubert, P.H., Waybright, S.M. and Reynolds, J.R. (2010) Electrochemistry of poly(3,4-al- kylenedioxythiophene) Derivatives. Advanced Materials, 15, 855-879. https://doi.org/10.1002/adma.200300376
- 8. Rousseau, T., Cravino, A., Bura, T., Ulrich, G., Ziessel, R. and Roncali, J. (2009) Bodipy Derivatives as Donor Materials for Bulk Heterojunction Solar Cells. Chemical Communications, 13, 1673. https://doi.org/10.1039/b822770e
- 9. Chen, H., Lu, Y., Ong, T.T. and Ng, S.C. (2009) Synthesis, Characterization, and Prop-erties of Regioregular Conjugated Polymers Containing Quaterthiophene and an Acceptor Repeating Units. Journal of Polymer Science, Part A: Polymer Chemistry, 47, 2163-2171. https://doi.org/10.1002/pola.23313
- 10. Hong, K.H., Oh, K.W. and Kang, T.J. (2010) Preparation and Properties of Electrically Conducting Textiles by in Situ Polymerization of poly(3,4-ethylenedioxythiophene). Journal of Applied Polymer Science, 97, 1326-1332. https://doi.org/10.1002/app.21835
- 11. Abdiryim, T., Jamal, R., Zhao, C., Awut, T. and Nurulla, I. (2010) Structure and Properties of Solid-State Synthesized Poly(3’,4’-ethylenedioxy-2,2’:5’,2’-terthiophene). Synthetic Metals, 160, 325-332. https://doi.org/10.1016/j.synthmet.2009.10.033
- 12. Roncali, J., Blanchard, P. and Frere, P. (2005) 3,4-ethylenedioxythiophene(edot) as a Versatile Building Block for Advanced Functional Pi-Conjugated Systems. Journal of Materials Chemistry, 15, 1589-1610. https://doi.org/10.1039/B415481A
- 13. Shuai, D., Ahmat, A., Ruxangul, J., Ling, X., Ziping, Z. and Tursun, A. (2018) An Electro-chemical Sensor of Poly(edot-pyridine-edot)/Graphitic Carbon Nitride Composite for Simultaneous Detection of cd2+ and pb2+. Ma-terials, 11, 702. https://doi.org/10.3390/ma11050702
- 14. Gunbas, G. and Toppare, L. (2012) Electrochromic Conjugated Pol-yheterocycles and Derivatives-Highlights from the Last Decade towards Realization of Long Lived Aspirations. Chemical Commu-nications, 48, 1083-1101. https://doi.org/10.1039/C1CC14992J
- 15. Abdurashid, A., Ahat, B., Mirzehmet, A., Awut, T. and Nurulla, I. (2016) New Soluble π-Conjugated Polymers Containing 2-Diisopropylamino-1,3,5-Triazine Unit: Synthesis, Characterization and Optical Properties. Journal of Polymer Research, 23, 92. https://doi.org/10.1007/s10965-016-0929-1
- 16. Baran, D., Balan, A., Celebi, S., Meana Esteban, B., Neugebauer, H., Sariciftci, N.S., et al. (2010) Processable Multipurpose Conjugated Polymer for Electrochromic and Photovoltaic Applications. Chemistry of Materials, 22, 2978-2987. https://doi.org/10.1021/cm100372t
- 17. Beaujuge, P.M. and Reynolds, J.R. (2010) Color Control in Pi-Conjugated Organic Polymers for Use in Electrochromic Devices. Chemical Reviews, 110, 268-320. https://doi.org/10.1021/cr900129a
- 18. 张国兵. 低能带隙、低HOMO能级的给/受体聚合物太阳能电池材料的设计、合成及光伏性能[D]: [硕士学位论文]. 上海: 上海交通大学, 2011.
- 19. Heinze, J. (2010) Cyclic Voltammetry—“Electrochemical Spectroscopy”. New Analytical Methods (25). Angewandte Chemie International Edition, 23, 831-847. https://doi.org/10.1002/anie.198408313
- 20. Ming, S., Zhen, S., Lin, K., Zhao, L., Xu, J. and Lu, B. (2015) Thiadiazolo[3,4-\r, c\r, ]pyridine as an Acceptor toward Fast-Switching Green Donor-Acceptor-Type Elec-trochromic Polymer with Low Bandgap. ACS Applied Materials and Interfaces, 7, 11089-11098. https://doi.org/10.1021/acsami.5b01188
- 21. Jian, N., Gu, H., Zhang, S., Liu, H., Qu, K., Chen, S., et al. (2018) Synthesis and Electrochromic Performances of Donor-Acceptor-Type Polymers from Chalcogenodiazolo [3,4-c]pyridine and Alkyl Prodots. Elec-trochimica Acta, 266, 263-275. https://doi.org/10.1016/j.electacta.2018.01.099
NOTES
*通讯作者。
