Material Sciences
Vol.
10
No.
07
(
2020
), Article ID:
36565
,
11
pages
10.12677/MS.2020.107069
Cell Removal, DNase Hydrolysis and Osteogenic Promotion of Extracellular Matrix Secreted by Bone Mesenchymal Stem Cells
Yuanjun Huang, Huan Wu, Guangfu Yin*
College of Materials Science and Engineering, Sichuan University, Chengdu Sichuan

Received: Jun. 26th, 2020; accepted: Jul. 10th, 2020; published: Jul. 17th, 2020

ABSTRACT
In the field of bone tissue engineering, the regulation of growth factor (GFs) is of great significance in promoting bone tissue regeneration and vascularization, but excessive tissue hyperplasia and vascular malformation caused by improper use of exogenous growth factors should be paid more attention. The extracellular matrix (ECM) of osteogenic-induced bone marrow mesenchymal stem cells (BMSCs) is rich in self-expressed osteogenic growth factors and is suitable for osteogenic differentiation, stromal mineralization and angiogenesis of BMSCs. Focusing on the ECM application in bone tissue engineering, some key issues, such as immunogenicity removal, active component retention, and effective coating on scaffolds were studied in this study. BMSCs were osteogenically induction with DXMS/β-sodium glycerophosphate (β-GP)/vitamin C, and the ECM secreted by BMSCs during osteogenic differentiation was collected. Then the residual cells and genetic components were removed by the repeated freezing-thawing and the DNase hydrolysis. ELISA test results showed that the decellularized extracellular matrix (dECM) still retained the moderate amount of active components with the COL-I of 230.89 ng/mg, the BMP-2 of 10.047 ng/mg, the VEGF of 10.857 ng/mg, and the OC of 16.866 ng/mg. Polylactic acid-glycolic acid copolymer (PLGA) and polycaprolactone/polyglycolic acid (PGA/PCL) three-dimensional porous scaffolds with pore diameter of 32 - 48 μm and porosity of 80% were prepared by solvent casting/particle filtration. DECM acetic acid dispersion was coated on the three-dimensional porous scaffold by vacuum impregnation-acetic acid evaporation process. The results of alkaline phosphatase (ALP) activity determination and alizarin red mineralized nodule staining showed that the three-dimensional porous scaffolds with dECM coating exhibited the obvious osteogenic promotion effect.
Keywords:Bone Marrow Mesenchymal Stem Cells, Extracellular Matrix, Decellularization, DNA Enzymolysis, Growth Factors

骨髓间充质干细胞胞外基质的细胞脱除、DNA酶水解及其成骨促进作用
黄元钧,吴欢,尹光福*
四川大学材料科学与工程学院,四川 成都
收稿日期:2020年6月26日;录用日期:2020年7月10日;发布日期:2020年7月17日

摘 要
在骨组织工程领域中,生长因子的调控对于促进骨组织的再生和血管化具有非常重要的意义,但外源性生长因子的不当使用所带来的组织过度增生及血管畸形等不良反应亦需给予高度的重视。经成骨定向诱导的骨髓间充质干细胞(BMSCs)的胞外基质(ECM)富含其自身表达的成骨相关生长因子,适应于BMSCs的成骨分化、基质矿化和血管生成。本研究针对BMSCs胞外基质在骨组织工程的应用,进行免疫原性去除、活性成分保留及ECM在组织工程支架有效涂装等关键问题的研究。以地塞米松/β-甘油磷酸钠/维生素C对BMSCs进行成骨化诱导并获取其在成骨分化过程中分泌的ECM,通过反复冻融法和DNA酶酶解法去除ECM中残留的细胞和遗传物质。ELISA测试结果表明,获取的脱细胞胞外基质(dECM)中COL-I为230.89 ng/mg、BMP-2为10.047 ng/mg、VEGF为10.857 ng/mg、OC为16.866 ng/mg。采用溶剂浇铸/颗粒滤沥法制备孔径32~48 μm,孔隙率为80%的聚乳酸–羟基乙酸共聚物(PLGA)及聚己内酯/聚乙醇酸(PGA/PCL)三维多孔支架,将dECM乙酸分散液通过真空浸渍–乙酸蒸发工艺对三维多孔支架进行涂装。碱性磷酸酶(ALP)活性测定和茜素红矿化结节染色等结果表明,dECM涂装的三维多孔支架具有明显的成骨促进效应。
关键词 :骨髓间充质干细胞,胞外基质,脱细胞化,DNA酶解,生长因子

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 绪论
由创伤、炎症、骨病等因素所造成的大段骨缺损已成为临床医学的一个重要问题,传统的治疗方法已无法满足临床的,基于可降解支架材料、种子细胞及生长信息三要素的骨组织工程成为目前最有前景的治疗方法。成骨相关生长因子(GFs)对骨髓基质细胞的分化及成骨矿化起着及其重要的调控作用,如骨形态发生蛋白-2 (BMP-2)可以加速新生BMSCs形成软骨的过程并提高BMSCs的成骨能力和血管内皮生长因子(VEGF)的表达,血管内皮生长因子(VEGF)可促进血管网络的生成等 [1]。但是外源性生长因子的不当使用具有产生不良反应的风险,如局部骨组织过度增生而压迫神经造成神经性疼痛,以及新生的骨组织存在骨密度较低,甚至其内部形成骨空腔的问题,另外局部组织的VEGF浓度过高导致大量血管增生,骨组织自身的再生无法跟上血管新生的速度而导致不健康的新生血管,继而可能出现出血现象。
BMSCs作为一种具有向多种细胞如成骨、软骨、脂肪、神经和成肌细胞分化潜能的细胞系 [2],在向成骨细胞分化的过程中会在胞外基质(ECM)中表达一些对分化过程有促进作用的活性物质如COL-I、BMP-2、VEGF等,同时ECM独特的生物学功能和优良的生物学特性可以为宿主细胞提供一个适宜生存的微环境,并通过自身复杂的信号转导系统影响他们的生理功能包括细胞形态、增殖、迁移、分化和代谢等 [3]。另外ECM还具有延缓BMSCs老化,维持细胞干性的功能,ECM中的一些趋化因子(CFs)还可以募集宿主血液中的BMSCs向缺损处聚集 [4] [5]。因此,利用BMSCs在向成骨细胞分化过程中分泌的ECM对可降解的支架材料进行涂装可以改善支架材料的生物学功能,还可以利用ECM中细胞表达的GFs在实现外源性GFs功能的同时避免相应的不良反应。然而,ECM的应用仍存在一些问题。首先,ECM中残留的细胞碎片和遗传物质会被受体的免疫系统识别为抗原,在植入过程中产生严重的炎症反应和免疫排斥,虽然通过对ECM进行脱细胞的处理可以有效减轻免疫反应的强度,但是ECM中的活性成分以及其自身独特的三维结构也会在脱细胞的过程中被破环,因此细胞及免疫物质的彻底脱除与活性物质的保留仍然是一个矛盾的问题。已有的脱细胞方式中应用较多的为反复冻融法和洗涤剂法,其中洗涤剂法即聚乙二醇辛基苯基醚(Triton X-100)和氢氧化铵的联合使用,两者相比,反复冻融法可以更好地保护ECM的三维结构以及其中的活性成分,但是对细胞及遗传物质的脱除没有洗涤剂法彻底 [6]。
本研究针对ECM免疫原性去除与活性成分保留的矛盾以及ECM在支架微孔内壁均匀涂装的难题。利用地塞米松(DXMC)、β-甘油磷酸钠(β-GP)和维生素C (VC)对BMSCs进行诱导培养,并获取其在向成骨细胞分化过程中分泌的ECM,利用反复冻融法和DNase-I水解法脱除ECM中残留的细胞和遗传物质,低浓度的醋酸对脱细胞胞外基质(dECM)进行分散处理获得分散液,以FDA批准临床使用的聚乳酸-羟基乙酸共聚物(PLGA)和聚己内酯(PCL)为原料 [7],通过溶剂浇筑/粒子溶出的方式制备多孔聚合物支架,该方法通过改变致孔剂的粒径和比例,可根据需要调节材料的孔径和孔隙率,PCL因为其降解动力学和生物活性较差的问题 [8],在制备过程中掺入聚乙醇酸(PGA)以提高材料的亲水性和力学性能 [9]。最后利用真空浸渍法在多孔聚合物支架材料表面涂装dECM。基于碱性磷酸酶(ALP)活力和矿化结节染色的方式验证涂装之后的支架材料对BMSCs向成骨细胞分化的促进作用。旨在寻找一种有效的方式,将dECM中的活性物质涂装在可生物降解的多孔聚合物支架表面以赋予其独特的生物学功能。
2. 材料和方法
2.1. 材料和试剂
试验所使用的BMSCs提取自无特定病原体(SPF)级,体重100~120 g的雄性Wistar大鼠,实验动物由成都达硕实验动物有限公司提供。主要试剂及耗材如表1所示。
Table 1. Experimental reagents and consumables
表1. 实验试剂及耗材
2.2. 细胞获取及培养
动物试验由四川大学动物护理及使用委员会批准,遵循中国科技院出版的《实验动物护理及使用指南》进行。Wistar大鼠经过颈椎脱臼法处死后,75% (v/v)乙醇浸泡消毒,取出两侧后肢股骨及胫骨并剔除多余的软组织和结缔组织。无菌条件下将股骨的两端剪开暴露骨髓腔,用一次性医用注射器吸取5 mL标准培养基(α-MEM,10%胎牛血清(FBS)和1%青链霉素溶液(P/S),4℃预冷)在无菌玻璃瓶中反复冲洗骨髓腔至骨髓完全被冲出,之后使用移液器反复吹打骨髓抽吸物并接种于25 cm2的一次性培养瓶中,在37℃,5% CO2的细胞培养箱中静置培养,胫骨与股骨操作类似。细胞培养72 h之后半换液,144 h后全换液,待贴壁细胞增殖到70%铺满瓶底用0.25%胰蛋白酶(Try)消化传代后作为第一代BMSCs,传代第二天全换液并在贴壁细胞增殖到70%时再次传代,得到第二代BMSCs用于后续试验,经过上述操作可以实现去除全部悬浮细胞和纯化BMSCs的目的。
2.3. 诱导培养及细胞和遗传物质的脱除
将第二代BMSCs消化并接种在75 cm2一次性培养瓶中,在标准培养条件下用诱导培养基(α-MEM, 10% FBS, 1% P/S, 10 nM DXMS, 10 mM β-GP, 50 μg/mLVC)培养14天,每三天更换一次培养基。培养结束后,用PBS洗涤,然后放入−80℃超低温冰箱冷冻30 min后转移到37℃烘箱中保温30 min,反复循环三次,通过让细胞内形成冰粒和细胞液的盐浓度增高引起溶胀,使细胞结构破碎。利用PBS洗涤除去细胞残片后,加入酶活力为150 units/mL的I型DNA酶(DNase-I),在37℃下孵育30 min以破环残留的DNA,再次使用PBS洗涤除去DNA碎片之后,用细胞刮刀缓慢地从瓶底将dECM刮下并收集在10 mL一次性离心管中,其中每3瓶的dECM保存在一个离心管中。
检验脱细胞效果,将第二代BMSCs消化计数后以5 × 103个/孔接种在24孔板中,通过上述培养方法培养14天后,利用4’,6-二脒基-2-苯基吲哚(DAPI)在脱细胞前后进行染色,培养好的细胞利用PBS清洗后加入即用型DAPI染色覆盖,室温下染色10 min,用PBS清洗三次之后,在倒置荧光显微镜下观察,激发波长为360~400 nm。DNA脱除情况的检测,利用DNA定量检测试剂盒测定脱细胞前后的DNA含量,具体试验操作遵循试剂盒说明书进行。
2.4. 酶联免疫吸附测定
装有dECM的离心管中加入0.02 mol/L的醋酸溶液并密封,在4℃条件下,利用涡旋分散仪处理10 min,经过低温离心机离心3 min (1500 r/min)收集上清液,未充分分散的dECM再次加入醋酸溶液重复上述操作直至分散完全,获得的dECM分散液全程保存在4℃条件下以保护其中的活性物质。收集的dECM分散液转移到截留分子量为3 kD的超滤管,在4℃条件下,4000 rpm超滤30 min,进行浓缩。再次通过低温离心机离心20 min (2500 r/min)并取上清液,利用酶联免疫吸附测定试剂盒(ELISA kits)测定其中的活性物质如COL-I、BMP-2、VEGF和骨钙素(OC)的浓度,具体操作遵循试剂盒说明书进行。
2.5. 含dECM的培养基中的细胞培养
经过超滤浓缩后的dECM分散液以体积比为0%、2%、4%、6%、8%、10%、14%、20%和30%与标准培养基配置为含不同浓度dECM分散液的培养基,BMSCs通过消化计数后以5 × 103个/孔接种在24孔板中,待细胞完全贴壁后,用先前配置的不同培养基在标准培养条件下进行培养,每个浓度设置4个平行。利用MTT在培养了1、3、5、7天后测定细胞增殖的情况,利用试剂盒在培养7天后对细胞分泌的ALP进行定性和定量的检测,操作步骤参见试剂盒说明书进行。在培养了28天之后,利用茜素红S对BMSCs形成的矿化结节进行染色。
2.6. dECM涂装的支架材料的构建
将PLGA以10%的比例溶解在三氯甲烷中,通过磁力搅拌器搅拌至完全溶解,将6倍于PLGA质量的粒径为35~48 μm的NaCl颗粒作为致孔剂加入PLGA溶液中,继续搅拌使致孔剂均匀分散在PLGA溶液中。将混合液加入到无水乙醇中,析出物放入不锈钢模具中,利用液压机在15 MPa压力下压制成直径为10 mm的圆柱体,自然晾干之后,在超纯水(UP水)中浸泡3天使支架材料中的致孔剂溶解在水中,期间每12小时更换一次UP水。PGA/PCL支架材料的制备除溶剂为六氟异丙醇和压制压力为10 MPa外,与PLGA支架材料的制备过程类似。去除致孔剂之后的支架经过自然晾干和液氮速冻后切割为厚度为1~2 mm的薄片材料备用。
薄片支架材料用75%乙醇浸泡并用紫外照射和臭氧联合灭菌处理之后放置在一个25 mL,配有带阀门的支口的玻璃反应管中,管口用装有10 mL分液漏斗的橡胶塞封住,支口与循环水真空泵相连,准备好的dECM分散液装在分液漏斗中。首先关闭分液漏斗的阀门,开启反应管支口的阀门,启动循环水真空泵,待真空泵的真空表指针到达−0.09 MPa时,轻轻旋动分液漏斗的阀门,让dECM分散液以1滴/秒的速度滴入反应管中,待支架材料完全被分散液浸没之后关闭分液漏斗的阀门并维持5 min,随后先关闭支管阀门再关闭真空泵,防止真空泵中的水回流到反应管内造成污染。断开支管与真空泵的连接之后,缓慢打开支管阀门,使反应管内压力恢复常压,取出涂装之后的支架材料,在无菌干燥箱中干燥备用。
2.7. 支架与BMSCs的体外共培养
第二代的BMSCs经过消化计数后以5 × 103个/孔接种在24孔板中,实验组每孔放入一个涂装了dECM的聚合物支架,对照组为没有涂装的聚合物支架,每组设置4个平行,在标准培养条件下用标准培养基进行培养,培养7天之后,利用ALP显色试剂盒和ALP活力检测试剂盒对BMSCs分泌的ALP进行检测,培养28天后,利用茜素红S对矿化结节进行染色。
2.8. 数据处理及统计学方法
MTT试验数据通过均一化处理,将酶标仪测定的光密度(OD)值换算成为细胞活力,ELISA试验数据利用试剂盒提供的标准样品绘制标准曲线,将测定的OD值换算为GFs浓度。数据采用SPSS 24.0统计软件包进行分析数据均数及标准差,组间比较采用单因素方差分析,P值<0.05为有统计学意义,柱状图由Origin2017软件包绘制。
3. 结果与讨论
3.1. 细胞及DNA脱除的有效性
脱细胞前后细胞和DNA的脱除情况如图1所示,经过反复冻融之后,倒置荧光显微镜下能观察到几乎所有细胞都被脱除,剩下的荧光也大多为不完整的细胞残片,说明通过反复冻融法脱除细胞的方法可行。DNA的脱除率达到了97%以上,认为达到了脱除免疫原性的目的。

Figure 1. Cell and DNA residue before and after decellularization: DAPI staining before decellularization (a); DAPI staining after decellularization (b); Results of DNA quantitative kit before and after decellularization
图1. 脱细胞前后细胞及DNA残留情况:脱细胞前DAPI染色(a);脱细胞后DAPI染色(b);脱细胞前后DNA定量试剂盒测定结果(c)
经过反复冻融和DNA酶解法的处理,仍然有少量的细胞碎片和DNA残留。目前,在脱细胞的研究方面,如何完全脱除细胞和免疫物质的同时更好地保留ECM中的活性成分仍然是一个矛盾的问题。基于已有的研究,反复冻融法对于细胞和DNA的去除程度来讲并非最佳方法,但对相关活性成分的保护相对更优,考虑到本研究重点为其中的活性物质对BMSCs向成骨细胞分化的促进作用,故而采用上述方法以保留更多的活性物质。另一方面,在实际应用中,允许可接受范围内免疫反应发生,上述结果表明的细胞碎片和DNA的残留量是否满足应用的条件可以考虑通过动物实验进行验证,可通过将获取的dECM直接植入大鼠皮下来验证免疫反应。
3.2. dECM中活性物质的保留
dECM分散液中及冻干的dECM中的活性物质的浓度由ELISA试剂盒测定,结果如表2所示,干重计算通过冷冻干燥测定质量,计算分散液中活性物质的总量,换算出dECM干重中的含量。
Table 2. Determination results of ELISA
表2. ELISA测定结果
已有的研究在动物实验中加入的外源性BMP-2溶液浓度为μg/mL级,在体外细胞试验中外源性VEGF使用浓度为ng/mL级,与本研究中分散液中的GFs浓度差异较大,考虑已有研究中的GFs为人工合成,测定的浓度为添加的浓度,在一系列操作之后活力会大大降低,最终有效的作用浓度远远小于添加的浓度,而本研究中获取的GFs为细胞自身表达,测定结果为具有活力的浓度,另外,通过在无菌条件下制成冻干粉再进行复溶预计可以获得活性成分浓度更高的分散液。
3.3. dECM对BMSCs行为的影响
MTT对BMSCs增殖情况的测定结果如图2所示,从图2的结果可以看出不同时间下的细胞增殖情况表现为低浓度下细胞活力更强,高浓度下细胞活力不仅没有促进作用甚至在培养第3天表现出显著的抑制作用。
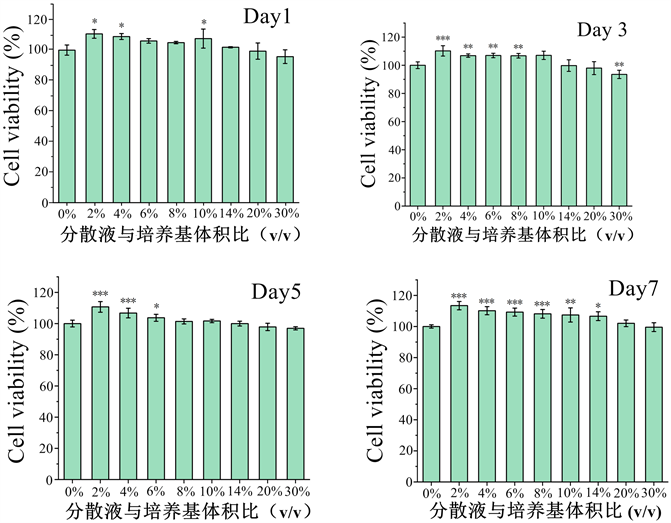
Figure 2. Cell proliferation under different dECM contents and different culture time
图2. 不同dECM含量不同培养时间的细胞增殖
ALP的定性和定量检测结果如图3、图4所示,如图3所示,2%和4%的实验组ALP的显色情况明显强于0%的对照组,4%以上的实验组相对于对照组没有明显差异甚至弱于对照组。如图4所示,2%和4%的实验组ALP的活力显著高于0%的对照组,8%及以上的实验组则表现出明显的抑制效果。矿化结节的染色结果如图5所示,0%的对照组完全没有矿化结节的存在,实验组虽然都存在矿化结节,表现为2%和4%的矿化结节的生长量最大,之后随着浓度的上升表现出一个逐渐下降的趋势,最高浓度和对照组之间仍存在显著性差异,故而说明了所有含有dECM分散液的实验组中均存在成熟的成骨细胞,即均含有一定数量的BMSCs完成了向成骨细胞分化的过程。

Figure 3. Test results of ALP color developing kit of different dECM contents culture
图3. 不同dECM含量培养的ALP显色试剂盒测试的结果
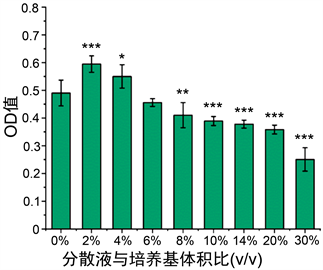
Figure 4. Results of ALP activity detection kit test of different dECM contents culture
图4. 不同dECM含量培养ALP活力检测试剂盒测试的结果
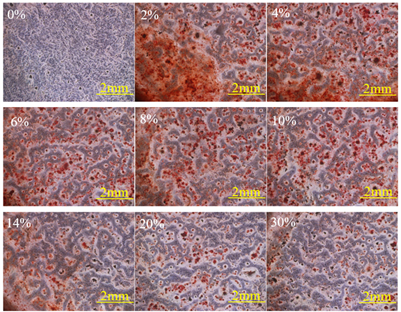
Figure 5. Results of alizarin red staining of different dECM contents culture
图5. 不同dECM含量培养茜素红染色的结果
在上述试验中,针对细胞增殖、ALP定性定量检测和矿化结节染色结果中表现出的低分散液浓度下促进效果显著,高浓度下促进效果相对较差,甚至出现抑制作用的问题。理论上讲,分散液中各活性成分的浓度远没有达到已有研究的常用浓度,随分散液浓度上升,对BMSCs的增殖和分化的促进效果应该呈现上升趋势,分析认为由于稀醋酸的引入导致培养基pH值出现一定的下降,同时培养基中的酚红指示剂也证明了培养基的酸碱度存在下降的情况。由于BMSCs属于嗜碱细胞,在7.2左右的弱碱性环境下细胞状态最佳,故而pH值随着分散液浓度的增加而下降会导致细胞增殖受到一定的影响,同时也会影响细胞向成骨细胞分化过程中ALP的分泌和矿化结节的产生。另一方面,ALP是一种含锌的糖蛋白,最适宜pH为10,在微酸性条件下活性可能受到严重影响或是高浓度组ALP表现为明显抑制的另一个原因。综合分析低浓度下对BMSCs增殖分化的显著促进效果,本研究认为利用醋酸分散的dECM用于促进BMSCs的增殖和分化的方式具有可行性,且如果解决醋酸引入的问题,推测促进效果还会更佳。针对解决醋酸引入的问题,因为本研究的重点是使用dECM涂装可降解的多孔聚合物支架材料,通过干燥过程可以除去引入的醋酸,因此在本研究中未进行除去醋酸的相关试验,建议可以通过引入一定的弱碱性物质综合其中的酸性,但是引入弱碱物质是否会导致分散液中活性成分浓度的进一步下降以及引入物对细胞是否有其他的影响还有待考证。
3.4. dECM涂装支架的成骨促进作用
dECM涂装的支架与BMSCs共培养之后ALP的定性和定量检测结果如图6所示,可以观察到实验组和对照组之间也存在显著性差异。由此证明涂装了dECM的多孔聚合物支架的生物学功能得到了有效的提升,实现了促进BMSCs向成骨细胞分化的作用。利用茜素红S对矿化结节的染色情况如图7所示,同样相比于没有涂装的多孔聚合物支架,矿化结节有显著增加,矿化结节为BMSCs向成骨细胞分化后期,即成骨细胞成熟阶段的标志,由此可以得出通过涂装的多孔聚合物支架可以促进BMSCs向成骨细胞分化。
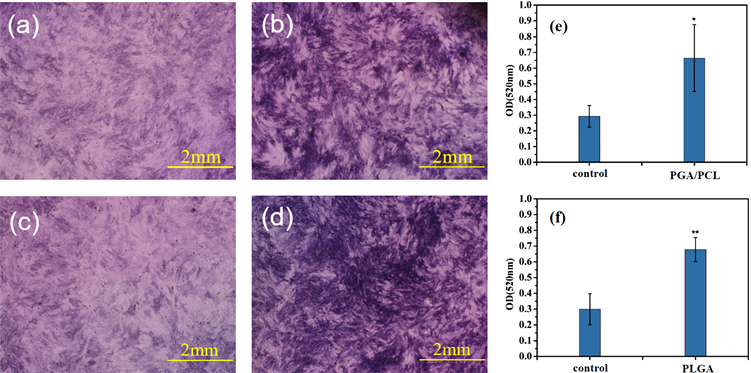
Figure 6. Test results of ALP: (a) Chromogenic results of fresh PPGA/PCL; (b) Chromogenic results of dECM coated PGA/PCL; (c) Chromogenic results of fresh PLGA; (d) Chromogenic results of dECM coated PLGA; (e) Quantitative results of PGA/PCL; (f) Quantitative results of PLGA
图6. ALP测试的结果:(a) 空白PGA/PCL显色结果;(b) dECM涂装PGA/PCL显色结果;(c) 空白PLGA显色结果;(d) dECM涂装PLGA显色结果;(e) PGA/PCL定量结果;(f) PLGA定量结果
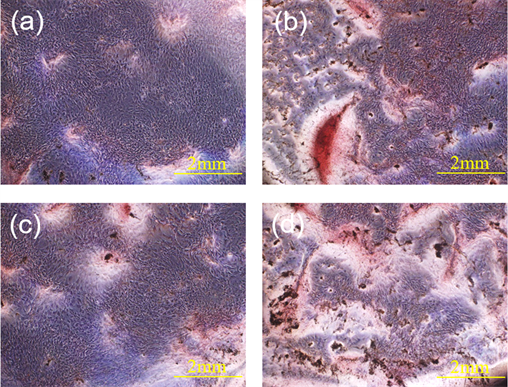
Figure 7. Results of alizarin red staining: (a) Fresh PGA/PCL; (b) dECM coated PGA/PCL; (c) Fresh PLGA; (d) dECM coated PLGA
图7. 矿化结节染色结果:(a) 空白PGA/PCL;(b) dECM涂装PGA/PCL;(c) 空白PLGA;(d) dECM涂装PLGA
从ALP定性和定量试验的结果来看,对于ALP的促进作用大于之前含有分散液的培养基培养BMSCs的效果,可以推测涂装在支架上,随支架材料降解而进入培养基中具有促进作用的活性成分含量应该更高,同时因为支架材料在涂装之后经过无菌干燥处理,分散液中的乙酸本身具有一定的可挥发性且含量相对较低,在干燥过程中挥发并脱离支架材料,从而因为乙酸改变培养环境pH值而影响BMSCs增殖和成骨分化的问题得以解决。
另一方面,目前也有研究将BMSCs提前种植在聚合物支架材料上,让细胞在支架材料上黏附增殖,再利用地塞米松诱导其向成骨细胞分化并脱除细胞和免疫物质,从而得到涂装了dECM的聚合物支架材料。两种方式对比,虽然通过先种植细胞的方式获得的dECM涂层理论上没有经过分散处理,应该具备更加完整的三维空间结构,在后续BMSCs的再种植时可以更好地促进细胞在支架材料上的黏附。但是本身没有进行涂装的聚合物支架材料由于其不利于细胞的黏附的限制,在进行第一步种植过程中,细胞在支架上的增殖必然受限,另外经过脱细胞处理后支架材料上的dECM涂层存在容易脱落的问题。同时,由于细胞增殖进入多孔聚合物支架的孔隙内部,脱除细胞和免疫物质的彻底程度也会受到影响,另外在整个过程中,支架材料会在培养液中浸泡较长时间会导致可降解材料发生降解而发生形态上的变化以及相对于将dECM分散后涂装的方式在应用于批量化生产时存在更多的技术难点。
综上所述,本研究认为通过醋酸分散dECM后,利用真空浸渍法对可降解多孔聚合物支架材料进行涂装的方式具有研究价值和应用前景。
4. 结论与展望
本研究表明,由DXMC定向诱导BMSCs向成骨细胞分化过程中分泌的ECM经过脱细胞处理和醋酸分散之后,能够保留其中的部分活性成分,并且对BMSCs的行为有调节作用。同时证明了利用dECM分散液对可生物降解的3D组织工程支架材料的表面进行涂装之后具有促进BMSCs向成骨细胞分化的能力。由此可以解决可生物降解的支架材料缺乏骨诱导性以及常规的dECM无法对多孔支架材料进行均匀的涂装的问题,针对分散液中酸性物质的引入导致BMSCs生理活动受到影响的问题可以通过涂装之后的干燥处理得到解决。
尽管目前研究的分散液对BMSCs的相关生物学行为具有促进作用,但是分散液中的活性成分的浓度还相对较低,考虑可以从探究更优的脱细胞脱DNA方法来减少脱细胞过程活性物质的损失,在分散过程中提高dECM的溶解度以及更有效的浓缩方式来提高分散液中活性物质的浓度。另外,探究dECM冻干粉或许也是一种具有前景的研究方向。最后本研究均为体外实验,通过体内的动物试验能够更加充分地验证上述方法的有效性。
致谢
感谢国家重点研发计划(2018YFC1105703)及四川省重点研发计划(2017SZ0047)对本研究的资助。
文章引用
黄元钧,吴 欢,尹光福. 骨髓间充质干细胞胞外基质的细胞脱除、DNA酶水解及其成骨促进作用
Cell Removal, DNase Hydrolysis and Osteogenic Promotion of Extracellular Matrix Secreted by Bone Mesenchymal Stem Cells[J]. 材料科学, 2020, 10(07): 570-580. https://doi.org/10.12677/MS.2020.107069
参考文献
- 1. Li, J., Wang, Y., Bao, X.M., et al. (2015) RhBMP-2 Induces Osteoporosis Rat BMSCs Osteogenesis and VEGF Ex-pression in Vitro. Chinese Bone Injury, 28, 446-449.
- 2. Li, H.P. and Liu, C.R. (2007) Research and Application of Bone Marrow Mesenchymal Stem Cells in Medicine. Journal of Clinical Rehabilitative Tissue Engineering Research, 11, 5622-5625.
- 3. Wei, B., Jin, C., Xu, Y., et al. (2014) Chondrogenic Differentiation of Marrow Clots after Micro-fracture with BMSC-Derived ECM Scaffold in Vitro. Tissue Engineering Part A, 20, 2646-2655. https://doi.org/10.1089/ten.tea.2013.0662
- 4. Badylak, S.F., Freytes, D.O. and Gilbert, T.W. (2015) Reprint of: Extracellular Matrix as a Biological Scaffold Material: Structure and Function. Acta Biomaterialia, 23, S17-S26. https://doi.org/10.1016/j.actbio.2015.07.016
- 5. Watt, F.M. and Huck, W.T.S. (2013) Role of the Extracellular Matrix in Regulating Stem Cell Fate. Nature Reviews Molecular Cell Biology, 14, 467-473. https://doi.org/10.1038/nrm3620
- 6. Keane, T.J., Swinehart, I.T. and Badylak, S.F. (2015) Methods of Tissue Decellularization Used for Preparation of Biologic Scaffolds and in Vivo Relevance. Methods, 84, 25-34. https://doi.org/10.1016/j.ymeth.2015.03.005
- 7. Anderson, J.M. and Shive, M.S. (2012) Biodegradation and Biocompatibility of PLA and PLGA Microspheres. Advanced Drug Delivery Reviews, 64, 72-82. https://doi.org/10.1016/j.addr.2012.09.004
- 8. Tambralli, A., Blakeney, B., Anderson, J., et al. (2009) A Hybrid Biomimetic Scaffold Composed of Electrospun Polycaprolactone Nanofibers and Self-Assembled Peptide Amphiphile Nanofibers. Biofabrication, 1, Article ID: 025001. https://doi.org/10.1088/1758-5082/1/2/025001
- 9. Aghdam, R.M., Najarian, S., Shakhesi, S., et al. (2012) In-vestigating the Effect of PGA on Physical and Mechanical Properties of Electrospun PGA/PCL Blend Nanofibers. Journal of Applied Polymer Science, 124, 123-131. https://doi.org/10.1002/app.35071
NOTES
*通讯作者。
