Hans Journal of Chemical Engineering and Technology
Vol.
09
No.
02
(
2019
), Article ID:
29455
,
9
pages
10.12677/HJCET.2019.92017
Fabrication and Amphiphilicity of Acylated Chitosan Derivatives
Huaimin Guan, Xinli Zhang, Xun Kan, Menglian Liao, Junyan Lin, Yuejin Tong*
College of Chemistry and Materials Science, Fujian Normal University, Fuzhou Fujian

Received: Mar. 5th, 2019; accepted: Mar. 20th, 2019; published: Mar. 27th, 2019

ABSTRACT
The acylated chitosan, distearyl chitosan, was synthesized by the selective protection of amino groups in MeSO3H, and characterized by means of Fourier translation infrared spectroscopy (FT-IR), nuclear magnetic resonance hydrogen spectrum (1H NMR) and water contact angle measurements. The preparation of the distearyl chitosan monolayer was carried out and amphiphilic behavior was investigated via Langmuir technique. By analyzing surface pressure-area (π-A) isotherm, the condensed distearyl chitosan monolayer fabricated at air-water interface had a collapse pressure of 44.35 mN/m and the average limited area (A*) of 268.75 cm2, indicating the formation of the stable Langmuir monolayer. Furthermore, the distearyl chitosan monolayer was successfully transferred onto Si electrode by Langmuir-Blodgett technique.
Keywords:Distearyl Chitosan Ester, Amphiphilicity, Langmuir Monolayer
壳聚糖酰基化衍生物的合成及其两亲性研究
关怀民,张新丽,阚巡,廖梦廉,林俊炎,童跃进*
福建师范大学,化学与材料学院,福建 福州

收稿日期:2019年3月5日;录用日期:2019年3月20日;发布日期:2019年3月27日

摘 要
本文从壳聚糖结构特点出发,采用氨基保护法在羟基上引入长链疏水性基团合成三种不同两亲性能的壳聚糖酰基化衍生物,红外光谱(FT-IR)和核磁共振氢谱(1H NMR)证实了两亲二硬脂酰基壳聚糖酯的化学结构。利用Langmiu-Blodgett槽制备两亲二硬脂酰壳聚糖酯单分子层,通过对二硬脂酰壳聚糖酯Langmiur膜的表面压–单分子层表观面积(π-A)等温曲线分析表明,硬酯酰基取代度4.8的二硬脂酰壳聚糖酯(DSCS-4.8)具有较强的两亲性,能形成稳定致密的Langmiur单分子膜,且Langmiur单分子膜的平均单分子极限表面积等于268.75 cm2,崩溃压等于44.35 mN/m。三种二硬酯酰壳聚糖酯对水的静态接触角随着两亲性的增加而增大。通过LB技术将单分子膜转移制备多层膜修饰的硅片。
关键词 :二硬脂酰壳聚糖酯,两亲性,Langmiur膜

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
壳聚糖(Chitosan, CS)是天然高分子甲壳素(Chitin)的N–脱乙酰基的产物 [1] [2] ,呈白色或淡黄色的固体,分子量从数十万至数百万。甲壳素在自然界中广泛存在于甲壳纲动物虾和蟹的甲壳、真菌的细胞壁和植物的细胞壁中 [3] ,它们的结构式见图1所示。壳聚糖具有生物相容性、生物可降解性、成膜性和无毒无害,因此,在如药剂学、生物医学、农业、食品加工和生物技术等领域的开发利用具有十分广阔的前景。然而,壳聚糖分子链上C2、C3和C6位含有大量的氨基和羟基极性基团,分子间强烈的氢键作用使其晶体结构呈紧密状态,导致它不溶于水和碱性溶液以及稀的硫酸和磷酸溶液,只可溶于稀醋酸、盐酸和硝酸等无机酸中 [4] ,壳聚糖溶解性能差极大地限制它的应用范围。同时正是因为这些反应性基团的存在,可以通过结构改性引入具有共价键结合、静电相互作用和配位作用的功能性基团 [5] ,破坏壳聚糖的晶体结构,使其结晶度变小,以改善其溶解性问题,使壳聚糖能够在实际应用中带来更好应用价值。
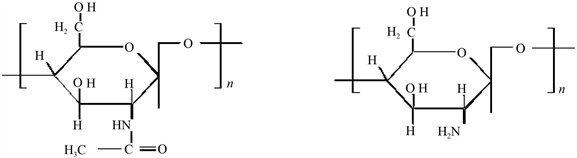
Figure 1. The chemical structure of chitin and chitosan
图1. 甲壳质和壳聚糖的化学结构式
通过在壳聚糖分子链上引入疏水性基团可以获得两亲性壳聚糖衍生物,改变润湿程度,赋予生物特性并拓宽应用领域。近年来两亲性壳聚糖衍生物的制备和性能研究逐渐活跃。英国Uchebgu课题组将乙二醇壳聚糖经马来酰化接枝后得到了两亲性衍生物 [6] 。李昆等人 [7] 以壳聚糖为功能性高分子的骨架,通过Schiff碱还原法,以正辛醛和端醛基聚乙二醇单甲基醚修饰壳聚糖,制备了具有亲疏水性质的N–辛基化–N-mPEG化壳聚糖衍生物。Yuan等人 [8] 以壳聚糖与环氧乙烷为原料制备亲水性O–羟乙基壳聚糖,进一步再与N–丁二酰羟亚胺基棕榈酸酯在避光下反应,获得了两亲性高分子量壳聚糖。当壳聚糖亲水性太强时作为药物载体难以实现疏水性药物的缓释,而含有一定疏水结构的材料有利于提高药物的稳定性和在人体生理上的相容性,可实现药物的输送,所以两亲性壳聚糖在药物控制释放方面具有良好的发展前途。隋卫平等人 [9] 所研究改性后的两亲壳聚糖具有表面活性和起泡稳泡性,对液体石蜡具有良好的乳化性,其吸湿保湿性可与透明质酸媲美。相对亲水性壳聚糖而言,两亲性壳聚糖由于疏水链的引入,转染能力提高,因此其在基因治疗方面有很大的用处 [10] 。两亲性壳聚糖形成的微胶束系统也可以作为疏水性药物、阴离子药物和蛋白质的载药系统 [11] 。另外,一些两亲性壳聚糖可作为响应温度或pH的智能材料 [12] 。两亲性的壳聚糖水相上成胶束排列,形成的单分子膜可用于模拟囊泡结构 [13] 。含发色基团的两亲性壳聚糖单分子膜还可以应用于微电子领域 [14] 。
在进行壳聚糖酰化改性这一方面,由于壳聚糖分子链上同时存在羟基和氨基,而酰化可以在羟基上发生酯化和或在氨基上生成酰胺,而氨基上因存在孤电子对,其反应活性更大,更易发生酰化反应 [15] ,所以对于壳聚糖的酰化改性,鲜有人去针对保护氨基,只在羟基上进行酰化改性。Zhang等人 [16] 在保护氨基上使用了过量醛、酮发生Schiff碱反应,生成了相应的醛、酮亚胺衍生物,虽然确保了仅在羟基上发生酰化,却在氨基上连上了庞大的基团,没有考虑去除氨基上的保护基团。马宁等人 [17] 采用N–邻苯二甲酰化反应保护氨基,再用肼脱去氨基保护剂,得到自由–NH2。Knidri等人 [4] 在进行这些反应后向体系中加入氨水多次中和,由于甲磺酸与氨水生成的盐溶于水使得平衡移动,产物的氨基以自由形式存在,最后得到产物。本论文采用甲磺酸以成盐的形式保护氨基后再利用碱性溶液还原氨基,方法简单,流程简便。
本文选用壳聚糖和硬脂酰氯为起始原料,通过甲磺酸保护氨基的方法,在C6和C3位上引入长链疏水基团,经过解保护后合成两亲二硬脂酰壳聚糖酯;通过调节不同的壳聚糖与硬脂酰氯起始物的摩尔比使得两亲壳聚糖衍生物具有不同的两亲性。用傅里叶变换红外光谱(FT-IR)和核磁共振氢谱(1H NMR)对二硬脂酰壳聚糖酯进行化学结构表征,通过对水的静态接触角测试和二硬脂酰壳聚糖酯Langmiur膜的π-A曲线研究二硬脂酰壳聚糖酯的两亲性。
2. 实验部分
2.1. 原料和试剂
壳聚糖(C6H11NO4)n,白色半透明片状物,脱乙酰度 ≥ 90.0%,粘度(mPa∙s) = 50.0~800.0,国药集团化学试剂有限公司;硬脂酰氯(C18H35ClO, 97%),分析纯(AR)和甲烷磺酸(CH3SO3H, 99%),分析纯(AR),阿拉丁试剂公司;氯仿,分析纯(AR),衡阳市凯信化工试剂有限公司;丙酮和碳酸氢钠,分析纯(AR),天津市福晨化学试剂厂;超纯水(作为亚相),电阻率 ≥ 18.25 mW∙cm,由WP-UP-II-20型超纯水机(四川沃特尔科技有限公司)制取。
2.2. 硬脂酰壳聚糖酯(DSCS)的合成
2.2.1. 壳聚糖氨基的保护
准确称取1 g壳聚糖于三份已加入约30 mL的甲磺酸的三口烧瓶中,在氮气的保护下,搅拌反应约3 h,使壳聚糖完全溶解。反应过程如图2所示。
2.2.2. 壳聚糖羟基的酰基化反应
在对壳聚糖的氨基进行保护后,在上述体系中加入一定比例的硬脂酰氯,注射滴加于反应烧瓶中,滴加速度不易过快,控制在60 min内。滴加完成后,升温到50℃,在氮气保护下继续搅拌反应24 h。该反应过程如图3所示。
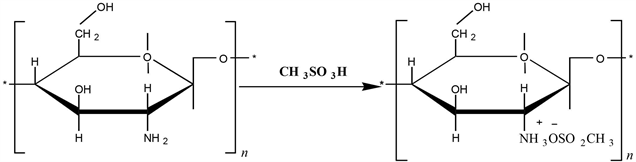
Figure 2. Scheme for the protection of the amino groups in chitosan
图2. 壳聚糖氨基保护示意图
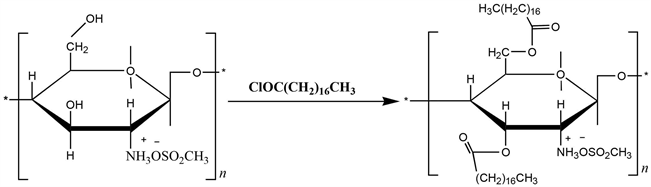
Figure 3. Scheme for the acylation of chitosan
图3. 壳聚糖的酰基化反应
2.2.3. 氨基脱保护和纯化
将上述反应所得产物体系倒入含适量冰水的烧杯中,搅拌后静置一段时间,抽滤,水洗,用饱和NaHCO3洗涤至pH为中性(氨基脱保护示意图4)。将所得产物通过溶解–沉淀方式进行提纯后进行抽滤,干燥并称重,合成得到三种不同取代度的硬脂酰壳聚糖酯。
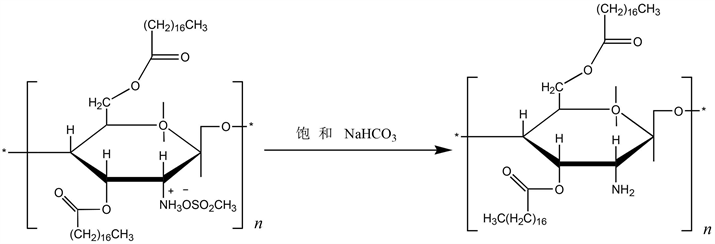
Figure 4. Scheme for the deprotection of the amino groups in the acylated chitosan
图4. 酰基化壳聚糖氨基脱保护示意图
2.3. 两亲壳聚糖化学结构的表征和两亲性能的测试
元素分析:利用德国Elementar公司Vario EL III型元素分析仪测定N、H、C和O原子组成,计算酰基化壳聚糖的酰基取代度。
傅里叶变换红外光谱:采用美国Thermo-Fisher公司Nicolet 5700型傅里叶变换红外光光谱仪测定硬脂酰壳聚糖酯的傅里叶变换红外光谱(FT-IR),扫描范围为4000~400 cm−1,采用KBr压片法制样,根据FT–IR中吸收峰的的峰形和峰值来确定样品的结构。
核磁共振波谱:在瑞士Bruker公司AVANCE III 400 MHz型核磁共振波谱仪上记录硬脂酰壳聚糖酯的核磁共振波氢谱(1H NMR),氘代氯仿作为溶剂。
Langmiur膜的π-A等温曲线的测定:采用英国Nima公司Nima-1232D1D2型LB槽(槽体面积:60 cm × 20 cm,亚相体积:1500 ml,滑障速度:±500 cm2/cm,表面压:0~235 mN/m,表面压精度:70 mN/m~1 mN/m)制备硬脂酰壳聚糖酯的Langmiur膜并记录π-A等温曲线。
静态接触角的测定:利用德国KRÜSS公司DSA25型接触角仪,通过进样器,滴入满足要求体积的液滴于被测样品压片表面,通过影像分析技术,测量或计算出液体与固体表面的接触角值进而分析比较出不同摩尔比的硬脂酰壳聚糖酯亲水性的变化规律。
3. 结果与讨论
3.1. 硬脂酰壳聚糖酯(DSCS)的化学结构
壳聚糖聚合物分子链上的大量氨基和羟基均具有反应活性,但是氨基显示出更高的活性,为了保留氨基赋予壳聚糖的生物活性、功能性和亲水性,必须在羟基上引入长链烷烃前对分子链上的氨基进行保护。为了合成不同疏水作用的壳聚糖衍生物,本文将通过调配不同的原料投料摩尔比合成三种取代度的二硬脂酰壳聚糖酯(反应式见图2、3和4)。
由元素分析测定三种DSCS分子链上键接的二硬脂酰基的取代度 [18] (每100个壳聚糖无水葡萄糖胺中硬脂酰基取代度)分别为0.9、1.3和4.8,相应的二硬脂酰壳聚糖酯分别标记为DSCS-0.9、DSCS-1.3和DSCS-4.8。此外,这三种二硬脂酰壳聚糖酯在氯仿中呈现良好的溶解性,而两亲性改性前的壳聚糖只能溶解在稀酸中。
为了证实二硬脂酰壳聚糖酯的形成,对三种二硬脂酰壳聚糖酯和起始原料壳聚糖的FT-IR进行测试,结果显示于图5中。通过对这些二硬脂酰壳聚糖酯与起始壳聚糖的FT-IR进行比较发现,三种二硬脂酰壳聚糖酯的FT–IR均在1740 cm−1出现新的归属于酯羰基C=O的特征吸收峰 [3] [19] ;在3420~3310 cm−1的宽峰归属于–OH和–NH2的伸缩振动特征吸收峰;与壳聚糖的相比,二硬脂酰壳聚糖酯在2960~2850 cm−1范围的C–H伸缩振动特征吸收的峰强明显增强,这是在壳聚糖分子链上引入了长碳链的硬脂酰基所致 [19] 。分子内不同官能团与化学键呈现特有的吸收谱带,因此上述FT-IR中新吸收峰的产生和特征吸收峰强度的增加表明硬脂酰基的疏水长链已经通过酯基的形成键接到壳聚糖的分子链上。

Figure 5. FT-IR spectra of chitosan and distearyl chitosan
图5. 壳聚糖和二硬脂酰壳聚糖酯的FT-IR
图6是二硬脂酰壳聚糖酯(DSCS-4.8)的1HNMR谱。由图6可见,在化学位移d = 0.93 (a)和1.36 (b) ppm处出现两个尖锐峰,它们分别对应于长链烷基上的–CH3和–CH2的质子峰,并且d = 1.36 ppm的峰强度明显大于d = 0.91 ppm [20] ,说明长链烷基的存在。此外,在d = 1.68 ppm (c)处出现的峰対应长链上离酯羰基较远的–CH2的质子峰;在d = 2.03 ppm (d)处出现的弱峰対应壳聚糖C6位上–CH2的质子峰;在d = 2.38 ppm (e)的峰为离酯羰基较近的–CH2的质子峰;在d = 2.75~2.85 ppm之间的微弱峰为壳聚糖葡萄糖胺基的质子峰;在d = 3.70和5.35 ppm (f)的弱峰为壳聚糖六元环以及六元环链接的羟基质子峰 [21] 。结合FT-IR和1H NMR的结果,证实合成得到的产物为目标壳聚糖衍生物。
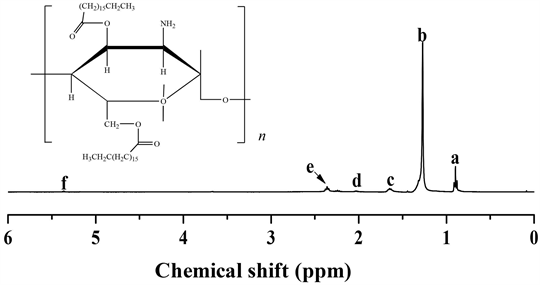
Figure 6. 1H NMR spectrum of DSCS-4.8
图6. DSCS-4.8的1H NMR
3.2. 二硬脂酰壳聚糖酯Langmiur膜的形成及其π-A等温曲线分析
由于在合成的壳聚糖酯的骨架上键接着疏水的长烷基链,同时骨架上含有亲水的氨基和部分残留的羟基,使得壳聚糖酯既具有疏水性又具有亲水性,是一种可以形成Langmiur单分子膜的两亲聚合物。壳聚糖酯DSCS-0.9和DSCS-1.3分子链上键接的疏水长链单元较少,在所使用的LB槽的条件下未能观察到明显的单分子膜塌陷压(见图7中的插图所示)。图7显示由Langmiu-Blodgett (LB)槽记录的在空气与亚相水界面DSCS-4.8的Langmiur膜形成过程的π-A等温曲线。通过对合成产物的Langmiur膜的π-A曲线的分析表明,DSCS-4.8的Langmiur膜清晰地出现明显气态、液态和固态三种物理形态及其转变过程,也就是说随着投料比中长链烷烃引入比例的增加,得到的二硬脂酰壳聚糖酯的两亲性较强。DSCS-4.8的Langmiur膜呈固态膜铺展意味着,分子之间相互作用力最大,分子排列有序且规整;当π-A等温曲线在表面压(p)等于44.35 mN/m时单层膜出现重叠或塌陷;随着压缩面积的减小,Langmiur膜发生重叠或坍塌,此外在图7的π-A等温曲线中发现固态膜形成时平均单分子极限表面积(A*,连续单分子层形成时的占据面积,由π-A等温曲线上直线区外推至零表面压时的膜面积)等于268.75 cm2。综上所述,一定酰基取代度(4.8)的壳聚糖衍生物具有强的两亲性,DSCS-4.8能在空气与亚相界面之间形成稳定致密的Langmiur膜,膜崩溃压较大。膜压大小与膜分子间的结合强度、膜分子密度成正比关系。疏水性酰基的引入使得单分子膜分子间容易形成紧密有序地排列,膜分子密度较高,以及具有较高的抗挤压能力,因此单分子膜稳定性高。
3.3. 二硬脂酰壳聚糖酯的静态接触角
通过对三种硬脂酰壳聚糖酯的静态接触角的测试可以发现,这些壳聚糖衍生物对水的静态接触角随着壳聚糖与硬脂酰氯投料摩尔比的增加而增大,表明疏水改性程度逐渐提高。DSCS-0.9、DSCS-1.3和DSCS-4.8的静态接触角平均值分别是63.3˚、81.12˚和93.49˚ (由于纯壳聚糖亲水性,无接触角数据)。
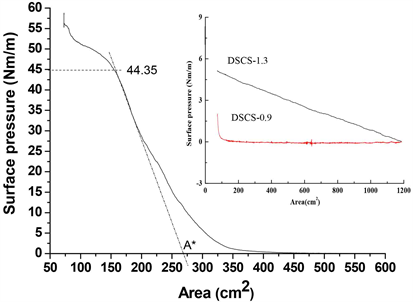
Figure 7. The π-A isotherm of the DSCS-4.8 monolayer
图7. DSCS-4.8的Langmiur膜的π-A等温曲线
3.4. 单分子层多层膜(LB膜)的形成
利用LB技术将两亲性DSCS-4.8的单分子膜转移至硅片上,形成多层单分子两亲膜。图8是两亲性DSCS-4.8单分子膜转移的时间–高度曲线。图8显示的几乎完全对称的转移曲线表明在空气/水相界面上形成稳定的DSCS-4.8单分子膜被均匀地转移到基片上形成多层LB膜。
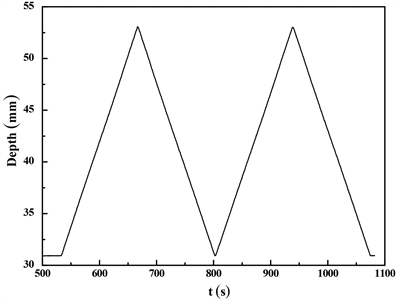
Figure 8. The transferring curve of the DSCS-4.8 monolayer
图8. DSCS-4.8单层膜的转移曲线
4. 结论
本文通过氨基保护法成功地合成了不同酰基取代度的二硬脂酰壳聚糖酯,利用FT-IR和1H NMR表征手段证实了酯基的形成。通过对壳聚糖衍生物Langmiur膜的膜行为的研究和π-A等温曲线分析以及静态接触角的测定表明,随着取代度的提高,疏水改性程度逐渐增大,具体表现为对水的静态接触角增大,Langmiur膜在空气/水界面的稳定性随之增大。壳聚糖衍生物(DSCS-4.8)可以在空气与水的界面上形成稳定的Langmiur单层膜,Langmiur单层膜的平均单分子极限表面积为268.75 cm2,Langmiur单层膜在表面压(p)等于44.35 mN/m遭遇重叠或破裂,较高的崩溃压表明DSCS-4.8的Langmuir膜稳定并具有一定的抗挤压能力。
基金项目
福建省自然科学基金资助项目(2016J01044)。
文章引用
关怀民,张新丽,阚巡,廖梦廉,林俊炎,童跃进. 壳聚糖酰基化衍生物的合成及其两亲性研究
Fabrication and Amphiphilicity of Acylated Chitosan Derivatives[J]. 化学工程与技术, 2019, 09(02): 117-125. https://doi.org/10.12677/HJCET.2019.92017
参考文献
- 1. Dash, M., Chiellini, F., Ottenbrite, R.M. and Chiellini, E. (2011) Chitosan-A Versatile Semi-Synthetic Polymer in Bi-omedical Applications. Progress in Polymer Science, 36, 981-1014. https://doi.org/10.1016/j.progpolymsci.2011.02.001
- 2. Tong, Y.J., Wang, S.F., Xu, J.W., Chua, B.S. and He, C.B. (2005) Synthesis of O, O-dipalmitoyl Chitosan and Its Amphiphilic Properties and Capability of Cholesterol Abeorption. Carbohydrate Polymers, 60, 229-233. https://doi.org/10.1016/j.carbpol.2005.01.005
- 3. Li, X.L., Tong, Y.J., Jia, L. and Guan, H.M. (2015) Fabrication of Molecularly Cholesterol-Imprinted Polymer Particles Based on Chitin and Their Adsorption Ability. Monatshefte für Chemie, 146, 423-430. https://doi.org/10.1007/s00706-014-1369-4
- 4. El Knidri, H., Belaabed, R., Addaou, A., Laajeb, A. and Lahsini, A. (2018) Extraction, Chemical Modification and Characterization of Chitin and Chitosan. International Journal of Bio-logical Macromolecules, 120, 1181-1189. https://doi.org/10.1016/j.ijbiomac.2018.08.139
- 5. Mourya, V.K. and Inamdar, N.N. (2008) Chitosan-Modifications and Applications: Opportunities Galore. Reactive and Functional Polymers, 68, 1013-1051. https://doi.org/10.1016/j.reactfunctpolym.2008.03.002
- 6. Dufes, C., Muller, J.M., Couet, W., et al. (2004) Anticancer Drug Delivery with Transferrin Targeted Polymeric Chitosan Vesicles. Pharmaceutical Research, 21, 101-107. https://doi.org/10.1023/B:PHAM.0000012156.65125.01
- 7. 李昆, 孙婷, 孙媛, 杨伯涵, 孟新雷, 李亚鹏, 王静媛. 两亲性壳聚糖衍生物的制备及其包覆量子点[J]. 高分子学报, 2012(2): 180-186.
- 8. Yuan, W.Z., Zhao, Z.D., Gu, S.Y. and Ren, J. (2010) Synthesis, Characterization, and Properties of Amphiphilic Chitosan Copolymers with Mixed Side Chains by Click Chemistry. Journal of Polymer Science Part A: Polymer Chemistry, 48, 3476-3486. https://doi.org/10.1002/pola.24136
- 9. 隋卫平, 杨秀利, 杨倩, 陈国华. (2-羟基-3-丁氧基)丙基-羟丙基壳聚糖的应用性质[J]. 应用化学, 2002, 19(9): 890-893.
- 10. Chan, P, Kurisawa, M, Chung, J.E. and Yang, Y.Y. (2007) Syn-thesis and Characterization of Chitosan-g-Poly(ethylene glycol)-Folate as a Non-Viral Carrier for Tumor-Targeted Gene Delivery. Biomaterials, 28, 540-549. https://doi.org/10.1016/j.biomaterials.2006.08.046
- 11. Ke, W.Y., Xin, R.L., Zhuo, L.Y., Ping, Z.L., Wang, F. and Liu, Y. (2009) Novel Polyion Complex Micelles for Liver-Targeted Delivery of Diammonium Gly Cyrrhizinate: In Vitro and in Vivo Characterization. Journal of Biomedical Materials Research Part A, 88, 140-148.23
- 12. Félix, L., Hernández, J., Argüelles, W.M. and Goycoolea, F.M. (2005) Kinetics of Gelation and Thermal Sensitivity of N-isobutyryl chitosan Hydrogels. Biomacromolecules, 6, 2408-2415. https://doi.org/10.1021/bm0501297
- 13. Li, M.C. and Xin, M.H. (2007) Mixed N, N-dilauryl Chitosan/Cholesterol Monolayer and Corresponding Vesicle Property. Acta Physico-Chimica Sinica, 23, 1291-1295.
- 14. Wu, Y.S, Hisada, K., Maeda, S. and Sasaki, T.K. (2007) Fabrication and Structural Characterization of the Langmuir-Blodgett Films from a New Chitosan Derivative Containing Cinnamate Chromophores. Carbohydrate, 68, 766-772. https://doi.org/10.1016/j.carbpol.2006.08.016
- 15. Motiei, M., Kashanian, S., Lucia, L.A. and Khazaei, M. (2017) Intrinsic Parameters for the Synthesis and Tuned Properties of Amphiphilic Chitosan Drug Delivery Nanocarriers. Journal of Controlled Release, 260, 213-225. https://doi.org/10.1016/j.jconrel.2017.06.010
- 16. Zhang, A.D., Ding, D., Ren, J., Zhu, X.L. and Yao, Y.H. (2014) Synthesis, Characterization, and Drug-Release Behavior of Amphiphilic Quaternary Ammonium Chitosan Derivatives. Journal of Applied Polymer Science, 131, 39890.
- 17. 马宁, 汪琴, 孙胜玲, 王爱勤. 甲壳素和壳聚糖化学改性研究进展[J]. 化学进展, 2004, 16(4): 643-653.
- 18. Hirano, S. and Osaka, T. (1983) Some O-Stearoyl Derivatives of Chitosan Prepared via Its Schiff’s Base Intermediates. Agricultural and Biological Chemistry, 47, 1389-1391. https://doi.org/10.1271/bbb1961.47.1389
- 19. Mekhail, G.M., Kamel, A.O., Awad, G.A.S. and Mortada, N.D. (2012) Anticancer Effect of Atorvastatin Nanostructured Polymeric Micelles Based on Stearyl-Grafted Chitosan. International Journal of Biological Macromolecules, 51, 351-363. https://doi.org/10.1016/j.ijbiomac.2012.05.026
- 20. Ma, G.P., Yang, D.Z., Kennedy, J.F. and Nie, J. (2009) Synthesize and Characterization of Organic-Soluble Acylated Chitosan. Carbohydrate Polymers, 75, 390-394. https://doi.org/10.1016/j.carbpol.2008.07.035
- 21. Zhang, H. and Neau, S.H. (2001) In Vitro Degradation of Chitosan by a Commercialenzyme Preparation Effect of Molecular Weight and Degree of Deacetylation. Biomaterials, 22, 1653-1658. https://doi.org/10.1016/S0142-9612(00)00326-4
NOTES
*通讯作者。