Hans Journal of Chemical Engineering and Technology
Vol.
10
No.
02
(
2020
), Article ID:
34396
,
8
pages
10.12677/HJCET.2020.102012
Synthesis and Anti-Bacterial Activities of Pyridine Substituted Bis(4-amino-1,2,4-triazole Thioethers)
Ying Xie1, Xin Qu1, Mengling Huang1, Xuan Guo2, Junming Yi1*
1Key Laboratory of Chemical Synthesis and Environmental Pollution Control-Remediation Technology, College of Biology and Chemistry, Xingyi Normal University for Nationalities, Xingyi Guizhou
2Environmental Protection Monitoring Station of Qianxinan Buyi-Miao Autonomous Prefecture, Xingyi Guizhou

Received: Feb. 13th, 2020; accepted: Feb. 25th, 2020; published: Mar. 3rd, 2020

ABSTRACT
Two pyridine bis(4-amino-1,2,4-triazole-3-thioethers) were synthesized from the starting material of pyridine-2,6-dicarboxylic acid through multistep chemical reactions in a simple method from etherification reaction of 4-amino-5-(6-(4-amino-5-mercapto-4H-1,2,4-triazol-3-yl)pyridin-2-yl)- 4H-1,2,4-triazole-3-thiol with halohydrocarbon, and characterized by 1H NMR,13C NMR, IR, elemental analysis, and single-crystal X-ray diffraction. The inhibitory activity, compounds 2a and 2b against Escherichia coli, Candida albican, Staphylococcus aureus and Bacillus subtilis were tested by the 96-well plate dilution doubling method. The experiment result revealed that crystal of compound 2b was a kind of twin crystal, and the two pyridine bis(4-amino-1,2,4-triazole-3-thioethers) had good bacteriostatic activities to Escherichia coli and Candida albican in the range of test concentration, but had no antibacterial activities against Staphylococcus aureus and Bacillus subtilis.
Keywords:Pyridine-2,6-dicarboxylic Acid, 4-Amino-4H-1,2,4-triazole-3-thiol, Thioether, Structural
Characterization, Antimicrobial Activity

吡啶取代基二(4-氨基-1,2,4-三氮唑-3-硫醚)的合成及其抑菌活性
谢莹1,曲昕1,黄梦玲1,郭璇2,易君明1*
1兴义民族师范学院生物与化学学院,化学合成及环境污染控制和生态修复技术实验室,贵州 兴义
2黔西南布依族苗族自治州环境保护监测站,贵州 兴义

收稿日期:2020年2月13日;录用日期:2020年2月25日;发布日期:2020年3月3日

摘 要
以2,6-吡啶二甲酸为起始原料,经多步化学反应制备吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫醇)中间体,该中间体与卤代烃进行醚化反应得到2个吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫醚)目标化合物,其结构通过1H NMR、13C NMR、MS、IR、元素分析及单晶X-射线衍射等进行表征,采用96孔板倍比稀释法测定目标化合物对金黄葡萄球菌、白色念珠菌、枯草芽孢杆菌、大肠杆菌的抑制活性。实验结果表明:吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫代苄)为孪晶,两个目标化合物在测试浓度范围内对白色念珠菌和大肠杆菌均具有很好的抑制活性,而对金黄葡萄球菌和枯草芽孢杆菌均无抑菌作用。
关键词 :吡啶-2,6-二甲酸,4-氨基-1,2,4-三氮唑-3-硫醇,硫醚,结构表征,抑菌活性

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
吡啶是含有一个氮杂原子且具有高度的共轭效应的六元杂环化合物,其衍生物具有广泛的生物活性,如杀虫、杀菌、除草等 [1] [2] [3] ,吡啶环上具有易与金属离子进行配位的氮原子,其衍生物能够与多种金属离子进行配位 [4] [5] [6] ,其金属配位化合物存在多样性的生物活性和重要的理化性质 [7] [8] [9] [10] ,因而开展吡啶基衍生物的合成及其生物活性研究受到国内外生物学、药学和农药学等研究领域工作者重视。据文献报道,4-氨基-1,2,4-三氮唑衍生物具有金属防腐性能 [11] [12] 和潜在的生物活性 [13] [14] [15] ,因其结构中含有多个氮原子而常被用于设计新型结构配位化合物 [16] [17] [18] ,在医药、农药、配位化学、金属腐蚀与防护等领域具有较好的学术价值和应用研究前景。关于吡啶-2,6-二(4-氨基-1,2,4-三氮唑-5-硫醇)的合成已有文献报道 [19] ,但是关于其硫醚化合物及其抗菌活性研究未见文献报道。我们在前人 [19] 及前期研究工作的基础上 [20] ,以吡啶-2,6-二甲酸经过多步化学反应制备吡啶-2,6-二(4-氨基-1,2,4-三氮唑-5-硫醇)中间体为原料,在碱性条件下进行醚化反应制备两个吡啶-2,6-二(4-氨基-1,2,4-三氮唑-5-硫醚)目标化合物化合物,其合成路线如图1所示(制备化合物2a时卤代烃为氯乙酸甲酯,2a时卤代烃为苄溴),通过1H NMR、13C NMR、MS、IR、元素分析以及单晶X-射线衍射等技术对化合物结构进行表征,采用96孔板倍比稀释法来测定目标化合物对金黄葡萄球菌、白色念珠菌、枯草芽孢杆菌、大肠杆菌的抑菌活性,为合成具有多样性生物活性的三氮唑衍生物及其新型架构的配合物提供参考。
2. 实验部分
2.1. 主要仪器和试剂
Bruker Smart APEX II CCD单晶X-射线衍射仪(德国Bruker公司),Bruker AV500型核磁共振波谱仪(德国Bruker公司),Agilent质谱仪(美国Agilent公司);Varian 640-IR傅立叶变换红外光谱仪(安捷伦公司),Sarteorius-BS110S电子天平(北京赛多利斯仪器系统有限公司),WRS-1B数字熔点仪(上海仪电物理光学仪器有限公司),Vario ELIII型元素分析仪(德国Elementar公司)。SW-CJ-1F博讯超净工作台(上海博讯实业有限公司医疗设备厂);YXQ-SL-100G博讯高压蒸汽灭菌锅(上海东亚压力容器制造有限公司);LRH-250生化恒温培养箱(韶关市泰宏医疗器械有限公司);DHG-9246A精宏电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
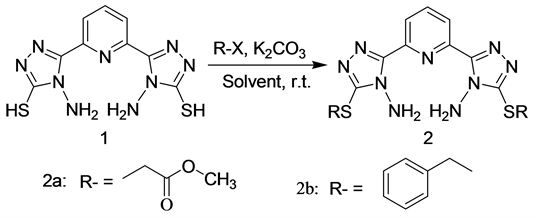
Figure 1. Synthetic pathway of the target compounds
图1. 目标化合物的合成路线图
化学试剂:吡啶-2,6-二(4-氨基-1,2,4-三氮唑-5-硫醇) 参照文献 [19] 制备,苄溴及氯乙酸甲酯等均购自山东西亚化学工业有限公司,其余试剂均为市售分析纯,实验前未作纯化处理。
供试菌种:大肠杆菌(Escherichia coli ATCC 8739),白色念珠菌(Candida albicans ATCC 10231),金黄色葡萄球菌(Staphylococcus aureus CICC 10786),枯草芽孢杆菌(Bacillus subtilis ATCC 6633)。
2.2. 2,6-吡啶-二(4-氨基-1,2,4-三氮唑-3-硫醚) (化合物2)的合成
化合物2a的合成参照文献 [20] 进行,在100 mL二口瓶中加入2,6-二(4-氨基-1,2,4-三氮唑-5-硫醇) 3.073 g (0.01 mol)、氢氧化钾1.127 g (0.02 mol)和水60 mL,搅拌至完全溶解后冰浴下缓慢滴加氯乙酸甲酯2.5 mL,反应4 h后薄层析(V乙醇:V乙酸乙酯 = 1:5)跟踪至反应结束,析出大量的白色固体,抽滤,用水反复洗涤。固体烘干即得粗产物,用1:1的无水乙醇–乙酸乙酯重结晶即得白色粉末固体产物2a。
吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫代乙酸甲酯)(化合物2a):白色粉末,产率71%,m.p.: 170˚C~171˚C。1H NMR (DMSO-d6, 500 MHz) δ: 1.21~1.24 (t, 6H, -CH3), 4.15 (m, 4H, -CH2-), 6.43 (s, 2H, -NH2), 8.14~8.17 (m, 2H, PyH). 13C NMR (DMSO-d6, 125 MHz,) δ: 168.9, 154.3, 152.5, 146.7, 139.1, 123.4, 61.7, 33.0, 14.5. ESI-MS, m/z: 474.08[M + Na]+. IR(KBr), n, cm−1: 3426.47, 3340.40, 3180.39, 2982.51, 2934.08, 1741.96, 1724.22, 630.44, 1589.47, 1573.63, 1506.58, 1461.51, 1422.80, 1372.97, 1361.91, 1304.44, 1257.66, 1207.66, 1175.60, 1144.70, 1112.11, 1044.98, 1021.99, 991.42, 904.54, 864.18, 829.62, 789.77, 745.73, 713.27, 694.63, 673.63, 559.28。元素分析,C15 H17 N9 O4 S2,实测值(计算值),%:C 39.87 (39.90),H 3.82 (3.80),N 27.95 (27.92)。
化合物2b的合成:在100 mL二口瓶中加入2,6-二(4-氨基-1,2,4-三氮唑-5-硫醇) 3.073 g (0.01 mol)和 DMF 50 mL,加热下搅拌至完全溶解后加入碳酸钾2.764 g (0.02 mol),搅拌至溶液呈现黄绿色后自然冷却至室温,再加入苄溴2.5 mL,室温搅拌反应4 h后薄层析(V乙醇:V乙酸乙酯 = 1:5)跟踪至反应结束,将反应液倒入大量的水中,陈化片刻,析出大量的白色固体,抽滤,固体用水反复洗涤后烘干即得粗产物,用DMF重结晶即得白色固体颗粒,收集白色固体颗粒烘干即得产物2b。
吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫代苄溴) (化合物2b):白色固体粉末,产率63%,m.p.: 150˚C~151˚C。1H NMR (DMSO-d6, 500 MHz) δ: 4.50 (s, 4H, -CH2-), 6.40 (s, 2H, -NH2), 7.26~7.29 (t, 2H, J = 15, PhH), 7.32~7.36 (t, 4H, J = 20, PhH), 7.48~7.50 (d, 4H, J = 10, PhH), 8.16 (s, 3H, PyH)。13C NMR (DMSO-d6, 125 MHz) δ: 154.5, 152.2, 146.8, 139.2, 138.0, 129.6, 128.9, 127.9, 123.5, 34.8. ESI-MS, m/z: 510.13[M + Na]+. IR(KBr), n, cm−1: 3337.38, 3185.18, 3083.85, 3026.18, 1617.99, 1589.07, 1573.09, 1493.83, 1461.84, 1423.27, 1250.20, 1200.96, 1162.24, 1134.03, 1069.82, 1052.37, 1030.14, 991.22, 920.22, 821.93, 789.60, 769.88, 737.29, 702.61, 675.21, 560.79。元素分析,C23 H21 N9 S2,实测值(计算值),%:C 56.70 (56.65),H 4.32 (4.34),N 25.91 (25.85)。
2.4. 单晶培养
取少许的化合物2b,用DMF加热溶解为饱和溶液,静止自然冷却,数天后即可析出大量的无色透明大颗粒晶体,收集晶体用于晶体结构测试。
2.5. 晶体结构的测定
选取尺寸大小适当的单晶置于Bruker Smart APEX II CCD衍射仪,以石墨单色化的CuKα (λ = 0.154184 nm)射线在低温下进行测试晶胞参数并收集晶体衍射数据。分子结构用SHELX-97程序进行解析和结构优化,用直接法解出非氢原子坐标,氢原子坐标由Fourier合成法得出,经各项异性修正,表1为化合物2b的主要晶体学数据和结构修正参数。
Table 1. Main crystal data and structure refinement for compound 2b
表1. 化合物2b的晶体结构测试条件及主要晶体学数据表
2.6. 抑菌活性测试
采用96孔板倍比稀释法测定化合物2a和2b的最低抑菌浓度(MIC)。细菌用LB培养,真菌用PDB液体培养。各供试菌株液体培养8 h,用0.5麦氏标准比浊法作对照,调整菌液浓度到1 × 105 cfu/mL的菌液待用。准确称取待测化合物2a及2b,分别用DMSO溶解配制成100 mg/mL母液,再用LB稀释成1 mg/mL工作液,采用倍比稀释法用LB依次稀释第1~11孔大待测物的浓度为:1000、500、250、125、62.5、31.25、15.625、7.8125、3.90625、1.953125、0.9765625和0.48828125 μg/mL,第12孔为空白培养基对照,再分别加入100 μL浓度为1 × 105 cfu/mL菌液,细菌置于30˚C恒温箱中培养24 h,真菌置于28˚C恒温箱中培养24 h。培养结束后,比较检测组与空白对照组浑浊度差异,观察孔内无明显细菌生长且液体相对澄清、无沉淀,所含的药物浓度即为最低抑菌浓度(MIC)值。
3. 结果与讨论
3.1. 制备条件及产物波谱学特征
目标产物的制备:采用制备化合物2b的方法(即用DMF作溶剂和碳酸钾作碱)亦可以制备化合物2a,两种实验方法所得产物的产率相差不大,于是我们使用经济环保的水做溶剂,同时亦便于分离产物,尽管化合物1在水中加热亦不溶解,但由于其分子结构中含有可与碱反应的巯基,当加入2倍其物质的量的氢氧化钾后搅拌片刻即可溶解为淡黄色透明溶液,推测可能是巯基发生化学反应生成可溶性的RS-Na+盐所致,该盐在水中可电离出亲核性较强的亲核试剂RS−,其可与P-p共轭型亲电试剂RCH2+发生SN2反应生成目标产物,反应需在冰浴下进行,当温度较高时得不到目标产物或产率极低。若制备化合物2b采用制备化合物2a的方法(即用水作溶剂和氢氧化钾作碱)进行,则所得产物产率较低(约只有20%),要用DMF作溶剂及碳酸钾作碱才能得到相对较好的产率,推测可能是化合物1在DMF溶剂中溶解后于高温下与碳酸钾反应生成RS−Na+盐,该盐在DMF中溶解度不大,溶液呈现黄绿色,当加入苄溴后,苄溴与溶液中的RS−Na+盐发生反应生成产物和溴化钠(DMF中溶解度极小)的同时,溶液中的RS−Na+盐在被消耗掉的同时,沉于瓶底的RS−Na+盐又可以发生溶解进行补充,直至反应完毕,因此反应过程中始终有未溶解的固体物质,反应结束后将反应体系倒入在水中进行沉淀,主要是为了去除水溶性的有机物杂质和无机盐。
晶体的制备:由于化合物2b在水中不溶解,我们尝试使用了DMF、DMSO、乙酸乙酯-乙醇等多种溶剂进行单晶培养,多次测试可结果均为孪晶,尤其是在加热条件下DMF作溶剂溶解产物为饱和溶液后放置,自然冷析出晶体所需时间最短。尽管我们试图尝试通过改变溶剂体系(单一溶剂或混合溶剂)的方法对化合物2a进行单晶培养,希望能够得到其单晶,遗憾的是目前还没有找到适合化合物2a的单晶培养实验条件。
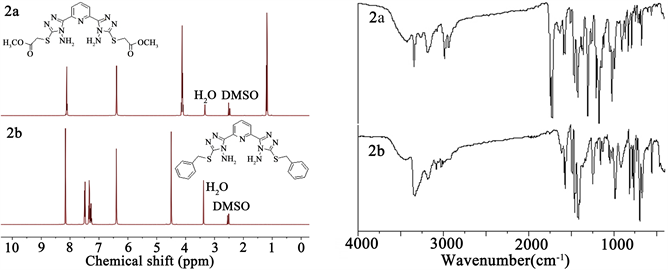
Figure 2. 1H NMR and FT-IR spectra of compound 2a and 2b
图2. 化合物2和2b的核磁共振氢谱(左)及红外吸收光谱(右)
产物的波谱学特征:核磁共振氢谱显示,化合物2a分子结构中的亚甲基上氢质子的化学位移值为4.15 ppm,氨基上氢质子的化学位移值为6.43 ppm;化合物2b分子结构中的亚甲基上氢质子的化学位移值为4.50 ppm,较化合物2a分子中的亚甲基质子的化学位移值向低场移动了0.25 ppm,而氨基上氢质子的化学位移值为6.40 ppm,仅较化合物2a分子中氨基质子的化学位移值向低场移动了0.03 ppm,十分接近。核磁共振碳谱显示,化合物2a分子中亚甲基碳的化学位移值为33.0 ppm,而化合物2b分子中亚甲基碳的化学位移值为34.8 ppm,较化合物2a分子中亚甲基碳的化学位移值仅向低场移动了1.8 ppm。红外吸收光谱图显示,在3300~3400 cm−1之间均能观察到氨基N-H键的伸缩振动吸收峰;化合物2a的红外吸收光谱图1700 cm−1附近能明显观察到羰基的伸缩振动吸收峰,而化合物2b的红外光谱图中在此附近观察不到羰基的伸缩振动吸收峰。化合物2a和2b的核磁共振氢谱(1H NMR)及红外吸收光谱(FT-IR)如图2所示。
3.2. 晶体结构
我们通过改变不同溶剂体系及实验条件的办法对两个目标化合物进行单晶培养,希望能够得到两个目标化合物的单晶,以便进一步了解化合物的空间立体结构,为后续性质研究提供参考,遗憾的是我们仅得到了吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫代亚甲基苯) (化合物2b)的单晶(实为孪晶)。尽管我们通过多次实验或改变不同溶剂体系的方法对化合物2b进行单晶培养实验,包括在DMSO、V乙醇:V乙酸乙酯为1:5的溶剂等单一溶剂或混合溶剂体系中均能得到晶体,只是在DMF溶剂体系中能快速析出,但是得到晶体都不是理想的单晶,均为孪晶,因而最终偏离因子[I > 2σ (I)]R值较大,但其结构仍能清晰可见。化合物2b晶体结构如图3所示,为使晶体结构清晰可见,忽略氢原子和未标注碳原子,仅标注杂原子,其中A图为晶体结构,B为晶胞堆积图,化合物2b为单斜晶系,P21空间群,每个晶胞中包含8个化合物分子。从晶体结构可以看出,两个氨基均与吡啶环上的氮原子形成分子内氢键,其作用距离分别为0.3088 nm [N(4)-H---N(5)]和0.3073 nm [N(9)-H---N(5)],十分接近,而两个氨基氮原子之间的距离仅为0.3642 nm [N(4)-N(9)]。两个三氮唑五元环和吡啶环几乎共平面,但是分子末端的两个苯环朝向确相反,一个向里另一个向外,其所在平面之间的夹角仅为3.33˚,几乎平行,两个苯环中心点之间的距离为1.5461 nm。分子中两个硫原子所成的键角分别为97.99˚ [C(7)-S(1)-C(8)]和98.60˚ [C(16)-S(2)-C(17)],仅相差0.61˚。
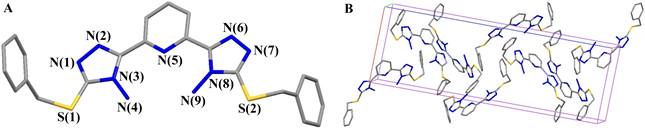
Figure 3. Crystal structure and packing diagram of compound 2b
图3. 化合物2b晶体结构(A)及晶胞图(B)
相邻分子之间主要通过氢键、p---p堆积以及C-H---p作用,氢键主要发生在氨基与相邻分子的三氮唑环上的氮原子之间,为N-H---N氢键,其构成氢键的两个氮原子之间的距离介于0.3003~0.3086 nm之间;p---p堆积则主要发生在苯环和其相邻分子的三氮唑五元环之间,苯环与三氮唑环上最近碳原子之间的距离为0.3269 nm;而C-H---p作用则主要发生在亚甲基C-H键和相邻分子的苯环之间,亚甲基碳原子至苯环中心点的距离为0.3517 nm。
3.3. 抗菌活性
化合物2a和2b对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌及白色念珠菌的抑菌活性测试结果如表2、表3所示。初步测试结果表明化合物2a和2b在1000~0.48828125 μg/mL范围内对白色念珠菌和大肠杆菌均具有较好的抑菌活性,其最小抑制浓度MIC值无明显区别,均为0.48 μg/mL,而两个目标化合物对枯草芽孢杆菌和金葡萄球菌均表现出无抑制活性。
Table 2. The antibacterial activity of compounds 2a
表2. 化合物2a的抑菌活性
注:表中“−”表示澄清且无肉眼可见菌落,“+”表示略浑浊且有肉眼可见菌落,“++”表示十分浑浊。
Table 3. The antibacterial activity of compounds 2b
表3. 化合物2b的抑菌活性
注:表中“−”表示澄清且无肉眼可见菌落,“+”表示略浑浊且有肉眼可见菌落,“++”表示十分浑浊。
从两个目标化合物的分子结构不难看出,其末端基团属于不同类型的取代基,化合物2a的末端基团为亚甲基取代的羧酸酯,而化合物2b的末端基团为亚甲基取代芳烃,从两个化合物的抑菌活性来看,他们对白色念珠菌和大肠杆菌均表现出较好的抑菌活性,而对枯草芽孢杆菌和金葡萄球菌均表现出没有抑制活性,推测其抑菌活性主要来自吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫醚)结构基团,因而该系列化合物及其衍生物具有潜在的应用研究价值。
4. 结论
本文合成并报道了两个吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫醚)化合物,并对化合物吡啶-2,6-二(4-氨基-1,2,4-三氮唑-3-硫代亚甲基苯)的晶体结构进行了讨论,两个目标化合物对白色念珠菌和大肠杆菌均表现出具有良好的抑菌活性,而对金黄色葡萄球菌和枯草芽孢杆菌均无抑菌活性。后续实验将探讨其抑菌活性作用机制,为进一步设计合成具有更好抑菌活性的新型三氮唑硫醚化合物及其衍生物提供实验参考。
基金项目
贵州省大学生创新计划训练项目(20195201867)及贵州省教育厅项目(2016年教改第163号)。
文章引用
谢 莹,曲 昕,黄梦玲,郭 璇,易君明. 吡啶取代基二(4-氨基-1,2,4-三氮唑-3-硫醚)的合成及其抑菌活性
Synthesis and Anti-Bacterial Activities of Pyridine Substituted Bis(4-amino-1,2,4-triazole Thioethers)[J]. 化学工程与技术, 2020, 10(02): 82-89. https://doi.org/10.12677/HJCET.2020.102012
参考文献
- 1. Tourabi, M., Sahibed-Dine, A., Zarrouk, A., Obot, B., Hammouti, B., Bentiss, F. and Nahlé, A. (2017) 3,5-Diaryl-4-amino-1,2,4-triazole Derivatives as Effective Corrosion Inhibitors for Mild Steel in Hydrochloric Acid Solution: Correlation between Anti-Corrosion Activity and Chemical Structure. Protection of Metals and Physical Chemistry of Surfaces, 53, 548-559. https://doi.org/10.1134/S2070205117030236
- 2. Ansari, K.R., Quraishi, M.A. and Singh, A. (2014) Schiff’s Base of Pyridyl Substituted Triazoles as New and Effective Corrosion Inhibitors for Mild Steel in Hydrochloric Acid Solution. Corrosion Science, 79, 5-15. https://doi.org/10.1016/j.corsci.2013.10.009
- 3. Saidov, N.B., Georgiyants, V.A. and Lipakova, E.Y. (2017) Synthesis and Pharmacological Potential of New 3-Mercapto-4-amino(pyrrolyl-1)-5-(thienyl-2)-1,2,4-triazole(4H) Derivatives. Pharmaceutical Chemistry Journal, 51, 26-29. https://doi.org/10.1007/s11094-017-1551-1
- 4. 马永超, 皇甫超申, 胡国强, 杨锐生, 刘彬. 三氮唑席夫碱衍生物对人肝癌细胞SMMC-7721的诱导分化作用[J]. 第四军医大学学报, 2007, 28(19): 1764-1767.
- 5. Afreen, F., Chakraborty, R. and Thakur, A. (2015) Synthesis of a Triazole Derivative and Evaluation of Their Antituberculer Activity. International Journal of Pharmaceutical Chemistry, 5, 343-349.
- 6. 苟玉婷, 岳凡, 陈华梅, 孙都成, 刘罡. 4-氨基-1,2,4-三氮唑的铁/钴混金属配合物的合成与晶体结构[J]. 化学试剂, 2012, 34(10): 891-894.
- 7. Chiacchio, M.A., Iannazzo, D., Romeo, R., Giofrè, S.V. and Legnani, L. (2019) Pyridine and Pyrimidine Derivatives as Privileged Scaffolds in Biologically Active Agents. Current Medicinal Chemistry, 26, 1-28. https://doi.org/10.2174/0929867325666180904125400
- 8. Patil, S.A., Naik, V.H., Kulkarni, A.D., Unki, S.N. and Badami, P.S. (2011) Synthesis, Characterization, DNA Cleavage, and in-Vitro Antimicrobial Studies of Co(II), Ni(II), and Cu(II) Complexes with Schiff Bases of Coumarin Derivatives. Journal of Coordination Chemistry, 64, 2688-2697. https://doi.org/10.1080/00958972.2011.594507
- 9. Singh, K., Kumar, Y., Puri, P., Sharma, C. and Aneja, K.R. (2012) Synthesis, Spectroscopic, Thermal and Antimicrobial Studies of Co(II), Ni(II), Cu(II) and Zn(II) Complexes with Schiff Base Derived from 4-Amino-3-Mercapto-6-Methyl-5-Oxo-1,2,4-Triazine. Medicinal Chemistry Research, 21, 1708-1716. https://doi.org/10.1007/s00044-011-9683-4
- 10. Xiao, H.H., Li, P.L., Guo, D.C., Hu, J.H., Cai, Y.C. and He, W. (2014) Synthesis and Antibacterial Activity Evaluation of 2,6-Bis(6-substituted-1,2,4-triazolo[3,4-b][1,3,4]thiadiazol-3-yl)pyridine Derivatives. Medical Chemical Research, 23, 1941-1949. https://doi.org/10.1007/s00044-013-0790-2
- 11. 易君明, 郑玉国, 陈明华. 联吡啶取代基二(4-氨基-1,2,4-三氮唑-3-硫醚)的合成及表征[J]. 化学试剂, 2019, 41(11): 1189-1196.
- 12. Kumar, S., Deep, A. and Narasimhan, B. (2019) A Review on Synthesis, Anticancer and Antiviral Potentials of Pyrimidine Derivatives. Current Bioactive Com-pounds, 15, 289-303. https://doi.org/10.2174/1573407214666180124160405
- 13. Patra, P. (2019) A Concise Review on Pyrido-coumarin/Azacoumarin Derivatives: Synthesis and Biological Activity. ChemistrySelect, 4, 2024-2043. https://doi.org/10.1002/slct.201803596
- 14. 余柱, 柏健, 王寒晖, 曹颖, 朱敦如. 吡啶取代苯酚配体构建的三个配合物的晶体结构[J]. 无机化学学报, 2019, 35(7): 1312-1320.
- 15. 关佳霖, 程清蓉, 潘志权. 基于吡啶配合物的合成及表征[J]. 武汉工程大学学报, 2019, 41(4): 307-310.
- 16. Ilmi, R., Juma Al-busaidi, I., Haque, A. and Khan, M.S. (2018) Recent Progress in Coordination Chemistry, Photo-Physical Properties, and Applications of Pyridine-Based Cu(I) Complexes. Journal of Coordination Chemistry, 71, 3045-3076. https://doi.org/10.1080/00958972.2018.1509070
- 17. 黄蓝仪, 陈瑶, 吴鹏, 梁延华, 李敏, 邢德刚. 钌多吡啶配合物诱导胃癌SGC-7901 细胞凋亡[J]. 中国病理生理杂志, 2019, 35(8): 1521-1525.
- 18. 蔡丽华, 叶亚娟, 锁进猛, 范康俊, 姜凌. 水杨醛Schiff碱仲胺配合物的合成及抗菌活性[J]. 精细化工, 2018, 35(5): 808-812.
- 19. 李娟, 杜凡凡, 冯锐, 胡倩, 介素云, 李伯耿. 锌配合物催化ε-己内酯/L-丙交酯共聚制备环状和线形嵌段共聚酯[J]. 高等学校化学学报, 2018, 39(6): 1297-1304.
- 20. Li, D.L., Wu, P.P., Sun, N., Lu, Y.J., Wong, W.L., Fang, Z.Y. and Zhang, K. (2019) The Diversity of Heterocyclic N-oxide Molecules: Highlights on Their Potential in Organic Synthesis, Catalysis and Drug Applications. Current Organic Chemistry, 23, 616-627. https://doi.org/10.2174/1385272823666190408095257
NOTES
*通讯作者。
