Hans Journal of Chemical Engineering and Technology
Vol.
11
No.
04
(
2021
), Article ID:
43844
,
12
pages
10.12677/HJCET.2021.114032
超高压提取松籽油和β-环糊精的包合物制备 及表征分析
董英魁1,陈冲1,赵修华2*,张茜2,祖述冲2
1东北林业大学生命科学学院,黑龙江 哈尔滨
2东北林业大学化学化工与资源利用学院,东北林业大学森林植物生态学教育部重点实验室,黑龙江 哈尔滨

收稿日期:2021年6月3日;录用日期:2021年7月6日;发布日期:2021年7月14日

摘要
不饱和脂肪酸等营养成分极易被氧化,在该研究中,使用β-环糊精与松籽油形成包合复合物,只改变其物理性质便能够保护其中的活性物质,便于加工处理、包装运输、使用方便,提高实用性。以东北红松籽为原料,经过粉碎,超高压辅助水相提取,离心分离等工艺制的红松松籽油,通过分析确定了提取红松籽油的最佳工艺条件:固液比为1/8,压强300 MPa,保压次数4次,保压时间5 min,产油率达到了31.74%。其中固液比是最重要因素。应用单因素优化方法确定最佳包合条件。通过饱和溶液法制备包合配合物,并通过傅里叶变换红外、X射线衍射、差示扫描量热法和核磁共振光谱分析进行表征。所有结果表明松籽油成功进入β-环糊精腔。此外,松籽油的包合率达到70.19% ± 1.93%,得到松籽油含量为33.01%的产物,复合物中的不饱和脂肪酸与松籽油的种类一致,并且所占比例相似。包合物具有更好的储存和运输稳定性。总的来说,制造的复合物改善了松籽油的特征,因此可以用于新颖的应用。
关键词
松籽油,超高压提取,β-环糊精,包合复合物,表征分析

Preparation and Characterization Analysis of Inclusion Complex of Pine Nut Oil and β-Cyclodextrin
Yingkui Dong1, Chong Chen1, Xiuhua Zhao2*, Qian Zhang2, Shuchong Zu2
1College of Life Science, Northeast Forestry University, Harbin Heilongjiang
2Key Laboratory of Forest Plant Ecology of Ministry of Education, College of Chemical Engineering and Resource Utilization, Northeast Forestry University, Harbin Heilongjiang

Received: Jun. 3rd, 2021; accepted: Jul. 6th, 2021; published: Jul. 14th, 2021

ABSTRACT
Unsaturated fatty acids and other nutrients are easily oxidized. In this study, β-cyclodextrin and pine nut oil were used to form the inclusion complex, and the active substance could be protected only by changing its physical properties, which is convenient for processing, packaging and transportation, and easy to use and improve practicability. The Korean pine seed oil is made from Northeast Korean pine seeds through crushing, ultra-high pressure auxiliary water extraction, centrifugal separation and other processes. Through analysis, the optimal process conditions for extracting Korean pine seed oil are determined: the solid-liquid ratio is 1/8, the pressure is 300 MPa, the pressure is held 4 times, the pressure is held for 5 minutes, and the oil production rate reaches 31.74%. Among them, the solid-liquid ratio is the most important factor. The single factor optimization method was used to determine the best inclusion conditions. The inclusion complexes were prepared by saturated solution method and characterized by FT-IR, X-Ray, DSC, TG and H-NMR. All results showed that pine nut oil successfully entered β-cyclodextrin cavity. In addition, the inclusion rate of pine nut oil reached 70.19% ± 1.93%, and the product with pine nut oil content of 33.01% was obtained. The types and proportions of unsaturated fatty acids in the complex were the same as those in pine nut oil. The inclusion compound has better storage and transportation stability. Overall, the resulting compounds improve the properties of pine nut oil and can therefore be used for novel applications.
Keywords:Pine Nut Oil, Ultra-High Pressure Extraction, β-Cyclodextrin, Inclusion Complex, Characterization Analysis

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 介绍
红松(Pinus koraiensis)为松科(Pinaceae)松属(Pinus) [1],它木材轻软、细致、纹理直、耐腐蚀性强,为建筑、桥梁、枕木、家具优良用材;树皮可提取栲胶,树干可采松脂;此外,种子供食用或药用,又可榨油供食用及工业用。松籽中含有53%~68%的油脂 [2],其中含有多种人体所必需的不饱和脂肪酸,例如亚油酸、亚麻酸、特有脂肪酸皮诺敛酸等 [3] [4]。亚油酸具有降低血脂、软化血管、降低血压、促进微循环的作用,可预防或减少心血管病的发病率,能起到防止人体血清胆固醇在血管壁的沉积,有“血管清道夫”的美誉,具有防治动脉粥样硬化及心血管疾病的保健效果 [5] [6]。亚麻酸能促进脑内核酸蛋白质及单胺类神经递质的合成,明显提高智力和视力,改善记忆;提高超氧化物歧化酶SOD活力,降低自由基代谢产物,具有很好的抗衰老作用;α-亚麻酸的降脂途径是任何降脂药所不能比拟的,因为它不是针对某一项血脂指标牞而是具有全项降脂作用 [7] [8];松籽油中特有的特殊不饱和脂肪酸皮诺敛酸可以刺激人体分泌两种饥饿感抑制激素胆囊收缩素和胰高血糖素样肽,不仅能帮助机体更好的消化脂肪,还能向大脑传递“饱腹感”信号,降低食欲,故有助于控制热量的摄取。
目前的松籽油提取方法主要有物理压榨法和溶剂浸出法,其中物理压榨法制取的松籽油品质较好,但是降低了松籽油中的氧化性油脂的含量,使得油脂中不饱和脂肪酸的双键被破坏;溶剂浸出法主要问题是提取物会有有机物(丙酮,乙醇)成分残留,难以纯化分离,所提取出的松籽油并不能用于日常食用。传统的提取工艺大多只关注松籽中的油脂出油量,但是对于松籽中一些不饱和脂肪酸被破坏却不加理睬,本文主要利用超高压水相提取法旨在提取出松籽油的同时尽量保留松籽中原有的成分不被破坏,同时也可为利用超高压分离提取植物成分提供指导 [9] [10] [11]。
现在市场上的松籽油加工品很少,常见的只是松籽加工品,如松籽乳、松籽风味饮料和松籽豆奶等 [12]。这类产品中大部分不饱和脂肪酸被氧化,没有达到预期的食用松籽油的效果。在此前提下,松籽油需要一种合适的方法在不改变营养成分的前提下降低氧化,提高稳定性,运输方便性等。这些可以通过β-环糊精“主客体”复合来实现。β-环糊精是一种大环碳水化合物,由七个D-葡萄糖单元组成;它可以形成包合物,因为它在吡喃葡萄糖单元之间的键合水平上缺乏自由旋转;β-环糊精具有环形或锥形和两亲性,具有疏水中心腔和亲水周边。此外,β-环糊精是一种无毒成分,自1998年以来一直被列入“公认安全”清单,作为食品中2%的风味载体和保护剂。并且它广泛应用于脂肪酸,挥发油和其他天然化合物包合物中。因此,将松籽油分子包裹到β-CD腔中是可行的 [13]。
考虑到极少数关于松籽油稳定性的研究,在这项工作中使用了β-环糊精来形成含有松籽油的包合物,用于将油从液体转化为固体粉末,以增强其稳定性,运输方便性等。并且对包合物的化学结构和稳定性进行了表征。
2. 材料和方法
2.1. 材料与仪器
2.1.1. 实验材料
东北红松籽,松籽油(实验室自制,平均分子量为899.23,由皂化值188.09 mg KOH/g油和酸值0.84 mg KOH/g油计算);正己烷(天津市富于精细化工有限公司);无水乙醇(天津市天力化学试剂有限公司);甲醇(山东禹王实业有限公司)。正己烷和甲醇在色谱上是纯的,其他试剂是分析纯的。β-环糊精分子量为1134.98,纯度为98%的β-环糊精购自阿拉丁化学试剂有限公司。试验用水为实验室自制蒸馏水。
2.1.2. 实验仪器
Startorious 1721型电子天平(德国赛多利斯集团);LXJ-IIB型离心机(上海安亭科学仪器厂);SHJ-A4水浴恒温磁力搅拌器(常州华奥仪器制造有限公司);R202B旋转蒸发仪(上海申胜生物技术有限公司);DHG-9145A鼓风干燥箱(上海合恒仪器设备有限公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);HPP.W1-400/1超高压设备(天津华泰森淼生物工程技术股份有限公司);204F1差示量热扫描仪(德国NETZSCH公司);204F1热重分析仪(德国NETZSCH公司);AVANCEIIIHD500MHz核磁共振波谱仪(瑞士布鲁克科学仪器有限公司);X,Pert3PowedrX射线衍射仪(荷兰帕纳科);IRAffinity-1傅立叶红外变换光谱仪(日本岛津公司)。
2.2. 包合物的制备
2.2.1. 实验方法
超高压水相提取松籽油:称取磨碎后的红松松籽样品2 g于5 × 10 (cm)的密封袋中,加入一定比例的水,真空密封后置于超高压设备中,初始实验设置300 MPa,时间5 min,4次,取出后进行11,000 r/min低温离心,去除底层固体,保留上层清液,随后用用正己烷进行萃取,萃取之后离心取上清,用50˚水浴旋蒸提取出松籽油。采用单因素实验对固液比(1/2, 1/4, 1/6, 1/8, 1/10),超高压处理的压强(单位:Mpa,200,250,300,350,400),处理时间(单位:min,3,5,10,15,20),处理次数(2, 3, 4, 5, 6)进行优化,比较各个参数对产油率的影响,得出最佳取值范围,确定最佳组合。提取出的松籽油用于β-环糊精包合物的制备。
β-环糊精包合物的制备:将β-环糊精溶解在水中以制备饱和溶液并使其静置。根据一定比例(w/w)将松籽油与乙醇混合。将松籽油–乙醇乳液逐渐加入到β-环糊精饱和溶液中。将混合物加热,搅拌并使其包埋一段时间,然后在0℃下温育12小时。之后,将悬浮液通过滤纸过滤。将沉淀物用冷乙醇洗涤三次以除去残留的油,在60℃下干燥8小时,然后称重。基于初步实验结果,首先通过单因素实验研究参数。 选择了影响松籽油包含率的四个因素;这些因素和水平如表1所示。在单因素实验中,初始因素选定温度50℃,时间2小时,乙醇加入量为4.5倍(乙醇/松籽油),松籽油与β-环糊精的摩尔比为1:1。当研究一个因子时,其他因素将保持初始因素,直到找到优化条件,基于最高包含率确定最佳值。在最佳条件下进行包埋三次以进行确认,在最佳条件下进行包合物的表征等 [14]。
Table 1. The factors and levels of single-factor design
表1. 单因素设计的影响因素及水平
2.2.2. 测量包合物中的松籽油含量
将包合物粉末干燥并称重,然后加入正己烷(10倍包合复合物,w/w)。通过超声波回流在70℃下处理悬浮液2小时并过滤以获得粉末。超声回流重复三次。将液体混合并在40℃下进行旋转蒸发以获得包合物中松籽油的重量。通过以下等式计算包合物的包合率:
包合率 = 含松籽油粉饼重量/加入物料总重量 × 100%
为了更好地知道松籽油的材料利用度,我们还通过以下等式计算了最佳条件产品的松籽油的包油率:
包油率 = 包合复合物中松籽油重量/加入油量 × 100%
2.3. 包合物的表征
2.3.1. 傅里叶变换红外(FT-IR)
β-环糊精和包合复合物的FT-IR光谱记录在IRAffinity-1,波数范围为4000~500 cm−1,分辨率为4 cm−1。将样品粉末用200 mgKBr混合粉末以1%稀释,然后压制成自支撑盘。将两个100毫克的KBr部分压到自支撑盘上。随后,将10 μL松籽油夹在两个盘之间,并通过IRAffinity-1检测。光谱也记录在4000~500 cm−1的波数范围内,分辨率为4 cm−1。
2.3.2. X射线衍射(XRD)
使用X,Pert3Powedr X射线衍射仪在CuKal辐射下分别在30 mA和40 kV的电流和电压下检测晶体形式的β-环糊精和包合复合物。角度范围以5˚ min−1的速率从5˚至50˚扫描2 h。
2.3.3. 差示扫描量热法(DSC)
简而言之,使用204F1DSC对5 mg β-环糊精和包合复合物样品进行DSC分析。在N2气氛下以10℃min−1的加热速率从50℃至400℃进行分析。
2.3.4. 核磁共振光谱(NMR)
将β-环糊精、松籽油和包合复合物溶解于氘代DMSO中。在500MHzNMR光谱仪上记录相应的光谱。以ppm表示化学位移,以四甲基硅烷为内标。
3. 实验结果和分析
3.1. 超高压提取松籽油各因素的影响
通过超高压优化实验对液料比,超高压处理的压强,处理时间,处理次数进行优化,比较各个参数对提取率的影响,得出最佳提取的条件为:固液比1/8,使用300 MPa的压强,处理时间5分钟,进行4次处理时得到最大产油率为31.74%。
实验发现在进行超高压水相进行提取的时候,由于过大的压力,使得水与松籽细胞中的脂肪酸进行了微妙的包合作用,导致最终的产油率相比传统物理压榨的低出一些,在第二次离心分离的水相中检测出了含有一些不饱和脂肪酸,这些不饱和脂肪酸与水分子形成了一种稳定的水包油的状态,通过萃取旋蒸并不能将其分离 [15]。通过超高压水相提取的红松松籽油进行理化性质的检测,其不饱和脂肪酸基本没有被破坏,极大程度的保留了红松松籽中的不饱和脂肪酸的种类以及含量,虽然相比于传统物理压榨的产油率有所下降,但是对于其不饱和脂肪酸的总体产量并没有造成影响 [16] [17]。
根据2.2.1所提取的松籽油与β-环糊精包合物的状态如图1所示。

Figure 1. Samples (a) Pine nut oil; (b) Inclusion complex
图1. 样品 (a) 松籽油;(b)包合复合物
3.2. 工艺因素对包合率的影响
根据目前的研究和结构研究,脂肪酸作为客体分子很容易被复合,由于β-环糊精与“客体”分子的结合能力,复合物具有其自身的熵和焓驱动性质。随着影响因素的变化,尤其是加热温度与时间的变化,“主客体”分子结构也会发生可逆变化,因此研究了四个主要因素对于包合率的影响。

Figure 2. Effect of each parameter on the inclusion rate of inclusion complex. (a) Inclusion time (temperature 50˚C, ethanolto-oil ratio 4.5, mole ratio of oil to b-CD 1:1); (b) Inclusion temperature (time 2 h, ethanol-to-oil ratio 4.5, mole ratio of oil tob-CD 1:1); (c) Ethanol-to-oil ratio (time 2 h, temperature 50˚C, mole ratio of oilto b-CD 1:1); (d) Mole ratio of oil to b-CD (time 2.5 h, temperature 50˚C, ethanolto-oil ratio 4.5)
图2. 每个参数对包合率的影响。(a) 包合时间(温度50℃,乙醇加入量4.5倍,油与β-环糊精的摩尔比1:1);(b) 包合温度(时间2小时,乙醇加入量4.5倍,油与β-环糊精的摩尔比1:1);(c) 乙醇加入量(温度50℃,时间2小时,油与β-环糊精的摩尔比1:1);(d) 松籽油与β-环糊精的摩尔比(温度50℃,时间2小时,乙醇加入量4.5倍)
图2(a)显示了包合率随加热时间的变化,在1到2小时包合率出现上升趋势,在2到7小时包合率呈现下降趋势。包合率在2小时达到最大值。在较长时间的加热过程中,不可避免的是未埋入的不饱和双键会被氧化,并且与不饱和双键相比,饱和结构对β-环糊精亲和力更高,因此包合率下降。在加热时间中选取2小时为最佳加热时间。
图2(b)显示了包合率与包合温度的变化,从初始温度升高到50℃,温度高于50℃时,随着温度的进一步升高,包合率明显降低。这是因为持续的过热会促进复杂的形成,但也会破坏它的稳定性。另一方面,升高的温度也可以促进松籽油的不饱和键的氧化,因此它需要一个平衡。在60℃也达到了相似的平衡,但是相比较来说50℃时的包合率更高。因此,50℃被认为是最佳的包含温度。
图2(c)显示了乙醇与油的比率对包合率的影响。包含率在0倍至4.5倍的比例下持续增加,然后观察到下降。当比例为4.5倍时,获得最高的包含率。这可能是由于适当量的用油乳化的乙醇增加了甘油三酯和脂肪酸的溶解度,从而促进了包合物的形成;但当系统达到平衡时,乙醇与松籽油比率的进一步提高降低了复合物形成的驱动力,即腔体与溶液之间疏水性的差异,从而导致包含率降低 [18]。因此,4.5倍被认为是最佳的乙醇与油的比率。
由于松籽油结构复杂,研究了松籽油与β-环糊精的摩尔比。图2(d)显示了松籽油与β-环糊精的摩尔比对包合率的影响。在松籽油的比例大于β-环糊精时,包合率很低。当松籽油与β-环糊精的摩尔比为1:2时,包合率达到最大值,这与许多研究一致 [19] [20] [21]。在本实验中,通过添加不同量的松籽油的环糊精饱和溶液法制备包合复合物。当实验中松籽油与β-环糊精的摩尔比大于1:3时,部分松籽油在制备过程中漂浮在表面上,油–水界面减少,这导致包合率降低。因此,1:2被认为是油与β-环糊精的最佳摩尔比。
在单因素实验的基础上,包合过程的最佳条件为:包合时间2小时;包合温度50℃;乙醇与油的比例为4.5倍;松籽油与β-环糊精的摩尔比为1:2。在最佳条件下,松籽油的包合率为70.19% ± 1.93%,松籽油含量为33.01%。随后对在最佳条件下制备的样品进行了表征。
3.3. 包合物的表征分析
3.3.1. 傅里叶变换红外光谱分析
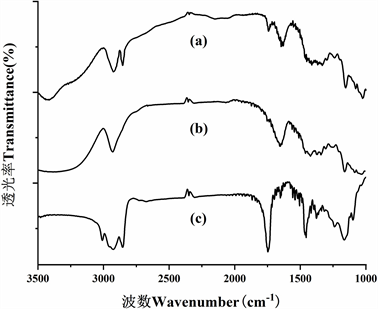 (a) 包合物 (b) β-环糊精 (c) 松籽油
(a) 包合物 (b) β-环糊精 (c) 松籽油
Figure 3. FT-IR spectra
图3. 傅里叶变换红外光谱图
如图3所示,包合物的FT-IR光谱类似于β-环糊精的FT-IR光谱,但也存在甘油三酯的特征峰。观察到松籽油的FT-IR光谱波段在3012.81 cm−1处存在−CH = CH−的伸缩振动;2926.01 cm−1和2856.58 cm−1处为−CH伸缩振动和1749.44 cm−1处是在酸性酸中的−C=O伸缩振动;所有这些都与甘油三酯结构有关。β-环糊精的FT-IR光谱显示在3373.50.14 cm−1处突出的宽吸收带是用于−OH伸缩振动;2927.94 cm−1的尖锐带是用于−CH伸缩振动;在1159.22 cm−1和1031.92 cm−1处的突出带分别用于拉伸−CO和拉伸−COC−的伸缩振动。然而,包合物在3429.43 cm-1处的特征谱带变得不如β-环糊精那么突出。在2924.09 cm−1峰旁边的2858.51 cm−1处的峰值与松籽油所产生的−CH伸缩振动相关。在1747.51 cm−1处的新的尖峰可以认为是脂肪酸中的强烈−C = O伸缩振动。这些变化很可能与松籽油和β-环糊精之间的分子内键的形成有关,并且很可能是由于主客体的相互作用 [22]。
3.3.2. X射线衍射分析
 (a) 包合物 (b) β-环糊精
(a) 包合物 (b) β-环糊精
Figure 4. XRD patterns
图4. X射线衍射图谱
为了确认包合物的形成,我们进行了XRD分析。特征峰的消失或新峰的出现表明包合物的形成。图4(b)显示了β-环糊精和包合复合物的XRD衍射图。β-环糊精的XRD衍射图证明,该分子以2θ 6.30˚,9.09˚,12.76˚,17.20˚,19.67˚,22.72˚的衍射角峰显示出明显的晶态。该衍射图与Kayaci等人提出的β-环糊精晶体结构中的笼型填充一致 [23]。此外,包含复合物的衍射图案与β-环糊精的衍射图案不同,显示出更多的非晶结构。几个强烈而尖锐的特征峰消失了;如图4(a)所示,在2θ 6.92˚,12.31˚,16.51˚,18.71˚,20.02˚,23.94˚的衍射角出现明显的一系列主峰;在2θ 37.66˚处还可以观察有一个较为平缓的小峰。X射线衍射图案的可见变化表明了分子结构的改变;这些变化可能与包合物的形成有关。因此XRD结果证实了FT-IR结果。
3.3.3. 差示扫描量热分析
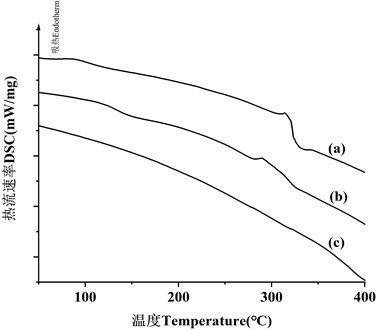 (a) β-环糊精 (b) 包合物 (c) 松籽油
(a) β-环糊精 (b) 包合物 (c) 松籽油
Figure 5. DSC diagrams
图5. 差示扫描量热图
差示扫描量热分析用于描述加热过程中β-环糊精和油包合物的解离过程。当客体分子被引入β-环糊精腔时,热峰可能会移位甚至消失。图5显示了β-环糊精,包合物,松籽油的DSC曲线。
松籽油的DSC曲线没有明显的吸收峰,符合非晶体特征,而β-环糊精的DSC曲线显示在314.00℃周围有大的吸热峰,这是由于β-环糊精的糊化和分解所产生的。包合物的DSC曲线在约289.65℃呈现低强度峰,其不同于β-环糊精和松籽油分子的峰。差异可能表明疏水性脂肪酸基团被掺入环糊腔。对于用天然化合物(例如红辣椒素)的β-环糊精包合物的DSC检测,以观察到类似结果 [24]。
这些检测的差异表明松籽油可以通过掺入β-环糊精以形成“主客体”分子结构。
3.3.4. 1H核磁共振光谱分析
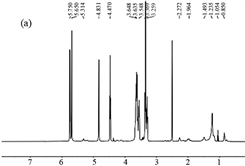 (a) 包合物
(a) 包合物
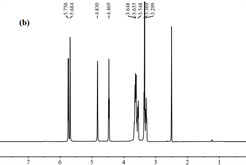 (b) β-环糊精
(b) β-环糊精
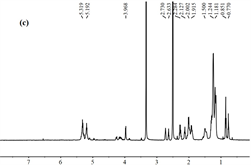 (c) 松籽油
(c) 松籽油
Figure 6. 1H NMR spectra
图6. 1H NMR光谱
1H NMR谱是包合物形成的最直接证据。在种子油主要成分的综述中表明大多数脂肪酸是单不饱和脂肪酸和多不饱和脂肪酸(主要是油酸,亚油酸和亚麻酸)以及饱和脂肪酸(主要是棕榈酸和硬脂酸) [25]。松籽油和β-环糊精的1H化学位移通过它们的1H NMR光谱测定(图6)。图中显示包合物的氢谱主体为β-环糊精的图谱,并存在一些松籽油的特征峰值。
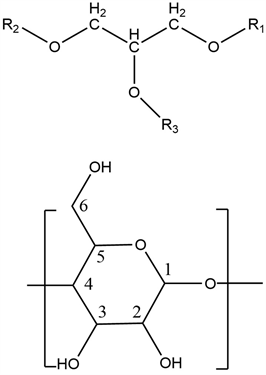
Figure 7. Chemical structure of triglycerides and β-CD unit
图7. 甘油三酯和β-环糊精单元的化学结构
Table 2. Chemical shifts δ (ppm) of β-CD in the 1H NMR of β-CD and inclusion complex
表2. 在β-环糊精和包合物1H核磁共振谱中β-环糊精的化学位移δ (ppm)
图7展示了甘油三酯和β-环糊精单元的化学结构。表2显示了β-环糊精的质子和包合物的重要化学位移以及相互作用中氢原子的化学位移的差异。松籽油的主要化学位移的值示于表3中。1H NMR光谱5.319 ppm表示来自不饱和的双键脂肪酸,从5.192到3.968 ppm的光谱代表甘油酯中的甘油基;从2.730到1.181 ppm的光谱代表亚甲基部分;0.851和0.770 ppm的那些代表甲基端 [26]。在包合物中,由于腔外的双键,包合物的质子峰值位移到5.314 ppm处,0.850处的峰值归因于末端甲基,而1.054到1.493 ppm处的峰值表示存在−CH2−;而一些甘油基等消失掉了。因此,PSO的主要甘油三酯结构成功进入b-CD腔,主要成分保留了几个末端甲基和亚甲基。该分析进一步支持了FT-IR结果。
Table 3. Chemical shifts δ (ppm) and assignment of fatty glyceride in the 1HNMR spectrum of Pine nut oil and inclusion complex [26]
表3. 在松籽油和包合物1H核磁共振谱中的化学位移δ (ppm)和脂肪甘油酯的分配 [26]
4. 结论
到目前为止,就我们所知,在探索超高压提取工艺以及实现利用超高压环境用水相提取溶于水和不溶于水的两类物质,这样一步提取,分离出两类物质的工作很少,这为其他植物的组织中有机物的提取及分离开拓思路。通过超高压提取出的松籽油再进行β-环糊精包合,形成了松籽油-β环糊精包合物,其最大包含率为70.19% ± 1.93%,松籽油含量为33.01%的产物。还通过FT-IR,XRD,DSC和1H NMR分析对包合复合物进行了全面表征,以证明基于主客体相互作用成功地将松籽油掺入β-环糊精中。
总之,利用超高压提取松籽油是一种可行的方法,并且包合物的形成是增强松籽油稳定性的一种令人鼓舞的方法。该技术可用于工业规模以改善储存和松籽油的运输方便,因为它经济,灵活,可以连续运行。因此,它有助于松籽油的高价值利用和工业化。
文章引用
董英魁,陈 冲,赵修华,张 茜,祖述冲. 超高压提取松籽油和β-环糊精的包合物制备及表征分析
Preparation and Characterization Analysis of Inclusion Complex of Pine Nut Oil and β-Cyclodextrin[J]. 化学工程与技术, 2021, 11(04): 235-246. https://doi.org/10.12677/HJCET.2021.114032
参考文献
- 1. 刘国刚. 坚果林树种——红松[J]. 中国林副特产, 2004(4): 47-48.
- 2. Asset, G., Staels, B., Wolff, R.L., Bauge, E., Madj, Z., Fruchart, J.C. and Dallongeville, J. (1999) Effects of Pinus pinaster and Pinus koraiensis Seed Oil Supplementation on Lipoprotein Metabolism in the Rat. Lipids, 34, 39-44. https://doi.org/10.1007/s11745-999-335-2
- 3. Wolff, R.L., Pedrono, F., Pasquier, E. and Marpeau, A.M. (2000) General Characteristics of Pinus spp. Seed Fatty Acid Compositions, and Importance of Δ5-Olefinic Acids in the Taxonomy and Phylogeny of the Genus. Lipids, 35, 1-22. https://doi.org/10.1007/s11745-000-0489-y
- 4. Lee, S.W. and Rhee, C. (2003) Processing Suitability of a Rice and Pine Nut (Pinuskoraiensis) Beverage. Food Hydrocolloids, 17, 379-385. https://doi.org/10.1016/S0268-005X(02)00121-2
- 5. 李婉莹, 刘俊渤, 唐珊珊, 常海波. 松籽油的精炼工艺[J]. 吉林农业大学学报, 2015, 37(6): 731-738+745.
- 6. Venkatachalam, M. and Sathe, S.K. (2006) Chemical Composition of Selected Edible Nut Seeds. Journal of Agricultural and Food Chemistry, 54, 4705-4714. https://doi.org/10.1021/jf0606959
- 7. Won, S.B., Jung, G.-Y., Kim, J., Chung, Y.S., Hong, E.K. and Kwon, Y.H. (2013) Protective Effect of Pinus koraiensis Needle Water Extract against Oxidative Stress in HepG2 Cells and Obese Mice. Journal of Medicinal Food, 16, 569- 576. https://doi.org/10.1089/jmf.2012.2665
- 8. Park, S., Shin, S., Lim, Y., Shin, J.H., Seong, J.K. and Han, S.N. (2016) Korean Pine Nut Oil Attenuated Hepatic Triacylglycerol Accumulation in High-Fat Diet-Induced Obese Mice. Nutrients, 8, Article No. 59. https://doi.org/10.3390/nu8010059
- 9. 周志强, 钱志伟, 曹乐民. 超高压萃取法提取山楂叶黄酮工艺研究[J]. 北方园艺, 2020(7): 116-123.
- 10. 王俊国, 袁泰增, 陈书曼, 宋玉卿. 超高压提取月见草油工艺条件的优化及理化性质的研究[J]. 粮食与油脂, 2019, 32(11): 26-30.
- 11. 董越, 刘会平, 刘易坤, 田丽元, 邵萍. 松子油提取工艺及3种松子油脂肪酸组成分析[J]. 中国油脂, 2017, 42(4): 8-11.
- 12. 刘景强. 红松籽的生产与深加工技术探讨[J]. 园艺与种苗, 2016(9): 71-72+76.
- 13. Chen, Y. and Liu, Y. (2010). Cyclodextrin-Based Bioactive Supramolecular Assemblies. Chemical Society Reviews, 39, 495-505. https://doi.org/10.1039/B816354P
- 14. 郭阳. 东北红松松籽油的提取及其微胶囊的制备[D]: [硕士学位论文]. 哈尔滨: 东北林业大学, 2017.
- 15. 马文君, 齐宝坤, 王晶, 李杨, 冯红霞, 曹亮, 隋晓楠, 江连洲. 不同方式提取松籽油理化性质及微波加热对其品质影响的研究[J]. 中国食物与营养, 2015, 21(3): 50-54.
- 16. 吴洪军, 付婷婷, 李靖彤, 赵凤臣. 水代法提取红松籽油加工工艺的研究[J]. 中国林副特产, 2014(4): 31-32, 33.
- 17. Sun, X.L., Li, W.G., Li, J., Zu, Y. and Zhao, X. (2017) Inclusion Complex of Peony (Paeonia suffruticosa Andr.) Seed Oil With β-Cyclodextrin: Preparation, Characterisation and Bioavailability Enhancement. International Journal of Food Science & Technology, 52, 2352-2361. https://doi.org/10.1111/ijfs.13519
- 18. Shrestha, M., Ho, T.M. and Bhandari, B.R. (2017) Encapsulation of Tea Tree Oil by Amorphous Beta-Cyclodextrin Powder. Food Chemistry, 221, 1474-1483. https://doi.org/10.1016/j.foodchem.2016.11.003
- 19. Szente, L., Szejtl, J., Szemán, J. and Kató, L. (1993) Fatty Acid-Cyclodextrin Complexes: Properties and Applications. Journal of Inclusion Phenomena and Molecular Recognition in Chemistry, 16, 339-354. https://doi.org/10.1007/BF00708714
- 20. Ishiguro, T., Adachi, S. and Matsuno, R. (1995) Thermogravimetric Analysis of Cyclodextrin-Fatty Acid Complex formation and Its Use for Predicting Suppressed Autoxidation of Fatty Acids. Bioscience, Biotechnology, and Biochemistry, 59, 51-54. https://doi.org/10.1271/bbb.59.51
- 21. Rungsardthong Ruktanonchai, U., Srinuanchai, W., Saesoo, S., Sramala, I., Puttipipatkhachorn, S. and Soottitantawat, A. (2011) Encapsulation of Citral Isomers in Extracted Lemongrass Oil with Cyclodextrins: Molecular Modeling and Physicochemical Characterizations. Bioscience, Biotechnology, and Biochemistry, 75, 2340-2345. https://doi.org/10.1271/bbb.110523
- 22. Sun, W., She, M.-Y., Yang, Z., Zhu, Y.-L., Ma, S.-Y., Shi, Z. and Li, J.-L. (2016) Study on the Inclusion Behaviour and Solid Inclusion Complex of Lomustine with Cyclodextrins. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 86, 45-54. https://doi.org/10.1007/s10847-016-0640-1
- 23. Kayaci, F., Sen, H.S., Durgun, E. and Uyar, T. (2014) Functional Electrospun Polymeric Nanofibers Incorporating Geraniol-Cyclodextrin Inclusion Complexes: High Thermal Stability and Enhanced Durability of Geraniol. Food Research International, 62, 424-431. https://doi.org/10.1016/j.foodres.2014.03.033
- 24. Martins Mendes Gomes, L., Petito, N., Gonçalves Costa, V., Quintanilha Falcão, D. and de Lima Araújo, K.G. (2014) Inclusion Complexes of Red Bell Pepper Pigments with β-Cyclodextrin: Preparation, Characterisation and Application as Natural Colorant in Yogurt. Food Chemistry, 148, 428-436. https://doi.org/10.1016/j.foodchem.2012.09.065
- 25. Picariello, G., Sacchi, R. and Addeo, F. (2007). One-Step Characterization of Triacylglycerols from Animal Fat by MAL- DI-TOF MS. European Journal of Lipid Sci-ence & Technology, 109, 511-524. https://doi.org/10.1002/ejlt.200600255
- 26. 杨登辉, 王鹤达, 江秀明, 向国强. 核磁共振氢谱法测定食用油中的脂肪酸含量[J]. 河南工业大学学报(自然科学版), 2019, 40(5): 13-17.
