Hans Journal of Chemical Engineering and Technology
Vol.
12
No.
03
(
2022
), Article ID:
51991
,
10
pages
10.12677/HJCET.2022.123025
氧化锆磁性吸附剂的制备及其磷吸附研究
胡天玉1,张占群1,王磊1,姜文旭1,但宏兵2,李建军1*,刘银1
1安徽理工大学材料科学与工程学院,安徽 淮南
2山东大学,山东省水环境污染控制与资源化重点实验室,山东 济南
收稿日期:2022年4月22日;录用日期:2022年5月23日;发布日期:2022年5月31日

摘要
以球磨后的粉煤灰磁珠(MS)为磁核,通过一步化学沉淀法,制备了氧化锆包覆的粉煤灰磁珠(MS@ZrO2)磁性磷吸附剂。系统的结构与磁性分析表明,ZrO2均匀地包覆在磁珠表面,样品中ZrO2质量百分比约为23%。MS@ZrO2的比磁化强度为17.25 emu/g,可借助外磁场高效分离回收。利用MS@ZrO2对20 mg/L含磷污水进行的吸附实验表明,在最优条件:MS@ZrO2投加量为0.4 g/L,pH为2时,磷的比吸附量可达18.80 mg/g,与Langmuir等温方程计算得出最大吸附量19.05 mg/g接近。吸附热力学和吸附动力学实验结果表明,MS@ZrO2对磷的吸附过程符合Langmuir模型和准二级动力学模型,说明磷吸附以单分子层化学吸附为主。磷吸附机理可以用ZrO2表面羟基化–离子交换模型解释。
关键词
磁性吸附剂,氧化锆,粉煤灰磁珠,磷吸附,表面羟基化–离子交换

Preparation of Magnetic Zirconia Adsorbent and Study on Phosphorus Adsorption
Tianyu Hu1, Zhanqun Zhang1, Lei Wang1, Wenxu Jiang1, Hongbing Dan2, Jianjun Li1*, Yin Liu1
1Department of Materials Science and Engineering, Anhui University of Science and Technology, Huainan Anhui
2Shandong Provincial Key Laboratory of Water Pollution Control and Resource Reuse, Shandong University, Jinan Shandong
Received: Apr. 22nd, 2022; accepted: May 23rd, 2022; published: May 31st, 2022

ABSTRACT
A magnetic phosphorus adsorbent coated with zirconia magnetic fly ash (MS@ZrO2) was prepared by one-step chemical precipitation method using magnetic fly ash (MS) as magnetic nucleus after ball milling. The structure and magnetic analysis of the system showed that ZrO2 was uniformly coated on the surface of the magnetic beads, and the mass percentage of ZrO2 in the sample was about 23%. The specific magnetization of MS@ZrO2 is 17.25 emu/g, which can be efficiently separated and recovered by external magnetic field. The adsorption experiments of 20 mg/L phosphorous wastewater by MS@ZrO2 show that the specific adsorption capacity of phosphorus can reach 18.80 mg/g under the optimal conditions: MS@ZrO2 dosage is 0.4 g/L and pH is 2, which is close to the maximum adsorption capacity of 19.05 mg/g calculated by Langmuir isothermal equation. The experimental results of adsorption thermodynamics and kinetics showed that the adsorption process of MS@ZrO2 for phosphorus was in accordance with Langmuir model and quasi-second-order kinetic model, indicating that the adsorption of phosphorus was dominated by mono-molecule chemisorption. The mechanism of phosphorus adsorption can be explained by ZrO2 surface hydroxylation and ion exchange model.
Keywords:Magnetic Adsorbent, Zirconia, Coal-Fly-Ash Magnetic Sphere, Phosphorus Adsorption, Surface Hydroxylation and Ion Exchange

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
水体富营养化的主要原因是氮、磷等营养物质进入水体,导致藻类迅速生长,消耗水中溶解氧,鱼类、虾类等生物缺氧死亡,产生恶臭,形成严重的环境问题 [1]。研究表明,相对于氮元素,磷元素对水质富营养化的影响更大,当水体中磷的浓度高于0.02 mg/L即可认定为水体富营养化,因此,除磷是更为高效的治理水体富营养化的方法 [2] [3]。传统除磷技术包括化学沉淀法、结晶法、生物法等 [4] [5] [6],正在发展的新技术有高级氧化技术、生态法等 [7] [8],但这些方法存在着药剂量大、化学污泥多和运行成本高等问题 [9]。吸附法由于除磷效率高、成本低、操作方便成为最具前景的除磷技术之一。常见的磷吸附剂有无机金属氧化物、有机高分子类等,其中无机吸附剂具有吸附效率高、比表面积大和结构稳定等特点成为当前研究热点 [10]。近年来,氧化锆作为一种具有较大磷吸附容量且成本低的吸附材料受到较多关注。林丽丹等 [11] 以沸石合成过程中产生的废碱液和氯氧化锆为原料,制备了沸石/水合氧化锆复合吸附剂,对磷的Langmuir最大吸附量达到22.62 mg/g。李永球 [12] 制备的磁性纳米锆/铁氧化物对磷的吸附率可达99.75%。
吸附法所使用的吸附剂由于颗粒微细、比表面积大且悬浮性好,因此难以固液分离,这一难题限制了吸附法的推广应用。为解决这一难题,国内外研究者在吸附过程中引入了磁分离技术,利用磁性吸附剂除磷,再通过外磁场将吸附剂高效固液分离 [13]。目前大多数的磁性吸附剂均以纳米Fe3O4为磁核,但合成纳米Fe3O4工艺复杂、成本高且易造成二次污染 [14],不能作为磁性吸附剂的磁核得到广泛应用,因此需要一种工艺简单、廉价清洁的磁核。以工业固废粉煤灰中提取的粉煤灰磁珠(MS)作为磁核,具有制备简单、成本低且磁性强的优点 [15],是制备磁性吸附剂的理想材料。但是由于粉煤灰自身密度大和比表面积小等原因,不能在水中悬浮,需对其进行预处理 [16]。
本研究以球磨处理后的粉煤灰磁珠颗粒为磁核,通过一步化学沉淀法制备了氧化锆负载粉煤灰磁珠(MS@ZrO2)磷吸附剂,并对所得样品的形貌、结构和磁性进行了系统表征。利用制备的磁性吸附剂对含磷废水进行吸附,并研究影响磷吸附的主要因素和吸附动力学。
2. 材料与方法
2.1. 实验药品及仪器设备
实验使用的粉煤灰磁珠(MS)选自淮南某发电厂,去离子水为实验室自制。实验所用药品有:硝酸锆(Zr(NO3)4),磷酸二氢钾(KH2PO4),四水合钼酸铵((NH4)6Mo7O24·4H2O),半水酒石酸锑钾(KSbC4H4O7· 1/2H2O),氢氧化钠(NaOH),抗坏血酸(C6H8O6),氯化钠(NaCl),碳酸氢钠(NaHCO3),硫酸钠(Na2SO4),氯化钾(KCl),氯化镁(MgCl2),氯化钙(CaCl2),级别均为分析纯,均购自上海国药试剂有限公司。
实验所用仪器包括:南京博蕴通有限公司XGB04型行星式球磨机,煤炭科学研究总院GXG-08SD型磁选管,上海元析仪器有限公司UV-5100型紫外可见分光光度计,常州金坛良友仪器有限公司JJ-6B型六联异步电动搅拌器等。
2.2. 实验方法
2.2.1. 粉煤灰磁珠(MS)及磁性磷吸附剂的制备
利用套筛选出200目以下的粉煤灰,调节磁选管磁场强度为300 mT进行磁分离,选出带有磁性的粉煤灰。将选出的磁性粉煤灰利用行星式球磨机进行球磨,转速为300 r/min球磨10 h,以减小磁性粉煤灰的粒径,增加比表面积。球磨结束后用去离子水清洗,真空烘干备用,即为粉煤灰磁珠颗粒。
取1 g粉煤灰磁珠颗粒与硝酸锆溶液按1:100的固液比混合并以700 r/min的速度搅拌12 h,搅拌过程中将3 mol/L的氢氧化钠溶液以3~5秒/滴的速度缓慢滴加至pH = 10.5,反应结束后生成灰黑色絮状物,利用永磁铁对其进行磁分离。得到的磁性物质在真空干燥箱内以110℃干燥12 h,自然冷却后研磨便得到MS@ZrO2磷吸附剂。
2.2.2. 磷吸附试验
1) 磷标准曲线
利用钼酸铵分光光度法对溶液中的磷浓度进行检测。配制浓度为4 mg/L的磷酸盐溶液。分别向50 mL试管移取0 mL、0.25 mL、0.5 mL、1.5 mL、2.5 mL、5m L、7.5 mL的4 mg/L的磷酸盐溶液并用去离子水定容至刻度线,向每支试管加入1 mL质量分数为10%的抗坏血酸溶液,再加入2 mL钼酸盐溶液,混合均匀的溶液静置15 min后使用紫外分光光度计在波长为710 nm下测吸光度数据使用Origin软件拟合,得到一条标准曲线,标准方程为:
(1)
式中,x:磷离子浓度(mg/L);y:吸光度。R2 = 0.9999,这说明在浓度为0~0.6 mg/L内,磷酸盐浓度在波长为710 nm下与吸收强度呈较好的线性关系。
2) 磷吸附试验
配置20 mg/L的磷酸盐溶液,分别向其中加入不同剂量的磁性吸附剂,改变pH,在室温下分别以300转/分的转速机械搅拌3 h。搅拌结束后,使用分光光度计检测上清液吸光度,与标准曲线对比,计算出吸附量和吸附率。计算公式如下:
(2)
(3)
式中,η:吸附率;C0:磷溶液初始浓度(mg/L);Ce:吸附后浓度(mg/L);Qe:吸附量(mg/g);v:溶液体积(L);m:吸附剂投加量(g)。
2.2.3. 样品的表征
使用扫描电子显微镜(SEM,ZEISS SUPRA 40,德国)和X射线衍射仪(XRD,BRUKER D8 ADVANCE,中国)对样品的表面形貌与化学组成进行表征,样品的磁性能通过振动样品磁力仪(VSM,HH-20,中国)进行分析。
3. 结果与讨论
3.1. 磁性吸附剂(MS@ZrO2)的结构表征
3.1.1. 扫描电镜分析
粉煤灰磁珠、粉煤灰磁珠颗粒以及MS@ZrO2的SEM如图1所示。由图1(a)可知,原始的MS粒径较大,多分布在10~80 μm,形状为类球型。经球磨后,MS的类球形结构被破坏,变为不规则形状,同时粒径减小到0.5~6.0 μm (见图1(b))。经锆盐修饰后,MS表面出现细小颗粒(见图1(c)和图1(d)),这些小颗粒形状不规则,粒径多分布在100~800 nm之间,应来自于锆盐的修饰过程。

Figure 1. SEM images of (a) original MS, (b) ball-milled MS, (c) and (d) MS@ZrO2
图1. (a) 原始磁珠,(b) 球磨磁珠,(c)、(d) MS@ZrO2的SEM图像
3.1.2. X-晶体衍射分析
为对比改性前后的结构变化,对样品进行了XRD分析。如图2所示,球磨后的磁珠(B)的衍射峰与原磁珠(C)的衍射峰相比,没有显著变化,说明球磨只改变了磁珠的粒径和外部形貌,并未对其晶体结构造成影响。但改性粉煤灰磁珠的XRD谱(A)却有显著变化,图谱中保留了粉煤灰磁珠所有衍射峰,但大多衍射峰的强度有所下降和峰型有所宽化,这应该是由于锆化合物修饰在磁珠颗粒表面所造成的。值得注意的是,在27.62˚、35.41˚、39.16˚和48.64˚处出现了新的衍射峰。通过对比标准PDF卡片,发现这些衍射峰为氧化锆(JSPD#: 83-0940)的衍射特征峰。这说明,包覆在磁珠表面的锆化合物小颗粒为氧化锆。
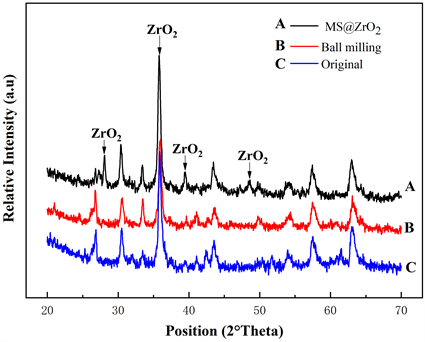
Figure 2. XRD patterns of MS, ball-milled MS and MS@ZrO2
图2. MS、球磨MS与MS@ZrO2的XRD衍射图
3.1.3. 磁性分析
通过VSM磁滞回线(图3)可以看出,改性前后的粉煤灰磁珠都有较强的磁性和较小剩磁与矫顽力,改性前磁珠的磁饱和强度为22.36 emu/g,改性后为17.25 emu/g,较原磁珠有所降低。这是因为磁珠表面负载了无磁性的氧化锆,根据前后磁饱和强度变化可以估算氧化锆包覆比例约为23%。虽然MS@ZrO2的磁性有所下降,但仍满足高效磁分离的要求。由图3中的插图可知,仅用普通手磁块即可做到高效固液分离,这对吸附剂的循环利用具有重要意义。

Figure 3. Magnetic hysteresis loops of MS and MS@ZrO2 (Inset: photo of the magnetic separation of MS@ZrO2)
图3. MS和MS@ZrO2的磁滞回线(插图:MS@ZrO2磁分离照片)
3.2. 磷吸附性能研究
3.2.1. MS@ZrO2的磷吸附性能
图4是不同溶液pH下MS和MS@ZrO2对含磷离子的吸附量。由图可知,MS对磷离子的吸附性能较弱,且受pH影响较小,比吸附量最高仅达到1.68 mg/g。而MS@ZrO2的比吸附量在最优条件可达17.4 mg/g:吸附剂投加量为0.4 g/L,磷溶液浓度为10 mg/L时,pH = 2。磷吸附量随着pH的增加逐渐减少,说明MS@ZrO2的磷吸附受pH的影响较为显著。MS@ZrO2的在酸性条件下吸附效果最佳可能是因为磷吸附主要来自于表面的包覆的ZrO2,ZrO2的磷吸附在pH 2~3条件下最优 [17]。

Figure 4. Adsorption performance at different pH
图4. 不同pH下的吸附性能
3.2.2. Zr(NO3)4用量对吸附效果的影响
磷吸附实验发现使用不同ZrO2包覆量的改性粉煤灰磁珠吸附效果并不相同。实验结果表明(图5(a)),包覆量达20%之前的吸附效果与包覆量呈正相关,包覆量为23%时效果最佳,约为12.20 mg/g。当ZrO2包覆量超过23%时吸附效果并不会增强,这是因为粉煤灰磁珠表面改性的点位已达到最佳,粉煤灰磁珠比表面积有限,增加ZrO2的包覆量并不会增加磷离子与吸吸附点位的接触;未用硝酸锆改性时吸附效果较差,仅为1.59 mg/g,这证明了改性粉煤灰磁珠对磷的吸附主要来源于磁珠表面的水和氧化锆。
3.2.3. 磁性吸附剂投加量对吸附效果的影响
实际应用中,投加量和去除率通常是较为重要的技术参数。选用浓度为5 mg/L的磷溶液模拟含磷污水,吸附剂投加量为0.1~0.6 g/L进行吸附实验,实验结果如图5(b),投加量为0.5 g/L时,磷去除率达83.42%,投加量为0.4 g/L时,去除率为82.92%,与最大去除率接近。吸附剂投加量的增加,吸附点位也随之增加,但比吸附量会减少,吸附容量利用率也降低。在实际应用中,既要保证净化效果也要合理选择合理投加量。
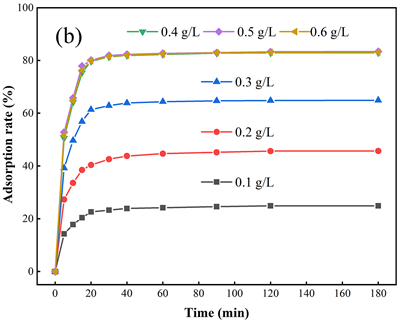
Figure 5. (a) Effect of ZrO2 ecoating percentage on adsorption effect; (b) Time-adsorption rate curve of different adsorbent dosage
图5. (a) ZrO2包覆量对吸附效果的影响;(b) 不同吸附剂投加量的时间–吸附率曲线
3.2.4. MS@ZrO2磷吸附的等温吸附线
MS@ZrO2对磷的吸附等温线如图6(a)所示。利用Langmuir和Freundlich模型对吸附等温线的数据进行拟合(图6(b)和图6(c)),Langmuir和Freundlich吸附模型的表达式为:
(4)
(5)
式中,Qmax:通过Langmuir方程计算出的最大吸附量(mg/g);KL:Langmuir常数(mg−1);KF:Freundlich常数。
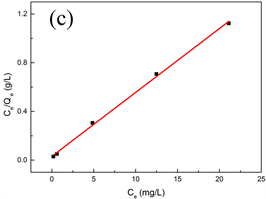
Figure 6. (a) Isothermal adsorption line; (b) Freundlich model; (c) Langmuir model
图6. (a) 等温吸附线;(b) Freundlich模型;(c) Langmuir模型
根据Langmuir等温方程拟合得到的相关系数R2 = 0.9979,大于Freundlich等温方程拟合得到的相关系数R2 = 0.8380,说明MS@ZrO2吸附磷的过程更符合Langmuir模型,属于单分子层吸附 [18]。由Langmuir等温方程计算得出最大吸附量为19.05 mg/g,与实验最大值18.80 mg/g接近。
3.2.5. MS@ZrO2磷吸附的吸附动力学
使用准一级和准二级动力学模型来对MS@ZrO2吸附磷的过程进行研究,方程如下:
准一级动力学模型:
(6)
准二级动力学模型:
(7)
式中,K1,K2:吸附速率常数[g/(mg·min)];Qt:t时刻的吸附量(mg/g);t:吸附时间。
根据MS@ZrO2吸附磷的拟合结果(图7)可知,实验数据与准一级动力模型的相关系数为R2 = 0.9785,与准二级动力模型的相关系数R2 = 0.9985。显然,MS@ZrO2吸附磷的过程跟符合准二级动力模型,即MS@ZrO2对磷的吸附主要为化学吸附过程。
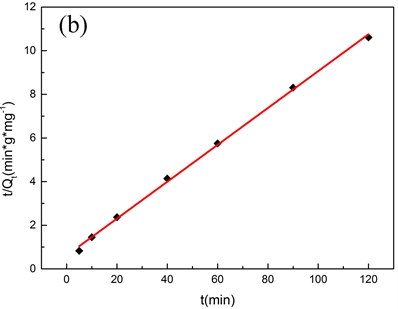
Figure 7. (a) Quasi first order kinetic model; (b) Quasi second order kinetic model
图7. (a) 准一级动力学模型;(b) 准二级动力学模型
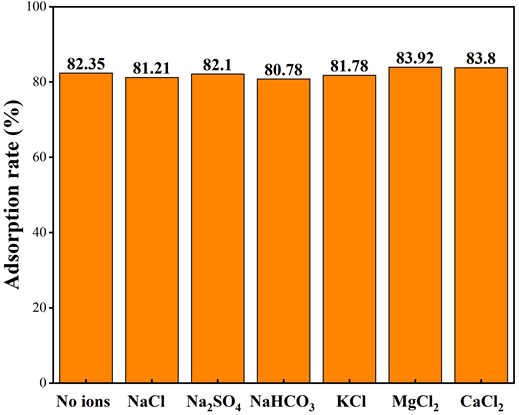
Figure 8. Effect of coexisting ions on phosphate adsorption rate
图8. 共存离子对磷酸根吸附率的影响
3.2.6. 共存阴阳离子对MS@ZrO2吸附水中磷酸盐的影响
污水中一般存在着各种阴离子和阳离子,如Cl−、 、、Na+、K+、Mg2+和Ca2+等,这些阴阳离子可能会干扰吸附剂对磷酸盐的吸附。为研究这些无机离子对磷吸附的影响,通过向磷酸盐溶液(5 mg/L)加入不同电解质来进行批量实验,结果如图8所示。从图8可以看出Cl−、 、、Na+和K+的存在对MS@ZrO2吸附水中磷酸盐的负面影响极为微弱,可以忽略不计。Mg2+和Ca2+对MS@ZrO2吸附水中磷酸盐有一定正面影响,这是因为 、Mg2+和Ca2+加入溶液中会导致溶液的酸性增强,促进了MS@ZrO2对水中磷酸盐的吸附。实验结果显示,MS@ZrO2磁性吸附剂适用于复杂水体。
3.2.7. MS@ZrO2磷吸附机理
根据动力学和热力学模拟可知,MS@ZrO2的磷吸附过程以单分子层化学吸附为主。由于磷吸附主要来源于样品表面的ZrO2,所以可以用水和氧化锆吸附磷的机理来解释磁性吸附剂MS@ZrO2对磷的吸附机理。氧化锆吸附磷的过程主要是化学吸附,且表面羟基在吸附过程中起着至关重要的作用 [19],表达式为式8 [20]:
(8)
而表面羟基随着化学环境的不同其化学性质也发生变化。当处于低pH环境下,材料表面的羟基会被质子化并且带正电荷反应,发生的反应见式9。因此在酸性条件下,会促进水和氧化锆对磷酸盐阴离子的吸附,使得吸附效果更佳。但当酸性过强时,根据式8,溶解反应将处于主导地位,对磷酸根的固化作用较为微弱 [15],使得吸附效果变差。反之,随着pH增大,表面羟基带负电荷。一方面OH−会占有磁性吸附剂表面上活性点位,不利于磷吸附反应进行 [21];另一方面,在pH为2~10范围内,磷酸盐离子存在的形式主要为带负电的 和 ,这使磷酸盐阴离子更倾向于通过静电吸引吸附在MS@ZrO2表面,具体反应过程见式10和式11,导致吸附效果不佳。
(9)
(10)
(11)
结合式8,可以说明MS@ZrO2的作用机理为:ZrO2表面羟基化–离子交换。
4. 结论
1) 以球磨后的粉煤灰磁珠作为磁核,通过一步化学沉淀法法制备了MS@ZrO2磁性磷吸附剂。样品比磁化强度为17.25 emu/g,可在磁场作用下实现高效磁分离。
2) 吸附试验表明,当磷溶液浓度为20 mg/L、MS@ZrO2磁性吸附剂投加量为0.4 g/L、pH = 2,实验最高吸附量为18.80 mg/g,由Langmuir等温方程计算得出最大吸附量为19.05 mg/g。溶液pH、吸附剂投加量等因素对磷吸附具有较大影响。
3) 通过吸附热力学和吸附动力学实验,MS@ZrO2对磷的吸附过程符合Langmuir模型和吸附准二级动力学模型,以单分子层化学吸附为主。可能的磷吸附反应机理:ZrO2表面羟基化–离子交换。
项目基金
安徽省自然科学基金(1908085ME127);大学生创新创业基金资助项目(202110361076);国家自然基金面上(51374015)。
文章引用
胡天玉,张占群,王 磊,姜文旭,但宏兵,李建军,刘 银. 氧化锆磁性吸附剂的制备及其磷吸附研究
Preparation of Magnetic Zirconia Adsorbent and Study on Phosphorus Adsorption[J]. 化学工程与技术, 2022, 12(03): 178-187. https://doi.org/10.12677/HJCET.2022.123025
参考文献
- 1. 黄添浩, 林磊, 王趁义, 等. 吸氮除磷材料的研究和应用现状[J]. 化工新型材料, 2019, 558(3): 45-48+52.
- 2. 张家洋, 陈丽丽, 李慧. 水生植物对富营养化水体除磷去氮的研究概述[J]. 西北师范大学学报(自然科学版), 2013, 49(1): 115-120.
- 3. 刘赫尊, 陈亮, 张海丰, 等. 改性海绵铁深度除磷及其再生磷回收方法[J]. 环境科学学报, 2020, 40(1): 147-154.
- 4. 杨永珠, 江映翔, 赵李丽, 等. 铁-镧系合金氧化物污水除磷及再生[J]. 环境工程学报, 2014, 8(1): 236-241.
- 5. 张千, 刘向阳, 陈旺, 等. 新型除磷填料的制备及除磷吸附床运行参数的优化[J]. 化工学报, 2019, 70(3): 1099-1110.
- 6. 罗丽芳. 污水生物脱氮除磷研究进展[J]. 生物化工, 2021, 7(2): 137-141.
- 7. 鲁杰罗, 王晓纪, 朱嘉浩, 刘辉, 葛飞. 碳酸氢钠对短带鞘藻-活性污泥共生体系在城镇污水脱氮除磷中的促进作用[J]. 环境工程学报, 2021, 15(4): 1344-1353.
- 8. Matsuura, N., Masakke, Y., Karthikeyan, S., et al. (2021) Metagenomic Insights into the Effect of Sulfate on Enhanced Biological Phosphorus Removal. Applied Microbiology and Biotechnology, 105, 2181-2193.
- 9. 付超, 宋怡明, 周子敏, 徐进. 含磷污水治理技术研究现状与进展[J]. 广州化工, 2019, 47(12): 31-33.
- 10. 崔婉莹, 艾恒雨, 张世豪, 魏金枝. 改性吸附剂去除废水中磷的应用研究进展[J]. 化工进展, 2020, 39(10): 4210-4226.
- 11. 林丽丹, 王哲, 顾伟, 吴德意. 沸石/水合氧化锆吸附水中的磷[J]. 环境工程学报, 2017, 11(2): 702-708.
- 12. 李永球. 磁性纳米锆/铁氧化物的制备及其对废水中磷的吸附研究[D]: [硕士学位论文]. 长沙: 湖南大学, 2017.
- 13. Zhang, Y., Zhou, F., Wang, W., et al. (2020) Recyclable Adsorbents Based on Fe3O4 Nanoparticles on Lanthanum-Modified Montmorillonite for the Efficient Phosphate Removal. IET Nanobiotechnology, 14, 527-536. https://doi.org/10.1049/iet-nbt.2020.0012
- 14. 王文娟, 张海鹏, 韩玉香, 郑寿荣, 许昭怡. 磁性Fe3O4@SiO2@ZrO2对水中磷酸盐的吸附研究[J]. 无机化学学报, 2014, 30(12): 2726-2732.
- 15. 李建军, 但宏兵, 谢蔚, 等. 粉煤灰磁性吸附剂的制备及磷吸附机理[J]. 无机化学学报, 2018, 34(8): 66-73.
- 16. 李建军, 鲍旭, 吴先锋, 等. 磁性壳聚糖复合微球的制备及其Cu2+吸附性能[J]. 无机化学学报, 2017, 33(3): 383-388.
- 17. 张惠欣, 王有臣, 夏邦望, 周刚. ZrO2掺杂介孔活性炭材料的制备及除磷性能研究[J]. 工业水处理, 2019, 39(5): 74-77.
- 18. Wu, J., Zhang, L., Long, C., et al. (2012) Adsorption Characteristics of Pentane, Hexane, and Heptane: Comparison of Hydrophobic Hypercrosslinked Polymeric Adsorbent with Activated Carbon. Journal of Chemical and Engineering Data, 57, 3426-3433. https://doi.org/10.1021/je300550x
- 19. Xie, J., Wang, Z., Wu, D., et al. (2013) Synthesis of Zeolite/Aluminum Oxide Hydrate from Coal Fly Ash: A New Type of Adsorbent for Simultaneous Removal of Cationic and Anionic Pollutants. Industrial & Engineering Chemistry Research, 52, 14890-14897. https://doi.org/10.1021/ie4021396
- 20. Su, Y., Cui, H., Li, Q., et al. (2013) Strong Adsorption of Phosphate by Amorphous Zirconium Oxide Nanoparticles. Water Research, 47, 5018-5026. https://doi.org/10.1016/j.watres.2013.05.044
- 21. Li, H., Ru, J., Yin, W., et al. (2009) Removal of Phosphate from Polluted Water by Lanthanum Doped Vesuvianite. Journal of Hazardous Materials, 168, 326-330. https://doi.org/10.1016/j.jhazmat.2009.02.025
NOTES
*通讯作者。