Advances in Analytical Chemistry
Vol.
09
No.
01
(
2019
), Article ID:
28951
,
6
pages
10.12677/AAC.2019.91007
Determination of Estradiol in Milk Samples by Molecularly Imprinted Solid Phase Extraction-HPLC
Xuanrui Lv, Le Meng, Rongrong Xu, Caihong Liu*
College of Pharmaceutical, Taishan Medical University, Tai’an Shandong

Received: Jan. 31st, 2019; accepted: Feb. 14th, 2019; published: Feb. 21st, 2019

ABSTRACT
Estradiol molecularly imprinting polymer (MIPs) displayed higher recognition ability and adsorption capacity to the template molecule estradiol. We used the MIPs as sorbents for on-column solid phase extraction of estradiol from milk samples. Under the optimal solid-phase extraction conditions, combined with HPLC analysis, the method for estradiol determination based on molecularly imprinted solid phase extraction technology was developed. This method is effective, accurate, and can meet the requirements of the determination of estradiol in milk.
Keywords:Molecularly Imprinted Polymers, Estradiol, Solid Phase Extraction
分子印迹聚合物固相萃取-HPLC检测牛奶中痕量雌二醇
吕旋瑞,孟乐,许蓉蓉,刘彩红*
泰山医学院 药学院,山东 泰安

收稿日期:2019年1月31日;录用日期:2019年2月14日;发布日期:2019年2月21日

摘 要
雌二醇分子印迹聚合物(MIPs)对雌二醇有特异性识别和结合能力,以MIPs为填料制备固相萃取小柱,在最佳固相萃取条件下,对牛奶中雌激素进行富集,结合高效液相色谱法,建立了MISPE-HPLC法检测实际样品中雌激素。该方法提取效果好,具有良好的回收率和重复性。
关键词 :分子印迹聚合物,雌二醇,固相萃取

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
牛奶是日常生活消费最多的食品之一,然而在奶牛的饲养过程中,为了促进生长,延长产奶期,提高牛奶产量,滥用雌激素的现象日趋严重,雌激素的残留已引起国内外高度重视 [1] [2] [3] [4] [5] 。这些过量残留于食品内的雌激素进入人体后,会与正常分泌的激素竞争,结合细胞中的激素受体,造成人体激素过剩,内分泌系统紊乱,影响人体性激素的正常工作,导致多种机能出现障碍 [6] 。因此分析检测雌激素残留意义重大,但由于牛奶中雌激素痕量存在,且基质复杂,往往需要进行前处理。
固相萃取(Solid phase extraction, SPE)是目前常用的痕量物质前处理方法之一 [7] 。但常用的固相萃取介质如C18等存在选择性不强,回收率低、内源性杂质干扰严重等问题。分子印迹聚合物(Molecularly-imprinted polymers, MIPs)对目标物有特异性吸附,非常适合分离富集复杂样品中痕量分析物 [8] [9] [10] [11] 。
本研究拟利用雌二醇分子印迹聚合物为固相萃取介质,MIPs固相萃取(MISPE)特异性分离富集牛奶中痕量雌二醇,并结合HPLC法检测牛奶中雌二醇的残留量,为建立食品中雌激素残留的分离分析方法奠定基础。
2. 仪器与试剂
雌二醇、雌三醇均为标准品,购自南京森贝伽生物科技有限公司;甲基丙烯酸(MAA)、三羟甲基丙烷三甲基丙烯酸酯(TRIM)、偶氮二异丁腈(AIBN)均为分析纯,购于国药集团化学试剂有限公司;乙酸分析纯,购自国药集团化学试剂有限公司;甲醇和乙腈均为色谱纯试剂,购自天津科密欧化学试剂有限公司生产。
2300II高效液相色谱仪(大连伊利特分析仪器有限公司);SHA-C型水浴恒温振荡器(江苏省金坛市医疗仪器厂);Anke KA-1000离心沉淀器(上海安亭科学仪器厂);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司)。
3. 方法
3.1. 色谱条件
色谱柱:Hypersil BDS C18 (4.6 mm × 200 mm,5μm);流动相:甲醇–乙腈(50:50,V/V);检测波长:205 nm;柱温:30℃;流速:1.0mL/min。
3.2雌二醇分子印迹聚合物的制备
MIPs可参考文献 [12] 方法制备。准确称取0.136 g (0.5 mmol)雌二醇做模板分子与0.2583 g (3 mmol)功能单体MAA、2.0304 g (6 mmol)交联剂TRIM和0.0493 g (0.3 mmol)引发剂AIBN,加入到30 mL乙腈中,超声10 min,不间断通入氮气5 min后,密封,转入60℃恒温水浴振荡器中,转速为280 r/min,24 h后离心分离得到聚合物。将所得聚合物分别用甲醇–乙酸(9:1,V/V)、纯甲醇为溶剂依次进行索氏提取24、12 h以去除模板分子,然后置于真空干燥箱内25℃下干燥过夜。
非印迹聚合物(Non-imprinted polymers, NIPs)的制备,除不加入模板分子外,其它与印迹聚合物的合成方法相同。
3.3. MIPs的结合能力
精密称定适量MIPs或NIPs置于磨口锥形瓶中,分别加入不同浓度的雌二醇乙腈溶液,充分混合后于25℃恒温空气振荡器内振荡12 h。高速离心沉淀,吸取上清液,用HPLC外标法定量,计算溶液中雌二醇的浓度,根据结合前后溶液中雌二醇的浓度变化计算聚合物对雌二醇的结合量Q。根据Q作结合等温线图,评价聚合物的结合能力。平衡结合量(Q)按公式(1)计算 [13] 。
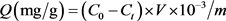 (1)
(1)
式中:C0为结合前雌二醇的质量浓度(mg/ml);Ct为结合后t时间溶液中雌二醇的平衡质量浓度(mg/ml);V为雌二醇溶液体积(ml);m为MIPs或NIPs的质量(g)。
3.4. MIPs的吸附动力学试验
精密称定一定量的MIPs于锥形瓶中,加入一定量的雌二醇溶液,25℃恒温空气振荡器内振荡,于不同时间下取样,高速离心沉淀,吸取上清液,用HPLC测定,计算溶液中雌二醇的浓度。
3.5. MIPs对雌二醇的特异识别性能
分别精密称定适量MIPs和NIPs置于磨口锥形瓶中,分别加入一定量的雌二醇乙腈溶液和雌三醇乙腈溶液,25℃恒温空气振荡器内振荡12 h。高速离心沉淀,吸取上清液,用HPLC外标法定量,测定游离雌二醇及雌三醇的浓度,根据结合前后溶液中物质浓度变化计算聚合物对各物质的结合量Q,评价聚合物的特异识别性能。
3.6. 固相萃取柱制备与活化
将适量MIPs (或NIPs)均匀填入SPE小柱(3 ml),在SPE柱底部和聚合物上方加孔径20 μm的聚乙烯筛板,得固相萃取小柱。用3ml甲醇–乙酸(9:1, V/V)溶液清洗小柱,收集流出液进行HPLC检测。未检测出雌激素,说明MIPs中的模板分子已被清洗干净。在上样之前,依次用9 ml甲醇,1 ml水活化小柱。
3.7. 样品处理
取牛奶50 g于250 ml烧杯中,加入150 ml甲醇–丙酮(1:1, V/V)的提取液,涡旋混匀后超声5 min,8000 r/min,离心10 min,收集上清液。残渣再重复操作1次后,合并上清液,并于旋转蒸发仪中蒸发至近干,用甲醇–水(1:5, V/V)溶解后,进行固相萃取,收集洗脱液,浓缩,进行HPLC测定。
4. 结果
4.1. MIPs的结合能力
为研究MIPs对雌二醇的结合能力,室温下在雌二醇浓度30 μg/ml~180 μg/ml的范围内测定了结合等温线。如图1所示,随着雌二醇浓度的增加,MIPs对雌二醇的结合量也10.11 mg/g逐渐增加到30.03 mg/g,而相同条件下NIPs对雌二醇的结合量由4.08 mg/g逐渐增加到10.46 mg/g,明显低于MIPs对模板分子的结合量。这说明MIPs对模板分子有较好的富集吸附作用。

Figure 1. Binding isotherm of MIPs and NIPs
图1. MIPs和NIPs的结合等温线
4.2. 吸附动力学试验
为研究MIPs达到吸附平衡所需的时间和吸附速率,测定了不同时间的MIPs对雌二醇的吸附容量,吸附动力学曲线见图2。MIPs对雌二醇的吸附速度较快,在短时间内吸附量有很大的增加,随着时间的延长,吸附量增加变缓,25 mim后吸附量变化趋于平缓,基本达到吸附平衡,因此该印迹聚合物作为固相萃取吸附功能材料具有较强的优势。

Figure 2. Adsorption dynamic curves of MIPs
图2. MIPs的吸附动力学曲线
4.3. MIPs对雌二醇的特异识别性能
为考察MIPs对雌二醇的特异性识别能力,实验选用模板分子雌二醇及与其结构类似的雌三醇为底物,测定MIPs和NIPs对底物的结合量。结果显示MIPs对模板分子雌二醇的结合量明显高于对雌三醇的结合量;NIPs对模板分子的结合量明显低于MIPs对雌二醇的结合量。这说明MIPs中存在与雌二醇结构互补的特定形状孔穴,对雌二醇具有特异识别能力。
4.4. MISPE条件优化
MIPs含有特异识别模板分子的结合位点,对雌激素吸附力强,NIPs主要以非特异性吸附雌激素,吸附力弱,所以在MISPE和NISPE柱中雌激素被淋洗的难易不同。最优的MISPE淋洗条件,应尽可能将NIPs上的雌激素淋洗下来,同时尽可能保留MIPs上的雌激素,这样既可洗去吸附在柱上的杂质又不影响雌二醇在MISPE柱的吸附。
选用不同体积分数的甲醇–水溶液为雌激素的淋洗液。当用50% (V/V)甲醇–水溶液淋洗时,MISPE和NISPE柱上均没有雌激素被淋洗下来,说明淋洗液洗脱能力偏小,不足以破坏雌激素与聚合物间的疏水作用;当淋洗液中甲醇含量达到60%时,MISPE柱上没有雌激素被淋洗下来,NISPE柱有33.6%的雌激素被淋洗下来;当甲醇含量为70%时,MISPE和NISPE柱上分别有40.5%和55.4%的雌激素被淋洗下来,说明淋洗液的洗脱能力过大。因而选择60%(V/V)甲醇–水溶液作为淋洗溶剂。
向甲醇中加入少量的乙酸可显著增强甲醇对雌二醇的洗脱能力,本实验选择甲醇–乙酸(9:1, V/V)为洗脱液,结果表明3 ml该洗脱液可将雌二醇从MISPE柱上完全洗脱下来。
4.5. 方法学评价及实际样品的应用
配制浓度分别为0.5 μg/ml,1 μg/ml,3 μg/ml,5 μg/ml,10 μg/ml,15 μg/ml的雌二醇标准溶液,以HPLC分别测定雌激素的峰面积,以峰面积比值为纵坐标,雌二醇溶液的浓度为横坐标,绘制标准曲线。所得线性方程为y = 226217x − 28182,线性相关系数为0.9989,说明在雌二醇在0.5 μg/ml~15 μg/ml的浓度范围线性关系良好。
在阴性牛奶样品中添加3个浓度水平(5 μg/kg,15 μg/kg和30 μg/kg)的雌二醇标准液,每个浓度平行测定6次,利用优化的MISPE和HPLC法测定方法的回收率和精密度结果见表1。结果表明MISPE对雌二醇具有很高的吸附性能,平均回收率为79.6%以上,相对标准偏差(RSD)小于5.14%;而NISPE的吸附性能相对较差,回收率较低,显示本方法可以准确可靠地测定牛奶中痕量雌二醇。
Table 1. Recovery and RSD for the determination of analytes in milk (n = 6)
表1. 牛奶样品加标回收率和精密度(n = 6)
5. 结论
本实验制备了雌激素分子印迹聚合物,并以此为固相萃取介质,建立了MISPE-HPLC方法富集和检测牛奶中的痕量雌激素,用MISPE柱净化,HPLC测定。方法的线性范围较宽,精密度和准确度较好,可用于实际样品的测定。
基金项目
国家级大学生创新创业训练计划(201810439043),泰安市科技发展计划(2017NS0164)。
文章引用
吕旋瑞,孟 乐,许蓉蓉,刘彩红. 分子印迹聚合物固相萃取-HPLC检测牛奶中痕量雌二醇
Determination of Estradiol in Milk Samples by Molecularly Imprinted Solid Phase Extraction-HPLC[J]. 分析化学进展, 2019, 09(01): 47-52. https://doi.org/10.12677/AAC.2019.91007
参考文献
- 1. 潘胜东, 何仟, 陈晓红, 等. 固相萃取–超高效液相色谱–高分辨质谱法快速测定食用油中4种酚类环境雌激素残留[J]. 色谱, 2017, 35(9): 980-986.
- 2. 李炜, 徐德林, 韦素梅. 牛奶及奶制品中雌激素残留和检测的研究[J]. 粮食与食品工业, 2014, 21(4): 117-122.
- 3. 李龙飞, 苏敏, 石晓蕾, 等. 基于溶胶凝胶技术的在线固相萃取与高效液相色谱联用测定饮用水中的雌激素残留[J]. 色谱, 2014, 32(2): 194-197.
- 4. 迂君, 张秀丽, 张玉黔. 高效液相色谱法测定牛奶中雌激素残留量[J]. 中国卫生检验杂志, 2007, 17(6): 1139-1140.
- 5. 卢巧梅. 水产品中多种雌激素残留的质谱分析方法研究[J]. 分析测试技术与仪器, 2016, 22(1): 1-8.
- 6. 严炜, 林金明. 雌激素类内分泌干扰物的液相色谱–质谱分析样品前处理方法[J]. 分析化学, 2010, 38(4): 598-606.
- 7. 李金花, 温莹莹, 陈令新. 分子印迹聚合物固相萃取研究进展[J]. 色谱, 2013, 31(3): 181-184.
- 8. 杜寒春, 王珏, 刘绍刚, 等. 分子印迹固相萃取技术在痕量物质分析中的应用进展[J]. 化工技术与开发, 2018, 47(9): 23-29.
- 9. Song, Y.P., Zhang, L., Wang, G.N., et al. (2017) Dual-Dummy-Template Molecularly Imprinted Polymer Combining Ultra Performance Liquid Chromatography for Determination of Fluoroquinolones and Sulfonamides in Pork and Chicken Muscle. Food Control, 82, 233-242.
https://doi.org/10.1016/j.foodcont.2017.07.002 - 10. 汤凯洁, 罗秋水, 余瑞龙, 等. 分子印迹固相萃取/高效液相色谱法测定猪肝中盐酸克伦特罗的方法研究[J]. 分析测试学报, 2016, 35(1): 115-118.
- 11. Chen, J., Zhang, W.T., Shu, Y., et al. (2017) Detection of Organophosphorus Pesticide Residues in Leaf Lettuce and Cucumber through Molecularly Imprinted Solid-Phase Extraction Coupled to Gas Chromatography. Food Analytical Methods, 10, 1-10.
https://doi.org/10.1007/s12161-017-0875-5 - 12. 马洪超, 李海普, 杨兆光, 等. 环境激素17β-雌二醇分子印迹聚合物的制备及其性能[J]. 中南大学学报(自然科学版), 2014, 45(5): 1403-1410.
- 13. Schwarz, L.J., Danylec, B. and Yang, Y.Z. (2011) Enrichment of (E)-Resveratrol from Peanut by Product with Molecularly Imprinted Polymers. Journal of Agricultural and Food Chemistry, 59, 3539-3543.
https://doi.org/10.1021/jf104230f
NOTES
*通讯作者。
