Advances in Analytical Chemistry
Vol.
11
No.
03
(
2021
), Article ID:
44558
,
12
pages
10.12677/AAC.2021.113015
Au@WP5光电化学传感器的制备及其对牛血红蛋白的分析应用
周琳,卑佳丽,郭旭,陈婷婷,姚勇,王锦*
南通大学化学化工学院,江苏 南通
收稿日期:2021年7月14日;录用日期:2021年7月28日;发布日期:2021年8月16日

摘要
目的:本研究将水溶性柱[5]芳烃(WP5)修饰在金纳米粒子(Au nanoparticles, AuNPs)表面,作为复合材料修饰玻碳电极(GCE),建立了一种检测牛血红蛋白的光电化学传感方法。利用Au NPs在可见光照下的局域表面等离子共振效应,WP5与多巴胺(DA)的主客体络合作用,及这二者的协同作用,检测溶液中的多巴胺。由于多巴胺与牛血红蛋白(BHb)的吸附作用,向DA中依次滴加不同浓度的牛血红蛋白。随着牛血红蛋白的加入,多巴胺产生的电信号会减弱,从而达到对牛血红蛋白的间接性检测。结果表明,在牛血红蛋白的浓度为10−11~10−4 mg/mL浓度范围内,阳极峰电流密度与牛血红蛋白的浓度呈较好的线性关系,检出限为5.2 × 10−12 mg/mL (S/N = 3)。
关键词
金纳米粒子,水溶性柱[5]芳烃,多巴胺,牛血红蛋白,光电化学传感器

Fabrication of Au@WP5 Modified Photoelectrochemical Sensor and Their Application in the Detection of Bovine Hemoglobin
Lin Zhou, Jiali Bei, Xu Guo, Tingting Chen, Yong Yao, Jin Wang*
School of Chemistry and Chemical Engineering, Nantong University, Nantong Jiangsu
Received: Jul. 14th, 2021; accepted: Jul. 28th, 2021; published: Aug. 16th, 2021

ABSTRACT
Purpose: In this study, a water-soluble pillar[5] arenes (WP5) were modified on the surface of gold nanoparticles (Au nanoparticles, Au NPs) as a composite material modified glassy carbon electrode (GCE), and their photoelectrochemical sensor was established for detecting bovine hemoglobin. The enhanced photocurrent signal benefited from the localized surface plasmon resonanc (LSPR) effect of Au, the host-guest complexation between WP5 and DA. With the addition of bovine hemoglobin, the electrical signal produced by dopamine will be weakened, so as to achieve indirect detection of bovine hemoglobin. The PEC immunosensor showed a specifically recognize toward BHb with a wide detection range of 1.0 × 10−11 to 10−4 mg/mL and a detection limit of 5.2 × 10−12 mg/mL (S/N = 3).
Keywords:Gold Nanoparticles, Water-Soluble Pillar[5] Arenes, Dopamine, Bovine Hemoglobin, Photoelectrochemical Sensor

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
血红蛋白(Hb),是人体必需的物质,是红细胞的主要组成部分,能与氧结合,运输氧和二氧化碳,调节血液的酸度 [1]。血红蛋白含量能很好地反映贫血程度。血红蛋白减少会引起各种贫血、大量失血、白血病、钩虫病等 [2] [3] [4]。因此,找到一种合适的检测血红蛋白的理想方法至关重要。
目前,许多方法用于Hb的检测,包括比重法,比色法 [5],荧光光谱法 [6] 和电化学法 [7] [8]。在各种方法中,电化学方法因其高灵敏度,便携性,低成本仪器,快速检测和易于自动化的特点受到研究者的广泛关注 [9]。与电化学方法相比,光电化学检测在检测范围和灵敏度上表现出了更为明显的优势 [10] [11]。但由于大多数蛋白质的分子结构庞大,电活性中心被包埋,且在常规电极上强烈吸附和变性,使其在普通电极上难以得到好的电化学响应。又因为BHb和Hb之间的相似度高达90%,牛血红蛋白(BHb)已被用作Hb的替代蛋白。因此本发明利用多巴胺与牛血红蛋白的吸附作用,进而达到间接检测牛血红蛋白的效果。
金纳米粒子因其特有的物理、化学性能正引起科学界越来越浓厚的兴趣。Au NPs由于尺寸小,比表面积大,表面原子的键态和配位情况与颗粒内部原子有较大差异,从而使其颗粒表面的活性位置大大增加,具备作为催化剂的基本条件 [12]。Au NPs还具有容易合成、易溶于水、良好的生物兼容性、低毒性以及容易进行表面修饰,并且在可见光照射下激发产生局域表面等离子共振效应(LSPR) [13]。由于这些特性,金纳米粒子已成为新型杂化纳米材料的重要组成部分 [14],并且在纳米电子学 [15]、生物医药 [16]、生物传感 [17]、和催化 [18] 中的应用中具有重要意义。然而,由于小尺寸的Au NPs溶液中容易形成不可逆的团聚 [19],严重影响其催化活性,极大地降低了其实际应用价值。
近年来,贵金属纳米掺杂有机材料的制备因其先进的电子、光学和生物性能而引起了人们的极大兴趣 [20] [21]。Au NPs和大环主体的复合,不仅可以有效地解决其稳定性问题,而且大大增强了两组分的性能,包括Au NPs的光学、电子和催化性能以及大环主体的超分子识别能力,扩展了它们在传感器、药物等方面的潜在技术应用。柱[n]芳烃由对苯二酚或其衍生物在其2和5位由亚甲基(-CH2-)桥连接而成 [22] [23]。与冠醚和杯芳烃相比,柱芳烃具有更强的刚性结构;另一方面,与环糊精和葫芦烯相比,柱[n]芳烃更容易改性。作为新兴的大环芳烃宿主家族,柱[n]芳烃以其新颖刚硬的对称柱状结构、疏水性供电子腔、独特而优异的主宾功能和可调功能的边缘等特点 [24] 受到广泛关注。由于这些独特的性质,柱[n]芳烃可用作组装超分子结构和超分子传感平台的构建块。因此,Au NPs和柱[n]芳烃的复合不仅了一种新型的混合纳米材料,而且有望带来新的性能、功能和应用
本课题采用氯金酸为前驱体,柠檬酸和柠檬酸钠作为还原剂,制备金纳米粒子,并采用配体交换法制备Au@WP5复合材料。利用金纳米粒子在可见光照下的局域表面等离子共振效应(LSPR)、水溶性柱 [5] 芳烃(WP5)和多巴胺的主客体络合作用以及二者的协同作用检测溶液中的多巴胺。根据多巴胺与牛血红蛋白的吸附作用,在多巴胺溶液中依次滴加不同浓度的牛血红蛋白,随着牛血红蛋白的加入,多巴胺产生的电化学信号会减弱,从而达到对牛血红蛋白的间接性检测。
2. 实验部分
2.1. 仪器与试剂
CHI660E (上海辰华),S-4700高分辨场发射扫描电镜(日立,日本公司),TecnaiG220透射电子显微镜(美国,FEI)。实验中的工作电极使用三电极体系:实验中的工作电极为玻碳电极(GCE) (直径3 mm) (天津艾达科技发展有限公司),对电极为铂丝(直径0.5 mm) (天津艾达科技发展有限公司),参比电极为饱和甘汞电极(SCE) (天津艾达科技发展有限公司)。
牛血红蛋白(BHb)、牛血清白蛋白(BSA)、卵白蛋白(EA)、溶菌酶(Lyz)和多巴胺(DA)购自上海麦克林生化有限公司,氯化钾(KCl)、铁氰化钾(K3[Fe(CN)6])、三水亚铁氰化钾(K4[Fe(CN)6])、无水柠檬酸(H3Cit),购自阿拉丁化学有限公司。柠檬酸钠(Na3Cit)购自国药化学试剂有限公司,氯金酸(HAuCl4)购自Sigma-Aldrich。所用的所有其他试剂均为分析纯,未经进一步纯化即按原样使用。在整个实验过程中,所有溶液都用均为二次蒸馏水配制。
2.2. Au纳米粒子的制备
采用一锅法,利用柠檬酸还原HAuCl4,制备Au纳米粒子溶液。主要步骤为:取150 mL去离子水,加热至沸腾,向其中加入0.6 mL H3Cit (0.1 M),2.1 mL Na3Cit (0.1 M),搅拌15 min。接着再注入15 mL HAuCl4 (25.4 mM),继续搅拌3 min,混合溶液的颜色从无色逐渐变成了酒红色。将混合溶液放入冰水猝灭,得到酒红色Au NPs水溶液。离心洗涤,最后分散在12.5 mL的去离子水中分散保存,供后续使用。
2.3. WP5的制备
WP5的合成是根据已有文献报道 [25] 合成的,并且经过少许改变(流程图1)。
2.4. Au@WP5的制备
取500 μL的金纳米粒子溶液加入到1.5 mL的去离子水中,加入2.58 mg WP5,超声1 h,制备Au@WP5水溶液。
2.5. Au/GCE电极和Au@WP5/GCE电极的制备
先用0.5 μm氧化铝粉末打磨GCE电极5 min,再用50 nm 氧化铝粉末打磨GCE电极7 min,然后将其分别用乙醇和去离子水各超声15 s。吹去电极表面的液滴,分别吸取10 μL Au和Au@WP5至玻碳电极表面,在50℃红外灯下烘干,制备Au/GCE电极和Au@WP5/GCE电极。
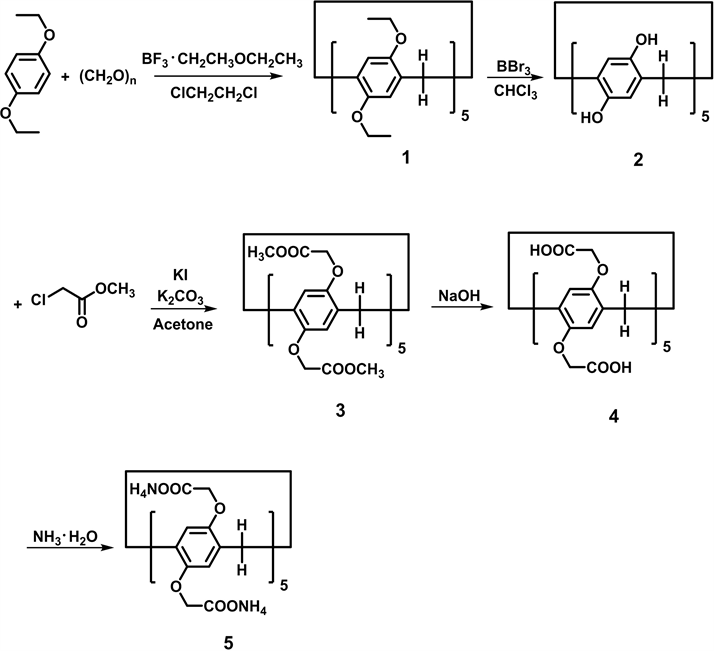
Scheme 1. Synthesis of WP5
流程图1. WP5的制备
3. 结果与讨论
3.1. Au和Au@WP5的形貌和结构表征
采用扫描电镜(SEM)和透射电镜(TEM)表征了Au和Au@WP5的形貌。图1A为Au的扫描电镜图,从图中可以清楚地看到金纳米粒子较为团聚,平均直径为15~17 nm。图1C是Au的高分辨电镜图,从图中我们可以明显地看到Au的晶格,经过计算可以得到其晶格间距为0.234 nm,对应于Au (111)晶面 [9]。图1B和D为Au@WP5的扫描电镜和透射电镜图,从图中可以看出加入WP5后,Au NPs形貌和尺寸没有明显变化,并且Au@WP5较单纯的Au分散性得到明显的提高,这可能是因为WP5负载在AuNPs表面,减少了Au与Au之间的团聚。
通过X射线衍射技术 (XRD) 探究了 Au 的晶体结构。图2A中2θ在37.69˚,44.39˚,65.28˚,75.98˚和80.24˚处的衍射峰分别对应于Au其 (111),(200),(220),(311)和(222)晶面(Au的XRD标准卡片JCPDS no. 89-3697) [26]。还对WP5,Au@WP5进行傅里叶变换红外光谱分析,图2B中可以看出,WP5的所有特征峰均出现在Au@WP5的曲线上,其中在1596 cm−1,1500 cm−1及1402 cm−1处的几个特征峰归属于WP5上苯环区的弯曲振动,在1207 cm−1和1070 cm−1的吸收峰是由于WP5上C-O-C及C-O的拉伸导致的。与纯的WP5相比,在1750 cm−2处,Au@WP5出现了一个新的峰,这归因于Au与WP5复合时,WP5负载在Au的表面,导致其C=O的拉伸 [13]。这也表明了WP5成功负载载在了Au纳米粒子的表面,Au@WP5复合材料被成功制备。
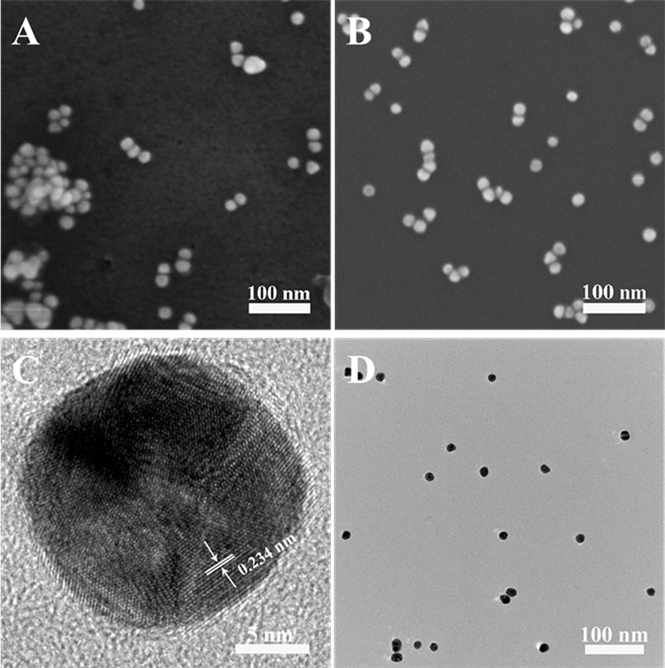
Figure 1. (A) SEM images of Au, (B) SEM images of Au@WP5, (C) HRTEM images of Au and (D) the TEM images of Au@WP5
图1. (A) Au的扫描电镜图,(B) Au@WP5的扫描电镜图,(C) Au的高分辨电镜图,(D) Au@WP5的透射电镜图
利用X射线光电子能谱(XPS)研究了Au@WP5中的化学元素。图2C-F分别为Au 4f、C 1s、N 1s和O 1s的XPS光谱。图3C中Au 4f的XPS图由两部分峰组成,结合能分别是87.53 eV和83.85 eV,对应于Au 4f5/2和4f7/2杂化轨道的峰。如图2D所示,Au@WP5样品中C1s的XPS谱图中位于288.80、286.25、285.40和284.23 eV的结合能处出现不同的峰,分别对应于WP5中O-C=O、C=O、C-O和C-C官能团。图2E描述的是N1s的XPS谱图,在401.43 eV出现的峰归属于WP5中的N-H键。最后,Au@WP5的O 1 s的XPS光谱(图2F)分别在532.60 eV (O-C=O)和531.35 (O-C)处显示两个峰。
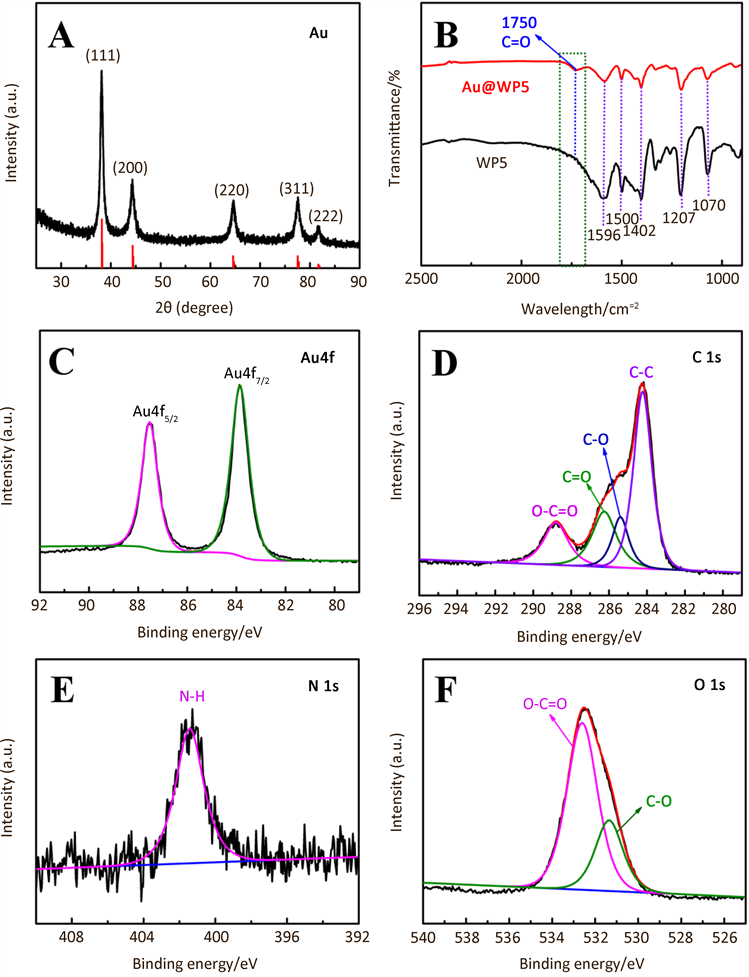
Figure 2. (A) XRD patterns of Au, (B) FTIR spectra of Au@WP5 and WP5, the XPS spectra of Au@WP5 (C) Au 4f, (D) C 1s, (E) N 1s and (F) O1s
图2. (A)Au的X射线衍射图谱,(B) Au@WP5和WP5的傅里叶变换红外光谱图,Au@WP5纳米粒子的(C) Au 4f,(D) C 1s,(E) N 1s和(F) O 1s轨道上X射线光电子能谱分析
3.2. Au和Au@WP5电极的光电化学行为和表征
图3阐述了Au/GCE电极和Au@WP5/GCE纳米复合材料修饰电极在含5 mM K3[Fe(CN)6]/K4[Fe(CN)6] 和0.1 M KCl溶液中的循环伏安曲线。电压范围是−0.2~1.0 V,扫描速度为100 mV s−1。在图3A中,Au电极上的峰电流约为120.14 μA,而Au@WP5电极上的峰电流约为52.42 μA,Au电极上的峰电流高于Au@WP5电极上的峰电流。这主要由于Au纳米粒子具有较好的导电性,可以较快传递电子,而WP5作为有机具有较弱的导电性,减缓了电子在电极表面和电解质溶液之间的传递。采用电化学阻抗谱(EIS)方法检测制备电极上有效电荷的转移,如图3B所示。在由直线和半圆弧组成的阻抗曲线图中,直线代表扩散过程,半圆弧代表电子传递受阻的过程,半圆的直径反映溶液与电极界面电荷转移电阻(Rct)的大小(Rct) [27]。计算得到Au和Au@WP5的Rct分别是255.9 Ω与4822.8 Ω,可以明显看出Au@WP5的电阻要远远大于Au的电阻,表明WP5的导电性比较差,该结果和图3A中结果吻合较好。图 3B 中的插图是相应的等效电路图,Rs是溶液电阻,Rct代表电荷转移电阻,Cd表示双电层溶液。
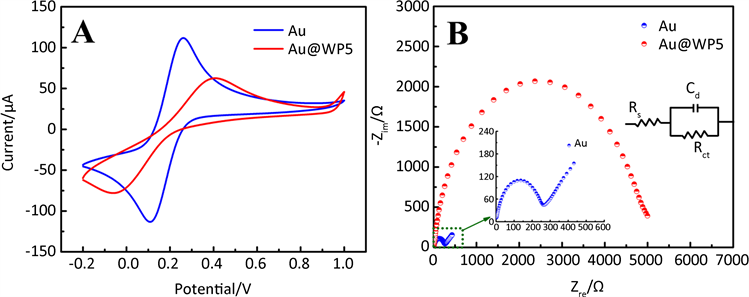
Figure 3. (A) CVs and (B) EIS of Au and Au@WP5 electrodes recorded in 5 mM K3[Fe(CN)6]/K4[Fe(CN)6] containing 0.1 M KCl solution
图3. (A) Au/GCE和Au@WP5/GCE电极在含有5 mM K3[Fe(CN)6]/K4[Fe(CN)6]和0.1 M KCl溶液中的循环伏安曲线,(B) 阻抗曲线
当Au/GCE和Au@WP5/GCE电极在无光照射条件下用差分脉冲伏安法(DPV)检测多巴胺时,我们可以观察到这两个电极上的氧化峰电流密度分别为108.35 μA cm−2 (Au@WP5)和70.49 μA cm−2 (Au) (图4A)。由此可见,WP5和DA的主客体络合作用,将更多的DA分子特异性识别到Au纳米粒子表面。根据以上原因,我们选择了Au@WP5/GCE电极作为最优电极来进行接下来的实验。在有可见光和无光照射下,我们用差分脉冲伏安法(DPV)研究了Au@WP5/GCE电极在含有0.5 mM多巴胺的PBS缓冲液(pH = 7.0)中的光电化学性能。可以发现,在可见光照射下Au@WP5/GCE电极上的氧化峰电流密度141.32 μA∙cm−2明显高于无光照时的氧化峰电流密度81.31 μA∙cm−2。这很可能是由以下两个原因产生的:一方面,在可见光照射下,金纳米粒子对光子能量具有很强的吸收作用,会产生局域表面等离子共振效应;另一方面,Au和WP5复合时,WP5被吸附在Au的表面,同时WP5和多巴胺的主客体络合作用会吸引更多的多巴胺到Au的表面上,促进DA的氧化还原过程。因此Au和WP5二者的协同效应有利于提高光电流密度,增加光电化学活性。
通过建立光电流–时间曲线(图4B)来探究Au/GCE和Au@WP5/GCE电极的光电化学性能。每30 s开、关一次可见光源氙灯来获得可见光照和无光照实验条件。当打开可见光光源后,光电流密度约为0.78 μA∙cm−2,当关闭光源后,光电流密度则会迅速下降。这有可能要归因于在可见光照射下,金纳米粒子对光子能量具有很强的吸收作用,会产生局域表面等离子共振效应;同时Au和WP5复合时,WP5被吸附在Au的表面上,由于WP5和多巴胺的主客体的络合作用,会吸引更多的多巴胺到Au表面上,促使更多的多巴胺分子发生氧化还原反应;在关闭光源后Au的局域表面等离子共振效应消失,导致光电流密度降低。
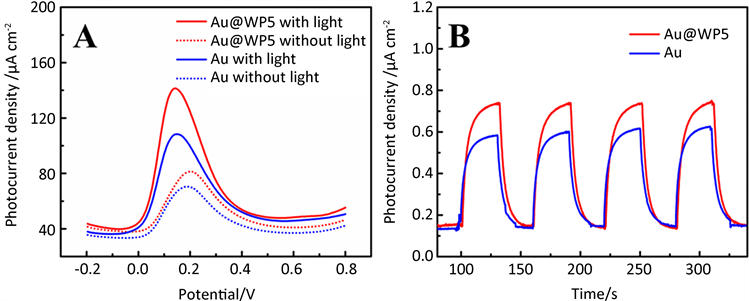
Figure 4. (A) DPVs of Au and Au@WP5 electrode recorded in 0.1 M PBS (pH = 7.0) containing 0.5 mM dopamine under visible light (solid line) and dark (dashed line) environment, (B) Transient photocurrent density versus time plotted for Au and Au@WP5 electrode in 0.1 M PBS containing 0.5 mM dopamine under visible light illumination. The illumination from a Xe lamp was interrupted every 30 s
图4. (A) Au/GCE和Au@WP5/GCE在含有0.5 mM多巴胺的0.1 M PBS缓冲液(pH = 7.0)中在可见光照射(实线)和无光照射(虚线)时的差分脉冲伏安曲线,(B) 可见光照射的瞬态光电流和时间曲线,光源为氙灯,每30 s中断一次
3.3. 检测条件的优化
为进一步探讨多巴胺对Au@WP5/GCE电极的反应动力学因素,我们研究了在不同pH值和扫描速度下对含0.5 mM多巴胺的PBS溶液检测时的光电化学性能的影响。如图5A所示,首先用差分脉冲伏安法研究了在溶液pH介于4.0到9.0范围内,Au@WP5/GCE电极在含有0.5 mM多巴胺的PBS溶液中pH值对相应光电流密度的影响。从图中可以明显地看到,在pH为7.0时多巴胺在Au@WP5/GCE电极上有最大光电流密度(图5B),表明在pH = 7.0时Au@WP5/GCE电极对多巴胺有最好的光电化学活性,因此选择在这个pH值进行后续实验。此外,从图中,我们可以看到,pH值在4.0~9.0之间,氧化峰电势呈负向迁移,这说明反应过程中涉及到了质子转移过程 [28]。图5C描述的是Au@WP5/GCE 电极在含有0.5 mM多巴胺的PBS溶液中(pH = 7.0)不同扫描速率下的线性扫描伏安曲线,扫描速度为40~200 mV∙s−1。氧化峰电流密度随着扫速的增加而增加,并且二者之间存在良好的线性关系,相应的线性方程为:Ipa = 1.8557υ (mV∙s-1) + 196.74 (R2 = 0.9988) (图5D),表明多巴胺和Au@WP5/GCE电极之间的电子转移是表面吸附控制的过程 [29] [30] [31]。
3.4. Au@WP5电极对牛血红蛋白的检测
为了定量研究Au@WP5/GCE电极对牛血红蛋白间接检测的光电化学响应情况,我们探究了在可见光照射下Au@WP5/GCE在含有不同浓度的牛血红蛋白(10−11~10−4 mg∙mL−1)的PBS缓冲溶液(pH = 7.0)的差分脉冲伏安曲线。和循环伏安法相比,差分脉冲伏安法可以降低背景电流和增大法拉第电流,具有较高的灵敏度和较低的检测限。图6A是Au@WP5/GCE电极在含有不同浓度牛血红蛋白的PBS缓冲溶液(pH = 7.0)中的差分脉冲伏安曲线。从图中我们可以观察到氧化峰电位大约是0.10 V,几乎保持不变。氧
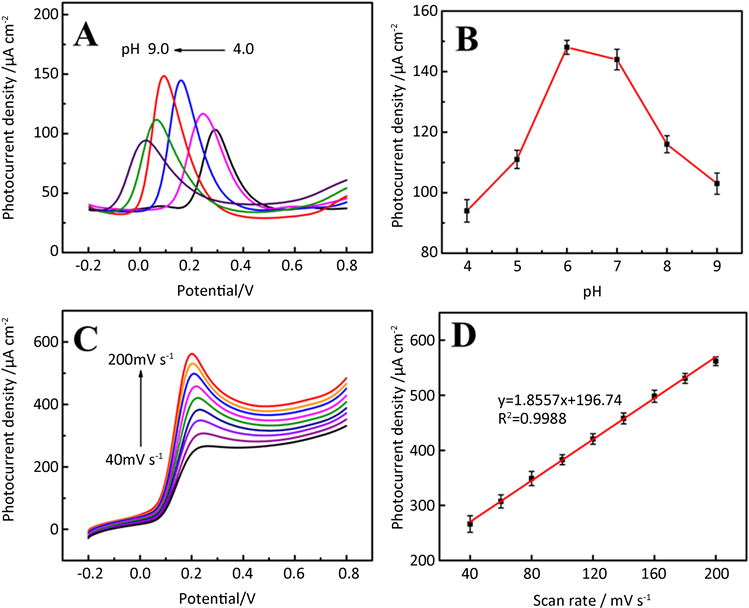
Figure 5. (A) The CVs of the Au@WP5/GCE in 0.1 M PBS solution containing 0.5 mM DA under visible-light illumination at pH ranging from 2.0 to 7.0, (B) the plots of the anodic peak potential against pH, and (C) at scan rates from 40 to 200 mV∙s−1, (D) the plots of anodic and oxidation peak photocurrent densities to the scan rates
图5. (A) Au@WP5/GCE电极在含有0.5 mM多巴胺的0.1 M PBS缓冲液中pH不同(4.0~9.0)时的差分脉冲伏安曲线,(B) 相应的氧化峰电流和pH之间的线性曲线,(C) Au@WP5/GCE电极在含有0.5 mM多巴胺的0.1 M PBS缓冲液中(pH = 7.0)时扫描速率的不同(40~200 mV∙s−1)时的线性扫描伏安曲线,(D) 相应的氧化峰电流和扫速之间的线性曲线
化峰电流随着牛血红蛋白浓度的不断增加(10−11~10−4 mg∙mL−1)而不断减小(图6A)。将不同浓度的牛血红蛋白加入到含有0.5 mM多巴胺溶液(pH = 7.0) 中,图6B为氧化峰电流密度和牛血红蛋白浓度的对数之间的线性关系,相应的线性回归方程为:Ipa = −10.096 lgC + 9.45,R2 = 0.9969。检测限为5.2 × 10−12 mg∙mL−1,信噪比为S/N = 3,说明我们制备的Au@WP5电极在可见光照射下间接性检测牛血红蛋白有很大的应用潜力。
3.5. Au@WP5电极检测多巴胺的稳定性、和抗干扰性
光电材料在实际应用中会遇到各种各样的复杂情况,因此复合材料的长期稳定性和抗干扰性是复合材料在制备过程中需考虑的非常关键的因素。为了评估Au@WP5/GCE电极在可见光照射下检测多巴胺的稳定性,我们测定了Au@WP5/GCE电极在含有0.5 mM多巴胺的0.1 M PBS缓冲液(pH = 7.0)中在可见光照射的瞬态光电流和时间曲线(图7A)。从图7A中我们可以看出,在每一轮可见光照射和无光照射时,在开关循环了10次之后,Au@WP5电极的光电流密度基本保持不变,表明Au@WP5电极有较好的
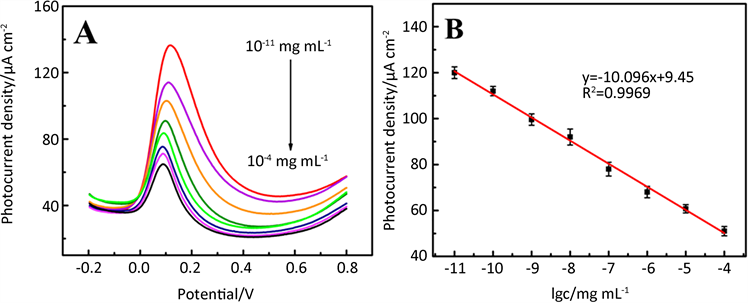
Figure 6. (A) The DPVs of Au@WP5/GCE in 0.5 mM DA (PBS, pH = 7.0) solution containing different concentrations of BHb from10−11 to 10−4 mg∙mL−1 and (B) the plots of the oxidation photocurrent densities versus the concentration of BHb
图6. (A) 在可见光照射下Au@WP5/GCE在含有不同浓度牛血红蛋白(10−11~10−4 mg∙mL−1)的0.5 mM DA溶液中(PBS, pH = 7.0)的差分脉冲伏安曲线,(B) 相应的牛血红蛋白浓度的对数和氧化峰电流密度之间的线性曲线
稳定性。此外,我们还通过差分脉冲伏安法来研究样品中可能存在的干扰物质对多巴胺检测的影响,并通过比较二者的氧化峰电流密度来进行探究Au@WP5/GCE电极的抗干扰性。把10 mM的葡萄糖和0.1 mM尿酸、柠檬酸和氯化钠分别加入0.5 mM多巴胺溶液,比较其电流密度值。此外,我们还通过差分脉冲伏安法检测咖啡酸和干扰物并比较二者的氧化峰电流密度来探究Au@WP5电极的干扰性。把10 mM的葡萄糖和0.1 mM尿酸、柠檬酸和氯化钠分别加入0.5 mM多巴胺溶液,比较其电流密度值。图7B中Ip为Au@WP5/GCE电极在0.5 mM多巴胺溶液中的氧化峰电流密度,Ipa为Au@WP5/GCE电极在0.5 mM多巴胺溶液与各抗干扰物质混合溶液中中的氧化峰电流密度,上述其他实验条件都完全一致。干扰物尿酸、柠檬酸、氯化钠和葡萄糖测得的电流相对值Ipa/Ip值分别为95.84%、90.10%、95.63%和110.29%,均接近100%,证明Au@WP5/GCE电极在多巴胺检测中具有良好的抗干扰性能。
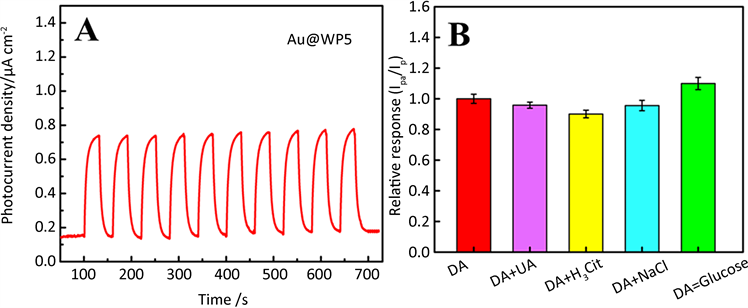
Figure 7. (A) Signal stability of photocurrent intensity of Au@WP5/GCE in PBS (pH =7.0) containing 0.5 mM DA solution, (B) Relative analytical response (Ipa/Ip) for 0.5 mM DA in presence of compounds. The potential interferents are UA, H3Cit, NaCl, and glucose
图7. (A) Au@WP5/GCE电极在含有0.5 mM多巴胺的0.1 M PBS缓冲液(pH = 7.0)中在可见光照射的瞬态光电流和时间曲线,(B) 0.5 mM多巴胺和存在干扰物质时的相对电流值,干扰物质分别为:尿酸、柠檬酸、氯化钠和葡萄糖
4. 结论
综上所述,本文构筑Au@WP5复合材料修饰的新型光电化学传感器,用于牛血红蛋白的超灵敏性的检测。在可见光照射下,Au@WP5/GCE电极间接检测牛血红蛋白时有明显的光电流响应,较宽的检测范围(10−11~10-4 mg∙mL−1)和较低的检测限(5.2 × 10−12 mg∙mL−1)。Au@WP5/GCE电极间接检测牛血红蛋白的优异性能主要归因于Au和WP5这二者的协同效应:一方面,在可见光的照射下,金纳米粒子可以产生局域表面等离子共振效应;另一方面,Au与WP5复合后,WP5负载在Au的表面,同时WP5和多巴胺的主客体络合作用会特异性地识别吸附在Au表面上的多巴胺,促进更多的DA分子发生氧化还原反应。所以,我们期待本文设计的检测灵敏性高、稳定性好的Au和WP5纳米复合材料在光电化学研究中有广阔的应用前景。
基金项目
本项目由国家自然科学基金(批准号:22007052),江苏省自然科学基金(批准号:BK20190917),江苏省高校基金(批准号:19KJB150015)和南通大学博士科研启动基金支持。
文章引用
周 琳,卑佳丽,郭 旭,陈婷婷,姚 勇,王 锦. Au@WP5光电化学传感器的制备及其对牛血红蛋白的分析应用
Fabrication of Au@WP5 Modified Photoelectrochemical Sensor and Their Application in the Detection of Bovine Hemoglobin[J]. 分析化学进展, 2021, 11(03): 132-143. https://doi.org/10.12677/AAC.2021.113015
参考文献
- 1. Scheller, F.W., Bistolas, N., Liu, S.Q., Michael, J., Martin, K. and Ulla, W. (2005) Thirty Years of Haemoglobin Electrochemistry. Advances in Colloid and Interface Science, 116, 111-120.
https://doi.org/10.1016/j.cis.2005.05.006 - 2. Hoban, M.D., Orkin, S.H. and Bauer, D.E. (2016) Genetic Treatment of a Molecular Disorder: Gene Therapy Approaches to Sickle Cell Disease. Blood, 127, 839-848.
https://doi.org/10.1182/blood-2015-09-618587 - 3. Chuang, S.W., Rick, J. and Chou, T.C. (2009) Electrochemical Characterisation of a Conductive Polymer Molecularly Imprinted with an Amadori Compound. Biosensors and Bioelectronics, 24, 3170-3173.
https://doi.org/10.1016/j.bios.2009.02.033 - 4. Gavalas, M.V., Breskin, A., Yuzefpolskaya, M., Eisenberger, A., Castagna, F., Demmer, R.T., et al. (2017) Discriminatory Performance of Positive Urine Hemoglobin for Detection of Significant Hemolysis in Patients with Continuous-Flow Left Ventricular Assist Devices. The Journal of Heart and Lung Transplantation, 36, 59-63.
https://doi.org/10.1016/j.healun.2016.08.026 - 5. Li, R., Jiang, Q., Cheng, H.J., Zhang, G.Q., Zhen, M.M., Chen, D.Q., Ge, J.C., Mao, L.Q., Wang, C. and Shu, C.Y. (2014) G-Quadruplex DNAzymes-Induced Highly Selective and Sensitive Colorimetric Sensing of Free Heme in Rat Brain. Analyst, 139, 1993-1999.
https://doi.org/10.1039/C3AN02025H - 6. Barati, A., Shamsipur, M. and Abdollahi, H. (2015) Hemoglobin Detection Using Carbon Dots as a Fluorescence Prob. Biosensors and Bioelectronics, 71, 470-475.
https://doi.org/10.1016/j.bios.2015.04.073 - 7. Zhou, Y., Dong, H., Liu, L., Hao, Y., Chang, Z. and Xu, M. (2015) Hemoglobin Detection Using Carbon Dots as a Fluorescence Probe. Biosensors and Bioelectronics, 64, 442-475.
- 8. Baghayeri, M., Rouhi, M., Lakouraj, M.M. and Amiri-Aref, M. (2017) Bioelectrocatalysis of Hydrogen Peroxide Based on Immobilized Hemoglobin onto Glassy Carbon Electrode Modified with Magnetic Poly(indole-co-thiophene) Nanocomposite. Journal of Electroanalytical Chemistry, 784, 69-76.
https://doi.org/10.1016/j.jelechem.2016.12.006 - 9. Jiang, J. and Du, X. (2014) Sensitive Electrochemical Sensors for Simultaneous Determination of Ascorbic Acid, Dopamine, and Uric Acid Based on Au@Pd-Reduced Graphene Oxide Nanocomposites. Nanoscale, 6, 11303-11309.
https://doi.org/10.1039/C4NR01774A - 10. Yang, Y.J. and Li, W. (2014) CTAB Functionalized Graphene Oxide/Multiwalled Carbon Nanotube Composite Modified Electrode for the Simultaneous Determination of Ascorbic Acid, Dopamine, Uric Acid and Nitrite. Biosensors and Bioelectronics, 56, 300-306.
https://doi.org/10.1016/j.bios.2014.01.037 - 11. Kang, Q., Wang, X.X., Ma, X.L., Kong, L.Q., Zhang, P. and Shen, D.Z. (2016) Sensitive Detection of Ascorbic Acid and Alkaline Phosphatase Activity by Double-Channel Photoelectrochemical Detection Design Based on g-C3N4/TiO2 Nanotubes Hybrid Film. Sensors and Actuators B: Chemical, 230, 231-241.
https://doi.org/10.1016/j.snb.2016.02.059 - 12. Yao, Y., Xue, M., Chen, J., Zhang, M. and Huang, F.J. (2012) An Amphiphilic Pillararene: Synthesis, Controllable Self-Assembly in Water, and Application in Calcein Release and TNT Adsorption. Journal of the American Chemical Society, 134, 15712-15715.
https://doi.org/10.1021/ja3076617 - 13. Zhao, G.F., Ran, X., Zhou, X., Tan, X., Lei, H., Xie, X.G., Yang, L. and Du, G.B. (2018) Green Synthesis of Hydroxylatopillararene-Modified Gold Nanoparticles and Their Self-Assembly, Sensing, and Catalysis Applications. ACS Sustainable Chemistry & Engineering, 6, 3938-3947.
https://doi.org/10.1021/acssuschemeng.7b04292 - 14. Ofir, Y., Samanta, B. and Rotello, V.M. (2008) Polymer and Biopolymer Mediated Self-Assembly of Gold Nanoparticles. Chemical Society Reviews, 37, 1814-1825.
https://doi.org/10.1039/b712689c - 15. Hassenkam, T., Moth-Poulsen, K. and Stuhr-Hansen, N.L. (2004) Self-Assembly and Conductive Properties of Molecularly Linked Gold Nanowires. Nano Letters, 4, 19-22.
https://doi.org/10.1021/nl034752d - 16. Dreaden, E.C., Alkilany, A.M. and Huang, X.H. (2012) The Golden Age: Gold Nanoparticles for Biomedicine. Chemical Society Reviews, 41, 2740-2779.
https://doi.org/10.1039/C1CS15237H - 17. Siwy, Z., Trofin, L. and Kohli, P. (2005) Protein Biosensors Based on Biofunctionalized Conical Gold Nanotubes. Journal of the American Chemical Society, 127, 5000-5001.
https://doi.org/10.1021/ja043910f - 18. Chen, M.S. and Goodman, D.W. (2008) Catalytically Active Gold on Ordered Titania Supports. Chemical Society Reviews, 37, 1860-1870.
https://doi.org/10.1039/b707318f - 19. Zhang, H., Zhang, W.Y., Gao, X., Man, P.H., Sun, Y., Liu, C.D., Li, Z., Man, B.Y. and Yang, C. (2019) Formation of the AuNPs/GO@MoS2/AuNPs Nanostructures for the SERS Application. Sensors and Actuators B: Chemical, 282, 809-817.
https://doi.org/10.1016/j.snb.2018.10.095 - 20. Li, H., Chen, D.X., Sun, Y.L., Zheng, Y.B., Tan, L.L., Weiss, P.S. and Yang, Y.W. (2013) Viologen-Mediated Assembly of and Sensing with Carboxylatopillararene-Modified Gold Nanoparticles. Journal of the American Chemical Society, 135, 1570-1576.
https://doi.org/10.1021/ja3115168 - 21. Tan, X.P., Zhang, Z, Cao, T.W., Zeng, W.J., Huang, T. and Zhao, G.F. (2019) Control Assembly of Pillararene-Modified Ag Nanoparticles on Covalent Organic Framework Surface for Enhanced Sensing Performance toward Paraquat. ACS Sustainable Chemistry & Engineering, 7, 20051-20059.
https://doi.org/10.1021/acssuschemeng.9b05804 - 22. Ogoshi, T., Kanai, S., Fujinami, S., Yamagishi, T.A. and Nakamoto, Y. (2008) Para-Bridged Symmetrical Pillararenes: Their Lewis Acid Catalyzed Synthesis and Host-Guest Property. Journal of the American Chemical Society, 130, 5022-5523.
https://doi.org/10.1021/ja711260m - 23. Xia, D.Y., Wang, P., Ji, X.F., Khashab, N.M., Sessler, J.L. and Huang, F.H. (2020) Functional Supramolecular Polymeric Networks: The Marriage of Covalent Polymers and Macrocycle-Based Host-Guest Interactions. Chemical Reviews, 120, 6070-6123.
https://doi.org/10.1021/acs.chemrev.9b00839 - 24. Chen, J., Wang, Y., Wang, C.W., Long, R., Chen, T.T. and Yao, Y. (2019) Functionalization of Inorganic Nanomaterials with Pillar[n]arenes. Chemical Communications, 55, 6817-6826.
https://doi.org/10.1039/C9CC03165K - 25. Ogoshi, T., Hashizume, M., Yamagishi, T.-A. and Nakamoto, Y. (2010) Synthesis, Conformational and Host-Guest Properties of Water-Soluble Pillararene. Chemical Communications, 46, 3703-3710.
https://doi.org/10.1039/c0cc00348d - 26. Yao, Y., Xue, M. and Chi, X.D. (2012) A New Water-Soluble Pillararene: Synthesis and Application in the Preparation of Gold Nanoparticles. Chemical Communications, 48, 6505-6507.
https://doi.org/10.1039/c2cc31962d - 27. She, X., Xu, H., Xu, Y., Yan, J., Xia, J. and Xu, L. (2014) Exfoliated Graphene-Like Carbon Nitride in Organic Solvents: Enhanced Photocatalytic Activity and Highly Selective and Sensitive Sensor for the Detection of Trace Amounts of Cu2+. Journal of Materials Chemistry A, 2, 2563-2570.
https://doi.org/10.1039/c3ta13768f - 28. Yang, B., Wang, J., Bin, D., Zhu, M., Yang, P. and Du, Y. (2015) A Three Dimensional Pt Nanodendrite/Graphene/MnO2 Nanoflower Modified Electrode for the Sensitive and Selective Detection of Dopamine. Journal of Materials Chemistry B, 3, 7440-7448.
https://doi.org/10.1039/C5TB01031D - 29. Wang, J., Lu, C., Chen, T.T., Hu, L.P., Du, Y.K., Yao, Y. and Goh, M.C. (2020) Simply Synthesized Nitrogen-Doped Graphene Quantum Dot (NGQD)-Modified Electrode for the Ultrasensitive Photoelectrochemical Detection of Dopamine. Nanophotonics, 9, 3831-3839.
https://doi.org/10.1515/nanoph-2019-0418 - 30. Sharma, S., Joshi, P., Mehtab, S., et al. (2020) Development of Non-Enzymatic Cholesterol Electrochemical Sensor Based Onpolyindole/Tungsten Carbide Nanocomposite. Journal of Analysis and Testing, 4, 13-22.
https://doi.org/10.1007/s41664-020-00117-0 - 31. Chen, M., Ning, Z., Chen, K., et al. (2020) Recent Advances of Electrochemiluminescent System in Bioassay. Journal of Analysis and Testing, 4, 57-75.
https://doi.org/10.1007/s41664-020-00136-x