Advances in Analytical Chemistry
Vol.
13
No.
02
(
2023
), Article ID:
65300
,
6
pages
10.12677/AAC.2023.132017
浅析酸碱滴定终点判断
阮菊香
南方科技大学化学系,广东 深圳
收稿日期:2023年4月11日;录用日期:2023年5月1日;发布日期:2023年5月15日

摘要
滴定实验中,确保滴定实验准确的一个重要因素就是准确的判断滴定终点。然而,对于学生来说,终点判断往往是他们的主要障碍。比如在碱滴定酸的实验中,用酚酞作指示剂,很多同学不能通过颜色的变化准确地指示反应达到终点。为了解决这一困扰,本文设计氢氧化钠(NaOH)分别滴定邻苯二甲酸氢钾(KHP)以及盐酸(HCl)的实验,同时采用pH计及酚酞指示终点。我们通过滴定曲线得到滴定突跃范围,借助实验照片等辅助手段,比对滴定曲线找到滴定终点合适的颜色。
关键词
酸碱滴定,滴定终点,指示剂,酚酞

Determination of End-Point of Acid-Base Titration
Juxiang Ruan
Department of Chemistry, Southern University of Science and Technology, Shenzhen Guangdong
Received: Apr. 11th, 2023; accepted: May 1st, 2023; published: May 15th, 2023

ABSTRACT
In titration experiment, it is an important factor that we could judge the end point of titration accurately to ensure the accuracy of titration experiment. However, to judge the end point of the titration is always a major barrier for students. For example, in the experiment of neutralization of acid with base, phenolphthalein was used as an indicator, but many students could not correctly judge the end point which the titration has reached through the change in color. To solve the problem, we designed an experiment of titrating potassium hydrogen phthalate (KHP) and hydrochloric acid (HCl) with sodium hydroxide (NaOH) in this paper. The end point was indicated by both pH meter and phenolphthalein. The range of titration jump was obtained by the titration curve. By experiment photos and other auxiliary means, we could find the appropriate color at the end point of titration compared with the titration curve.
Keywords:Acid-Base Titration, Titration End Point, Indicator, Phenolphthalein

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
化学常常伴随着一些迷人的感观现象,如冒气泡、结晶体、变颜色等。分析化学中滴定的实验,由于引进终点指示剂,在终点时颜色的突变引起了同学们极大的兴趣,同时也使得很多初学的同学感到极大的迷茫,因为他们拿捏不准滴定终点时颜色的突变。为了解决这类问题,有些高校甚至研发出了判断酸碱滴定终点的APP [1] 。
有很多教师,想从各种角度来解释滴定的误差。邵利民研究了基于电荷平衡式的终点误差通用计算策略 [2] ;乔成立等研究了通过求解滴定方程来计算终点误差的方法 [3] ,苏铁军根据质子平衡原理,推导终点误差体积比定义式,构建了计算酸碱滴定终点误差的通用公式 [4] 。但是所有的误差计算要建立在准确判断滴定终点的基础上,否则误差计算就没有意义。
化学分析中滴定法是常用的一种分析方法,是大学分析化学基础实验中的基本实验操作。其中包括酸碱中和滴定、络合滴定、氧化还原滴定、沉淀滴定。在这些滴定的实验中通常需要借助指示剂指示终点。但是利用指示剂判断终点存在很大的主观性,在实际的课堂上很多同学很难把握好滴定终点。本实验针对酸碱滴定,同时使用了pH计及酚酞指示终点。让学生从理论和感观上来认识滴定终点,比对指示剂和pH计指示终点。同时可以绘制出滴定曲线,学会自己找到最佳的终点颜色和终点pH值。
2. 实验内容
本论文中开展了以下实验,用0.10 mol/L、0.01 mol/L、0.001 mol/L的NaOH分别滴定0.1000 mol/L、0.0100 mol/L、0.0010 mol/L的KHP;以及0.1 mol/L、0.01 mol/L、0.001 mol/L的NaOH分别滴定0.1 mol/L、0.01 mol/L、0.001 mol/L的HCl。实验中同时采用pH计以及酚酞指示终点。
2.1. 实验器材与实验试剂
【实验器材】:电子分析天平(mettler ME204E),pH计(mettler FE-20),滴定管(bomex,通用性),容量瓶(250 mL, bomex),移液管(25 mL, bomex),烧杯(250 mL,蜀牛),滴定台,移液枪(5 mL, eppendorf)。
【实验试剂】:氢氧化钠(NaOH,天津金汇),邻苯二甲酸氢钾(KHP,乐研试剂),盐酸(HCl,衡阳楚杰),酚酞指示剂。
2.2. 实验过程
【NaOH溶液配制】:准确称取1.00 g NaOH固体,配成0.10 mol/L的NaOH溶液250 mL。移取0.10 mol/L的NaOH溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.01 mol/L的NaOH溶液。再移取0.01 mol/L的NaOH溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.001 mol/L的NaOH溶液。
【KHP溶液配制】:准确称取5.10 g KHP固体,配成0.10 mol/L的KHP溶液250 mL。移取0.10 mol/L的KHP溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.01 mol/L的KHP溶液。再移取0.01 mol/L的KHP溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.001 mol/L的KHP溶液。
【HCl溶液配制】:用移液枪准确移取2.08 mL浓盐酸溶液,稀释成0.10 mol/L的HCl溶液250 mL。移取0.10 mol/L的HCl溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.01 mol/L的KHP溶液。再移取0.01 mol/L的HCl溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.001 mol/L的HCl溶液。
【滴定实验】:取一定浓度的NaOH溶液与50.00 mL的滴定管中,用移液管移取相同浓度的KHP溶液或是HCl溶液与100 mL的烧杯中,在烧杯中滴加2~3滴酚酞指示剂,同时插入pH计电极指示终点。观察烧杯颜色,并记录滴定的体积和pH值。
2.3. 实验结果与讨论
2.3.1. 0.1 mol/L NaOH滴定0.1000 mol/L KHP
高浓度的强碱滴弱酸的实验中,我们从滴定曲线来看,滴定终点在pH值为8.80左右;而同时采用的酚酞作指示剂的现象是pH = 8.40时溶液并没有变色(图1(b)),而多加一滴(约0.05 ml),溶液的pH值变为9.27,瞬间变为红色(图1(c))。在这个实验当中时,从pH判断终点来看,稍过量一点,溶液的颜色可以稍浅一点。此时NaOH溶液的浓度比较大,加入一滴NaOH溶液pH的变化比较明显,因此溶液颜色的改变是很明显。因此,在高浓度的强碱滴弱酸实验中,溶液出现浅红色即为终点。
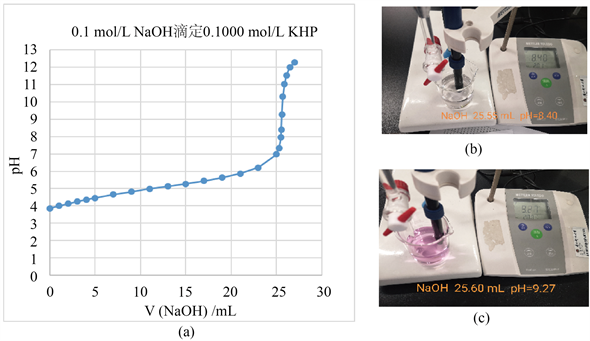
Figure 1. (a) Titration curve for 25.00 mL 0.1000 mol/L KHP versus 0.1 mol/L NaOH; (b) (c) Color change of end point in 25.00 mL 0.1000 mol/L KHP versus 0.1 mol/L NaOH
图1. (a) 0.1 mol/L NaOH滴定25.00 mL 0.1000 mol/L KHP的滴定曲线;(b) (c) 0.1 mol/L NaOH滴定25.00 mL 0.1000 mol/L KHP终点颜色变化
2.3.2. 0.01 mol/L NaOH滴定0.0100 mol/L KHP
低浓度的强碱滴弱酸的实验中,我们从滴定曲线来看(图2(a)),滴定终点在pH 值为8.80左右;而同时采用的酚酞作指示剂的现象是pH = 8.63时溶液并没有变色(图2(b)),溶液的pH值变为8.87,瞬间变为红色(图2(c))。在这个实验当中时,两种指示终点的方法一致,并没有引入太大的误差。该实验得到的结论与第一次实验相同,因此,在溶液刚出现浅红色即为滴定终点。
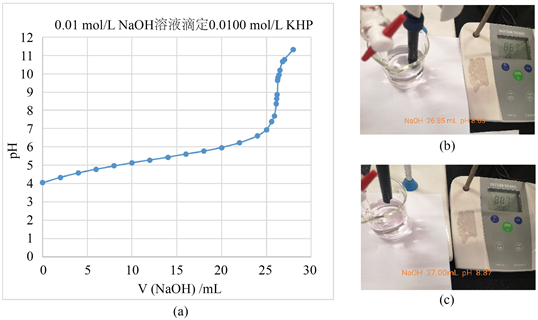
Figure 2. (a) Titration curve for 25.00 mL 0.0100 mol/L KHP versus 0.01 mol/L NaOH; (b) (c) Color change of end point in 25 mL 0.0100 mol/L KHP versus 0.01 mol/L NaOH
图2. (a) 0.01 mol/L NaOH滴定25.00 mL 0.0100 mol/L KHP的滴定曲线;(b) (c) 0.01 mol/L NaOH滴定25.00 mL 0.0100 mol/L KHP终点颜色变化
2.3.3. 0.001 mol/L NaOH滴定0.0010 mol/L KHP
本实验由于浓度太低,在滴定曲线上的滴定突跃不如高浓度滴定的明显(图3(a))。通过pH计来判断终点,有点困难。溶液pH为8.44时,开始出现微红色(图3(b));继续滴加1.00 mL NaOH溶液的颜色稍微一点(图3(c));再继续滴加0.50 mL溶液的颜色又稍深一点(图3(d))。所以低浓度的溶液滴定时,酚酞指示终点可会更好一些,终点的现象则是刚出现红色。通过滴加半滴或是一滴来增加溶液的颜色判断终点,可能会带来较大的误差。

Figure 3. (a) Titration curve for 25.00 mL 0.0010 mol/L KHP versus 0.001 mol/L NaOH; (b)~(d) Color change of end point in 25 mL 0.0010 mol/L KHP versus 0.001 mol/L NaOH
图3. (a) 0.001 mol/L NaOH滴定25.00 mL 0.0010 mol/L KHP的滴定曲线;(b)~(d) 0.001 mol/L NaOH滴定25.00 mL 0.0010 mol/L KHP终点颜色变化
2.3.4. 0.1 mol/L NaOH滴定0.1 mol/L HCl
用0.1 mol/L NaOH滴定0.1 mol/L HCl时(图4(a)),用pH和酚酞两种方法指示终点。由于滴定终点时pH = 7.00,而酚酞的理论变色范围为8.20~10.0,这样带进来的误差就会比较大。滴定至pH = 7.00时,溶液颜色无变化;靠1滴(0.04 mL)时,溶液的pH = 9.17,溶液的颜色瞬间变为紫红色。由于溶液的浓度较大,引入的误差会较大。因此在这样一个实验当中,建议直接用pH计判定终点更加合理。当用0.01 mol/L NaOH滴定 0.01 mol/L HCl时(图4(b)),滴定的现象与上述相同。
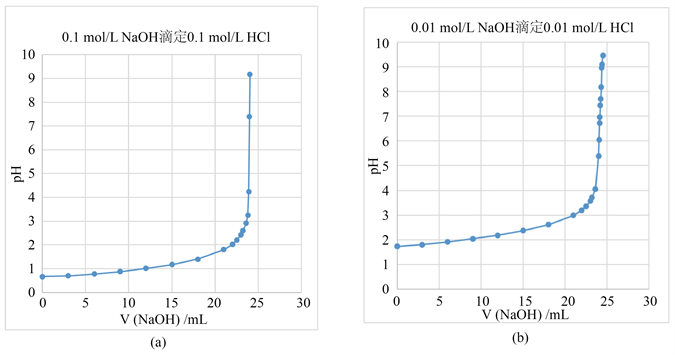
Figure 4. (a) Titration curve for 25.00 mL 0.1 mol/L HCl versus 0.1 mol/L NaOH; (b) Titration curve for 25.00 mL 0.01 mol/L HCl versus 0.01 mol/L NaOH
图4. (a) 0.1 mol/L NaOH滴定25.00 mL 0.1 mol/L HCl的滴定曲线;(b) 0.01 mol/L NaOH滴定25.00 mL 0.01 mol/L HCl的滴定曲线

Figure 5. (a) Titration curve for 25.00 mL 0.001 mol/L HCl versus 0.001 mol/L NaOH; (b)~(d) Color change of end point in 25 mL 0.001mol/L HCl versus 0.001 mol/L NaOH
图5. (a) 0.001 mol/L NaOH滴定25.00 mL 0.001 mol/L HCl的滴定曲线;(b)~(d) 0.001 mol/L NaOH滴定25.00 mL 0.001 mol/L HCl的终点颜色变化
2.3.5. 0.001 mol/L NaOH滴定0.001 mol/L HCl
0.001 mol/L NaOH滴定0.001 mol/L HCl过程中(图5(a)),建议用pH指示终点,结果会更加准确。在这次的滴定中,pH = 8.24时(图5(b)),溶液出现微红且30 s不褪色;继续滴加1.00 mL NaOH,溶液pH = 8.40时,溶液出现浅红(图5(c));再继续滴加1.00 mL NaOH,溶液pH = 8.67时(图5(d)),溶液浅红加深一点。从滴定曲线我们可以看出,滴定终点就是pH = 7.00左右。所以强碱滴强酸pH计指示终点更加适合。指示剂指示终点,出现红色即可。
3. 结论
强碱滴弱酸时,采用酚酞或是pH计指示终点都可以。值的注意的是,不管是高浓度的还是低浓度的,酚酞作指示剂的时候,刚出现微红且30 s不褪色时即为指示终点。通过滴加半滴或是一滴来增加溶液的颜色判断终点,这样会带来较大的误差。强碱滴定强酸时,为减少误差,最好采用pH计指示终点。浓度从0.1 mol/L到0.001 mol/L,滴定突跃都比较明显。本文中,低浓度的强碱滴定低浓度的强酸,用酚酞作指示剂时,误差相对高浓度的滴定较小。但是滴定终点时,也是刚出现微红即可,继续滴加滴定剂终点颜色变化不是很明显。
文章引用
阮菊香菊香. 浅析酸碱滴定终点判断
Determination of End-Point of Acid-Base Titration[J]. 分析化学进展, 2023, 13(02): 143-148. https://doi.org/10.12677/AAC.2023.132017
参考文献
- 1. Rathod, B.B., Murthy, S. and Bandyopadhyay, S. (2019) Is This Solution Pink Enough? A Smartphone Tutor to Resolve the Eternal Question in Phenolphthalein-Based Titration. Journal of Chemical Education, 96, 486-494.
https://doi.org/10.1021/acs.jchemed.8b00708 - 2. 邵利民. 分析化学[M]. 北京: 科学出版社, 2016.
- 3. 乔成立, 陈世界, 李英杰. 用林邦的副反应思想处理滴定分析[J]. 化学教育(中英文), 2017, 38 (18): 18-21.
- 4. 苏铁军. 精确计算酸碱滴定终点误差的通用公式化[J]. 化学教育(中英文), 2020, 41(6): 17-21.