Bioprocess
Vol.
12
No.
02
(
2022
), Article ID:
52383
,
7
pages
10.12677/BP.2022.122011
孔雀粪样宏基因组DNA提取方法的优化
陶芬,姜玉莎,廖琦,徐扩卫,苗睿,赵浪,孙嘉良,邵博,吴培福*
西南林业大学,生命科学学院,云南 昆明
收稿日期:2022年4月27日;录用日期:2022年6月5日;发布日期:2022年6月14日

摘要
目的:本研究旨在优化孔雀粪样中菌群基因组DNA的提取方法,以便为后续的研究奠定基础。方法:从野生动物园和圆通山动物园采集孔雀粪样,基于粪样用量、杂质去除方法和消化酶的添加等角度优化了孔雀粪样宏基因组DNA的提取方法,并通过16S rDNA基因和ERIC的PCR扩增验证了纯化DNA的效果。结果:采用0.5 g孔雀粪样、利用丙酮和乙醇交替漂洗样品及消化液中添加CTAB是提取孔雀肠道宏基因组DNA的优化关键点,通过该方法提取的DNA可用于后续的PCR扩增。结论:根据优化的方法可有效地提取孔雀粪样中的基因组DNA,研究结果为孔雀肠道菌群的研究奠定了基础。
关键词
孔雀,粪样,菌群,基因组DNA,提取

Optimization of Extraction Method of Metagenomic DNA from Pavo Fecal Samples
Fen Tao, Yusha Jiang, Qi Liao, Kuowei Xu, Rui Miao, Lang Zhao, Jialiang Sun, Bo Shao, Peifu Wu*
College of Life Sciences, Southwest Forestry University, Kunming Yunnan
Received: Apr. 27th, 2022; accepted: Jun. 5th, 2022; published: Jun. 14th, 2022

ABSTRACT
Objective: The aim of this study is to optimize the extraction method of genomic DNA of microbiota from peacock feces, so as to lay a foundation for follow-up researches. Methods: The dung samples from Pavo were collected from the Wildlife Park and Yuantongshan Zoo in Yunnan province. The extraction method of metagenomic DNA from peacock dung samples was optimized based on the sampling amount of dung, the methods of impurity removal and the addition situation of digestive enzymes, et al. The effect of DNA purification was verified by PCR amplification of 16S rDNA gene and ERIC. Results: The key points for the optimization of extracting metagenomic DNA from peacock gut were using 0.5 g peacock fecal sample, rinsing the sample alternately with acetone and ethanol and adding CTAB to the digestive fluid. The DNA extracted by this method could be used for subsequent PCR amplification. Conclusion: The genomic DNA could be effectively extracted from peacock feces using the optimized method in this study, and the results would have laid a foundation for the research of peacock intestinal microbiota.
Keywords:Pavo, Fecal Sample, Microbiota, Genomic DNA, Extraction

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
动物粪便来自于动物对机体消化残留物的排泄,其中含有大量的肠道微生物和宿主细胞,亦即动物粪便中含有大量蕴含肠道微生物组和宿主自身的DNA信息。鉴于此,动物粪便不断受到了国内外学者的广泛关注,并进行了系列相关研究:利用野生动物粪便中的宿主DNA进行动物遗传多样性、种群社会结构、种群数量等方面的研究 [1] [2] [3] [4];利用动物粪便分离培养具有生物工程价值的微生物 [5];从动物粪便中分离培养潜在致病菌,进而分析分离株与动物疾病间的联系性 [6];基于宏基因组学技术,研究动物粪便中菌群的组成和结构特征,进而反映动物采食习性、地理分布、生产性能和动物疾病等与肠道菌群间的相关性 [3] [4];通过动物粪便研究动物机体发育与肠道菌群间的联系,如肠道菌群与免疫系统、胃肠道和神经系统等相应器官发育间的联系;基于动物粪便研究细菌耐药性的产生和传播等 [7]。
在动物粪便的研究过程中涉及的一个核心点是有效地提取粪样中的DNA,这直接决定了后续研究的成败和研究结果的准确性。研究表明,动物种类和采食习性不同时,提取其粪便DNA的难易程度也会存在明显的差异。当前,基于动物粪样宏基因组DNA的研究中主要涉及的宿主来源有人 [7]、猪 [8] [9]、鸡 [10]、牛 [11]、鸭和犬 [12] 等动物,在野生动物中涉及的宿主有熊猫 [13]、梅花鹿 [14]、马鹿 [15]、黑麂 [16]、林麝 [17] 和候鸟 [18] 等。蓝孔雀是我国国家一级保护动物,种群数量少,但对其肠道微生物组的研究鲜有报道,故本研究从动物园采集孔雀的粪样,尝试从采集样品中提取菌群DNA,以期为后续的相应研究奠定基础。
2. 材料与方法
2.1. 材料与试剂
2.1.1. 粪样采集
孔雀粪样采集于云南省野生动物园和圆通山动物园,其中,从云南省野生动物园采集了120份粪样,从圆通山动物园采集了19份粪样。样品采集于2021年8月,采集样品时遵循了以下注意事项:1) 采集新鲜、无明显污染的粪样;2) 无菌采集,采集高压灭菌的50 mL离心管来收集样品;3) 原则上采集不同个体的粪样,但动物园孔雀以散养模式为主,无法做到粪样与个体间的对应,故采用分散样地采样法,即在孔雀活动的不同区域采样,在一定程度上可避免同一个体的重复采样;4) 采集成形的独立粪样,不采集已混合的粪样,一个粪样一个离心管;5) 样品采集后即时送回实验室,−20℃保存备用。
2.1.2. 主要试剂
消化液I (20 mmol/L Tris-HCl、5 mmol/L EDTA);消化液II (20 mg/mL CTAB, 81.82 mg/mL NaCl, 100 mmol/L Tris-HCl, 10 mmol/L EDTA);溶菌酶(北京百泰克生物技术有限公司);10%十二烷基磺酸钠;丙酮和无水乙醇。
2.2. 样品预处理
在每份样品中,剔除表面可能被污染的部分,称取2 g粪样,置于50 mL无菌离心管内,做如下处理:1) 加入20 mL灭菌的PBS缓冲液,充分混匀,300 rpm/min离心3 min,将液相转入另一无菌的50 mL离心管内;2) 将沉淀物如前述重复处理,合并两次液相;3) 将收集液9000 rpm/min离心8 min,弃去液体,收集沉淀;4) 向沉淀中加入1 mL无水乙醇,充分混匀,6000 rpm/min离心5 min,弃去液体,收集沉淀;5) 向沉淀中加入1 mL丙酮,充分混匀,洗涤1 min,6000 rpm/min离心5 min,弃去液体,收集沉淀;6) 重复步骤(4)和(5)至洗涤液透明;7) 用PBS漂洗沉淀2次,加入5 mL无水乙醇,充分混匀,按1 mL混悬液分装于2 mL离心管内,置于−80℃保存。
2.3. 菌群基因组DNA的提取
参考以往报道的提取方法,并在这些方法的基础上进行了改进。简而言之,提取方法如下:1) 重悬保存样品,6000 rpm/min离心5 min,沉淀菌体,用PBS漂洗2次;2) 用8倍稀释的消化液II (200 μL)漂洗沉淀;3) 用PBS再次漂洗;4) 加入180 μL TE缓冲液、40 μL溶菌酶和20 μL蛋白酶K (20 mg/mL),充分混匀,37℃水浴30 min,而后55℃水浴振荡消化2 h;5) 加入300 μL消化液I和70 μL 10% SDS,充分混匀,于55℃水浴30 min;6) 12,000 rpm/min离心5 min,收集上清,移入干净的1.5 mL离心管内;7) 用酚氯仿法纯化DNA。260 nm和280 nm波长下测定提取DNA的吸光值,根据OD260/OD280比值分析DNA的纯度。
在基因组DNA提取过程中,本研究从以下几个方面进行了优化改进:1) 分别采用0.1 g、0.25 g、0.5 g、1 g、2 g、3 g和4 g粪样来提取DNA;2) 6层纱布过滤去除粪样大杂质,或采用差速离心法去除杂质;3) 去除可溶性杂质方面,分别采用PBS多次漂洗、乙醇多次漂洗、乙醇和丙酮交替漂洗来去除杂质;4) 消化液中含CTAB或不含CTAB;5) 添加溶菌酶或不添加溶菌酶;6) 70 μL、80 μL、90 μL和100 μL 10% SDS的添加量。
2.4. 提取DNA的PCR扩增
为了验证提取的DNA能否用于PCR扩增,本研究采用两对引物,分别对16S rDNA基因和肠杆菌基因间重复一致序列(ERIC)进行了扩增。
2.4.1. 微生物组16S rDNA基因扩增
采用27F和1492R引物来扩增微生物组16S rDNA基因。扩增体系为:上下游引物(10 µmol/L)各1 µL;Taq酶1 µL;10× Taq Buffer 2.5 µL;dNTP Mixture (2.5 mM) 2 µL;模板2 µL;牛血清白蛋白(BSA) 0.1 µL;ddH2O为15.4 µL。扩增反应程序为:94℃ 5 min;30个循环程序(94℃ 30 s,55℃ 1 min,72℃延伸1 min);72℃总延伸6 min。
2.4.2. ERIC扩增
采用引物R1(5'-ATGTAAGCTCCTGGGGATTCAC-3')和R2(5'-AAGTAAGTGACTGG GGTGAGCG-3')进行ERIC-PCR扩增,扩增体系同上,反应程序为:94℃ 5min;35个循环程序(94℃ 30 s,40℃ 1 min,72℃延伸1 min);72℃总延伸6 min。
2.4.3. 扩增产物的检测
配置1%的琼脂糖凝胶,吸取5 µL PCR产物,加入凝胶孔内,在120 V在电泳仪上电泳检测PCR产物。
2.5. 数据分析和作图
采用R语言vcd包进行相应的统计和作图。
3. 结果
3.1. 菌群基因组DNA的提取
基于改进的方法,本研究成功地提取了孔雀肠道菌群的宏基因组DNA (图1(a))。经凝胶电泳,观察到提取DNA的大小约为24 kb左右。
提取宏基因组DNA时,粪样的采用量对DNA提取效果具有明显的影响:当粪样量为0.1 g时,本研究未观察到明显的电泳条带;当粪样量为0.25 g时,提取DNA的条带很弱或有时观察不到条带,DNA的提取效果不稳定;当粪样量为0.5 g、1 g和2 g时,均能观察到明显的DNA条带,但随着样品量的增加,在DNA迁移的琼脂上逐步出现明显的杂质干扰现象,即在DNA条带附近出现拖尾现象,且样品量为2 g时纯化的DNA液带有颜色;当粪样量在3 g和4 g时,杂质干扰现象进一步增加,甚至影响DNA的提取效果。
在去除大杂质方面,6层纱布过滤与差速离心具有同等效应,两者间无明显的差别。
在去除可溶性杂质方面,PBS多次漂洗、乙醇多次漂洗、乙醇和丙酮交替漂洗对DNA提取效果也具有明显的影响:采用PBS多次漂洗后,尽管漂洗液呈透明无色,但纯化的DNA液携带明显的颜色;乙醇多次漂洗后,虽然纯化DNA液的颜色变淡,但电泳时仍有较明显的杂质干扰现象;乙醇和丙酮交替漂洗后,纯化DNA液的颜色明显变淡,电泳后的杂质干扰现象明显减少。
CTAB的添加与否会影响纯化DNA液中可溶性杂质的含量:当使用含CTAB的消化液II时,纯化DNA液的颜色呈透明色,电泳后的杂质干扰现象明显减少;不使用CTAB时,情况刚好相反。
溶菌酶的添加与否会影响纯化DNA的得率:用溶菌酶消化后,可观察到明显的基因组DNA条带;不使用溶菌酶时,DNA的得率下降。
增加10% SDS的添加量会明显干扰DNA的提取过程:除70 μL外,其它添加量的SDS均可致消化液中析出白色絮状化合物,但向消化液中添加NaCl,可使絮状化合物逐步溶解。
基于上述结果的对比和分析,本研究最终建立了上述方法中所述的孔雀粪样宏基因组DNA提取方法。
3.2. 微生物组16S rDNA基因的扩增
利用通用引物27F和1492R,从提取的DNA中扩增微生物组16S rDNA基因,本研究成功扩增了16S rDNA基因,条带大小与预期的大小一致,为1400 bp左右(图1(c))。
3.3. ERIC-PCR扩增
利用R1和R2引物从宏基因组DNA中扩增出了不同大小的条带,条带大小类型有250 bp、400 bp、550 bp、800 bp、1000 bp、1200 bp、1500 bp、1750 bp、2000 bp、2800 bp和3000 bp (图1(b))。整体而言,400 bp和550 bp条带是扩增的优势条带,分别占总样品数的95.68%和55.40%,其次为800 bp、1000 bp和1200 bp,分别占总样品数的7.19%、17.99%和8.63%。野生动物园和圆通山动物园的样品具有不同的ERIC扩增特征(图2(a)),但在热点聚类中两者未形成明显的单独聚类。野生动物园样品与圆通山动物园相比,圆通山动物园样品中550 bp、1000 bp和1750 bp的扩增率明显高于野生动物园(圆通山动物园样品中分别为89.47%、47.37%和15.79%;野生动物园样品分别为50%、13.33%和0%),其它条带未见明显的差异(图2(b)和图2(c),图中横坐标的标注从左到右分别为250 bp、400 bp、550 bp、800 bp、1000 bp、1200 bp、1500 bp、1750 bp、2000 bp、2800 bp和3000 bp)。

Figure 1. The electrophoretic diagrams of DNAs extracted or the products obtained from PCR amplification in this study. (a) showed the electrophoretic bands of genomic DNA isolated from partial fecal samples; (b) indicated the electrophoretic bands of ERIC-PCR products of some samples; (c) showed the electrophoretic bands of the amplified product of 16S rDNA genes
图1. 本研究中DNA提取或PCR扩增产物电泳图。(a)为部分粪样菌群基因组DNA的电泳图;(b)为部分样品ERIC-PCR产物的电泳图;(c)为16S rDNA基因扩增产物的电泳图
从单一样品中的扩增条带总数来看,扩增条带数的范围为1~4条(图2(d)和图2(e))。野生动物园中条带数1、2、3和4分别占该来源样品总数的36.67%、32.50%、23.33%和3.33%,但圆通山动物园中未发现有4条扩增带的样品,而条带数1、2和3分别占该来源样品总数的5.26%、31.58%和63.16%。
4. 讨论
肠道菌群含有大量的生物学信息,作为人和动物的“新型器官”,在人和动物的生长发育、动物生产形状、疾病发生等方面具有非常重要的意义 [5] [6]。大量研究已表明动物肠道是重要的耐药基因库,不仅含有临床上重要的耐药基因,还包括临床上不常见的或新的耐药基因。对孔雀粪样菌群进行研究有以下几方面的理论和现实意义:1) 虽然国内外对人和动物的肠道菌群进行了大量研究,但动物方面的研究主要集中于家养动物(如,猪、鸡、牛和羊等),在孔雀方面的研究报道很少,故对孔雀肠道宏基因组DNA提取方法的优化,可为其它动物粪样DNA提取的研究奠定基础;2) 蓝孔雀是我国国家一级保护动物,种群数量少,采用非损伤的采样方式提取粪样基因组,可为孔雀遗传多样性、种群社会关系和种群数量等的研究奠定基础,进而为孔雀的保护措施的提出奠定理论基础;3) 孔雀与人间有较高的直接或间接接触的几率,易造成耐药性或致病菌的水平传播,本研究可为耐药性或致病菌传播的研究奠定基础。
粪样菌群宏基因组DNA提取效果受多种因素的影响,如动物的种类、粪样采集方法、粪样保存方法、粪样保存时间等。当前报道的粪样保存方法包括:低温保存、福尔马林保存、硅珠保存、DETs (DMSO/EDTA/Tris盐溶液)保存、干燥保存和乙醇保存等 [19]。不同的保存方法有其相应的优缺点和适应范围,如远距离在野外采集大批量样品时,难以做到低温保存,那么福尔马林、DETs和乙醇等液体保存方法具有操作便利和便于携带等优点;在实验室长时间保存可用−80℃低温保存或加保护剂低温保存的方法。本研究采用添加无水乙醇后低温保存的方法,在3个月的保存期中没有发现DNA降解现象。
动物粪便中所含杂质的种类可能随动物种类的不同而存在差异,主要取决于动物的生活环境、饮食行为、健康状态等。动物粪便中不仅含有源自动物宿主自身的体细胞,而且含有肠道微生物、食物残渣、胃肠道分泌的各种酶、胆碱、胆红素、黏多糖类物质、脲、腐殖酸、食源性植物的多糖、多酚、萜类等物质,其中,酶、胆碱、胆红素、多糖、多酚和萜类等物质均易致使DNA发生降解,影响肠道菌群DNA提取的产量和质量,进而影响后期的PCR扩增 [20]。理想情况下,提取肠道菌群DNA,首先要去除肠道内容物中的各种杂质,但在实际操作中只能尽可能地减少杂质的干扰。本研究基于差速离心、丙酮和
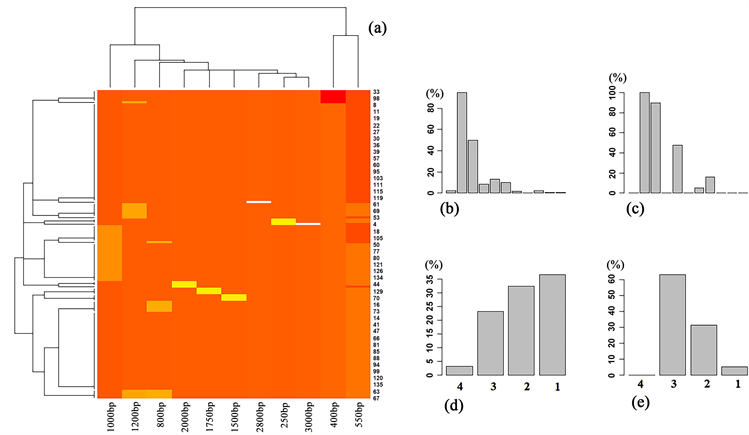
Figure 2. The distribution patterns of the bands of ERIC-PCR amplification bands. (a) showed the hotspot features of different types of amplification bands; (b) and (c) indicated the amplification rates of bands of different sizes; (d) and (e) showed the percentage of amplified bands in a single sample to the total number of source samples
图2. ERIC-PCR扩增条带的分布特征。(a)为不同类型条带扩增结果的热点图;(b)和(c)为不同大小条带的扩增率;(d)和(e)为单一样品中扩增条带数占来源样品总数的百分比
乙醇交替漂洗和PBS漂洗的方法,能够明显地减少粪样组织中的可溶性和不可溶性杂质成份,为成功提取宏基因组DNA做了铺垫。CTAB可与蛋白质和大多数的多糖结合形成复合物,有助于DNA与多糖分开。在后续的酚氯仿纯化过程中,还可去除一定量的蛋白质、多糖和糖脂等干扰杂质。总而言之,通过本研究所采取的方法可有效地提取孔雀粪样中的宏基因组DNA,提取的DNA可用于后续的PCR扩增分析,这点通过16S rDNA基因和ERIC的扩增得到了验证。此外,还可以用纯化柱来替代酚氯仿纯化步骤,这样可更加有效地去除粪样杂质的干扰。
ERIC-PCR主要针对肠杆菌基因间重复一致序列,常用于流行菌株间的区分和致病菌的流行病学调查,用于粪样宏基因组DNA时,可有助于区分不同个体肠道菌群组成间的差异。从本研究可以看出,野生动物园和圆通山动物园的孔雀在肠道菌群的结构上有非常高的相似性,但也存在一定的个体间差异。
基金项目
西南林业大学大学生创新训练计划项目(202010677092);云南省教育厅科学研究基金项目(2022J0505)。
文章引用
陶 芬,姜玉莎,廖 琦,徐扩卫,苗 睿,赵 浪,孙 嘉良,邵 博,吴培福. 孔雀粪样宏基因组DNA提取方法的优化
Optimization of Extraction Method of Metagenomic DNA from Pavo Fecal Samples[J]. 生物过程, 2022, 12(02): 99-105. https://doi.org/10.12677/BP.2022.122011
参考文献
- 1. 周芸芸, 冯金朝, 朵海瑞, 杨海龙, 李娟, 李迪强, 等. 基于粪便DNA的青藏高原雪豹种群调查和遗传多样性分析[J]. 兽类学报, 2014, 34(2): 138-148.
- 2. 盛桂莲, 吴恋娟, 高照民, 白磊, 侯新东, 赖旭龙. 湖北石首麋鹿粪便DNA的提取及系统发育分析[J]. 华中师范大学学报(自然科学版), 2009, 43(3): 468-473.
- 3. 秦啼, 王东权, 曲宁新, 刘帅齐, 李波, 柴洪亮. 基于粪便DNA技术的鸟类物种鉴定体系研究[J]. 野生动物学报, 2020, 41(1): 145-151.
- 4. 任鹏, 龚堃, 鲍毅新, 黄相相, 周晓, 韩金巧. 基于粪便DNA的小麂亲权鉴定和婚配制研究[J]. 生态学报, 2017, 37(20): 6933-6944.
- 5. 单磊, 胡义波, 魏辅文. 粪便DNA分析技术在分子生态学研究中的机遇与挑战[J]. 兽类学报, 2018, 38(3): 235-246.
- 6. 张子敬, 朱肖亭, 吕世杰, 金磊, 徐嘉威, 黄永震, 等. 腹泻犊牛与健康犊牛粪便菌群结构组成与功能研究[J]. 中国畜牧兽医, 2020, 47(9): 2779-2788.
- 7. Hu, Y., Yang, X., Qin J., Lu, N., Cheng, G., Wu, N., et al. (2014) Metagenome-Wide Analysis of Antibiotic Resistance Genes in a Large Cohort of Human Gut Microbiota. Nature Communications, 4, Article No. 2151. https://doi.org/10.1038/ncomms3151
- 8. Bich, V., Le, V.T., Thai, P.D., Van Phuong, T.T., Oomen, M., Driessen, C., et al. (2019) An Exploration of the Gut and Environmental Resistome in a Community in Northern Vietnam in Rela-tion to Antibiotic Use. Antimicrobial Resistance and Infection Control, 8, Article No. 194. https://doi.org/10.1186/s13756-019-0645-9
- 9. Mencía-Ares, O., Cabrera-Rubio, R., Cobo-Díaz J.F., Álva-rez-Ordóñez, A., Gómez-García, M., Puente, H., et al. (2020) Antimicrobial Use and Production System Shape the Fecal, Environmental, and Slurry Resistomes of Pig Farms. Microbiome, 8, Article No. 164. https://doi.org/10.1186/s40168-020-00941-7
- 10. Torok, V.A., Hughes, R.J., Mikkelsen, L.L., Perez-Maldonado, R., Balding, K., MacAlpine, R., et al. (2011) Identification and Characterization of Potential Performance-Related Gut Microbiotas in Broiler Chickens across Various Feeding Trials. Applied & Environmental Microbiology, 77, 5868-5878. https://doi.org/10.1128/AEM.00165-11
- 11. Ozutsumi, Y., Hayashi, H., Sakamoto, M., Itabashi, H. and Benno, Y. (2005) Culture-Independent Analysis of Fecal Microbiota in Cattle. Bioscience Biotechnology & Biochemistry, 69, 1793-1797. https://doi.org/10.1271/bbb.69.1793
- 12. Mondo, E., Marliani, G., Accorsi, P.A., Cocchi, M. and Di Leone, A. (2019) Role of Gut Microbiota in Dog and Cat’s Health and Diseases. Open Veterinary Journal, 9, 253-258. https://doi.org/10.4314/ovj.v9i3.10
- 13. 王燚, 何廷美, 钟志军, 王承东, 何永果, 程安春, 等. 不同季节亚成体大熊猫肠道菌群ERIC-PCR指纹图谱分析[J]. 中国兽医科学, 2011, 41(8): 778-783.
- 14. 刘国兴, 刘源涌, 张辉, 丛立新. 东北梅花鹿瘤胃微生物基因组的DNA提取[J]. 黑龙江畜牧兽医, 2015(6): 227-229.
- 15. 田新民, 张明海. 基于粪便DNA的马鹿种群数量和性比[J]. 生态学报, 2010, 30(22): 6249-6254.
- 16. 周襄武, 鲍毅新. 黑麂粪便DNA的简易提取方法[J]. 浙江师范大学学报(自然科学版), 2008, 31(2): 214-219.
- 17. 康强, 周鑫, 罗燕, 田青, 程建国, 赵位. 林麝粪便基因组DNA的提取及PCR扩增[J]. 西北农林科技大学学报(自然科学版), 2016, 44(11): 1-7.
- 18. 林贤广, 李铁钢, 夏云, 刘艳慧. 广州南沙湿地公园候鸟源肠杆菌科耐药性及产超广谱β-内酰胺酶基因监测调查[J]. 微生物学通报, 2022, 49(2): 679-689.
- 19. 贠航, 胡闭月, 王健, 郭仁妹, 王丽. 3种粪便标本保存方法对肠道菌群检测结果影响的比较研究[J]. 微生物学杂志, 2020, 40(3): 74-80.
- 20. 左锐, 林峻, 朱琳妍, 姜文倩, 蔡伟文. 不同方法提取肠道微生物宏基因组DNA的比较[J]. 生物化工, 2018, 4(4): 1-5.
NOTES
*通讯作者。