World Journal of Cancer Research
Vol.
09
No.
01
(
2019
), Article ID:
28413
,
6
pages
10.12677/WJCR.2019.91007
Effect and Mechanism of Hyperhomocysteine on Metastasis of Nasopharyngeal Carcinoma through EMT
Ping Yin, Honghai Hong*
Laboratory Department, Third Affiliated Hospital of Guangzhou Medical University, Guangzhou Guangdong
Received: Dec. 18th, 2018; accepted: Jan. 4th, 2019; published: Jan. 11th, 2019

ABSTRACT
Objective: To investigate the effect of Homocysteine on the invasion and migration capability in nasopharyngeal carcinoma CNE-2 cells and to explore the possible mechanism. Methods: After high concentration HCY treatment, the cell morphology of CNE-2 cells was evaluated by phase-contrast microscopy, the colony forming ability was detected by soft agar cloning experiment, and the invasion and migration capability was reflexed by invasion and migration experiments. Moreover, the mechanism was also investigated. Results: HCY exposure led to the transformation of the cobblestone-like cells CNE-2 to spindle-like, fibroblastic cells, accompanied by enhanced colony forming ability and invasion and migration capability. Western blot showed that the mesenchymal marker was up-regulated and the epithelial marker was down-regulated after HCY treatment, which implied that HCY might work through EMT to promote the malignant transformation of CNE-2 cells.
Keywords:Homocysteine, CNE-2, Invasion, Migration, Epithelial-Mesenchymal Transition
高同型半胱氨酸通过EMT促进鼻咽癌转移作用及机制
尹萍,洪宏海*
广州医科大学附属第三医院检验科,广东 广州
收稿日期:2018年12月18日;录用日期:2019年1月4日;发布日期:2019年1月11日

摘 要
目的:探讨同型半胱氨酸HCY对鼻咽癌CNE-2细胞侵袭和转移能力的影响及其机制。方法:高浓度HCY处理CNE-2细胞,通过相差显微镜观察细胞形态的改变,通过软琼脂克隆形成以及侵袭和转移实验观察对其克隆形成能力、侵袭和转移能力的影响,并探讨可能的分子机制。结果:HCY处理后,CNE-2细胞从卵圆形向纺锤形转变,伴随着克隆形成能力、侵袭和迁移能力的增强。WB结果显示HCY的处理上调了CNE-2细胞间充质标记物、下调了CNE-2细胞上皮标志物的表达,提示其可能是通过EMT促进CNE-2细胞的恶性转化。
关键词 :同型半胱氨酸,CNE-2,侵袭,转移,上皮间充质转化

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
鼻咽癌是一种在中国华南地区和东南亚高发、侵袭性和转移率最高的头颈恶性肿瘤,很多患者确诊时已经发生转移 [1]。随着放射治疗方法的不断进步与完善、放化疗的联合应用,鼻咽癌的局部控制率不断提高,远处转移逐渐成为治疗失败的主要原因 [1] [2]。因此探索鼻咽癌转移机制是下一步鼻咽癌研究的重点问题。
以往的研究认为高同型半胱氨酸血症与动脉粥样硬化、心血管疾病以及中风的发生密切相关 [3] ,这可能与同型半胱氨酸能够损伤心血管内皮和平滑肌细胞,进而影响动脉结构和功能有关。除此之外,高同型半胱氨酸血症被认为是充血性心力衰竭、年龄相关的黄斑变性以及阿尔兹海默症的诱发因素 [4]。而近年来,高同型半胱氨酸血症在肿瘤中作用受到更多关注 [5]。但是,在鼻咽癌的发生和转移中,同型半胱氨酸(Homocysteine, HCY)发挥什么样的作用尚未见相关文献报道。
研究表明上皮间充质转化(Epithelial-mesenchymal Transition, EMT)与肿瘤的转移密切相关。EMT在胚胎形成、纤维化和肿瘤侵袭过程中均会发生,细胞连接的缺失伴随着上皮标志物表达的减少和间充质标志物的增多为EMT的主要特征 [6]。文献表明EMT与鼻咽癌的转移密切相关,抑制鼻咽癌的EMT之后能够观察到鼻咽癌的转移受到明显抑制 [7] [8]。那么同型半胱氨酸是否也是通过EMT参与鼻咽癌细胞的转移呢?这些就是本文主要探讨的问题。
2. 材料方法
2.1. 细胞培养
鼻咽癌细胞株CNE-2由中山大学肿瘤医院曾木圣教授构建并赠送。CNE-2细胞培养采用DMEM基础培养基(Hyclone)中加入10%胎牛血清(Gibico),1%青链霉素双抗(100*) (Hyclone),置于37℃含5% CO2培养箱中培养。按需传代、种板。同型半胱氨酸(Homocysteine, Sigma#69453) ddH2O溶解后配置成20 mmol/L储存液,按照1:500比例加入培养液中。
2.2. 细胞迁移和侵袭
对数生长期细胞消化成单细胞悬液后,用PBS洗涤离心两次后加入无FBS的DMEM,混匀,按照每孔4 × 104个细胞加入Transwell小室。小室下方放置含10% FBS的DMEM培养液,培养24小时后染色计数。迁移实验需要提前在小室中铺上Matrigel胶,其它同迁移实验。
2.3. 软琼脂克隆形成实验
对数生长期细胞消化后制成单细胞悬液,1.2%琼脂溶液与2 * DMEM以1:1比例混合铺在培养皿底部,0.7%琼脂溶液与2 * DMEM以1:1比例混合后加入细胞悬液,待底层溶液凝固后铺在上层。待上层琼脂凝固后,加入适量培养液覆盖表面,置于培养箱中连续培养10~14天后显微镜观察计数,只计数细胞数大于50个的克隆。
2.4. Westernblot
处理过的细胞充分裂解后、定量,与10×变性缓冲液9:1的比例配置上样缓冲液后,100℃煮沸5 min,与蛋白marker一起加入SDS-PAGE凝胶的上样孔中(12%分离胶和5%浓缩胶),80 V电泳30 min,120 V电泳90 min;后以300 mA恒流电转180 min (注意降温,防止干膜),将凝胶上的蛋白转移至PVDF膜(Merck Millipore);将膜用7%脱脂牛奶封闭60 min,加入一抗β-actin (Sigma #A5441)、β-catenin (CST #9582S)以及E-cadherin (BD #610181) 4℃振摇过夜,次日洗膜后,加入二抗4℃孵育4 h。洗膜后成像。
2.5. 统计学方法
统计学分析采用SPSS 18.0软件,两组定量资料之间的差异分析采用t检验,P < 0.05差异认为有统计学意义。
3. 结果
3.1. HCY处理改变CNE-2细胞形态
参考文献采用浓度为5 μmol/L~15 μmol/L同型半胱氨酸处理细胞 [9] ,故我们将同型半胱氨酸储存液(HCY)分别按照1:2000、1:1000、1:500 (终浓度分别为10 μmol/L、20 μmol/L、40 μmol/L)的比例加入培养基中,连续培养CNE-2细胞72 h,中间需传代一次,贴壁10小时后相差显微镜观察,发现与对照组相比,只有40 μmol/L处理组鼻咽癌CNE-2细胞形态发生了明显的改变,从原来的卵圆形向纺锤形转变(图1)。
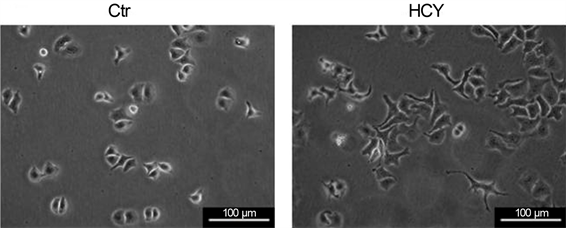 Cell morphology was evaluated by phase-contrast microscopy
Cell morphology was evaluated by phase-contrast microscopy
Figure 1. HCY treatment change the Cell morphology of CNE-2 cells
图1. HCY影响CNE-2的细胞形态
3.2. HCY促进CNE-2细胞克隆形成能力
我们采用软琼脂克隆形成实验观察HCY处理后细胞形态的改变对CNE-2细胞克隆形成能力的影响。将HCY处理后的CNE-2细胞消化后吹打成单个细胞,六孔板每孔接种1 × 104个细胞,10天后观察计数发现,与对照组相比,HCY处理的CNE-2细胞在软琼脂培养基中形成的克隆更多、更大,t检验发现两组之间差异具有统计学意义(图2)。
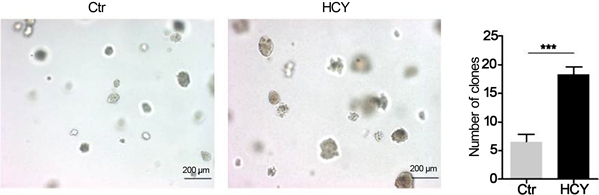 Representative micrographs of indicated cells grown on soft agar for 14 days in cloning formation of soft agar assay. Bars correspond to mean ± standard deviation (SD), ***P < 0.001.
Representative micrographs of indicated cells grown on soft agar for 14 days in cloning formation of soft agar assay. Bars correspond to mean ± standard deviation (SD), ***P < 0.001.
Figure 2. HCY treated CNE-2 cells showed increased colony forming ability
图2. HCY处理增强CNE-2细胞的克隆形成能力
3.3. HCY处理促进CNE-2细胞的侵袭和迁移
我们采用侵袭和迁移实验反映HCY处理对细胞侵袭迁移能力的影响。细胞种板24小时后,与对照组相比,HCY处理组迁移和侵袭的能力显著增强,差异有统计学意义(图3)。
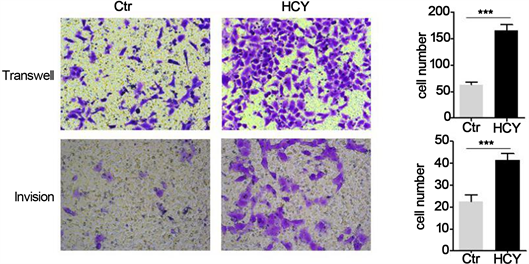 The migration/invasion ability of indicated cells was evaluated by transwell assay. Bars correspond to mean ± standard deviation (SD), ***P < 0.001.
The migration/invasion ability of indicated cells was evaluated by transwell assay. Bars correspond to mean ± standard deviation (SD), ***P < 0.001.
Figure 3. HCY treated CNE-2 cells had increased invasion and migration capabilities
图3. HCY处理提高了CNE-2细胞的侵袭和迁移能力
3.4. HCY通过EMT促进CNE-2细胞的侵袭和转移
前面的研究已经发现HCY处理能够改变鼻咽癌细胞形态,促进其克隆形成、侵袭以及迁移能力,那么其分子学基础是什么呢?我们检测了HCY处理后CNE-2细胞上皮标志物E-cadherin和间皮标志物β-catenin的表达情况,结果发现与对照组相比,HCY处理组E-cadherin表达水平明显降低,而β-catenin显著增高,且具有明显的浓度依赖效应(图4)。
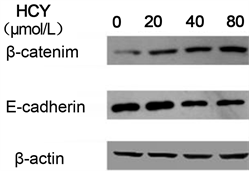 Expression of epithelial cell markers (E-cadherin) and mesenchymal cell markers (β-cadherin) in indicated cells were examined by WB. β-actin was used as a loading control.
Expression of epithelial cell markers (E-cadherin) and mesenchymal cell markers (β-cadherin) in indicated cells were examined by WB. β-actin was used as a loading control.
Figure 4. HCY treatment changed the expression level of Epithelial and mesenchymal markers
图4. HCY改变CNE-2细胞的上皮和间充质标志物的表达水平
4. 讨论
本文通过软琼脂克隆形成实验、侵袭和迁移实验发现高浓度HCY处理能够增强鼻咽癌细胞的单克隆形成能力以及转移和侵袭能力,进一步研究结果验证HCY可能是通过调控鼻咽癌细胞EMT、改变细胞形态从而发挥促进肿瘤转移的作用。因此我们首次发现HCY能够促进鼻咽癌细胞转移,并且提出了可能的发生机制。
Chiang FF实验室的研究表明血浆高水平的同型半胱氨酸与结肠癌的发病风险存在一定相关性 [5]。Almadori G团队的研究结果表明,与吸烟对照组和不吸烟对照组相比,血浆同型半胱氨酸水平在头颈部鳞状细胞癌患者中明显升高,提示高同型半胱氨酸血症可能是促进肿瘤发生发展的重要因素 [10]。也有研究结果显示放射治疗后鼻咽癌患者血浆HCY水平较治疗前明显下降,表明HCY水平的降低可能提示鼻咽癌的好转。但是关于高同型半胱氨酸血症与鼻咽癌细胞转移之间关系的研究未见报道。本文首先发现HCY处理能够改变鼻咽癌细胞的形态,使其恶性转化向纺锤体样改变,进一步通过软琼脂克隆形成以及体外的侵袭和迁移实验验证了HCY对CNE-2细胞侵袭能力的促进作用。这些实验结果表明HCY处理使CNE-2发生了恶性转化,增强了CNE-2细胞侵袭和转移的能力。那么,HCY促进CNE-2侵袭和转移的机制是什么呢?文献报道高水平HCY能够通过表观遗传学促进乳腺癌的发生和发展 [11] ,本人之前的研究发现低表达的色素上皮衍生因子(Pigment Epithelium Derived Factor, PEDF)能够通过诱导鼻咽癌细胞发生上皮间充质转化(Epithelial-mesenchymal Transition, EMT)促进其侵袭和转移 [12] ,那么同型半胱氨酸是否也是通过影响鼻咽癌细胞EMT从而改变其细胞行为的呢?EMT是鼻咽癌转移的重要发生机制 [7] ,我们通过WB实验发现HCY处理能够使CNE-2细胞上皮细胞标志物E-cadherin表达明显下调,间充质标志物β-catenin表达显著上调,提示HCY可能是通过EMT进而促进CNE-2细胞恶性转化的。
本研究发现HCY能够通过EMT促进鼻咽癌细胞侵袭和转移,这些结果提示高同型半胱氨酸血症的病人发生肿瘤转移的风险可能较正常人是升高的,为肿瘤转移的监测提供了一个可选择的指标。
文章引用
尹 萍,洪宏海. 高同型半胱氨酸通过EMT促进鼻咽癌转移作用及机制
Effect and Mechanism of Hyperhomocysteine on Metastasis of Nasopharyngeal Carcinoma through EMT[J]. 世界肿瘤研究, 2019, 09(01): 39-44. https://doi.org/10.12677/WJCR.2019.91007
参考文献
- 1. Cao, S.M., Simons, M.J. and Qian, C.N. (2011) The Prevalence and Prevention of Nasopharyngeal Carcinoma in China. Chinese Journal of Cancer, 30, 114-119.
https://doi.org/10.5732/cjc.010.10377 - 2. Faivre, S., Janot, F. and Armand, J.P. (2004) Op-timal Management of Nasopharyngeal Carcinoma. Current Opinion in Oncology, 16, 231-235.
https://doi.org/10.1097/00001622-200405000-00007 - 3. Chrysant, S.G. and Chrysant, G.S. (2018) The Current Status of Homocysteine as a Risk Factor for Cardiovascular Disease: A Mini Review. Expert Review of Cardiovascular Therapy, 16, 559-565.
https://doi.org/10.1080/14779072.2018.1497974 - 4. Kim, J., Kim, H., Roh, H. and Kwon, Y. (2018) Causes of Hyperhomo-cysteinemia and Its Pathological Significance. Archives of Pharmacal Research, 41, 372-383.
https://doi.org/10.1007/s12272-018-1016-4 - 5. Chiang, F.F., Wang, H.M., Lan, Y.C., Yang, M.H., Huang, S.C. and Huang, Y.C. (2014) High Homocysteine Is Associated with Increased Risk of Colorectal Cancer Independently of Oxidative Stress and An-tioxidant Capacities. Clinical Nutrition (Edinburgh, Scotland), 33, 1054-1060.
https://doi.org/10.1016/j.clnu.2013.11.007 - 6. Kalluri, R. and Weinberg, R.A. (2009) The Basics of Epithelial-Mesenchymal Transition. Journal of Clinical Investigation, 119, 1420-1428.
https://doi.org/10.1172/JCI39104 - 7. Kong, Q.L., Hu, L.J., Cao, J.Y., et al. (2010) Epstein-Barr Virus-Encoded LMP2A Induces an Epithelial-Mesenchymal Transition and Increases the Number of Side Population Stem-Like Cancer Cells in Nasopharyngeal Carcinoma. PLoS Pathogens, 6, e1000940.
https://doi.org/10.1371/journal.ppat.1000940 - 8. Loegl, J., Nussbaumer, E., Hiden, U., et al. (2016) Pigment Epitheli-um-Derived Factor (PEDF): A Novel Trophoblast-Derived Factor Limiting Feto-Placental Angiogenesis in Late Pregnancy. Angio-genesis, 19, 373-388.
https://doi.org/10.1007/s10456-016-9513-x - 9. Minami, S., Miura, K., Ishioka, M., et al. (2018) Homocysteine Supplementa-tion Ameliorates Steatohepatitis Induced by a Choline-Deficient Diet in Mice. Hepatology Research, 13234.
- 10. Naushad, S.M., Reddy, C.A., Kumaraswami, K., et al. (2014) Impact of Hyperhomocysteinemia on Breast Cancer Initiation and Progression: Epigenetic Perspective. Cell Biochemistry and Biophysics, 68, 397-406.
https://doi.org/10.1007/s12013-013-9720-7 - 11. Almadori, G., Bussu, F., Galli, J., et al. (2002) Serum Folate and Homocysteine Levels in Head and Neck Squamous Cell Carcinoma. Cancer, 94, 1006-1011.
https://doi.org/10.1002/cncr.10343 - 12. Zhang, T., Yin, P., Zhang, Z., et al. (2017) Deficiency of Pigment Epithelium-Derived Factor in Nasopharyngeal Carcinoma Cells Triggers the Epithelial-Mesenchymal Transition and Metastasis. Cell Death & Disease, 8, e2838.
https://doi.org/10.1038/cddis.2017.114
NOTES
*通讯作者。