Hans Journal of Agricultural Sciences
Vol.
11
No.
02
(
2021
), Article ID:
40389
,
7
pages
10.12677/HJAS.2021.112015
底栖硅藻悬浮培养初探
张凝,孙东红,颜纲,邹宁
鲁东大学生命科学学院,山东 烟台

收稿日期:2021年1月8日;录用日期:2021年2月3日;发布日期:2021年2月18日

摘要
底栖硅藻是鲍鱼和海参的主要饵料,足量优质饵料是人工育苗生产中最为重要因素,底栖硅藻大部分采用固定化培养和静置培养,无法达到规模生产,因此其工业化大规模生产十分必要。本文以舟形藻为研究材料,研究了不同硅浓度静置培养、不同硅浓度悬浮培养、光合反应器培养三种培养方式,打破传统的附着性生长培养状态,通过悬浮培养达到较高的培养密度。通过其OD值和细胞密度比较分析,初步得出对舟形藻生长影响最佳培养条件和最佳硅浓度,结果表明,悬浮条件培养下,最有利于舟形藻培养,藻细胞密度最高可达2.45 × 106个/mL,为大规模悬浮培养优质舟形藻提供初步参考。
关键词
底栖硅藻,培养条件,营养成分
Preliminary Study on Suspension Culture of Benthic Diatoms
Ning Zhang, Donghong Sun, Gang Yan, Ning Zou
College of Life Sciences, Ludong University, Yantai Shandong
Received: Jan. 8th, 2021; accepted: Feb. 3rd, 2021; published: Feb. 18th, 2021

ABSTRACT
Benthic diatoms are the main food for abalone and sea cucumber. Sufficient and high-quality food is the most important factor in the production of artificial seedlings. Most benthic diatoms are cultured in immobilized culture and static culture, which cannot achieve large-scale production, therefore, its large-scale industrial production is very necessary. In this paper, three kinds of culture methods, I. E. Static culture with different silicon concentration, suspension culture with different silicon concentration and photosynthetic reactor culture are studied, which broke the traditional adherent growth culture state and achieved high culture density through suspension culture. The optimum culture conditions and the optimum silicon concentration were obtained by comparing the OD value and the cell density. The results showed that the suspension culture was the most favorable for the cultivation of Navicular, and the maximum cell density was 2.45 × 106 cells/mL, which provided a preliminary reference for large-scale suspension culture of high quality Navicular.
Keywords:Benthic Diatom, Culture Condition, Compositions

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
舟形藻(Navicula),属于硅藻门,羽纹纲,舟形藻目,舟形藻科,舟形藻属,其模式种为Navicula tripunctata (Müller) Bory [1]。其个体小、培养周期短、繁殖快,是一种常用作贝类养殖的单胞藻类,其脂肪含量高且脂肪酸种类丰富,有研究指出微藻在单位面积及单位时间上比陆生作物能提供更多的能量 [2]。浮游植物为水中生物提供饵料、溶氧及生存环境,成为水中的初级生产者,浮游植物中的舟形藻属在全球生态环境占非常重要的地位,在地球的生物圈中所有的氧气有四分之一都由本属物种生产 [3],因此它能够为池塘中的生物提供足够的氧气,避免缺氧对于水生生物造成伤害。它在食物链中具有关键作用,不仅是鲍鱼、刺参等名贵水产动物理想的开口饵料,也是海参鲍鱼的主要饵料以及其生长必需饵料 [4],作为新兴海水养殖业的鲍和海参人工养殖,已在多个国家得到发展 [5]。人们认为鲍鱼苗的生长及其幼虫的变态与附着生物膜关系密切,鲍鱼苗幼期主要以舟形藻分泌物为食,其中氨基酸、胞外多糖等能诱导鲍鱼幼苗变态,其诱导鲍鱼海参幼苗的附着,它密度、质量、理化成分都是影响海产动物生长的重要因素 [6] [7] [8]。也是一种具有潜在药学价值的海洋生物,同时该藻作为一个潜力富油微藻值得进一步地研究和开发 [9]。
在培养底栖硅藻的过程中,光照、盐度、温度、酸碱度等因素和N、P、Fe、Si等营养元素以及某些植物激素都能影响底栖硅藻的生长速率 [10]。影响单细胞藻类生长的环境因子有很多,但温度对藻类的生长尤为重要,环境温度的快速变化会对藻类的新陈代谢及生长繁殖产生重大影响 [11]。在底栖硅藻的大量培养中,除了光、温度、盐度、pH等环境因素外,影响硅藻生长的重要因子大都认为是氮、磷、铁、硅4种营养元素,它们的常用浓度及比值为10:1:0.1:1 (mg/L) [12]。目前,这一浓度配比在国内鲍育苗场培养饵料时仍广泛采用。当下大量培养还是基于固化培养,由于反应器遮光,使用时需清洗硅藻,造成一定量的损失,将固定化培养转向悬浮培养,不仅可以提供舟形藻藻种密度,充分利用水体及其营养物质,还可以更好的被水中经济动物如海参等利用。本文本研究以舟形藻为研究对象,改变了传统的底栖硅藻培养方式,通过悬浮培养达到极高的培养密度,为进一步达到初步大规模培养提供初步参考。
2. 材料与方法
2.1. 实验材料
本实验采用通用培养基配方对获得藻种进行扩种培养,舟形藻(Navicula)藻种由烟台市大境藻类研究所提供,通用培养基配方 [4] 为KNO3 (150 g/L),NaH2PO4 (5 g/L),Na2SiO3 (30 g/L),Fe-EDTA (5.57 g/L),f/2微量元素(1 mL/L)。藻种不同接种密度不同,如藻细胞均匀分布于水中,则接种时间不受限制,如藻细胞具有趋光上浮的特性,则在上午8~10点进行接种为宜 [13]。无菌条件下接种在1000 mL三角烧瓶中,上午十点于室内进行接种培养,室内培养温度在20℃ ± 1℃,静置培养20天,每天上午十点,下午四点进行摇动。
2.2. 实验仪器
显微镜(CX21FS1,日本OLYMPLUS公司),分光光度计(WFJ7200,上海尤尼柯仪器有限公司),血球计数板(XB-K-25,上海求精生化试剂仪器有限公司),全温空气摇床(QYC-211,上海福玛实验设备有限公司),SK-1快速混匀器(SK-1,金坛市科析仪器有限公司),光合有效辐射计(FGH-1型,北京师范大学光电仪器厂)。
2.3. 实验分组及浓度设计
实验所用藻种经扩增培养至指数生长期,达到实验所需藻密度供实验接种使用。实验分为不同硅浓度静置培养,不同硅浓度悬浮培养,光和生物反应器培养:1) 不同硅浓度静置培养,将舟形藻接入预先装有灭菌的新配制培养液锥形瓶中,实验设置6种硅浓度梯度,分别为0 mg/L、15 mg/L、30 mg/L、60 mg/L、120 mg/L、600 mg/L,于实验室内静置培养,光照时长12 h;2) 不同硅浓度悬浮培养,将舟形藻接入预先装有灭菌的新配制培养液锥形瓶中,实验设置6种硅浓度梯度,分别为10 mg/L、100 mg/L、500 mg/L、600 mg/L、800 mg/L、1000 mg/L,于全温空气摇床内悬浮培养,光照时长12 h;3) 光和生物反应器培养,将舟形藻接入预先装有灭菌的新配制培养液光和生物反应器中,与室内培养,光照时长12 h。
2.4. 生长测定与统计学分析
每日观察外观,看表面气泡情况,培养基颜色,显微镜下观察细胞形态,检査藻细胞的生长状况。摇匀后,取3个样品做平行实验,用血球计数板计数,紫外分光光度计测定藻细胞密度值。
实验数据采用SPSS19.0进行相关性分析和显著性差异。硅浓度对藻细胞生长的显著性差异采用单因素方差分析(One-Away ANOVA),数据在方差分析前方差齐性检验(Levene检验)。当p值小于0.05时,表示硅浓度对藻细胞生长影响差异性显著;当p值小于0.01时,表示硅浓度对藻细胞生长影响差异性极显著。
3. 结果与分析
3.1. 舟形藻细胞干重与OD560的关系曲线
OD值小于1.0时,随着培养液OD560的增大,舟形藻细胞干重不断增加,二者呈较好的线性关系,相应的回归方程为:单位干重(g /mL培养液) = 0.6872x + 0.4184,线性相关系数R2 = 0.9085。其舟形藻细胞干重与OD560关系曲线如图1。
3.2. 不同硅浓度静置培养
不同浓度硅酸钠下,静置培养舟形藻的OD值的变化如图2所示,藻细胞密度的变化如图3所示,不同浓度硅酸钠静置培养对舟形藻的生长有显著影响(p < 0.05),其中600 mg/L影响最大。在接种时OD值和细胞密度均较为低,随着时间变化,舟形藻在不断生长,OD值和细胞密度总体上呈增长趋势,虽中间有一定幅度的波动,但波动都在合理范围内。600 mg/L硅酸钠浓实验组细胞密度要显著高于其他5组,且颜色最深呈棕褐色。
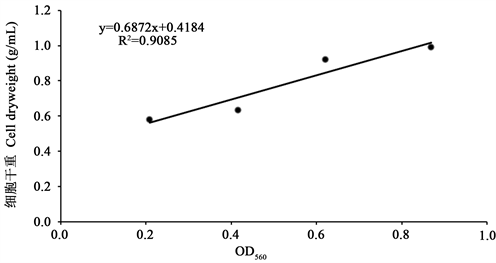
Figure 1. Relation curves of OD560 and per unit dry weight of Navicula cell
图1. 舟形藻细胞干重与OD560关系曲线

Figure 2. Effects of different concentrations of sodium silicate on the OD of Navicula
图2. 不同浓度的硅酸钠对舟形藻OD值的影响

Figure 3. Effects of different concentrations of sodium silicate on the cell density of Navicula
图3. 不同浓度的硅酸钠对舟形藻细胞密度的影响
在相同培养条件下,静置培养,设置不同硅酸钠浓度,通过舟形藻OD值和细胞密度进行比较,硅酸钠浓度为600 mg/L时最有利于舟形藻的生长,说明高浓度硅酸钠对舟形藻生长有较大促进作用。
在实验数据测量过程中,发现舟形藻的OD值和藻细胞密度并非随着时间的延长一直都增加的,而是在测量过程中有一定幅度的波动,这可能是由于多方面原因造成的:1) 舟形藻分布不均匀,且大多附着在锥形瓶瓶壁上,导致随机取样时,对测量结果产生一定的误差;2) 环境变化对舟形藻生长产生一定的影响,舟形藻OD值和细胞密度随外界条件的变化产生一定幅度的波动;3) 实验过程中,发现高浓度的硅酸钠的培养瓶中产生少量沉淀,且受温度影响沉淀会变化,最终对实验结果造成一定的误差,导致实验结果不能作为较为准确的参考,需进一步探究硅酸钠的最优添加量及培养条件等,进行更加详细的实验探讨,获得更加准确的实验结果。
3.3. 不同硅浓度悬浮培养
不同浓度硅酸钠下,悬浮培养舟形藻的OD值的变化如图4所示,藻细胞密度的变化如图5所示,不同浓度硅酸钠对舟形藻的生长有极显著影响(p < 0.01),其中600 mg/L、800 mg/L、1000 mg/L影响最为显著。600 mg/L、800 mg/L、1000 mg/L硅酸钠浓实验组藻细胞密度差别不大,并且均随着时间的变化,呈稳定增长状态,其细胞密度远高于其他3组,颜色深均呈棕褐色,且最大藻细胞密度均可达2.45 × 106 个/mL。

Figure 4. Effects of different concentrations of sodium silicate on the OD of Navicula
图4. 不同浓度的硅酸钠对舟形藻OD值的影响
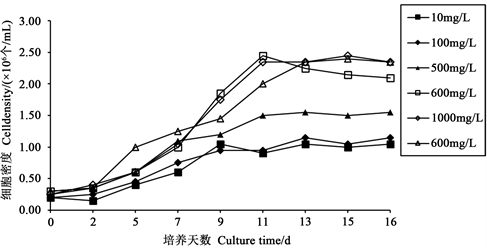
Figure 5. Effects of different concentrations of sodium silicate on the cell density of Navicula
图5. 不同浓度的硅酸钠对舟形藻细胞数目的影响
实验过程中,硅酸钠的浓度增加,培养瓶中产生沉淀量会随之增加,且受温度影响沉淀会变化,所以最初接种时,OD值和藻细胞起始浓度不同,最终对实验结果造成一定的影响,需进一步探究硅酸钠培养条件等,进行更加详细的实验探讨,获得更加准确的实验结果。
在相同培养条件下,悬浮培养,设置不同硅酸钠浓度,通过舟形藻OD值,细胞密度进行比较,硅酸钠浓度越高越有利于舟形藻的生长,综上,选择600 mg/L硅酸钠浓度进行进一步探究。
3.4. 光和生物反应器培养
600 mg/L硅酸钠浓度下,光和生物反应器培养舟形藻的OD值变化如图6所示,藻细胞密度变化如图7所示,随时间增加,OD值增加,藻细胞密度增加,在第16天达到最高峰。从接种到第12天,舟形藻细胞密度增加,最高藻细胞密度可达2.60 × 106个/mL,反应器中藻液颜色逐步加深。从第12天以后,舟形藻细胞密度开始减少,但反应器中藻液颜色却未发生较为明显的变化。

Figure 6. Effect of 600 mg/L Sodium Silicate on the OD Value of Navicula
图6. 600 mg/L硅酸钠对舟形藻OD值的影响

Figure 7. Effect of 600 mg/L Sodium Silicate on the cell density of Navicula
图7. 600 mg/L硅酸钠对舟形藻细胞密度的影响
4. 结论与展望
不同硅浓度静置培养实验中,硅酸钠浓度为600 mg/L时,藻细胞密度最高可达7.2 × 104个/mL,郑维发等 [14] 通过优化培养的舟形藻,藻细胞最大细胞密度可达2.69 × 105个/mL,其结果远高于本实验,说明培养基配方及种类对藻细胞密度均有影响。不同硅浓度悬浮培养中,硅酸钠浓度为600 mg/L,藻细胞密度最高可达2.45 × 106个/mL,其结果却远高于郑维发等 [14] 实验和静置培养以及利用污水培养 [15],张力等 [16] 充气条件下抗絮凝剂添加的实验结果表明,在0.2 g/L的添加量下,硅藻的生长情况最佳达到9.4 × 105个/mL,赵世宝等 [17] 打破传统固定化培养底栖硅藻的模式,去掉附着基进行培养,其中硅源硅酸钠浓度为100 mg/L,其藻细胞密度达到4.97 × 104个/mL,但仍为静置培养,说明培养条件对藻细胞密度影响较大。而光和生物反应器培养实验中,硅酸钠浓度为600 mg/L,藻细胞密度最高可达2.60 × 106个/mL,说明光合生物反应器可以相对较高的提高细胞密度,需进一步探究培养条件,探究最高细胞密度。
底栖硅藻是一类营固着和附着生活的微藻,其分泌具有黏附作用的胞外多糖,且对生长条件要求高,不像浮游藻一样可以高效、立体的利用水体,难以进行规模化的培养,大都集中于培养基的优化,所以底栖硅藻在室内封闭式静置培养的过程中屡屡受阻 [18]。硅是底栖硅藻细胞壁的特有成分之一,且硅在底栖硅藻的生长和代谢过程,如细胞分裂、蛋白质和色素的合成过程中扮演着重要角色 [19],所以硅的添加量对底栖硅藻培养及进行规模化生产尤为关键,对于进一步开发底栖硅藻的潜能有巨大的帮助。其次由于其特殊的细胞壁,悬浮培养出现,进一步改变了这一处境。随着对底栖硅藻研究的深入,发现底栖硅藻在水产养殖、环境保护、生物燃料、计算机芯片及清洁剂生产、医学研究等方面发挥着日益重要的作用,相信未来,随着底栖硅藻的规模化生产,底栖硅藻定能在更多的方面更好地造福于人类,充分发挥其价值 [20] [21]。
文章引用
张 凝,孙东红,颜 纲,邹 宁. 底栖硅藻悬浮培养初探
Preliminary Study on Suspension Culture of Benthic Diatoms[J]. 农业科学, 2021, 11(02): 104-110. https://doi.org/10.12677/HJAS.2021.112015
参考文献
- 1. Cox, E.J. (1979) Studies on the Diatom Genus Navicula Bory. Navicula scopulorum Bréb. and a Further Comment on the Genus Berkeleya Grev. British Phycological Bulletin, 14, 161-174.
- 2. 王兆凯. 基于海洋硅藻的生物燃油生产[J]. 渔业现代化, 2008, 35(2): 60-63.
- 3. 李雪梅, 张庆华, 甘一萍, 周军, 戴家银, 曹宏, 许木启. 持久性有机污染物在食物链中积累与放大研究进展[J]. 应用与环境生物学报, 2007(6): 901-905.
- 4. 陈世杰, 陈木, 卢豪魁, 等. 鲍苗的饵料——底栖硅藻培养试验初报[J]. 动物学报, 1977, 23(1): 47-52.
- 5. Gordon, H.R. and Cook, P. (2004) World Abalone Fisheries and Aquaculture Update: Supply and Market Dynamics. Journal of Shellfish Research, 23, 935-939.
- 6. 徐力文, 刘广锋, 王江勇. 鲍育苗生物学中饵料硅藻的相关研究进展[J]. 海洋科学进展, 2006, 24(4): 611-618.
- 7. 李太武, 丁明进, 刘金屏, 聂立萍. 皱纹盘鲍及其饵料营养成分的研究[J]. 海洋科学, 1995(1): 52-57.
- 8. 李太武, 聂丽萍, 刘金屏, 丁明进, 宋协民. 皱纹盘鲍消化酶的研究[J]. 水产科学, 1995, 14(5): 3-7.
- 9. Chisti, Y. (2007) Biodiesel from Microalgae. Biotechnology Advances, 25, 294-306. https://doi.org/10.1016/j.biotechadv.2007.02.001
- 10. 邹宁, 孙东红, 郭小燕. 培养条件对底栖硅藻生长的影响[J]. 水产养殖, 2005, 26(5): 14-16.
- 11. 马志珍, 季梅芳, 陈汇远. 一种可作鲍和海参饵料的底栖舟形藻的培养条件的研究[J]. 海洋通报, 1985, 4(4): 36-39.
- 12. 魏鹏骥. Cd~(2+)、Cu~(2+)和Zn~(2+)对舟形藻生理与油脂积累的影响[D]: [硕士学位论文]. 北京: 清华大学, 2017.
- 13. 张志良. 植物生理学实验指导(第二版) [M]. 北京: 高等教育出版社, 1990.
- 14. 郑维发, 王雪梅, 王义琴, 储成才. 四种营养盐对舟形藻(Navicula)BT001生长速率的影响[J]. 海洋与湖沼, 2007, 38(2): 157-162.
- 15. 吴夏芫, 李环, 韦萍. 舟形藻的污水培养及条件优化[J]. 安徽农业科学, 2009, 37(8): 3414-3417.
- 16. 张力. 底栖硅藻的规模化培养及其在刺参育苗中的应用[D]: [硕士学位论文]. 扬州: 扬州大学, 2013.
- 17. 赵世宝. 柠檬酸铁对舟形藻生长及理化成分的影响[J]. 青岛科技大学学报(自然科学版), 2015, 36(S2): 90-93.
- 18. 曲青梅, 邹宁. 底栖硅藻悬浮培养条件及活性物质研究进展[J]. 安徽农业科学, 2013, 41(33): 13090-13093.
- 19. Werner, D. (1977) Silicate Metabolism—The Biology of Diatoms. Blackwell Scientific Publications, London, 110-149. https://doi.org/10.1007/978-1-4613-4018-8_7
- 20. 王伟. 硅藻[J]. 生物学杂志, 1997(1): 15+21.
- 21. Parkinson, J. and Gordon, R. (1999) Beyond Micromachining: The Potential of Diatoms. Trends in Biotechnology, 17, 190-196. https://doi.org/10.1016/S0167-7799(99)01321-9