Mechanical Engineering and Technology
Vol.
07
No.
06
(
2018
), Article ID:
27939
,
11
pages
10.12677/MET.2018.76057
Research Status and Key Technology Analysis of Vascular Robots
Zhijian Zeng1, Yabo Deng1, Yongcong Huang1, Juan Xiong2, Zhongwei Hu1,3
1College of Mechanical and Electrical Engineering, Huaqiao University, Xiamen Fujian
2Huaqiao University Hospital, Xiamen Fujian
3Institute of Manufacturing Engineering, Huaqiao University, Xiamen Fujian

Received: Nov. 16th, 2018; accepted: Dec. 4th, 2018; published: Dec. 11th, 2018

ABSTRACT
In recent years, vascular robot technology has developed rapidly and gradually used in medical fields such as disease diagnosis, information collection, vascular dredge, drug delivery, etc. According to different driving modes of vascular robots, the structure and driving modes of micro-nano-scale and millimeter-scale vascular robots are analyzed in this paper. The principle and research status of different driving modes of vascular robots are summarized, including peristaltic driving, bionic swimming, bionic flagella driving, spiral driving and so on. The characteristics of various structures of current vascular robots are discussed, and the key technologies and development prospects of vascular robots are analyzed.
Keywords:Blood Vessel Robot, Driving Mode, Nano-Robot, MEMS Robot
血管机器人研究现状与关键技术问题分析
曾志坚1,邓亚博1,黄永聪1,熊娟2,胡中伟1,3
1华侨大学机电及自动化学院,福建 厦门
2华侨大学校医院,福建 厦门
3华侨大学制造工程研究院,福建 厦门

收稿日期:2018年11月16日;录用日期:2018年12月4日;发布日期:2018年12月11日

摘 要
近年来,血管机器人技术发展迅速,已被逐步用于疾病诊断、信息采集、血管疏通、药物投放等医疗领域,具有广阔的医学应用前景。本文根据血管机器人的不同驱动方式,对微纳米尺度和毫米尺度的血管机器人结构、驱动方式等进行了分析,综述了国内外血管机器人的不同驱动方式原理及研究现状,包括蠕动驱动,仿生游动,仿细菌鞭毛驱动,螺旋驱动等。探讨了目前血管机器人各类结构的特点,并分析了血管机器人发展的关键技术与发展前景。
关键词 :血管机器人,驱动方式,纳米机器人,MEMS机器人

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
近年来,因心血管疾病致死、致残的发病率居各类病因之首。血管介入手术作为治疗心血管疾病诊断治疗的重要手段,有着创伤小,恢复快等优点,但手术中医生长时间暴露在射线环境中手动操作导管通过血管到达患处,不仅对医生身体伤害大,同时操作复杂,对医生的操作技巧要求较高。同时,刚性的手术器械会导致许多死角无法检测到,定位精度较差,容易因操作的不稳而伤及人体组织器官。为了克服传统血管介入手术中存在的这些问题,血管机器人的概念应运而生。血管机器人是能够沿血管运动并能在血液中自动或受控制治疗身体特定部位的微小机器人。有着高灵活性,可以在不损伤人体组织器官的情况下直达患处,甚至是血管介入器械无法到达的盲区,携带信息采集与药物注射等模块的血管机器人可以协助医生完成血管介入手术。
2. 血管机器人研究现状
由于血管大量的分支与血管内复杂的血液环境,对血管机器人要求高、设计难度大,许多关键技术还待进一步解决,血管机器人的功能也待进一步完善,目前可应用于心血管疾病介入治疗的血管机器人并不多。但随着近几年来微纳领域科学与技术的不断发展,电子元件不断的微小化与集成化,也推动了MEMS (微电子机械系统)技术的发展,许多血管机器人纷纷问世。目前,血管机器人主要分为两种级别:一种是纳米尺度的纳米机器人,另一种是微米至毫米尺度的MEMS机器人。
2.1. 纳米血管机器人
纳米机器人是一种在微纳米尺度上应用生物学原理设计的分子机器人,具有成像、操纵、表征机械特性和跟踪的多种功能,使得医生能够从微观甚至分子水平进行血管的诊断和治疗。纳米机器人也可用于对活细胞进行复杂的纳米手术,实现在血管中进行的诊疗,有着血管介入治疗等医疗领域的应用前景。
2000年,瑞典的学者Edwin W.H. Jager研制出一种纳米级的微机器人 [1] ,如图1所示,该机器人以黄金和多层聚合物制成,有着2至4个类似人类手指的灵活部件。该纳米微机器人能捡起并移动肉眼看不见的玻璃珠,在细胞介质和体液中捕捉和移动单个细胞,可应用在血管疾病的诊疗中。

Figure 1. Nano micro robot
图1. 纳米微型机器人
2006年,日本东京大学的科研人员将2个分子机器人进行组装,制作了一个形状像“钳子”的分子机器复合体,该复合体以紫外线和可见光作为驱动力,能够穿行于血管之中杀死癌细胞。2007年,韩国科学家研制出一种动脉微型机器人,该机器人随着心肌肌肉细胞的收缩而移动,可用于药物投放和血管疏通等医疗应用。2010年,中科院上海硅酸盐研究所的施剑林等人研制出了直径只有200 nm的“纳米药物分子运输车” [2] ,这辆纳米药物分子运输车不仅仅可以运输药物,还可以实现治疗过程的监控。
2010年,哥伦比亚大学的科研人员研制出一种“纳米蜘蛛”微型机器人 [3] ,如图2所示,该机器人由DNA分子构成,大小只有4 nm。具有沿着DNA的运行轨迹移动的能力,可用于血管的介入诊疗,协助医生完成手术。

Figure 2. “Nano spider” micro robot
图2. “纳米蜘蛛”微型机器人
2015年,Li等学者提出并研制开发出了混合动力驱动微机器人 [4] ,如图3所示。该机器人由鞭毛细菌和电磁场结合驱动的,依靠电磁场控制的路径和细菌的趋化性及运动性,使得机器人能在血管内进行有效移动,由于电磁制动系统的驱动力较大、高速可控,细菌致动系统具有主动靶向性,有望用于药物运输等医疗领域。
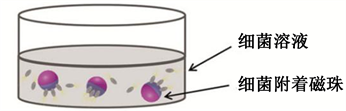
Figure 3. Hybrid power driven micro robot
图3. 混合动力驱动微机器人
2.2. MEMS血管机器人
除了纳米血管机器人,MEMS机器人也是国内外血管机器人研究的热点之一。随着MEMS技术的不断发展,人们已经可以加工越来越小的机器人。MEMS机器人可进入很小的器官和组织,并具有自动进行细微精确操作的特点,可大大提高介入治疗的精度,MEMS机器人直接进入相应病变区域进行工作,降低手术风险 [5] 。
2.2.1. 仿生蠕动机器人
为了满足微型机器人驱动器尺寸小、功重比高的要求,通常采用直接驱动,减小传递链。蠕动运动方式是借鉴蚯蚓和线虫运动的原理,通过伸缩引起形状变化和重心移动,实现缓慢伸缩运动,这种运动方式不损伤脆弱的血管内壁。蠕动为一类有利于微小型机器人实现的移动方式 [6] ,微小化的蠕动机器人可以进入血管中进行诊疗。
2009年,日本Yuichi和Nakazato等人研制了一种仿蚯蚓有缆血管机器人 [7] ,如图4所示。该机器人能够通过使用液压,特别是使用生理盐水溶液作为作用流体,通过反复扩张和收缩的蠕动运动,可在2 mm~3 mm直径的血管中移动。类似于蚯蚓和线虫的蠕动,引起形状变化和重心移动,导致伸展波传播,从而实现运动而不损害脆弱的血管内壁。
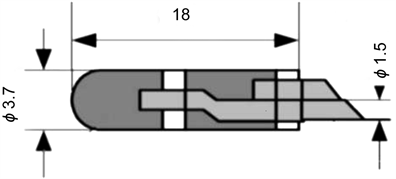
Figure 4. Imitation earthworm vascular robot
图4. 仿蚯蚓血管机器人
2009年,国防科技大学徐从启等人研制一种蠕动式微小管内机器人 [8] ,如图5所示,该机器人采用三组直流减速电机和螺杆传动装置,机器人能适应18 mm~20 mm的管径。机器人的蠕动爬行是通过控制三组电机顺序协调动作。该机器人由三个组成单元,包括前后爪单元和中间的蠕动单元,都由直流减速电机驱动,三单元由换向节连接。该机器人负载能力大,能双向移动。

Figure 5. New peristaltic micro pipe robot
图5. 新型蠕动式微小管内机器人
2014年,日本正平上野等人研制了一种电共轭流体微型蠕动机器,这个微型的机器人长32 mm,宽8.5 mm,重量约为1.9 g。如图6所示,该机器人通过使用(安电共轭流体)ECF作为动力来源,实现一种微型的尺蠖机器人 [9] 。该机器人通过不断地弯曲和拉伸中间的“肌肉”来获得驱动力,实验表明该机器人在平面上有良好的移动速度。

Figure 6. Micro peristalsis robot with electric
图6. 电共轭流体微型蠕动机器人
蠕动驱动方式有着结构简单,驱动力大,能耗小等优点。但机器人运动过程中与人体血管壁之间摩擦力一旦过大,对血管壁还是有损伤。而仿生游动机器人有着较高的性能,对于血管的损伤可以降至较小水平。能在人体液体中自由移动,通过模仿微生物完成一些生物医学操作。仿生游动机器人可以在体内药物输送、疾病早期症状监测等医学应用中发挥作用。
2.2.2. 仿生游动机器人
目前,仿生游动机器人是国内外研究的热点,游动机器人有很多不同的驱动方式,主要有压电材料、形状记忆合金(SMA)、应用 IPMC 高分子材料、应用IEM-pt高分子材料等材料驱动的游动血管机器人。
1997年,美国Mojarrad等人研制出了一种新型的仿生鱼形推进装置 [10] ,如图7所示,该仿生鱼形机器人以IEM-Pt为致动器。原理是在IEM-Pt薄膜上化学镀铂,所得到的膜被切割成条状,类似于鱼尾鳍,可作为一种推进结构装置,在液体中推动微型机器人。这种聚电解质离子交换膜−金属复合人工肌肉有望运用到血管机器人的结构上。
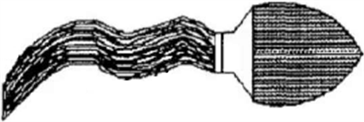
Figure 7. IEM-Pt driven bionic fish robot
图7. IEM-Pt 驱动仿生鱼形机器人
2002年,Kazuhiro Tsuruta等人研制了一种利用压电陶瓷驱动的管道无线微型机器人 [11] ,如图8所示,机器人可在直径为10mm的管道中移动,并可对管道内进行观察。利用微电子器件技术,已开发出高性能微器件用于微型机器人,成功地实现了管道内无线移动和每秒2帧的无线图像数据通信。
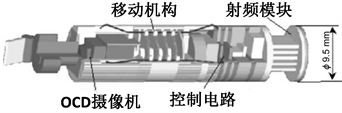
Figure 8. Wireless micro robot driven by piezoceramic
图8. 压电陶瓷驱动的管道无线微型机器人
2005年,日本香川和哈尔滨工程大学根据仿生学模仿游动并结合爬行机制的原理研制了一种利用IPEC驱动的水下微型机器人 [12] ,如图9所示,该机器人长40 mm,宽10 mm。水下微型机器人有一对尾鳍,由ICPF材料制成,并且可以依靠改变脉冲电压的频率,控制ICPF材料,由于其柔软性和低电压性,可以完成微机器人在血管的游动和行走。

Figure 9. IPEC driven underwater micro robot
图9. IPEC驱动的水下微型机器人
2011年,国内哈尔滨工业大学王扬威等人研制了仿生乌贼机器人 [13] ,该仿生机器人以0.2 mm的SMA(形状记忆合金)丝作为驱动,如图10所示。SMA丝的加热收缩和冷却伸长使硅胶外套膜实现往复运动,完成吸水和尾部脉冲式的喷水游动,最高游动速度达到58 mm/s。
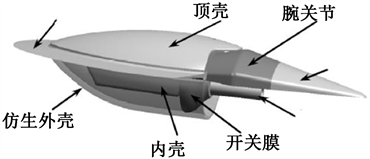
Figure 10. Imitation swimming robot for cuttlefish
图10. 仿乌贼游动机器人
2.2.3. 外部磁场驱动游动机器人
许多仿生游动机器人运用智能材料驱动,如IPMC和SMA,这些材料被称致动器。然而,它们常常占据了血管机器人体积的大部分,使得这些机器人在使用和推广上有一定的局限性,较难应用到血管诊疗。不需要电源电缆、电池或控制系统的外磁场驱动机器人应运而生,它们非常适合于医疗应用。通过外部的磁场控制,驱动机器人的磁致微制动器产生推动力,实现血管机器人的泳动。
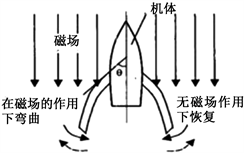
Figure 11. Micro robot driven by ferromagnetic rubber
图11. 铁磁橡胶驱动微小机器人
2002年,中国科学院智能机械研究所梅涛等人研制出了一种游动微机器人 [14] ,该微机器人利用铁磁橡胶执行器(FMP)作为驱动,通过外部磁场无线驱动,实现无缆驱动和控制。如图11所示,微型机器人的总尺寸为长20 mm,宽14 mm和厚5 mm。实验表明FN·T型游泳微机器人可以被外部磁场无线驱动和控制,运动速度和方向取决于磁通密度和磁脉冲频率。因此,可以通过改变磁强度和频率来控制机器人。
2006年,张永顺等人研制了一种泳动微型机器人 [15] ,如图12所示,该机器人应用仿生学原理,以超磁致伸缩薄膜作为该微型机器人的鱼尾鳍,其驱动器质量轻,响应频率快、位移变形大,可以运送药物到达患处应用于诊疗。
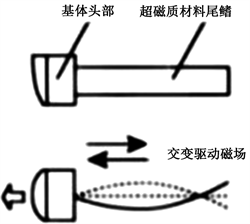
Figure 12. Giant magnetostrictive membrane driven micro robot for swimming
图12. 超磁致伸缩薄膜驱动泳动微型机器人
2011年,韩国的Donghak Byun等人研制了一种由两对亥姆霍兹线圈系统驱动的微型游泳机器人 [16] ,如图13所示。该机器人长11.3 mm~19.3 mm,宽1.44 mm和高3 mm。通过两对亥姆霍兹线圈利用外部交变磁场产生推进力和转向力,使用EMA系统(电磁驱动系统)能够为微型机器人产生无线驱动力,微型机器人由位于微型机器人体内的小尺寸永磁体驱动,所以微型机器人可以小型化,有望用于医疗应用中。

Figure 13. Micro swimming robot driven by Helmholtz coil system
图13. 亥姆霍兹线圈系统驱动的微型游泳机器人
2.2.4. 仿细菌鞭毛驱动机器人
由于采用柔性桨和螺旋桨的人造细菌鞭毛(ABF)驱动血管机器人,在血液环境下具有高效和高适应性。因此许多科研人员提出了基于鞭毛运动的微泳动方法用于血管机器人。
2008年,南京航空航天大学白辰等人为验证精子推进的理论结果,研制了游泳机器人放大样机,并用硅油模拟生物管对其进行了表征。研制了一种仿精子游动的介入微机器人 [17] ,如图14所示。该机器人通过控制四个鞭毛在液体中旋转。当鞭毛旋转的方向一致时液体产生推力,微机器人获得前进的驱动力。实验结果表明,仿精子驱动微型机器人可以有效地控制游动。
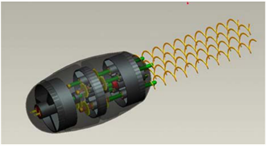
Figure 14. Imitated spermatozoon driven interventional Microrobot
图14. 仿精子驱动的介入微机器人
2009年,加拿大的Scogna J和Olkowski J研制了一种仿大肠杆菌运动的微型机器人 [18] ,如图15所示。该机器人根据大肠杆菌的运动原理,机器人头部可以用来携带药物,尾部的鞭毛使用磁性材料制作,利用外部三维磁场来驱动鞭毛旋转,旋转鞭毛产生推进力。机器人的定向运动通过控制鞭毛丝实现,通过一个高速相机和一个特定的旋转磁场(通过调整提供的电压和频率产生)提供了实时有效控制。

Figure 15. Robot simulating Escherichia coli movement
图15. 仿大肠杆菌运动机器人
2.2.5. 螺旋驱动机器人
螺旋驱动机器人是通过尾部形成的螺旋波为血管机器人提供推进力,科研人员通过实验表明螺旋鞭推进优于柔性桨推进,是一种良好的驱动方式。
2004年,日本M. Sendoh等人研制了一种医用螺旋式磁性微致动器 [19] ,如图16所示。磁体和螺旋结构组成的磁致动器可以通过施加外部旋转来无线移动。通过改变磁场的旋转平面,可以控制磁执行器的方向。因此,这些致动器有望在医学上应用。
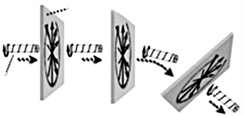
Figure 16. Medical spiral magnetic micro actuator
图16. 医用螺旋式磁性微致动器
2012年,广州大学江帆等人研制了双螺旋驱动的血管机器人 [20] ,如图17。该机器人可以通过6mm的血管。双螺旋结构有助于提高血管机器人运动的灵活性,其两端为两个锥螺旋鞭毛,主体为圆柱体(电机和齿轮装配),锥端为电机,鞭毛由电机通过齿轮和轴驱动。通过螺旋鞭毛的正反转来控制机器人前进和后退。
2016年,羌府等人研制了一种采用电磁驱动系统的螺旋运动微机器人 [21] ,如图18所示,该微型机器人由基于阿基米德螺旋结构的螺旋外壳和用于致动器的O形环磁体组成。阿基米德螺杆结构由于磁场和嵌入的磁体产生的扭转力矩而产生轴向推进力,所述扭转力矩沿着轴向旋转。
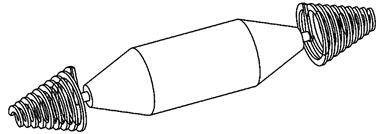
Figure 17. Double helix driven vascular robot
图17. 双螺旋驱动的血管机器人
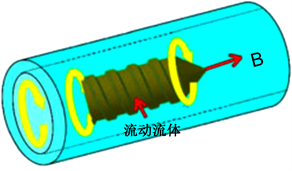
Figure 18. Spiral motion micro robot
图18. 螺旋运动微机器人
2018年,Seungmin Lee等人研制了一种用于靶向药物和细胞递送的胶囊型微机器人 [22] 如图19所示,机器人长290 μm,宽83 μm。由磁性操纵器无线控制,微型机器人的整个身体在旋转磁场(RMF)中经历螺旋运动。因此,胶囊型微型机器人可以输送悬浮或粘附细胞。

Figure 19. Capsule type Microrobot
图19. 胶囊型微机器人
3. 血管机器人特点与关键技术
3.1. 血管机器人驱动方式特点
纳米机器人自身的特殊性质以及微小尺寸,它在药物运输领域拥有巨大潜力,而在纳米机器人技术的应用过程中,最突出的风险是用于制造纳米机器人的纳米颗粒的安全性问题 [23] 。对于MEMS机器人而言,蠕动的运动方式结构简单、耗能少、驱动力大等优点,但运动效率低,对管壁有一定损伤。仿生游动机器人在血管特殊条件下有巨大的应用前景,驱动力大,但结构较复杂,且无法精准定位。仿细菌鞭毛在血液环境下灵活性较好,且具有高效、高适应性,但结构复杂难以控制。外部磁场驱动的血管机器人具有无线控制与无线能源供应,但也难以精准控制且容易受信号衰减等影响。现如今,大多数的血管机器人仅仅能实现简单的运动,很多实验成果还停留在实验室阶段,还未能造福人们。随着纳米机电系统(NEMS)技术和微电子机械系统(MEMS)的发展,血管机器人功能进一步完善后,能为心血管疾病治疗带来了新的希望。
3.2. 血管机器人的关键技术问题
1) 血管机器人安全性问题
血管机器人应用在医疗领域,由于血管等体内管道,曲折复杂细致多变,确保血管机器人的安全性是首要任务。因此在设计制造血管机器时,首先必须为血管机器人设计保护措施,保证在异常的状态下,机器人能够主动或受控制动,保证患者的安全。
2) 血管机器人能源供给问题
对于血管机器人而言,有缆供电缺陷较大,与传统介入导管相似,缆线降低机器人的灵活性,活动受阻,且容易伤及人体器官。无缆驱动机器人在如何选择能源与传动方式上是一大难题。机器人无缆能源驱动主要靠微电池和外加能量场,随着MEMS技术的发展,高容量微型电池或许是解决微机器人能源问题的一种途径,外部磁场虽可持续供应能量,但较难精确控制,有待更深入地研究 [24] 。
3) 血管机器人导航定位问题
传统血管手术器械在手术过程中主要是由医生在导管尾端控制,操作难度大,系统定位不精确。血管机器人灵活性高,体积小,但对于系统三维定位精度要求更高,因此解决好血管机器人的导航定位问题,使得血管机器人能精确到达特定位置,减少血管手术难度,才能提高手术质量,保证手术的安全性,准确率。
4) 血管机器人控制问题
由于血管内环境复杂,机器人的体积小,能量有限,要实现对机器人的精确控制十分困难。另外,人机交互困难,医生常常难以对机器人进行实时控制。对于血管介入手术,需要血管机器人在封闭的血管内完成药物投放与信息采集时,血管机器人需要高度的自主控制能力,才能进一步提高血管机器人的作用。
要使机器人在血管内正常工作,在弯曲分叉结构复杂的柔软血管与复杂的血液条件下,机器人能安全的完成各种诊疗操作,首先要考虑机器人微型化问题,在微型化的同时也要充分考虑避免造成血管损伤,包含材料与血液的相容性与驱动时对管壁的保护措施。其次考虑到厘米级的机器人运动主要受惯性力和其他体力的控制,而血管机器人的运动主要受表面积相关的力,如摩擦力、粘附力、阻力和粘性力等,如何对机器人进行可控稳定的控制也是关键技术难题之一,并且机器人最好能够与医生有良好的人机信息交换。最后是血管结构对血流流动参数产生影响,也会对血管机器人外流场产生影响 [25] 。
4. 结语
血管机器人是多学科交叉的研究领域,涉及机械、电子、生物、医学和通信等方面的技术。从国内外的研究来看,目前血管机器人大部分仍属于实验室阶段,许多研究成果由于技术的不完善,价格昂贵,未能得到广泛应用。但随着微电子机械系统(MEMS)和纳米机电系统(NEMS)技术的发展,血管机器人会不断的完善能快速且精确的到达患处进行诊疗,这门技术便会开始造福人们。
文章引用
曾志坚,邓亚博,黄永聪,熊 娟,胡中伟. 血管机器人研究现状与关键技术问题分析
Research Status and Key Technology Analysis of Vascular Robots[J]. 机械工程与技术, 2018, 07(06): 462-472. https://doi.org/10.12677/MET.2018.76057
参考文献
- 1. Jager, E.W., Inganäs, O. and Lundström, I. (2000) Microrobots for Micrometer-Size Objects in Aqueous Media: Potential Tools for Single-Cell Manipulation. Science, 288, 2335-2338. https://doi.org/10.1126/science.288.5475.2335
- 2. Zhu, Y., Shi, J., Shen, W., et al. (2010) Stimuli-Responsive Controlled Drug Release from a Hollow Mesoporous Silica Sphere/Polyelectrolyte Multilayer Core-Shell Structure. Angewandte Chemie International Edition, 117, 5213-5217. https://doi.org/10.1002/ange.200501500
- 3. 佚名. 美研制出纳米机器人可清理动脉血管垃圾[J]. 科技传播, 2010(10): 16.
- 4. Li, D., Choi, H., Cho, S., et al. (2015) A Hybrid Actuated Microrobot Using an Electromagnetic Field and Flagellated Bacteria for Tumor-Targeting Therapy. Biotechnology & Bioengineering, 112, 1623-1631. https://doi.org/10.1002/bit.25555
- 5. 王多. MEMS发展应用现状[J]. 才智, 2011(22): 70.
- 6. 白绍平, 汪劲松. 小型蠕动机器人原理与实现[J]. 机器人, 1994, 16(3): 140-143.
- 7. Nakazato, Y., Sonobe, Y. and Toyama, S. (2010) Development of an In-Pipe Micro Mobile Robot Using Peristalsis Motion. Journal of Mechanical Science & Technology, 24, 51-54. https://doi.org/10.1007/s12206-009-1174-x
- 8. 徐从启, 解旭辉, 戴一帆, 等. 一种新型蠕动式微小管内机器人的研制[J]. 机械设计与研究, 2008, 24(6): 42-45.
- 9. Ueno, S., Takemura, K., Yokota, S., et al. (2014) Micro Inchworm Robot Using Elec-tro-Conjugate Fluid. Sensors & Actuators a Physical, 216, 36-42. https://doi.org/10.1016/j.sna.2014.04.032
- 10. Mojarrad, M. and Shahinpoor, M. (1997) Biomimetic Robotic Propulsion Using Polymeric Artificial Muscles. IEEE International Conference on Robotics and Automation, 3, 2152-2157.
- 11. Tsuruta, K., Sasaya, T. and Kawahara, N. (2001) In-Pipe Wireless Micro Robot. Pro-ceedings of SPIE—The International Society for Optical Engineering, 3834, 166-171. https://doi.org/10.1163/156856301760132150
- 12. Guo, S., Okuda, Y. and Asaka, K. (2005) Hybrid Type of Underwater Micro Biped Robot with Walking and Swimming Motions. IEEE International Conference on Mechatronics and Automation, 3, 1604-1609.
- 13. Wang, Y., Wang, Z. and Li, J. (2011) Initial Design of a Biomimetic Cuttlefish Robot Actuated by SMA Wires. Inter-national Conference on Measuring Technology & Mechatronics Automation, 425-428.
- 14. Mei, T., Chen, Y., Fu, G., et al. (2002) Wireless Drive and Control of a Swimming Microrobot. Proceedings of the IEEE International Conference on Robotics and Automation, 1131-1136.
- 15. 张永顺, 李海亮, 王惠颖, 等. 超磁致伸缩薄膜驱动仿生游动微型机器人[J]. 机器人, 2006, 28(2): 76-82.
- 16. Byun, D., Choi, J., Cha, K., et al. (2011) Swimming Microrobot Actuated by Two Pairs of Helmholtz Coils System. Mechatronics, 21, 357-364. https://doi.org/10.1016/j.mechatronics.2010.09.001
- 17. Chen, B., Liu, Y.D., Chen, S., et al. (2008) A Biomimetic Spermatozoa Propulsion Method for Interventional Micro Robot. Journal of Bionic Engineering, 5, 106-112. https://doi.org/10.1016/S1672-6529(08)60080-3
- 18. Scogna, J., Olkowski, J., Fatema, N., et al. (2011) Biologically Inspired Robotic Microswimmers. 37th Annual Northeast Bioengineering Conference, Troy, 1-3 April 2011, 1-2.
- 19. Sendoh, M., Yamazaki, A., Chiba, A., et al. (2004) Spiral Type Magnetic Micro Actuators for Medical Applications. International Symposium on Mi-cro-Nanomechatronics and Human Science, 2004 and the 4th Symposium Micro-Nanomechatronics for Information-Based Society, Nagoya, 31 October-3 November 2004, 319-324.
- 20. 江帆, 何华. 双螺旋驱动的血管机器人绿色设计[J]. 广州大学学报(自然科学版), 2012, 11(1): 87-95.
- 21. Fu, Q., Guo, S., Huang, Q., et al. (2016) Development and Evaluation of Novel Magnetic Actuated Microrobot with Spiral Motion Using Electromagnetic Actuation System. Journal of Medical & Biological Engineering, 36, 1-9. https://doi.org/10.1007/s40846-016-0147-7
- 22. Lee, S., Kim, S., Kim, S., et al. (2018) A Capsule-Type Microrobot with Pick-and-Drop Motion for Targeted Drug and Cell Delivery. Advanced Healthcare Materials, 7, e1700985. https://doi.org/10.1002/adhm.201700985
- 23. 张楚熙. 纳米机器人的现状与发展[J]. 电子技术与软件工程, 2018(13).
- 24. 张永顺, 刘巍, 张瑞侠, 等. 外磁场驱动医用微型机器人的研究现状与展望[J]. 机器人, 2005, 27(3): 87-92.
- 25. 江帆, 黄春燕, 王一军, 等. 血管结构对血管机器人外流场的影响研究[J]. 科学技术与工程, 2014, 14(2): 8-13.