Botanical Research
Vol.
09
No.
05
(
2020
), Article ID:
37763
,
6
pages
10.12677/BR.2020.95061
大叶榕组培快繁技术研究初报
黎东均,詹启成*,蒋雄辉,周博,陆小康
佛山市三水阳特园艺有限公司,广东 佛山

收稿日期:2020年8月29日;录用日期:2020年9月16日;发布日期:2020年9月23日

摘要
目的:利用组培培养研究大叶榕的快速繁殖,以满足市场对该植物的需求。以大叶榕茎尖或幼嫩的茎段为外植体,选择不同培养基和激素配比,初步建立大叶榕组培快繁体系,并进行对比试验;结果表明:(1) 用75%酒精消毒60 S、0.1% HgCl2消毒35 min方法较适合大叶榕外植体的离体快繁;(2) 诱导出芽培养基:1/2 MS + 6-BA 0.5 mg/L + TIBA 1.0 mg/L;(3) 继代培养基:MS + 6-BA 5.0 mg/L或1/2 MS + 6-BA 5.0 mg/L,增殖倍数为3.1~3.2倍;(4) 生根培养基:MS基本培养基,生根率可达100%,生根周期为7~15天。
关键词
大叶榕,组织培养,快繁
Study on Tissue Culture and Rapid Propagation of Ficus umbellata
Dongjun Li, Qicheng Zhan*, Xionghui Jiang, Bo Zhou, Xiaokang Lu
Foshan Sanshui Youngplants Co. Ltd., Foshan Guangdong
Received: Aug. 29th, 2020; accepted: Sep. 16th, 2020; published: Sep. 23rd, 2020

ABSTRACT
The aim of the research was to breed Ficus umbellata by using tissue culture and rapid propagation technologies and meet the demands of flower market to this plant. With shoot tip or young stem segments of Ficus umbellata as explants, different medium and hormone combinations were selected to set up the tissue culture and rapid propagation system of F. umbellata preliminarily and make a comparative test. The result showed that: (1) The more suitable sterilization method of in vitro rapid propagation of F. umbellata was treating with 75% alcohol for 60 s and 0.1% HgCl2 for 35 min; (2) The medium for bud differentiation was 1/2 MS + 0.5 mg/L 6-BA + 1.0 mg/L TIBA; (3) The medium for successive transfer culture medium was MS + 5.0 mg/L 6-BA or 1/2 MS + 5.0 mg/L 6-BA, and under this culture medium the multiplication coefficient of 3.1 - 3.2 was achieved. (4) The optimum rooting medium was MS, and under this culture medium rooting rate of 100% was achieved and the rooting cycle for 7 - 15 days.
Keywords:Ficus umbellata, Tissue Culture, Rapid Propagation

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
桑科榕属,全球约800多种 [1],原产于印度、马来西亚、等热带和亚热带地区 [2],是绿化优良的行道树、风景树 [3],在城市园林绿化、美化中被广泛应用 [4] [5]。大叶榕(Ficus umbellata),别名爱心榕、观音树、伞榕,常绿室内观叶植物,乔木,高可达10米,树皮光滑呈浅灰色,枝干有较强的直立单干性,少分枝,且枝条有一定的柔韧性。单叶互生,薄纸质,叶片巨大呈心形,叶径可达30厘米,叶脉清晰,叶缘微波浪。大叶榕原产于非洲西部到中部的热带洼地,目前国内并不常见,是优良的园林绿化树种,同时可开发成中大型盆栽。当前的繁殖方式主要是扦插繁殖,但是扦插繁殖慢,且扦插成功率低,使大叶榕规模化生产受到很大的限制,本文通过组培快繁技术,可向市场提供大量的大叶榕种苗,从而满足市场的需求,获得较好的经济效益和社会效益。
2. 材料与方法
2.1. 材料
大叶榕,种植于佛山市三水阳特园艺有限公司的大树。
2.2. 方法
1) 外植体消毒:摘取户外乔木大叶榕的茎尖,置于干净的碟子中晾放至茎尖和茎段稍微变软,用酒精消毒过的手术刀环割掉茎尖上的苞叶,再用酒精棉轻轻擦拭外植体表面的灰尘,再置于无菌玻璃瓶中,在超净工作台上用75%酒精和0.1% HgCl2消毒,具体方法如下:① 酒精消毒20 s、0.1% HgCl2消毒30 min;② 酒精消毒40 s、0.1% HgCl2消毒20 min;③ 酒精消毒30 s、0.1% HgCl2消毒30 min;④ 酒精消毒40 s、0.1% HgCl2消毒35 min。无菌水冲洗4~5次,切成带1~2个节的小段,进行接种。
2) 诱导出芽:将消毒后的外植体接种至MS + 6-BA 0.5 mg/L培养基上进行出芽。30天后,无菌外植体长出侧芽,将已有2 cm长及以上的的侧芽切下接种于MS + 6-BA 0.5 mg/L中继续诱导出丛芽。培养温度(25 ± 1)℃,光照时间12 h/d,光照强度1000~3000 lx。
3) 继代培养:将1~2代的丛生芽切成一个个小芽,接种于继代增殖培养基上进行扩繁。具体的增殖培养基如下:① MS + 6-BA 3 mg/L;② MS + 6-BA 5 mg/L;③ MS + CPPU 0.1 mg/L;④ MS + CPPU 0.5 mg/L;⑤ 1/2 MS + 6-BA 3 mg/L;⑥ 1/2 MS + 6-BA 5 mg/L;⑦ 1/2 MS + CPPU 0.1 mg/L;⑧ 1/2 MS + CPPU 0.5 mg/L。其中,每种培养基附加30 g/L蔗糖,5.5 g/L卡拉胶,pH值调至6.0~6.2。每种培养基配制15瓶,每瓶接种8个单芽增殖。培养温度(25 ± 1)℃,光照时间12 h/d,光照强度1000~3000 lx。
4) 生根:生根培养基以MS为基本培养基,分别添加不同浓度的活性炭AC和萘乙酸NAA,共计6个处理,如下:A) MS;B) MS + AC 0.5 g/L;C) MS + AC 1.0 g/L;D) MS + NAA 0.1 g/L;E) MS + NAA 0.3 g/L;F)MS + NAA 0.5 g/L。每个处理5瓶,每瓶接种12株,从增殖苗中切下1~2 cm的单株接种。培养温度(25 ± 1)℃,光照时间12 h/d,光照强度1000~3000 lx。
5) 驯化移栽:当生根苗生根率达到95%以上、根长到1 cm以上、形态已显健壮,可将苗移除组培室进行驯化移栽。将苗取出放于平筛中,在清水下冲洗干净附着在根上的培养基,将洗净的苗浸泡于1000倍的甲基托布津药液30S后再拿出种植。以5~20 mm规格的品氏泥炭为基质,用1000倍的甲基托布津药液拌土,而后基质装入128孔穴盘中,苗竖直种植于穴孔中,种完后放置于具有水帘风机温室中养护,最适环境控制:温度22℃~28℃,湿度60%~80%,光照6000~18,000 lux。
3. 结果与分析
3.1. 不同消毒方式对大叶榕无菌体获得的影响
由表1可知:处理1和处理3比较,0.1% HgCl2消毒时间同为30 min的情况下,75%酒精消毒为30 s处理的污染率比较低,但是效果也较差,污染率也高达75%;处理2和处理4比较,75%酒精消毒时间同为40 s的情况下,0.1% HgCl2消毒时间为35 min的处理污染率较低,而0.1% HgCl2时间为20 min处理的污染率为100%。其中,四个处理的外植体没有出现死亡情况,原因是消毒时间不够长,还在大叶榕茎尖可承受范围内。综合来说,75%酒精40 s + 0.1% HgCl2对大叶榕的消毒效果最佳(图3(A))。
Table 1. Effects of different disinfection methods
表1. 不同消毒方式的效果
3.2. 不同基本培养基和不同浓度激素对大叶榕不定芽增殖的影响
由表2可知,芽增殖倍数均随着6-BA的浓度和CPPU的浓度提高而稍微增加,6-BA处理的增殖倍数比CPPU处理的增殖倍数稍微大点,而经方差分析的多重比较可知,这8个处理的增殖倍数没有显著差异,MS基本培养基和1/2基本培养基对大叶榕增殖的影响没有差异;当增殖激素为6-BA时,芽正常、但成苗小且少,大叶榕增殖苗在6-BA浓度为3 mg/L比在浓度为5 mg/L时芽更小、粉末的无效愈伤更多;而当增殖激素为CPPU时,,芽体呈现扭曲状态、成苗叶片畸形,且浓度越大(≥0.1 mg/L)苗畸形越严重。综合来说,培养基MS+6-BA 5 mg/L或1/2+6-BA 5 mg/L较适合大叶榕的芽增殖培养(图3(B))。
3.3. 不同培养基对大叶榕试管苗生根的影响
由表3可知,试管苗生根30天后,处理1和处理4、5、6的生根率均达到100%,生根率最低的为处理3、即添加1 g/L的AC培养基,与其他处理均有显著差异,而其他处理间没有显著差异,且其根数和根长随着AC和NAA的浓度的升高而呈现下降的趋势;见图1,当培养基中添加物为AC时,根尖及基部变黑,不利于移栽,且随着AC浓度提高越严重;当添加物为NAA时,根多且短粗、且基部膨大呈团块、且苗玻璃化,不利于移栽,且随着NAA浓度提高情况越严重。见图2,处理1的生根最快,生根7天,生根率已达到63.3%,其次是处理4,生根率已达到50%,而随着NAA和AC浓度的升高,生根越慢、生根周期越长。综合来说,AC处理效果比NAA处理效果差,而MS培养基无任何添加物时,大叶榕的生根率、根数和根长均最佳,较适合大叶榕的生根培养基。
Table 2. Effects of different concentrations of basic media and hormones on the bud proliferation of Ficus umbellata*
表2. 不同浓度基本培养基和激素对大叶榕芽增殖的影响*
注:*同一列不同字母表示在0.01或0.05水平上差异显著。
Table 3. Effects of different media on rooting of test-tube seedlings of Ficus umbellata*
表3. 不同培养基对大叶榕试管苗生根的影响*
注:*同一列不同字母表示在0.05水平上差异显著。

Figure 1. Tissue culture rooting seedlings of Ficus umbellata under different treatments
图1. 不同处理的大叶榕组培生根苗
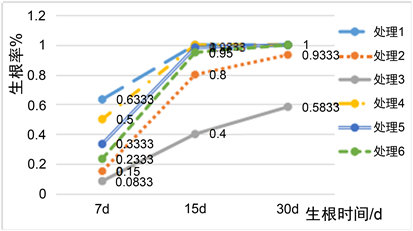
Figure 2. Rooting rates of test-tube seedlings of Ficus umbellata at different rooting times under different media
图2. 不同培养基下大叶榕试管苗不同生根时间的生根率
3.4. 驯化移栽
当组培生根苗长至2~4 cm高时(图3(C)),在散光条件下炼苗3天或不进行炼苗可直接种植,打开瓶盖,用镊子把苗从培养瓶中取出放在平筛中,在清水下冲洗干净根部培养基,再浸泡于1000倍的甲基托布津药液30 S,移栽入装有5~20 mm规格泥炭的128孔穴盘中(图3(D)),浇定根水后放入温室中养护。生根期注意叶面喷雾、不浇肥,补清水,成活后每周浇一次20-10-20水溶肥,成活率可达95%以上,注意调控植株株型,大叶榕长势快易发生徒长,移栽后月45天可上盆栽培(图3(E))。
 注:(A) 出芽诱导;(B) 继代培养;(C) 生根;(D) 移栽驯化;(E) 盆栽
注:(A) 出芽诱导;(B) 继代培养;(C) 生根;(D) 移栽驯化;(E) 盆栽
Figure 3. Different stages of tissue culture and rapid propagation of Ficus umbellata
图3. 大叶榕组培快繁的不同阶段
4. 讨论
1) 大叶榕母树生长于户外,外植体接触的污染物较多,本次在此研究中,大叶榕外植体的消毒成功率不是很高,尚还有可继续研究空间。
2) 对大叶榕组培苗继代培养发现,经过长期在MS + 6-BA 5 mg/L培养基上丛生继代繁殖,会造成细胞分裂素积累现象,主要表现在继代的组培苗丛生能力特别强、而株高不够、成苗较少、且部分芽上会长出粉末状的无效愈伤,这既影响后代的增殖又给后期生根带来不便,当出现这情况时,要适当降低6-BA的使用浓度,以便在出苗时得到适宜生根的组培苗。目前,在大叶榕组培苗增殖培养基上使用单激素培养,这还不是最好的方法,这方面的研究还可再继续深入探讨,在此基础上寻找更佳的增殖激素配比。
3) 对大叶榕组培苗生根培养发现,大叶榕组培生根苗对活性炭非常敏感,在添加后活性炭的壮苗培养基或生根培养基中,大叶榕组培苗长势慢、苗长不大、生根差,而当活性炭浓度大于0.5 mg/L时,苗基部发黑、黄叶、掉叶,因此大叶榕的生根培养基不宜使用活性炭,若必要时,活性炭浓度不能超过0.5 mg/L。
基金项目
广东省现代种业提升工程项目粤农计[2017] 42号。
文章引用
黎东均,詹启成,蒋雄辉,周 博,陆小康. 大叶榕组培快繁技术研究初报
Study on Tissue Culture and Rapid Propagation of Ficus umbellata[J]. 植物学研究, 2020, 09(05): 487-492. https://doi.org/10.12677/BR.2020.95061
参考文献
- 1. 中国科学院华南植物研究所. 广东植物志[M]. 广州: 广东科技出版社, 1987: 186-214.
- 2. 姚君兆, 黄玲燕. 花卉栽培学讲义[M]. 北京: 中国林业出版社, l987: 362-363.
- 3. 黄月明. 榕树在园林中的应用[J]. 吉林农业, 2010(6): 212-214.
- 4. 蒋谦才, 黄悦朝, 李增祥. 广东榕属观赏植物资源及其开发利用[J]. 亚热带植物科学, 2004, 33(4): 48-51.
- 5. 丁印龙, 谭忠奇, 林益明. 厦门引种的榕属植物资源及其园林应用[J]. 亚热带植物科学, 2008, 37(4): 51-54.
NOTES
*通讯作者。
