Botanical Research
Vol.
13
No.
02
(
2024
), Article ID:
83373
,
10
pages
10.12677/br.2024.132018
大果木姜子LlTPS11基因克隆及生物信息学 分析
孔德静#,梁进丽#,鞠志刚*
贵州中医药大学药学院,贵州 贵阳
收稿日期:2024年1月26日;录用日期:2024年3月12日;发布日期:2024年3月27日

摘要
大果木姜子为贵州十大苗药之一,因其挥发油具有独特的香味及药用价值,被广泛应用于食品、药品行业。萜类化合物是植物中重要的次级代谢产物,可影响果实风味和花香,并间接起预防虫害的作用。大果木姜子挥发油主要为萜类物质,萜类合酶(TPS)是萜类物质的合成途径中关键基因。本文以大果木姜子为研究对象,克隆出LlTPS11的全长编码序列。利用生物信息学分析软件对LlTPS11氨基酸序列进行分析,结果表明,LlTPS11编码区序列长1692 bp,编码563个氨基酸,分子质量为65.41 kDa,LlTPS11属不稳定亲水性的酸性蛋白。不具有跨膜结构域及信号肽。该蛋白二级结构中主要含有α-螺旋67.32%,结果与三级结构预测结果一致。LlTPS11具有植物萜烯环化酶催化活性位点,与沉水樟萜类合酶CmTPS具有较高同源性。综上所述,本文对大果木姜子萜类合酶基因进行初步研究,为进一步研究萜类物质合成代谢途径及樟科植物中萜类物质提供理论依据。
关键词
大果木姜子,萜类合酶,基因克隆,生物信息学分析

Cloning and Bioinformatics Analysis of LlTPS11 Gene in Cinnamomum migao H. W. Li
Dejing Kong#, Jinli Liang#, Zhigang Ju*
Pharmacy School, Guizhou University of Traditional Chinese Medicine, Guiyang Guizhou
Received: Jan. 26th, 2024; accepted: Mar. 12th, 2024; published: Mar. 27th, 2024

ABSTRACT
Cinnamomum migao H. W. Li is one of the top 10 Miao medicines in Guizhou Province. Its volatile oil is widely used in food and medicine industry because of its unique flavor and medicinal value. Terpenes is an important Secondary metabolite in plants. It can affect fruit flavours and floral aroma and indirectly prevent pests. Terpenoid synthase (TPS) is a key gene in the synthetic pathway of terpenoids, and the main components of essential oil in the Cinnamomum migao H. W. Li are terpenoids. In this paper, the full-length coding sequence of LlTPS11 was cloned from Cinnamomum migao H. W. Li .Bioinformatics analysis of the protein encoded by LlTPS11 showed that the open reading frame of 1692 bp, encoding 563 amino acids residues, the molecular weight of the protein was 39.22 kDa. The LlTPS11 protein was an acidic protein with no signal peptide recognition function and no transmembrane region. LlTPS11 was an acidic protein with unstable hydrophilicity. The secondary structure of the protein mainly contains α-helix (67.32%), which is consistent with the prediction of the tertiary structure. LlTPS11 has the catalytic activity site of Terpene cyclase plant C1 and has high homology with CmTPS (Cinnamomum micranthum). To sum up, the article studied the Cinnamomum migao H. W. Li terpenoid synthase gene, which provides a theoretical basis for further study on the pathway of terpenoid biosynthesis and the terpenoids in Lauraceae plants.
Keywords:Cinnamomum migao H. W. Li, Terpenoid Synthase, Gene Cloning, Bioinformatics Analysis

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
大果木姜子为米槁(Cinnamomum migao H. W. Li)的干燥成熟果实,属樟科樟属植物,主要分布于贵州、云南、广西等省 [1] 。大果木姜子作为药食两用植物具有温中散寒、理气止痛等功效,临床上主要用于冠心病、心绞痛等心血管疾病及胃肠道疾病的治疗,且具有极好的抗氧化作用 [2] 。以大果木姜子为原料开发出米稿心乐滴丸、理气活血滴丸、米稿精油滴丸、心胃丹胶囊等制剂 [3] 。在体外抑菌实验中发现,大果木姜子挥发油对幽门螺杆菌有较强的抑制作用。在民间,大果木姜子常作为调味品使用,起健脾开胃的效果。大果木姜子挥发油为其主要药效及食用部位,主要含有单萜类,倍半萜类物质,如桉油精、香桧烯、(−)-β-蒎烯、(+)-α-蒎烯、(−)-α-蒎烯、β-石竹烯、δ-杜松烯等。此外,还有酮类、芳香烃类及环氧化合物 [4] 。目前,大果木姜子野生资源日渐枯竭,对其萜类物质合成途径中关键酶基因的挖掘研究具有重要意义。
萜类化合物具有多种生理和生化活性,在植物适应环境、抵御天敌、传递信号等方面发挥重要的作用,可作为天然植物源农药的重要来源。青蒿素、紫杉醇、植物甾醇等萜类物质都对不同病症具有显著疗效 [5] 。萜类化合物由单个或多个异戊二烯单元组成,其合成途径主要分为三步:首先,合成异戊烯基焦磷酸(IPP)及其异构体二甲基烯丙基二磷脂(DMAPP)前体物质;而后,合成牦牛儿基焦磷酸(GPP)、法尼基焦磷酸(FPP)和牦牛儿牦牛儿基焦磷酸(GGPP)等。最后,通过不同的酶合成丰富多样的萜类化合物并进行修饰 [6] 。萜类合酶是萜类化合物合成的关键酶,已在多种植物中被克隆出来,如雷公藤TwMTS能催化GPP生成β-香茅醇,结球甘蓝BoGES以GGPP为底物生成香叶基芳樟醇,樟树中存在大量的TPS基因,可催化GPP生成冰片基焦磷酸、芳樟醇和1,8-桉叶油,还可与FPP反应生成橙花叔醇 [7] [8] [9] 。本课题组前期测得大果木姜子转录组数据,在此实验基础上,从大果木姜子中克隆到一个萜类合酶基因LlTPS11,对其进行生物信息学分析,以期为解析大果木姜子中萜烯类物质的生物合成机制提供理论依据。
2. 材料与方法
2.1. 材料
大果木姜子采自贵州省罗甸县,Jm109感受态由本实验室自行保存。植物RNA提取试剂盒购于康为世纪生物科技有限公司,pMD18-T、BamH I、Hind III限制性核酸内切酶及PrimeScript™ Ⅱ 1st Strand cDNA Synthesis Kit试剂盒购于宝日医生物技术(北京)有限公司,琼脂糖、质粒小提试剂盒、琼脂糖凝胶回收试剂盒购于天根生化科技(北京)有限公司购于生工生物工程(上海)股份有限公司,基因克隆引物由武汉金开瑞生物工程有限公司合成。
2.2. 方法
2.2.1. RNA提取及cDNA 合成
取约50~100 mg大果木姜子,在液氮中将其研磨粉碎,利用植物RNA提取试剂盒提取大果木姜子总RNA,用超微量紫外分光光度计检测其浓度。利用PrimeScript™ Ⅱ 1st Strand cDNA Synthesis Kit试剂盒将所提取的大果木姜子总RNA反转录成cDNA,测定浓度,−20℃冻存备用。
2.2.2. LlTPS11基因克隆
Table 1. Primers sequence used in this study
表1. 引物序列
Table 2. PCR amplification program
表2. PCR扩增程序
使用Primer 5软件对LlTPS11基因序列分析,设计基因特异性引物(表1)。以反转录得到的cDNA为模板进行按表2中PCR程序扩增,用1%的琼脂糖凝胶电泳初步判断目的基因条带,利用PCR产物纯化试剂盒回收目的片段,经B500超微量紫外分光光度计检测其浓度和纯度后,与pMD18-T 16℃连接16 h,次日转入Jm109感受态细胞中。挑取单克隆进行菌液PCR验证,并进行BamH I、Hind III双酶切鉴定,重组质粒送生工生物工程(上海)股份有限公司进行测序,运用DNAMAN将测序拼接结果与转录组数据进行比对。
2.2.3. LlTPS11生物信息学分析
利用表3中生物信息学软件对LlTPS11蛋白序列的开放阅读框、相对分子质量、氨基酸序列、等电点、不稳定系数、亲水性等理化性质,以及蛋白质二级、三级结构进行分析,
通过NCBI选择不同植物的TPS序列,利用DNAMAN进行多序列分析,并利用MEGA7.0软件采用邻接法(NJ)构建LlTPS11的分子进化树。
Table 3. Bioinformatics analysis
表3. 生物信息学分析
3. 结果与分析
3.1. LlTPS11全长CDS序列克隆
以大果木姜子cDNA为模板,用设计的引物进行扩增,获得一条约为1600 bp大小的条带(如图1)。将PCR产物通过琼脂糖凝胶回收试剂盒回收,回收产物与pMD18-T连接,而后转入Jm109感受态,得到重组质粒。重组质粒进行酶切验证后送生工生物有限公司测序,测序结果与转录组序列比对完全一致(如图2)。NCBI OFR分析表明LlTPS11的全长开放阅读框为1692 bp,共编码563个氨基酸。
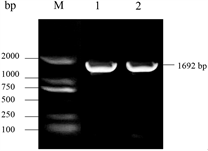
Figure 1. Gene cloning
图1. 基因克隆
注:M:DL2000 DNA Maker;1~2:PCR产物

Figure 2. Alignment sequence
图2. 比对序列
注:LlTPS11-1:拼接结果;LlTPS11-zhuan:转录组序列
3.2. LlTPS11蛋白理化性质
使用Expasy在线分析软件对LlTPS11序列分析,结果显示该基因编码的蛋白质大小为65.41 kDa,带负电荷的残基85,带正电荷的残基65,分子式为C2947H4608N770O868S22,理论等电点为5.29,不稳定指数为42.36,属不稳定蛋白。脂肪指数为96.32。ProtParam结果显示LlTPS11蛋白亲水性总平均值为−0.324,亲水亲油平衡值最低为−3.0,在115号位,亲水亲油平衡值最高为2.6,在424号位,为亲水性蛋白(图3)。

Figure 3. Prediction of hydrophilicity and hydrophobicity of LlTPS11 amino acid
图3. LlTPS11氨基酸亲疏水预测
3.3. LlTPS11蛋白的信号肽、蛋白结构域预测

Figure 4. Signal peptide prediction of LlTPS11 protein
图4. LlTPS11 蛋白的信号肽预测

Figure 5. Domain analysis of LlTPS11 protein
图5. LlTPS11结构域分析
信号肽是蛋白质N-末端一段编码长度为5~30的疏水性氨基酸序列,存在于分泌蛋白、跨膜蛋白和真核生物细胞器内的蛋白中。使用SignalP-5.0预测LlTPS11的信号肽位置,分析结果显示,有信号肽的概率为0.077%,没有信号肽结构,属于非分泌蛋白(图4)。使用在线工具NCBI CD-Search预测LlTPS11蛋白结构域,结果显示其含有Terpene_cyclase_plant_C1保守结构域,属于Isoprenoid_Biosyn_C1超家族(图5)。
3.4. LlTPS11跨膜结构及亚细胞定位预测
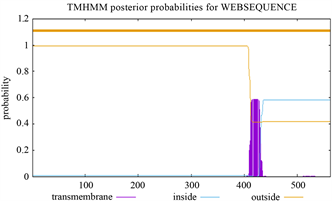
Figure 6. Transmembrane domain prediction of LlTPS11 protein
图6. LlTPS11跨膜区域预测
用TMHMM在线软件分析预测LlTPS11的跨膜结构域,结果显示该蛋白肽链上无跨膜结构域,表明该蛋白属于非跨膜蛋白(图6)。利用Softberry分析预测StGID1的亚细胞定位(图7),结果显示,该蛋白质有较大可能位于细胞质、叶绿体内。
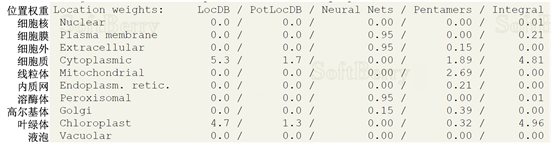
Figure 7. Prediction of LlTPS11 subcellular location
图7. LlTPS11亚细胞定位预测
3.5. LlTPS11蛋白的二级、三级结构预测
SOPMA在线网站显示LlTPS11蛋白的二级结构包含67.32% α-螺旋、4.97%延伸链、3.20% β转角、24.51%无规卷曲(图8(A))。利用在线软件SWISS-MODEL对其三级结构进行预测,结果显示LlTPS11与沉水樟CmTPS (Cinnamomum micranthum f. kanehirae)相似度达70.59%,GMQE为0.91 (图8(B)),与二级结构预测结果一致。

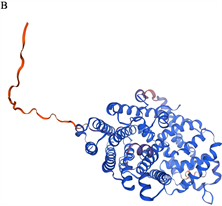
Figure 8. Prediction of the structure of LlTPS11 protein
图8. LlTPS11蛋白结构预测
3.6. LlTPS11多序列比对及系统进化树构建
将LlTPS11与已报道的大豆(Glycine max, XP_04086321.1, XP_014617595.1)、拟南芥(Arabidopsis thaliana, NP_001190374.1)、樟树(Cinnamomum micranthum, RWR94587.1)、玉兰(Magnolia sinica, XP_058104887.1)中TPS家族蛋白序列进行多序列比对,发现LlTPS11及其同源蛋白序列N端均具有保守结构域,富含天冬氨酸的DDxx D基序和NSE/DTE基序(红色方框),表明LlTPS11为I类TPS家族成员(图9)。
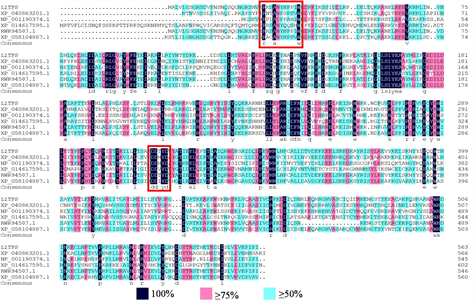
Figure 9. Comparison of TPS amino acid sequences of plants
图9. 多种植物TPS氨基酸序列对比
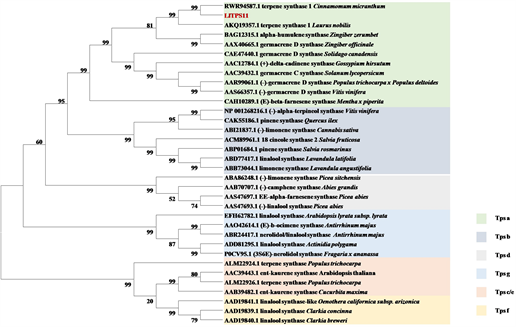
Figure 10.Phylogenetic analysis
图10. 系统进化分析
将LlTPS11与其他植物中已报道的不同亚型的TPS蛋白构建系统进化树,结果表明,LlTPS11与沉水樟(Cinnamomum micranthum)、月桂(Laurus nobilis L.)、红球姜(Zingiber zerumbet)及姜(Zingiber officinale)聚为一支,且与沉水樟关系最近,属TPSa亚家族(图10)。
4. 讨论
现代药理研究表明,大果木姜子挥发油具有抗氧化 [10] 、抗病毒 [11] 、抗炎镇痛 [10] 、抑菌 [12] 等作用,且对心血管系统有一定影响 [13] 。中草药萜烯类化合物多被应用于医药、化妆品、香料、生物燃料及杀虫剂等领域 [14] 。大果木姜子研究主要集中于化学成分、药理药效以及产业化发展等方面,而关于大果木姜子萜类合酶研究鲜有报道 [15] 。
萜类化合物是一类生物自身产生的种类丰富、结构复杂的天然产物家族 [16] 。大果木姜子的风味及功效是由其挥发性萜类化合物决定的,萜类化合物具有多种生理和生化活性,主要为单萜、倍半萜及衍生物,如1,8-桉叶素、α-水芹烯、龙脑、D-柠檬烯和α-松油醇等。单萜类化包含两个异戊二烯单元,根据化学结构可分为环状单萜以及非环形或线形单萜,经不同的单萜合成酶催化香叶基二磷酸酯可生成了不同的单萜。倍半萜是则是由倍半萜合成酶催化法尼基二磷酸酯环化反应而成,紫穗槐-4,11-二烯合成酶(ADS)是倍半萜物质青蒿素生物合成途径中关键限速酶 [17] 。萜类化合物的多样性主要是因为萜类合酶(Terpenoid synthetase, TPS)催化前体物质的环化模式不同,其中催化单萜和倍半萜类生物合成关键酶主要为TPS-a、TPS-b、TPS-g亚家族。目前已从紫丁香 [18] 、温郁金 [19] 、深纹核桃 [20] 等植物中克隆出了TPS基因。
本文克隆得到大果木姜子萜类合酶基因(LlTPS11),并对LlTPS11蛋白序列的理化性质、信号肽、亚细胞定位和亲疏水性等进行分析。分析表明,大果木姜子的LlTPS11基因完整开放阅读框全长1698 bp,共编码563个氨基酸,蛋白分子质量为65.41 kDa,理论等电点5.29。此外,LlTPS11脂肪系数为96.32,不稳定指数为42.36,大于40,则LlTPS11为不稳定蛋白。疏水性预测显示,LlTPS11平均疏水性为−0.324,亲水的蛋白。结合信号肽和跨膜结构域预测分析,该蛋白是一种不稳定的、非跨膜的蛋白。亚细胞定位可将某种蛋白或者表达产物定位于细胞中的具体位置,如细胞核内、各种细胞器以及质膜上,从而为理解基因的作用机制提供研究方向。亚细胞定位分析表明,LlTPS11蛋白最有可能存在于细胞质或叶绿体中。因此,可推断该蛋白在细胞质和叶绿体上发挥作用,进一步调控萜类化合物的合成与积累。结果显示其含有植物萜烯环化酶保守结构域,属于类异戊二烯生物合成酶超家族。蛋白比对显示,LlTPS11肽链N端富含天冬氨酸DDxxD基序和NSE/DTE基序。同时,对大果木姜子的LlTPS11进行系统进化树的构建,发现其TPS-a亚家族具在一起,与沉水樟CmTPS亲缘关系较近高。然而,它是否具有合成单萜和倍半萜功能还需进一步研究。
综上所述,本研究可加强对大果木姜子萜类物质调控机制的认识,特别是萜类合酶的调控,进而为从分子水平增加萜类化合物的种类和含量,并达到改善大果木姜子香味或预功效目的。后期将通过转基因及体外酶活实验对LlTPS11蛋白在体内、体外功能上进行深入研究。
5. 结论
本文克隆到大果木姜子LlTPS11基因,开放阅读框全长1698 bp,共编码563个氨基酸,生物信息学分析表明LlTPS11为不稳定的、亲水性的、非跨膜的蛋白,可能定位于细胞质、叶绿体内。LlTPS11肽链N端富含天冬氨酸DDxxD基序和NSE/DTE基序,属于类异戊二烯生物合成酶家族。大果木姜子LlTPS11进行系统进化树的构建,发现其TPS-a亚家族聚在一起,与沉水樟CmTPS亲缘关系较近高。
基金项目
本研究由贵中医大创合字(2021) 36号、贵州省科技厅基础研究项目(黔科合基础[2019]1019号)和贵州省“千层次”人才项目(贵中医[ZQ2018004])共同资助。
文章引用
孔德静,梁进丽,鞠志刚. 大果木姜子LlTPS11基因克隆及生物信息学分析
Cloning and Bioinformatics Analysis of LlTPS11 Gene in Cinnamomum migao H. W. Li[J]. 植物学研究, 2024, 13(02): 163-172. https://doi.org/10.12677/br.2024.132018
参考文献
- 1. 李锡文. 中国樟科植物志资料(一) [J]. 植物分类学报, 1978, 16(2): 90-92.
- 2. 郑亚玉, 邱德文, 粱光义, 等. 贵州苗药大果木姜子的研究及产业化[J]. 世界科学技术, 2005, 7(2): 112-114.
- 3. 邱德文, 杜茂端. 贵州苗药大果木姜子研究及产业化[J]. 贵阳中医学报, 2003, 25(1): 48-51.
- 4. Huang, X., Chen, J., Liu, J., et al. (2019) Autotoxicity Hinders the Natural Regeneration of Migao H.W. Li in Southwest China. Forests, 10, 919. https://doi.org/10.3390/f10100919
- 5. 黄凯, 刘杰, 黄彩河, 等. 不同来源大果木姜子挥发油及脂肪油成分的比较分析[J]. 中国药房, 2020, 31(16): 1961-1966.
- 6. Jia, Q., Brown, R., Köllner, T.G., et al. (2022) Origin and Early Evolution of the Plant Terpene Synthase Family. Proceedings of the National Academy of Sciences of the United States of America, 119, e2100361119. https://doi.org/10.1073/pnas.2100361119
- 7. 尹艳, 郭思远, 向安娅, 等. 雷公藤中一个合成香茅醇的单萜合酶基因的克隆与表征[J]. 中国中药杂志, 2019, 44(16): 3588-3593.
- 8. 汪一萍, 葛洋, 张译心, 等. 结球甘蓝香叶基芳樟醇合酶基因的克隆及功能分析[J]. 浙江大学学报(农业与生命科学版), 2022, 48(5): 583-593.
- 9. 马青, 马蕊, 苏平, 等. 樟树化学型形成关键萜类合酶的系统鉴定[J]. 中国中药杂志, 2023, 48(9): 2307-2315.
- 10. 郭江涛, 张永萍, 刘杰, 等. 大果木姜子不同部位挥发油成分及其抗氧化活性分析[J]. 食品工业科技, 2023, 44(17): 306-315.
- 11. 胡万福, 张永萍, 邱德文. 复方大果木姜子软胶囊抗流感病毒作用的体外实验研究[J]. 时珍国医国药, 2006(10): 2121-2122.
- 12. 吴碧清, 吴贤倩, 陈丽玄, 等. 苗药大果木姜子挥发油对幽门螺杆菌的体外抑菌实验研究[J]. 中国民族民间医药, 2020, 29(24): 7-11.
- 13. 李亚辉, 杨欣. 贵州大果木姜子对急性心肌缺血损伤的保护作用[J]. 中医药信息, 2020, 37(3): 4-8.
- 14. 苗轶男, 李敬知, 王帅, 等. 萜烯生物合成中关键酶的研究进展[J]. 中国生物工程杂志, 2021, 41(6): 60-70.
- 15. 孙恒灿, 李军, 周智宦, 等. 大果木姜子化学成分、药理作用与产业化研究进展[J]. 中南药学, 2022, 20(3): 668-671.
- 16. Abdallah, I.I., van Merkerk, R., Klumpenaar, E., et al. (2018) Catalysis of Amorpha-4,11-diene Synthase Unraveled and Improved by Mutability Landscape Guided Engineering. Scientific Reports, 8, Article No. 9961. https://doi.org/10.1038/s41598-018-28177-4
- 17. Ajikumar, P.K., Tyo, K., Carlsen, S., et al. (2008) Terpenoids: Opportunities for Biosynthesis of Natural Product Drugs Using Engineered Microorganisms. Molecular Pharmaceutics, 5, 167-190. https://doi.org/10.1021/mp700151b
- 18. 吴静, 邹吉睿, 汪进萱, 等. 紫丁香花香成分鉴定及关键TPS基因的功能分析[J]. 植物遗传资源学报, 2024: 1-13.
- 19. 张玉秀, 卢丽兰, 王慧针, 等. 温郁金萜类合酶基因CwTPS4的克隆和表达特征[J]. 生物资源, 2021, 43(4): 419-425.
- 20. 徐令文, 王毅, 郝佳波, 等. 深纹核桃与防御相关的萜烯合成酶基因鉴定分析[J]. 福建农林大学学报(自然科学版), 2021, 50(6): 789-797.
NOTES
#第一作者。
*通讯作者。
