Modeling and Simulation
Vol.
12
No.
02
(
2023
), Article ID:
62075
,
9
pages
10.12677/MOS.2023.122063
骨支架仿生材料不同拓扑结构力学性能的 有限元分析
金淼,赵改平*,薛雅茹,翟海涛,张萌,刘泊钧,韩东晓,许宇琦,甘廷杰,张志豪
上海理工大学,健康科学与工程学院,上海
收稿日期:2023年1月11日;录用日期:2023年2月22日;发布日期:2023年3月3日

摘要
目的:通过建立骨支架材料再生丝素蛋白、海藻酸钠和生物陶瓷(氧化铝陶瓷)不同拓扑结构的三维有限元模型,探究骨支架仿生材料在压缩、拉伸、扭转时的力学性能的特性。方法:基于材料实验获得仿生材料相关参数,分析三种骨支架材料:骨纤维丝直径为0.50 mm,线条间夹角为30 (M-30˚)、45 (M-45˚)和60 (M-60˚)度,线密度从0.30 (M-3)、0.50 (M-5)到0.70 (M-7)变化时,骨支架在拉伸、压缩和扭转时的力学性能。结果:骨支架材料再生丝素蛋白、海藻酸钠和氧化铝陶瓷在M-5结构下压缩位移有明显差别,在M-3、M-5、M-7、M-30˚、M-45˚和M-60˚模型中压缩、拉伸和扭转性能均随丝线密度增大而减小,随线条间角度增大而增大,并且M-3模型承受压缩、拉伸和扭转的应力均为最大。结论:骨支架材料再生丝素蛋白压缩形变比海藻酸钠和氧化铝陶瓷材料都大,材料拓扑结构不同对压缩、拉伸和扭转力学性能存在明显的影响,为骨支架仿生材料力学性能的应用研究提供理论依据。
关键词
仿生骨材料,拓扑结构,力学性能,有限元分析

Finite Element Analysis of Mechanical Properties of Different Topologies of Bone Scaffold Biomimetic Materials
Miao Jin, Gaiping Zhao*, Yaru Xue, Haitao Zhai, Meng Zhang, Bojun Liu, Dongxiao Han, Yuqi Xu, Tingjie Gan, Zhihao Zhang
School of Health Sciences and Engineering, University of Shanghai for Science and Technology, Shanghai
Received: Jan. 11th, 2023; accepted: Feb. 22nd, 2023; published: Mar. 3rd, 2023

ABSTRACT
Objective: To explore the mechanical properties of bone scaffold biomimetic materials during compression, stretching and torsion by establishing three-dimensional finite element models of different topologies of bone scaffold materials regenerating silk fibroin, sodium alginate and bioceramics (alumina ceramics). Methods: Based on the material experiments, the relevant parameters of biomimetic materials were obtained, and three bone scaffold materials were analyzed: bone fiber filament diameter was 0.50 mm, the angle between lines was 30 (M-30˚), 45 (M-45˚) and 60 (M-60˚), and the mechanical properties of bone scaffold during tension, compression and torsion were analyzed when the linear density changed from 0.30 (M-3), 0.50 (M-5) to 0.70 (M-7). Results: The compression displacement of bone scaffold material regenerated silk fibroin, sodium alginate and alumina ceramics was significantly different under the M-5 structure, and the compression, tensile and torsional properties of the M-3, M-5, M-7, M-30˚, M-45˚ and M-60˚ models decreased with the increase of filament density and increased with the increase of the angle between lines, and the compression, tensile and torsional stresses of the M-3 model were the largest. Conclusion: The compression set of bone scaffold material regenerated silk fibroin is larger than that of sodium alginate and alumina ceramic materials, and the different material topology has obvious effects on the mechanical properties of compression, tensile and torsion, which provides a theoretical basis for the application of mechanical properties of bone scaffold biomimetic materials.
Keywords:Bionic Bone Material, Topological Structure, Mechanical Property, Finite Element Analysis

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
骨移植材料常用于临床骨外科移植手术中,主要包括:自体骨、同种异体骨、动物源性骨和人工骨材料 [1] [2] 。其中人工骨移植材料不具备天然骨的孔隙结构,但必须具备良好的生物相容性、机械性能、骨传导性和骨诱导能力 [3] [4] [5] ,人工骨支架材料有金属材料、生物活性陶瓷、生物惰性陶瓷和高分子材料 [6] [7] 等,其中研究表明高分子材料中再生丝素蛋白具有巨大的应用潜力 [8] [9] ,海藻酸钠和生物陶瓷材料在人工骨移植中应用也比较广泛 [10] [11] [12] 。
人工骨支架材料通过实验和仿真结合研究材料力学性能、结构孔隙率、承载能力等已开展相关工作,如裴葆清 [13] 等研究骨小梁微结构孔隙率为30%单元模型的最优化结构,植入股骨颈进行其应力–应变力学性能的分析。Palanivelu [14] 等研究复合材料管在冲击载荷作用下轴向拉伸、挤压对变形行为的实验研究,详细分析冲击速度对复合材料管能量吸收的影响。孙伟 [15] 等采用有限元方法对玻璃纤维增强聚合物复合材料管进行准静态轴向压缩试验,获得复合材料管的失效参数,从而进行结构优化。Abdewi [16] 等研究粗纱玻璃纤维/环氧树脂复合编织管材料径向波纹几何、圆柱几何、环圆柱几何形状复合管,在承受压缩载荷时的位移变化特征,结果表明不同形状结构对复合编织管承载能力有明显影响。张雪飞 [17] 等采用实验和有限元法(FEM)研究锯齿形三维编织间隔物复合材料的弯曲特性,结果表明不同高度“之字形”锯齿对复合编织管弯曲性能有显著影响。朱黎明 [18] 等建立了3D玄武岩纤维/环氧树脂复合材料三维管的几何模型进行有限元模拟,并与实验结果进行对比,结果表明两者数据吻合较好。人工骨支架置入人体后的压缩变形、断裂等导致内固定失效问题 [19] ,仍需要更深入探索新材料实现更好的功能适应性。
本文基于再生丝素蛋白材料M-5结构下压缩实验获得的材料参数分析再生丝素蛋白、海藻酸钠和氧化铝陶瓷三种骨支架材料的压缩力学性能;建立再生丝素蛋白材料的六种骨支架模型为:骨纤维线条直径为0.50 mm,线条间夹角为30 (M-30˚)、45 (M-45˚)和60 (M-60˚)度,线密度从0.30 (M-3)、0.50 (M-5)到0.70 (M-7)变化,分析不同拓扑结构的骨支架在承受拉伸、压缩和扭转载荷下的载荷与位移、应力与应变和扭力与转角的变化特征。
2. 材料与方法
2.1. 骨支架模型建立
建立再生丝素蛋白、海藻酸钠和氧化铝陶瓷三种材料骨支架的三维有限元模型如图1所示。基于再生丝素蛋白材料M-5结构下压缩实验数据,设置骨纤维线条直径为0.50 mm;建立再生丝素蛋白材料骨支架不同拓扑结构,线条间夹角分别为30 (M-30˚),45 (M-45˚)和60 (M-60˚)度变化,线密度从0.30 (M-3),0.50 (M-5)到0.70 (M-7)变化。从实验数据获得非线性材料参数,其中模型中剪切模量(m)和应变硬化指数(a)的数值分别为:m1 = −2.30,a1 = 5.11,m2 = 1.51,a2 = 7.56,m3 = 1.13,a3 = 1.70,m4 = −0.15,a4 = −4.90,可压缩参数d = 0。
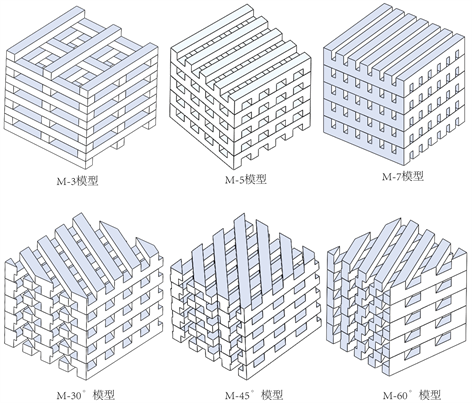
Figure 1. 3D finite element models of bone scaffold of RSF, alginate and alumina ceramics materials
图1. 再生丝素蛋白、海藻酸钠和氧化铝陶瓷材料骨支架的三维有限元模型
2.2. 负载与边界条件
依据实验条件和方法对骨支架模型底部进行约束固定,其上表面设置绑定耦合,对再生丝素蛋白、海藻酸钠和氧化铝陶瓷材料M-5结构模型,在耦合点施加从0 N到2.00 N间隔0.25 N的载荷数据;对再生丝素蛋白材料六种模型施加从0 N到0.20 N间隔0.02 N的压缩载荷;拉伸载荷为0 N到0.18 N间隔0.02 N;扭转载荷数值分别为0 N、0.10 N、0.30 N和0.50 N。采用ABAQUS软件数值计算获得压缩、拉伸和扭转载荷下骨支架的载荷与位移、应力与应变和扭力与转角的变化特征。
3. 结果分析
3.1. 压缩力学性能分析
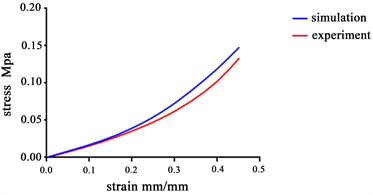
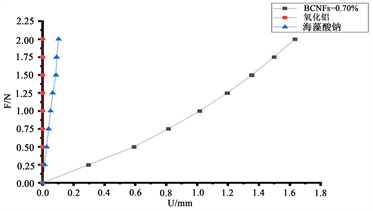
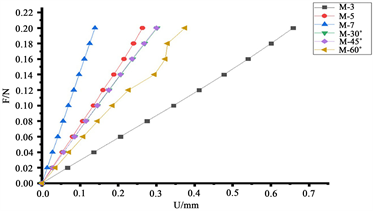
再生丝素蛋白、海藻酸钠和氧化铝陶瓷材料骨支架的压缩性能曲线如图2所示。由图2(a)可见应力相对较小时(≤0.05 Mpa)应力–应变实验曲线与有限元仿真拟合较好,随着应力值的增大,两者变化的趋势相似,但实验与仿真数值存在着偏差,由于实验的破坏性所致。由图2(b)载荷–位移曲线可见,超弹性材料再生丝素蛋白压缩变形速率远大于其他两种材料,再生丝素蛋白超弹性材料压缩曲线呈非线性变化趋势,载荷均匀增大而位移增量渐减,而氧化铝和海藻酸钠材料的压缩变形曲线呈线性。当最大压缩载荷达到2.00 N时,再生丝素蛋白材料的压缩位移为1.63 mm,氧化铝和海藻酸钠材料压缩位移仅为3.43 × 10−6 mm和0.11 mm。再生丝素蛋白超弹性材料骨支架不同结构的压缩载荷–位移曲线显示如图2(c),M-3、M-5和M-7结构模型承受0.10 N载荷时压缩位移分别为0.34 mm、0.14 mm和0.07 mm,在0.20 N时位移为0.66 mm、0.26 mm和0.14 mm,分别增大了91.03%、94.96%和99.42%,表明载荷线性增大,压缩位移增量呈非线性变化趋势。骨支架纤维线条间夹角M-30˚、M-45˚和M-60˚模型的压缩位移增加量随载荷线性增加也呈非线性变化趋势。M-30˚、M-45˚和M-60˚模型,在0.06 N载荷下压缩位移分别为8.60 × 10−2 mm、8.56 × 10−2 mm和1.08 × 10−2 mm,载荷增加到0.12 N时,位移值为1.76 × 10−1 mm、1.75 × 10−1 mm和2.27 × 10−1 mm,分别增大104.81%、104.41%和109.89%。其中M-60˚模型的骨支架形变相对较大,载荷超过0.12 N后导致其压缩性能呈现出不规则的变化趋势。
再生丝素蛋白超弹性材料骨支架不同结构的压缩应力云图如图3所示。在同一载荷下,对于M-3、M-5和M-7模型,M-3模型应力最大区域集中在模型中间纤维层,大小为1.70 MPa,而M-5和M-7模型最大应力区域集中在模型上下两端,数值分别为5.78 × 10−2 MPa和1.63 × 10−2 MPa,M-3承受的应力比M-7模型高出65倍。M-3、M-5和M-7模型随着骨支架压缩变形增大,应力最大区域向着骨支架中心区域的纤维移动。对于同一载荷下的M-30˚、M-45˚和M-60˚模型,M-30˚模型最大应力区域位于每一层纤维连接处,而M-45˚和M-60˚模型应力最大区域位于模型一侧,这可能是由于模型变形不对称所致。
3.2. 拉伸力学性能分析
再生丝素蛋白超弹性材料骨支架不同结构拉伸载荷–位移曲线如图4所示,可见再生丝素蛋白六种结构模型M-3、M-5、M-7、M-30˚、M-45˚和M-60˚模型随着载荷增大,拉伸位移呈非线性变化。承受载荷为0.08 N时拉伸位移分别为0.21 mm、0.086 mm和0.041 mm,此时M-3与M-5、M-7与M-5模型拉伸位移差值分别为1.2 × 10−1 mm和4.5 × 10−2 mm,当载荷逐渐递增至0.16 N时值分别为0.40 mm、0.16 mm
 (a)
(a)
 (b)
(b)
 (c)
(c)
Figure 2. Compression performance curves of bone scaffolds made of regenerated filamentous protein, sodium alginate and alumina ceramics (a) experimental and simulated compression curves of regenerated filamentous protein (b) load-displacement curves of three different bone scaffolds made of regenerated filamentous protein, sodium alginate and alumina ceramics and (c) load-displacement curves of regenerated filamentous protein materials M-3, M-5, M-7, M-30˚, M-45˚ and M-60˚ Load-displacement curves for six configurations
图2. 再生丝素蛋白、海藻酸钠和氧化铝陶瓷材料骨支架压缩性能曲线:(a) 再生丝素蛋白材料实验与仿真压缩曲线(b)再生丝素蛋白、海藻酸钠和氧化铝陶瓷三种不同骨支架材料压缩性能载荷–位移曲线和(c) 再生丝素蛋白材料M-3、M-5、M-7、M-30˚、M-45˚和M-60˚六种结构下载荷–位移曲线

Figure 3. Compressive stress nephogram of RSF material M-3, M-5, M-7, M-30˚, M-45˚ and M-60˚ structural model
图3. 再生丝素蛋白材料M-3、M-5、M-7、M-30˚、M-45˚和M-60˚结构模型压缩应力云图
和0.079 mm,M-3、M-5和M-7间的差值分别增大93.55%和77.78%,随着线密度等差增加,M-3、M-5和M-7骨支架拉伸位移差值呈非线性变化趋势。M-30˚、M-45˚和M-60˚模型在载荷为0.08 N时拉伸位移分别为1.04 × 10−1 mm、1.06 × 10−1 mm和1.29 × 10−1 mm,此时M-30˚与M-45˚、M-45˚与M-60˚模型拉伸位移差值分别为0.002 mm和0.023 mm,载荷增加到0.16 N时其位移分别为1.94 × 10−1 mm、2.00 × 10−1 mm和2.39 × 10−1 mm,M-30˚、M-45˚和M-60˚之间的差值增大到0.006 mm和0.039 mm,可见随着线条间角度等差增加,M-30˚、M-45˚和M-60˚骨支架拉伸位移差值也呈非线性变化趋势。
再生丝素蛋白超弹性材料骨支架不同结构的拉伸应力云图如图5所示,对于承受同一载荷M-3、M-5和M-7模型,M-3模型应力集中区域位于纤维连接处,最大应力为1.48 × 10−1 MPa,M-5和M-7模型在最上层纤维以及最下层纤维出现较大应力,分别为2.02 × 10−2 MPa、3.64 × 10−2 MPa。随着线条密度的增加,各模型中相邻纤维之间所承受的拉伸应力差值逐渐减小,其中M-7模型纤维之间拉伸应力差值最小,应力分布最为均匀。M-30˚、M-45˚和M-60˚模型均在纤维连接处出现较大的应力,最大应力分别为2.86 × 10−1 MPa、3.42 × 10−1 MPa和5.80 × 10−1 MPa,且所受应力从骨支架模型中间层向两端逐渐增大。
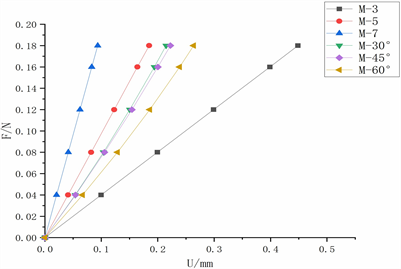
Figure 4. Load displacement curves of RSF material M-3, M-5, M-7, M-30˚, M-45˚ and M-60˚
图4. 再生丝素蛋白材料 M-3、M-5、M-7、M-30˚、M-45˚和M-60˚六种结构下载荷–位移曲线
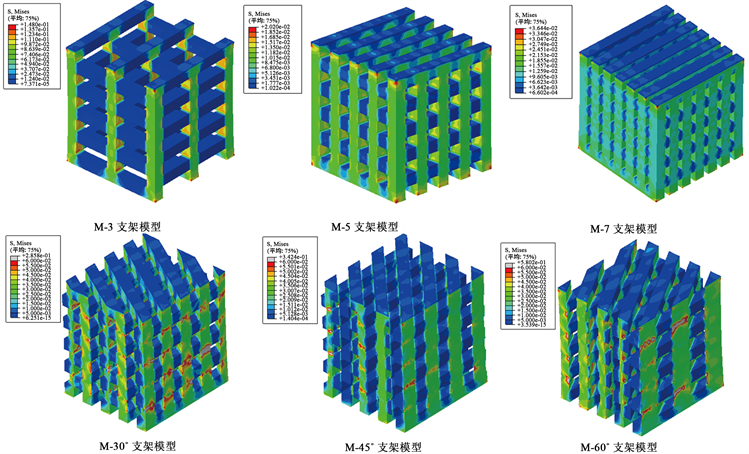
Figure 5. Tensile stress nephogram of RSF material M-3, M-5, M-7, M-30˚, M-45˚ and M-60˚ structural model
图5. 再生丝素蛋白材料M-3、M-5、M-7、M-30˚、M-45˚和M-60˚结构模型拉伸应力云图
3.3. 扭转力学性能分析
再生丝素蛋白超弹性材料骨支架M-3、M-5、M-7、M-30˚、M-45˚和M-60˚不同结构的载荷–扭转角度曲线如图6所示,由图可见M-3、M-5和M-7在承受0.1 N载荷时扭转角度分别为24.16˚、8.62˚和3.90˚,当载荷渐增至0.5 N时M-3、M-5和M-7模型扭转角度比0.1 N时分别增加了182.24%、225.64%和311.54%,可见载荷线性增加,扭转变形增量减小且呈非线性变化。对于M-30˚、M-45˚和M-60˚不同角度排布模型在承受0.5 N载荷时扭转变形角度分别为29.37˚、40.95˚和49.78˚,此时M-30˚和M-45˚、M-45˚和M-60˚模型之间的扭转角度差值分别为11.58˚,8.83˚,M-45˚到M-60˚变化量较M-30˚到M-45˚下降23.75%,线条排布角度等差变化,M-30˚、M-45˚和M-60˚扭转性能差距将会逐渐增大且呈非线性变化。
再生丝素蛋白材料M-3、M-5、M-7、M-30˚、M-45˚和M-60˚六种结构模型扭转应力云图如图7所示,M-3、M-5和M-7支架模型应力从扭转轴开始向四周呈辐射状逐渐增大且应力最大区域集中在模型的每个顶点,其值分别为1.92 MPa、1.51 × 10−1 MPa和1.70 × 10−1 MPa,M-3模型承受的最大应力比M-7模型大出1021.02%。M-30˚、M-45˚和M-60˚模型应力最大区域分布在骨支架上侧的纤维连接处,其值分别为0.66 MPa、0.97 MPa和3.93 MPa,M-60˚模型承受应力比M-30˚模型高出495.45%,并且纤维连接区域都出现较大应力,越靠近扭转轴线区域的应力越小。在扭转作用下M-3、M-5、M-7、M-30˚、M-45˚和M-60˚模型侧面均承受了拉应力和压应力,孔隙处角度变大的区域(如图7 M-3模型所示,其余孔隙处及其他模型规律与M-3模型一致)主要承受拉应力且中间区域拉应力最小向两侧逐渐增大,角度变小区域主要承受压应力,越靠近两侧压应力也越大。
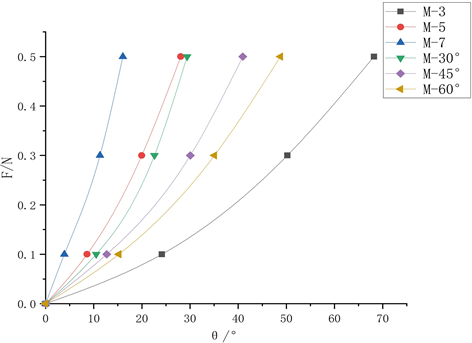
Figure 6. RSF material M-3, M-5, M-7, M-30˚, M-45˚ and M-60˚ structural model torsion angle curve
图6. 再生丝素蛋白材料M-3、M-5、M-7、M-30˚、M-45˚和M-60˚结构模型扭转–角度曲线
4. 讨论
在组织工程中,骨支架为细胞的生长提供三维环境和力学支撑 [20] [21] ,需要骨支架材料具有一定的力学特性。本文基于实验中材料参数利用有限元方法模拟分析再生丝素蛋白、海藻酸钠和氧化铝陶瓷三种骨支架材料不同拓扑结构下拉伸、压缩和扭转的力学性能,结果表明海藻酸钠和氧化铝陶瓷具有更好
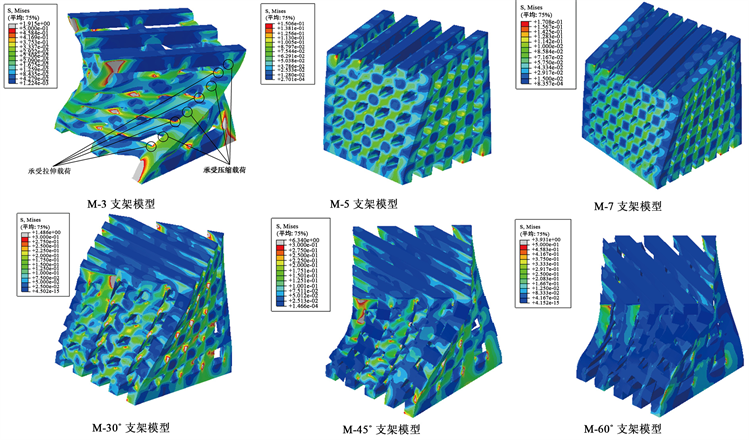
Figure 7. Nephogram of torsional stress of six structural models of RSF material M-3, M-5, M-7, M-30˚, M-45˚ and M-60˚
图7. 再生丝素蛋白材料M-3、M-5、M-7、M-30˚、M-45˚和M-60˚六种结构模型扭转应力云图
的抗压缩性能,能适用于承载较大载荷的工况,新材料再生丝素蛋白的压缩性能远大于其他两种骨支架材料适合大变形工况,在再生丝素蛋白材料的力学性能增强研究中,由于其独特的材料特性可基于不同的生物医学应用要求将力学性能优异的高分子与其进行共混,以提高再生丝素材料的力学性能,为需应对不同工况提供新型材料并通过实验和仿真结合的方式验证其力学性能。在相同的压缩、拉伸和扭转载荷下,M-3 和M-30˚模型的变形位移都为最大,其力学性能最好,适合应用于大变形场合,M-7和M-60˚能在保证一定的变形能力下有更好的支撑性能,是因为M-3、M-5、M-7和M-30˚、M-45˚和M-60˚拓扑结构孔隙率逐渐减小,每层纤维间的接触面积逐渐增大,这使得不同拓扑结构对骨支架的力学性能有明显的影响。可见若需要选择材料进行大变形实验时,应设计模型线条密度较为稀疏;若要求材料有较大的承载能力时,应选用线条间角度变化的结构模型并且较大的倾斜角度更好,再生丝素蛋白材料骨支架的变化规律和对应的力学性能,可以为选择合适的拓扑结构提供依据。但研究也存在一些局限性,未考虑孔隙率的影响,在后续骨支架拓扑结构有限元研究中增加孔隙率的研究,可以更好的反应具有一定力学性能且适合移植的骨支架拓扑结构,对骨支架结构设计提出指导性作用。
目前骨组织工程支架材料的研究虽然取得了很大的进展,但要真正在临床上应用仍有许多关键的障碍有待清除。未来研究重点是研发与人体自体骨组织结构和性能相类似的材料,对其进行仿生设计,从而研制出与人体自体骨力学性能相似的组织工程的人工骨 [22] 。本文模拟再生丝素蛋白、氧化铝和海藻酸钠材料在压缩载荷下的力学性能和再生丝素蛋白材料六种拓扑结构在压缩、拉伸和扭转载荷下的力学性能,获得再生丝素蛋白材料在三种材料中具有更好的压缩性能,M-3结构相比于其他五种拓扑结构中具有最好的力学性能。本文对于再生丝素蛋白材料六种不同拓扑结构力学性能的初步探究,有利于在不同载荷工况下选择较为合适的拓扑结构,为仿生骨支架的材料和结构设计、力学性能判断等方面提供理论依据。
基金项目
国家自然科学基金项目(11502146),上海市自然科学基金项目(15ZR1429600)。
文章引用
金 淼,赵改平,薛雅茹,翟海涛,张 萌,刘泊钧,韩东晓,许宇琦,甘廷杰,张志豪. 骨支架仿生材料不同拓扑结构力学性能的有限元分析
Finite Element Analysis of Mechanical Properties of Different Topologies of Bone Scaffold Biomimetic Materials[J]. 建模与仿真, 2023, 12(02): 668-676. https://doi.org/10.12677/MOS.2023.122063
参考文献
- 1. 陈岩松, 陈哲, 王硕凡. 骨修复生物材料临床研究进展[J]. 浙江中西医结合杂志, 2018, 28(10): 892-895.
- 2. 郝剑, 郝钊. 骨移植材料研究进展[J]. 中国中西医结合外科杂志, 2016, 22(1): 92-94.
- 3. Mondschein, R.J., Kanitkar, A., Wil-liams, C.B., et al. (2017) Polymer Structure-Property Requirements for Stereolithographic 3D Printing of Soft Tissue Engineer-ing Scaffolds. Biomaterials, 140, 170-188. https://doi.org/10.1016/j.biomaterials.2017.06.005
- 4. Salmoria, G.V., Pereira, R.V., Fredel, M.C., et al. (2018) Proper-ties of PLDLA/Bioglass Scaffolds Produced by Selective Laser Sintering. Polymer Bulletin, 75, 1299-1309. https://doi.org/10.1007/s00289-017-2093-0
- 5. Sheikh, Z., Hamdan, N., Ikeda, Y., et al. (2017) Natural Graft Tissues and Synthetic Biomaterials for Periodontal and Alveolar Bone Reconstructive Applications: A Review. Biomaterials Research, 21, 1-20. https://doi.org/10.1186/s40824-017-0095-5
- 6. 王海江, 陈启富. 组织工程支架材料研究进展[J]. 中国现代医生, 2012, 50(1): 27-29.
- 7. 邱荣敏, 梁雁. 石墨烯/丝素蛋白复合支架材料及其在组织工程的研究进展[J]. 右江民族医学院学报, 2020, 42(4): 509-511+515.
- 8. 黄利. 丝素蛋白仿生组织工程支架的成型, 结构与性能研究[D]: [博士学位论文]. 上海: 东华大学, 2020.
- 9. Farokhi, M., Mottaghitalab, F., Samani, S., et al. (2018) Silk Fibroin/Hydroxyapatite Com-posites for Bone Tissue Engineering. Biotechnology Advances, 36, 68-91. https://doi.org/10.1016/j.biotechadv.2017.10.001
- 10. 周思佳, 姜文学, 尤佳. 骨缺损修复材料: 现状与需求和未来[J]. 中国组织工程研究, 2018, 22(14): 2251-2258.
- 11. Zhang, B.G.X., Myers, D.E., Wallace, G.G., et al. (2014) Bioactive Coatings for Orthopaedic Implants-Recent Trends in Development of Implant Coatings. International Journal of Molecular Sciences, 15, 11878-11921. https://doi.org/10.3390/ijms150711878
- 12. 曹国定, 裴豫琦, 刘军, 李鹏, 刘鹏, 李旭升. 骨缺损修复材料的研究进展[J]. 中国骨伤, 2021, 34(4): 382-388.
- 13. 裴葆青, 王田苗, 王军强. 松质骨微观骨小梁结构的生物力学有限元分析[J]. 北京生物医学工程, 2008(2): 120-122.
- 14. Palanivelu, S., Van Paepegem, W., Degrieck, J., et al. (2010) Experimental Study on the Axial Crushing Behaviour of Pultruded Composite Tubes. Polymer Testing, 29, 224-234. https://doi.org/10.1016/j.polymertesting.2009.11.005
- 15. Zhang, Z., Sun, W., Zhao, Y. and Hou, S. (2018) Crash Wor-thiness of Different Composite Tubes by Experiments and Simulations. Composites Part B: Engineering, 143, 86-95. https://doi.org/10.1016/j.compositesb.2018.01.021
- 16. Abdewi, E.F., Sulaiman, S., Hamouda, A.M.S., et al. (2008) Quasi-Static Axial and Lateral Crushing of Radial Corrugated Composite Tubes. Thin-Walled Structures, 46, 320-332. https://doi.org/10.1016/j.tws.2007.07.018
- 17. Zhu, L., Lyu, L., Zhang, X., et al. (2019) Bending Properties of Zig-zag-Shaped 3D Woven Spacer Composites: Experiment and FEM Simulation. Materials, 12, 1075. https://doi.org/10.3390/ma12071075
- 18. Zhu, L., Zhang, H., Guo, J., et al. (2020) Axial Compression Experiments and Finite Element Analysis of Basalt Fiber/Epoxy Resin Three-Dimensional Tubular Woven Composites. Materials, 13, 2584. https://doi.org/10.3390/ma13112584
- 19. 王莉莎, 罗艳红. 骨科植入物研究成果在国内相关期刊发表文章的数据分析[J]. 中国组织工程研究与临床康复, 2008, 12(27): 5370-5373.
- 20. Ji, W.C., Zhang, X.W. and Qiu, Y.S. (2016) Selected Suitable Seed Cell, Scaffold and Growth Factor Could Maximize the Repair Effect Using Tissue Engineering Method in Spinal Cord Injury. World Journal of Experimental Medicine, 6, 58. https://doi.org/10.5493/wjem.v6.i3.58
- 21. 刘家利, 索海瑞, 杨翰, 王玲, 徐铭恩. 填充结构对3D打印聚己内酯支架力学性能的影响[J]. 中国组织工程研究, 2022, 26(16): 2492-2497.
- 22. 廖欣宇, 王福科, 王国梁. 骨组织工程支架的进展与挑战[J]. 中国组织工程研究, 2021, 25(28): 4553.
NOTES
*通讯作者。