Advances in Microbiology
Vol.
08
No.
03
(
2019
), Article ID:
32253
,
11
pages
10.12677/AMB.2019.83019
Construction of Stable Expression Respiratory Syncytial Virus M2-1 Protein Hep-2 Cell and Characteristics of the Cell in RSV Infection
Qian Liu1,2*, Wenkuan Liu3, Aiping You3, Duo Xu3
1Scientific Research Center, The First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou Guangdong
2Dongguan Institute of Pediatrics, Dongguan Children’s Hospital, Dongguan Eighth People’s Hospital, Dongguan Guangdong
3State Key Laboratory of Respiratory Diseases, National Clinical Research Center for Respiratory Disease, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou Institute of Respiratory Health, Guangzhou Medical University, Guangzhou Guangdong

Received: Sep. 2nd, 2019; accepted: Sep. 13th, 2019; published: Sep. 20th, 2019

ABSTRACT
Objective: To construct stable expressing respiratory syncytial virus M2-1 protein Hep-2 cells and analyze the characteristics of the cell in RSV infection. Methods: M2-1 eukaryotic expression plasmid was constructed and transfected into Hep-2 cells. The stable expression cell was screened by G418, identified by RT-PCR, qRT-PCR and Western blot. Cell proliferation was analyzed using MTT assay. The characteristics of Hep-2 and the constructed cell in RSV infection were analyzed by observing the state of the cells, the emergence of cytopathic effect (CPE), and the yield of RSV genomic RNA. Results: Hep-2 2F5 with stable expression respiratory syncytial virus M2-1 protein was obtained in this study. The growth rate of the cell is higher than that of the original Hep-2 cell. Hep-2 2F5 and Hep-2 were both infected with RSV with titer of 1000 - 10−2 TCID50 (E1 - E6). Under the titer of 1000 TCID50 (E1), both cells developed CPE, but more obvious in Hep-2 2F5 cell; under the titer of 100 - 10 TCID50 (E2 - E3), the CPE developed earlier and more obvious in Hep-2 2F5 than Hep-2; Under the titer of 1 - 0.1 TCID50 (E4 - E5), Hep-2 2F5 cells developed a small amount of CPE, however, no CPE found in Hep-2. After 12 h infection at E1 - E4 titer, the mean value of RSV genome in Hep-2 2F5 cells was higher than that in Hep-2 cells, and no RSV virus nucleic acid was detected in both cells 12 h post infection with RSV at E5 - E6 titer. With prolongation of infection time, RSV genome content in Hep-2 was higher than that in Hep-2 2F5 under the titer of E1 - E2. Under the titer of E4 or higher, the proliferation of RSV in Hep-2 2F5 was better than in Hep-2. Conclusion: Hep-2 2F5 cell with stable expression respiratory syncytial virus M2-1 protein was successfully constructed. The cell is more sensitive in RSV infection, and in the case of low titer virus infection, the CPE developed earlier, and the viral nucleic acid content was higher comparing to Hep-2.
Keywords:Respiratory Syncytial Virus, M2-1 Protein, Stable Expression Cell, Infection Characteristics
呼吸道合胞病毒M2-1蛋白Hep-2细胞稳定表达株的构建及其在呼吸道合胞病毒感染中的特点
刘倩1,2*,刘文宽3,游爱萍3,许多3
1广东药科大学附属第一医院,科学研究中心,广东 广州
2东莞市第八人民医院(东莞市儿童医院),东莞市儿科研究所,广东 东莞
3呼吸疾病国家重点实验室,国家呼吸系统疾病临床医学研究中心,广州医科大学,广州呼吸健康研究院,广州医科大学附属第一医院,广东 广州

收稿日期:2019年9月2日;录用日期:2019年9月13日;发布日期:2019年9月20日

摘 要
目的:构建稳定表达呼吸道合胞病毒(RSV) M2-1蛋白的Hep-2细胞,并分析稳定表达细胞株RSV感染的特点。方法:构建M2-1真核表达质粒,转染至Hep-2细胞。通过G418筛选阳性单克隆;RT-PCR、qRT-PCR以及Western blot鉴定,最终得到稳定表达株。通过MTT法分析细胞增殖特征;通过分析不同浓度RSV病毒感染Hep-2细胞与所构建的稳定表达株细胞后在状态、细胞病变(CPE)出现时间以及RSV基因组核酸产量分析比较RSV在两种细胞中的感染特点。结果:获得一株稳定表达M2-1蛋白的细胞Hep-2 2F5。该株细胞的生长速度高于原始细胞株。采用1000~10−2 TCID50 (E1~E6)的病毒滴度对Hep-2 2F5与Hep-2两种细胞进行感染发现,1000 TCID50 (E1)的滴度下,两种细胞均产生病变,但Hep-2 2F5细胞产生的病变更明显;100~10 TCID50 (E2~E3)滴度下RSV感染两种细胞,Hep-2 2F5细胞产生的病变更早且更明显;1~0.1 TCID50 (E4~E5)滴度下RSV感染两种细胞,Hep-2 2F5细胞产生少量病变,Hep-2则无明显病变。E1~E4滴度下攻毒12 h后,RSV在Hep-2 2F5细胞中的核酸定量平均值高于Hep-2细胞,E5~E6滴度下攻毒12 h两细胞均未检测到RSV病毒核酸;随着时间延长,E1~E2滴度感染后的Hep-2中RSV含量高于Hep-2 2F5,在E4滴度及以下,RSV在Hep-2 2F5中的增殖优于Hep-2。结论:成功构建稳定表达M2-1蛋白的Hep-2 2F5细胞株。该细胞株在RSV感染中更具敏感性,低滴度病毒感染的情况下,更早产生CPE效应,且病毒核酸的含量也较Hep-2高。
关键词 :呼吸道合胞病毒,M2-1蛋白,稳定表达细胞株,感染特点

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 前言
呼吸道合胞病毒(respiratory syncytial virus,RSV)可在世界范围内引起婴幼儿、老年人、免疫受抑者严重的下呼吸道感染 [1] [2],且可造成院感爆发 [3] [4],具有较高的致病率和死亡率 [5] [6]。
病毒分离培养是鉴定病毒感染的“金标准”,同时针对病毒的防控预警、临床诊治、药物研发、疫苗研制等方面研究均需要分离培养的单克隆毒株,然而分离培养效率低下严重制约了病毒性疾病的各项研究。
M2-1由RSV基因组编码,前期研究表明M2-1是一种重要的转录延长因子,可提高转录效率,增加全长mRNA产量,且体外实验证实其对RNA序列没有特异性要求 [6] [7]。本研究利用Hep-2细胞构建稳定表达RSV M2-1蛋白的细胞株,以期获得在细胞增殖速度及RSV易感性高于原始细胞株的新细胞,为RSV临床病毒样本的分离培养提供备选细胞株。
2. 材料与方法
2.1. 病毒与细胞株
本研究中使用的RSV Long株(VR26)、人喉癌上皮细胞Hep-2 (CCL-23)均为本研究室保存。
2.2. 主要试剂
本研究使用胎牛血清、RPMI 1640培养基、0.25%胰酶-EDTA、PBS均来自Gibco公司;G418购自sigma公司;RT-PCR相关试剂以及转染试剂Lipofectamine 2000购Thermo Fisher Scientific公司;逆转录PCR试剂及荧光定量PCR检测试剂购自TAKARA公司;Taqman荧光定量PCR试剂购自广州呼研所医药科技有限公司;M2-1单克隆抗体购置Abcam公司;pcDNA3.1(+)载体由本研究室保存。
2.3. pcDNA3.1-M2-1真核表达载体构建
本研究从RSV Long株中通过RT-PCR获得M2-1基因,并通过BamHI、XbaI酶切、连接、测序鉴定等操作将其克隆至pcDNA3.1(+) (5428 bp)质粒中获得 pcDNA3.1-M2-1 (5957 bp)。
正向引物:5’-AAAGGATCCATGTCACGAAGGAATCCTTGCA-3’
反向引物:5’-AAATCTAGATCAGGTAGTATCATTATTTTTGGCATG-3’
G418耐受性分析
将细胞均匀铺到24孔板中(105个细胞/孔),细胞培养液为含终浓度100、200、300、400、500、600、700、800、900 μg/ml G418的培养基,于37℃ 5% CO2环境中培养10~14天,以细胞全部死亡的最低浓度作为 G418筛选浓度,稳定细胞系维持浓度减半。
2.4. 稳定表达株筛选
将pcDNA3.1-M2-1载体转染至Hep-2细胞,G418筛选14天,得到抗性克隆。有限稀释法得到单细胞悬液,继续使用G418筛选,得到疑似阳性克隆。
2.5. 荧光PCR鉴定M2-1的转录情况
分别配制检测Hep-2 2F5和Hep-2 RNA的RSV M2-1和内参GAPDH的mRNA的qRT-PCR 25 μl反应体系,使用下列引物序列及反应条件分析M2-1的转录情况。
反应条件如下:42℃ 5 min;95℃ 10 sec;95℃ 5 sec、60℃ 30 sec (读值)循环40个;熔解95℃ 15 sec、60℃ 30 sec、95℃ 15 sec (读值)。
2.6. Western Blot分析M2-1蛋白表达情况
培养Hep-2 2F5及Hep-2细胞(60 mm培养皿)各一皿,使用SDS裂解液充分裂解细胞;充分裂解后,13000 rpm离心5 min,加入6× SDS PAGE上样缓冲液,100℃水浴5 min,用于SDS-PAGE蛋白电泳;使用抗RSV M2-1单克隆抗体及抗GAPDH单克隆抗体进行Hep-22F5及Hep-2中M2-1 (分子量约22 KD)和内参GAPDH (分子量约36 KD)的蛋白表达检测。
2.7. MTT分析细胞增殖情况
2 × 104个细胞/孔接种24孔板,每天中午12时每孔加入5 mg/ml MTT溶液100 μl,37℃孵育4小时;吸去孔内培养基,加入200 μL DMSO,室温震荡裂解10分钟;取50 μl × 3加入96孔板,于OD490测定吸光值。
3. 结果
3.1. M2-1 稳定表达株Hep-2 2F5的建立
Hep-2细胞经G418耐受性实验,获取其筛选浓度为200 μg/ml,稳定系维持所用的浓度则减半为100 μg/ml。pcDNA3.1-M2-1真核表达载经线性化转染至Hep-2细胞后,经过G418筛选后,初步得到2F5和2C6株;经RT-PCR筛选,得到2F5株较2C6株具有明显的213 bp目标条带(图1),后续实验都使用Hep-22F5株进行。

Figure 1. RT-PCR test for M2-1 gene expression of Hep-2 2F5
图1. Hep-2 2F5细胞M2-1基因表达RT-PCR检测
经过连续20代培养后,分别使用染料法qRT-PCR (引物序列见表1)和Western blot对Hep-2 2F5中的M2-1 mRNA (图2)和蛋白进行检测(图3),证明Hep-2 2F5中稳定表达M2-1,获得稳定细胞系。
3.2. Hep-2 2F5细胞增殖速度高于Hep-2细胞
2 × 104个细胞/孔接种24孔板,经过连续6天的培养,通过MTT法分析细胞的增殖情况,得到Hep-2 2F5细胞的生长曲线(图4)。Hep-2 2F5细胞的增殖速度高于Hep-2细胞。
Table 1. Primers for real-time PCR test
表1. 荧光定量PCR检测引物序列
 HEP2-2F5-GAPDH-扩增曲线
HEP2-2F5-GAPDH-扩增曲线
 HEP2-2F5-GAPDH-熔解曲线
HEP2-2F5-GAPDH-熔解曲线
 HEP2-2F5-M2-1-扩增曲线
HEP2-2F5-M2-1-扩增曲线
 HEP2-2F5-M2-1-熔解曲线
HEP2-2F5-M2-1-熔解曲线
 HEP2-GAPDH-扩增曲线
HEP2-GAPDH-扩增曲线
 HEP2-GAPDH-熔解曲线
HEP2-GAPDH-熔解曲线
 HEP2-M2-1-扩增曲线
HEP2-M2-1-扩增曲线
 HEP2-M2-1-熔解曲线
HEP2-M2-1-熔解曲线
Figure 2. Real-time PCR test for M2-1 mRNA of Hep-2 2F5 cell
图2. 荧光定量PCR检测Hep-2 2F5细胞表达的M2-1 mRNA
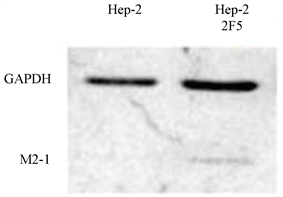
Figure 3. Western Blot test for M2-1 protein expression of Hep-2 2F5 cell
图3. Western blot检测Hep-2 2F5细胞表达的M2-1蛋白

Figure 4. The growth curve of Hep-2 2F5 detected by MTT assay
图4. MTT法检测Hep-2 2F5生长曲线
3.3. Hep-2 2F5感染RSV的特征分析
为了分析改造细胞对RSV感染与增殖特性,实验设计了使用从1000 TCID50 (E1) (RSV核酸定量为1.2 × 106 copies/ml)到10−2 TCID50 (E6) 6个梯度的病毒感染实验,时间分0 h、12 h、1天(1 D)、2天、3天、4天、5天。通过实验观察,细胞增殖方面在细胞培养24 h和36 h可见Hep-2 2F5要明显快于Hep-2 (图5),而细胞在培养总时间至5天(4 D接种病毒 + 24 h贴壁时间)时产生气泡样的空泡,并在第6天(5 D接种病毒 + 24 h贴壁时间)更明显(图6)。

Figure 5. Culture Hep-2 2F5 and Hep-2 cell for 24 h and 36 h (Optical microscope, 200×)
图5. Hep-2 2F5与Hep-2培养24 h、36 h的细胞增殖。可见光镜下(200×)
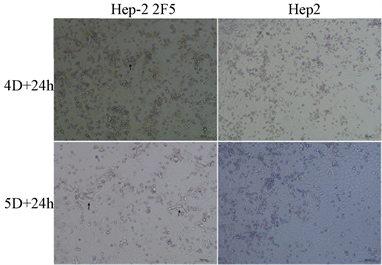
Figure 6. The vacuoles developed in Hep-2 2F5 cell after 5 and 6 days culture (Optical microscope, 200×)
图6. Hep-2 2F5培养5天和6天产生的空泡。可见光镜下(200×)
在感染RSV中,1000 TCID50 (E1) (RSV核酸定量约1.2 × 106 copies/ml) RSV接种时,Hep-2 2F5与Hep-2都能在1天内产生CPE,但前者CPE更加明显(图7)。较低滴度下RSV感染两种细胞时,攻毒两天时间后,Hep-2 2F5产生CPE的时间比原始细胞早且明显(E2~E3),而在E4及更低浓度下,Hep-2未发现CPE,而E5下Hep-2 2F5仍可见少量CPE (图8)。
E1-E4攻毒12 h后RSV在Hep-2 2F5和Hep-2两种细胞中的核酸定量平均值分别为3.41 × 105和1.34 × 105 (E1) (图9(a))、4.91 × 104和1.27 × 104 (E2) (图9(b))、2.09 × 102和1.45 × 102 (E3) (图9(c))、10和23 copies/ml (E4) (图9(d)),E5~E6在12 h未检测到RSV病毒核酸(图9(e)、9(f))。随着时间延长,高浓度E1~E2的Hep-2中RSV含量高于Hep-2 2F5,在E4及之后RSV在Hep-2 2F5中的增殖优于Hep-2 (图9)。通过对细胞中RSV核酸的定量,Hep-2 2F5在E1~E2之间RSV含量低于Hep-2;在低浓度E3-E6中则总体高于Hep-2 (图9)。
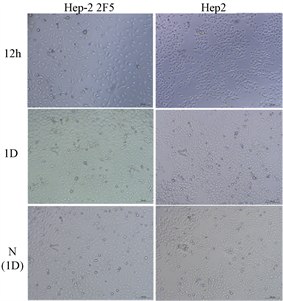
Figure 7. Development of CPE of Hep-2 2F5 and Hep-2 with RSV infection for 12 hours and 1 day under the titer of 1000 TCID50 (Optical microscope, 200×), N: Hep-2 2F5 and Hep-2 cells without RSV infection
图7. Hep-2 2F5与Hep-2感染1000 TCID50 RSV后12 h和1天的CPE。可见光镜下(200×),N为未加病毒的细胞对照

Figure 8. Development of CPE of Hep-2 2F5 and Hep-2 with RSV infection for 2 days under the titer of 100 TCID50 (E2) to 10−2 TCID50 (E6) (Optical microscope, 200×), N: Hep-2 2F5 and Hep-2 cells without RSV infection
图8. Hep-2 2F5与Hep-2感染100TCID50 (E2)至10−2 TCID50 (E6) RSV后2天的CPE。可见光镜下(200×),N为未加病毒的细胞对照
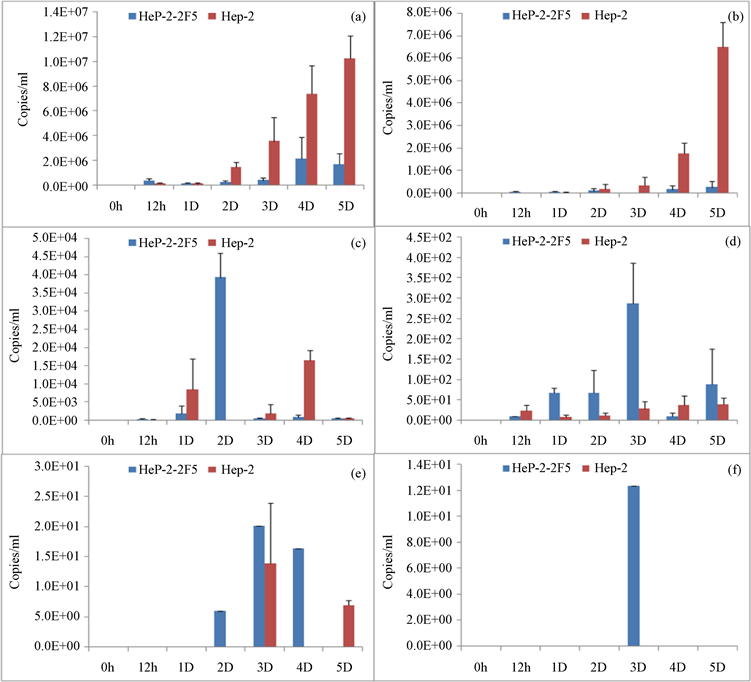
Figure 9. Detection of virus proliferation after Hep-2 2F5 infection with RSV virus by real-time PCR. (a)-(f): RSV nucleic acid content of cells with RSV infection for 0 to 5 days under the titer of 1000 TCID50 (E1)~10−2 TCID50 (E6) titer testing with real-time PCR. *Only one sample detected in total three parallels
图9. 荧光定量PCR检测 Hep-2 2F5感染RSV病毒后病毒增殖情况。(a)-(f):1000 TCID50 (E1)~10−2 TCID50 (E6)六个梯度RSV感染细胞0~5天后使用荧光定量PCR检测结果细胞中RSV核酸含量;*三个平行孔实验只一孔检出
4. 讨论
RSV是一个世界范围内引起婴幼儿严重下呼吸道感染的最常见的病原体 [1] [2],全球每年有约四百万儿童受其感染,具有较高的致病率和死亡率 [3] [4] [5]。M2-1蛋白是由RSV基因组M2基因的第一个开放阅读框编码,全长194aa [6] [7] [8]。M2-1蛋白与核蛋白N、磷酸化蛋白P和大聚合酶复合体L形成螺旋核衣壳结构与RSV基因组紧密结合 [9] [10]。对于M2-1,以往的研究主要集中在转录调控方面。M2-1蛋白与核蛋白N、磷酸化蛋白P和大聚合酶复合体L形成螺旋核衣壳结构与RSV基因组紧密结合 [10] [11] [12]。
M2-1被命名为转录抗终止因子(transcription antitermination factor),其抗终止作用主要体现在两个方面 [8] :1) M2-1可以促进单顺反子全长mRNA的合成(intragenic antitermination)主要体现在M2-1存在的情况下,长基因的转录产物全长mRNA的产量明显增加;2) M2-1还可以促进多顺反子的通读(polycistronic readthrough),其功能体现在M2-1存在的情况下,帮助RNA聚合酶跳过转录终止点(Gene-End signal)继续转录。
我们利用M2-1蛋白在RSV基因组转录中的转录抗终止作用,构建M2-1稳定表达的Hep-2细胞株Hep-2 2F5。通过RT-PCR鉴定可确定M2-1的表达(图1)。经过20代传代后,qRT-PCR以及Western blot分析(图2、图3),M2-1仍有较高的表达水平。通过显微镜观察以及细胞生长曲线的绘制,发现Hep-2 2F5细胞的生长速率较Hep-2高(图4、图5)。通过病毒的灵敏性检测,发现低Hep-2 2F5细胞比起原始细胞株Hep-2具有更高的灵敏性。较低滴度的病毒感染后,Hep-2 2F5更早出现CPE (图7、图8),且RSV核酸含量高于Hep-2,但在高滴度病毒感染中,Hep-2细胞中的病毒核酸量高于Hep-2 2F5 (图9)。
5. 小结
综上,本研究团队成功构建稳定表达M2-1蛋白的Hep-2 2F5细胞株,在用于RSV病毒培养中具有更高的灵敏度,为RSV临床病毒样本的分离培养提供灵敏度更高的细胞株。
基金项目
本研究获得广东省科技计划项目(2016A020215001)、广东省自然科学基金纵向协同项目(2018A030310401)以及国家自然科学基金青年基金(31900877)的资助。
文章引用
刘 倩,刘文宽,游爱萍,许 多. 呼吸道合胞病毒M2-1蛋白Hep-2细胞稳定表达株的构建及其在呼吸道合胞病毒感染中的特点
Construction of Stable Expression Respiratory Syncytial Virus M2-1 Protein Hep-2 Cell and Characteristics of the Cell in RSV Infection[J]. 微生物前沿, 2019, 08(03): 154-164. https://doi.org/10.12677/AMB.2019.83019
参考文献
- 1. Liu, W.K., Liu, Q., Chen, D.H., Liang, H.X., Chen, X.K., Chen, M.X., Qiu, S.Y., Yang, Z.Y. and Zhou, R. (2014) Epidemiology of Acute Respiratory Infections in Children in Guangzhou: A Three-Year Study. PLoS One, 9, e96674. https://doi.org/10.1371/journal.pone.0096674
- 2. Ciarlitto, C., Vittucci, A.C., Antilici, L., Concato, C., Di Camillo, C., Zangari, P. and Villani, A. (2019) Respiratory Syncityal Virus A and B: Three Bronchiolitis Seasons in a Third Level Hospital in Italy. Italian Journal of Pediatrics, 45, 115. https://doi.org/10.1186/s13052-019-0704-0
- 3. Cervantes-Ortiz, S.L., Zamorano Cuervo, N. and Grandvaux, N. (2016) Respiratory Syncytial Virus and Cellular Stress Responses: Impact on Replication and Physiopathology. Viruses, 8, 124. https://doi.org/10.3390/v8050124
- 4. Borchers, A.T., Chang, C., Gershwin, M.E. and Gershwin, L.J. (2013) Respiratory Syncytial Virus—A Comprehensive Review. Clinical Reviews in Allergy & Immunology, 45, 331-379. https://doi.org/10.1007/s12016-013-8368-9
- 5. 里奇曼. 临床病毒学[M]. 北京: 科学出版社, 2012.
- 6. Collins, P.L., Fearns, R. and Graham, B.S. (2013) Respiratory Syncytial Virus: Virology, Reverse Enetics, 105 and Pathogenesis of Disease. Current Topics in Microbiology and Immunology, 372, 3-38. https://doi.org/10.1007/978-3-642-38919-1_1
- 7. Munday, D.C., Wu, W., Smith, N., Fix, J., Noton, S.L., Galloux, M., Touzelet, O., Armstrong, S.D., Dawson, J.M., Aljabr, W., et al. (2015) Interactome Analysis of the Human Respiratory Syncytial Virus RNA Polymerase Complex Identifies Protein Chaperones as Important Cofactors That Promote Protein Stability and RNA Synthesis. Journal of Virology, 89, 917-930. https://doi.org/10.1128/JVI.01783-14
- 8. Buchholz, U.J., Biacchesi, S., Pham, Q.N., Tran, K.C., Yang, L., Luongo, C.L., Skiadopoulos, H., Murphy, B.R. and Collins, P.L. (2005) Deletion of M2 Gene Open Reading Frames 1 and 2 of Human Metapneumovirus: Effects on RNA Synthesis, Attenuation, and Immunogenicity. Journal of Virology, 79, 6588-6597. https://doi.org/10.1128/JVI.79.11.6588-6597.2005
- 9. Tran, T.L., Castagne, N., Dubosclard, V., Noinville, S., Koch, E., Moudjou, M., Henry, C., Ernard, J., Yeo, R.P. and Eleouet, J.F. (2009) The Respiratory Syncytial Virus M2-1 Protein Forms Tetramers and Interacts with RNA and P in a Competitive Manner. Journal of Virology, 83, 6363-6374. https://doi.org/10.1128/JVI.00335-09
- 10. Tanner, S.J., Ariza, A., Richard, C.A., Kyle, H.F., Dods, R.L., Blondot, M.L., Wu, W., Trincao, J., Trinh, C.H., Hiscox, J.A., et al. (2014) Crystal Structure of the Essential Transcription Antiterminator M2-1 Protein of Human Respiratory Syncytial Virus and Implications of Its Phosphorylation. Proceedings of the National Academy of Sciences of the United States of America, 111, 1580-1585. https://doi.org/10.1073/pnas.1317262111
- 11. Muniyandi, S., Pangratiou, G., Edwards, T.A. and
Barr, J.N. (2018) Structure and Function of the Human Respiratory Syncytial Virus M2-1 Protein. Subcellular Biochemistry, 88, 245-260. https://doi.org/10.1007/978-981-10-8456-0_11 - 12. Molina, I.G., Josts, I., Almeida Hernandez, Y., Esperante, S., Salgueiro, M., Garcia Alai, M.M., de Prat-Gay, G. and Tidow, H. (2018) Structure and Stability of the Human Respiratory Syncytial Virus M2-1 RNA-Binding Core Domain Reveals a Compact and Cooperative Folding Unit. Acta Crystallographica Section F: Structural Biology Communications, 74, 23-30. https://doi.org/10.1107/S2053230X17017381
NOTES
*通讯作者。
