Hans Journal of Soil Science
Vol.
11
No.
03
(
2023
), Article ID:
69737
,
11
pages
10.12677/HJSS.2023.113020
根系分泌碳输入对刺槐凋落叶细菌群落结构的影响
胡凯,王微*
重庆文理学院园林与生命科学学院,重庆
收稿日期:2023年6月20日;录用日期:2023年7月21日;发布日期:2023年7月28日

摘要
为深入理解根系分泌碳输入对凋落物分解细菌群落的调节作用,在刺槐凋落叶分解环境中添加不同浓度的模拟根系分泌物碳溶液(每g土壤添加CK 0 mg、L 0.27 mg、M 0.54 mg、H 1.08 mg碳),通过45 d的室内培养后,采用16S rRNA测序研究外源根系分泌碳对刺槐凋落叶表面细菌群落的影响。结果表明:1) 各处理间细菌群落的丰富度无差异,但中、高浓度(M和H)的分泌碳输入显著提高了其多样性。2) 变形菌门(Proteobacteria)、浮霉状菌门(Planctomycetes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和酸杆菌门(Acidobacteria)是刺槐凋落物的主要分解细菌类群。3) 变形菌门和放线菌门的丰度对于分泌碳输入浓度的响应特征具有低促高抑的现象;同时较高浓度的根系分泌碳输入处理(H)促进了拟杆菌门的繁殖。4) 刺槐凋落叶表面细菌功能群以化学异养和好氧化学异养为主,固氮类、碳氢化合物降解类和纤维素分解类功能基因的丰度随着输入分泌碳浓度的增加而逐步提高。研究结果有助于理解根系分泌物对凋落物降解细菌群落的影响机制,为深入揭示根系–微生物–凋落物降解互作效应提供一定理论依据。
关键词
根系分泌碳,凋落叶,分解,细菌群落结构

Effects of Root Exudation Carbon Inputs on the Structure of Bacterial Microbial Communities during Symplocos Lucida Litter Decomposition
Kai Hu, Wei Wang*
College of Landscape Architecture and Life Science, Chongqing University of Arts and Sciences, Chongqing
Received: Jun. 20th, 2023; accepted: Jul. 21st, 2023; published: Jul. 28th, 2023

ABSTRACT
To understand how root exudates influence litter decomposition in forest ecosystems, different concentrations of simulated root exudate carbon solutions (CK 0, L 0.27, M 0.54, H 1.08 mg C per gram of soil) were added to the Symplocos lucida litter decomposition environment. After 45 days of laboratory incubation, the impact of different carbon input levels on the bacterial community was assessed using 16S rRNA sequencing. The results showed that: 1) There was no significant difference in the richness of bacterial communities among the treatments, but the input of medium and high concentrations (M and H) of exudate carbon significantly increased their diversity. 2) Proteobacteria, Planctomycetes, Actinobacteria, Bacteroidetes, and Acidobacteria were the main bacterial phyla involved in the decomposition of Symplocos lucida litter. 3) The abundance of Proteobacteria and Actinobacteria exhibited a low promotion-high inhibition response to the concentration of exudate carbon input. Additionally, the higher concentration of root exudate carbon input (H) promoted the proliferation of Bacteroidetes. 4) The functional groups of bacteria on the surface of Symplocos lucida litter were primarily associated with chemoheterotrophy and aerobic chemoheterotrophy. The abundance of functional genes related to nitrogen fixation, hydrocarbon degradation, and cellulolysis increased gradually with the increase in exudates carbon input concentration. Overall, these research findings contribute to the understanding of the mechanisms by which root exudates influence the bacterial community involved in litter decomposition. They also provide a theoretical basis for further revealing the interactions among roots, microorganisms, and litter decomposition processes.
Keywords:Root Exudation Carbon, Leaf Litter, Decomposition, Bacteria Microbial Community

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
根系分泌物作为森林土壤碳库的主要来源和媒介 [1] ,是构成根际微生态系统活力与功能特征的内在驱动因素 [2] ,对于根际生态过程调控和地下生态系统功能具有重要影响 [3] 。植物根系在生长期所分泌的大量活性有机碳化合物,可为土壤微生物提供重要且丰富的碳源和能源 [4] ,促进微生物群落繁殖,提高有机质降解速率,从而深刻地影响土壤养分代谢过程 [5] [6] 。正是由于根系分泌物在调控根际微生态系统结构与功能方面重要作用,森林地下根际是土壤生物地球化学循环过程的热点区域。
凋落物分解过程中产生大量的养分元素和凋落物层良好的透水性和持水能力使得根系向凋落物层生长是多种森林生态系统普遍存在而易被忽视的现象 [7] 。有研究发现,根系在凋落物层生长时可通过机械碎裂凋落物物理结构 [8] 和释放分泌物影响微生物群落结构,加快凋落物分解 [9] [10] 。根源C输入及其介导的根系–微生物–凋落物分解互作效应已成为森林生态系统碳循环研究中一个非常重要而又缺乏了解的关键环节 [11] 。
在前期研究中我们通过定量PCR等实验证实少量根系分泌物碳输入(每g土中添加碳低于1.2 mg)可提高凋落物表面微生物特别是真菌基因拷贝数量,促进微生物代谢活力,产生正激发效应,加速凋落物的分解 [12] 。在野外实验中也发现根系处理对凋落物表面细菌数量影响不显著,但凋落物分解细菌所分泌胞外酶差异显著 [13] 。我们猜测在根系生长过程中根系分泌物碳输入对微生物群落结构具有选择塑造作用,其中细菌群落能够对碳输入进行迅速响应,凋落物分解的优势细菌类群随着时间和根系分泌碳浓度差异发生显著变化。
为进一步理解该过程中外源输入根系分泌碳对凋落物表面优势细菌类群及功能的影响特征,本研究以中亚热带常绿阔叶林优势种刺槐(Symplocos lucida)凋落叶为研究对象,通过人工添加根系分泌有机碳复合物,利用16S rRNA测序技术研究不同浓度根系分泌物碳添加对凋落物分解过程中细菌群落动态的影响,探讨不同优势细菌类群对碳源的响应特征,为深入揭示根系生长对森林凋落物分解影响的微生物学机理提供一定的科学依据。
2. 材料与方法
2.1. 采集地概况及实验材料
采集地为重庆市缙云山国家级自然保护区(29˚48'25''~29˚51'53''N, 106˚20'18''~106˚24'42''E),缙云山位于亚热带常绿落叶和针阔混交林植被地带,海拔200~952.5 m,森林覆盖率达96.6%。在常绿阔叶林内收集优势树种刺槐的新鲜凋落叶,风干,避开主脉用无菌打孔器(内径6 mm)剪成小圆片,作为供试材料。供试土壤取自相同采样点腐殖质层下方土壤,去除土壤中植物碎屑、死根等杂质,风干后过2 mm筛备用。
2.2. 人工模拟根系分泌碳溶液制备
根据de Graaff等 [14] 的方法制备模拟根系分泌碳母液。溶液包含了根系分泌物中最常见的含碳化合物,主要包括:葡萄糖,果糖,木糖,草酸,延胡索酸,琥珀酸,乙酸,L-脯氨酸,L-精氨酸,L-甘氨酸,丝氨酸和谷氨酸,其总碳含量为2.86 mg/mL。根据我们前期实验研究 [12] ,利用无菌蒸馏水稀释制备不同碳浓度的模拟根系分泌物溶液:CK (0 mg/L)、L (150 mg/L,低浓度)、M (300 mg/L,中浓度)、H (600 mg/L,高浓度)。
2.3. 实验设计
为模拟凋落叶在野外的分解过程,本实验参考相关文献中分解袋处理法 [12] [15] ,将供试土壤10 g放入培养皿(内径9 cm)内,在土壤层上方平铺刺槐凋落叶(2 g)并轻轻压实,使其与土层充分接触。每间隔5 d加入对应处理的模拟根系分泌碳溶液2 ml以维持外源碳持续输入,每种处理3次重复。培养皿放入置于温度25℃、相对湿度50%的智能气候箱中培养处理,试验布置完毕后开始计算天数,共培养45 d使分泌碳添加最终加入量为每g风干土中添加碳:CK-0 mg,L-0.27 mg,M-0.54 mg,H-1.08 mg。
2.4. 凋落叶表面微生物总DNA的提取与16s rRNA测序
使用试剂盒UltraCleanTM Soil DNA Isolation Kit (MoBio, Carlsbad, CA, USA)提取凋落叶表面总DNA。总DNA送至广州基迪奥生物技术公司,利用带barcode的特异性引物对16S rDNA V3 + V4区进行扩增测序。引物序列为:341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT。
测序数据处理参考Liu等方法 [16] ,采用EasyAmplicon分析流程:利用USEARCH 10.0对所有有效序列进行去噪获得操作分类单元OTU (operational taxonomic units);依据RDP 2.11数据库进行物种注释后多样性分析,使用Greengenes 13_8对OTUs进行物种注释后功能预测;使用USEARCH和R 4.2.0对上述OTUs表进行多样性分析,包括Alpha多样性、Beta多样性和基于BrayCurtis指数(Bray-Curtis相似性系数矩阵)的限制性主坐标分析(CPCoA);对不同处理的细菌群落组间分析采用线性判别分析(LEfSe,默认设置LDA Score的筛选值为4) [17] 和基于FAPROTAX的群落功能预测分析 [18] 。所有数据预处理和绘图采用ggplot2包和STAMP 2.13完成。
3. 结果与分析
3.1. 凋落叶细菌群落丰度及多样性分析
本试验12份凋落叶样本中,含有1,151,388条高质量序列,平均碱基长度为244 bp,共检测到4126个OTUs,其中4种处理共有OTUs1747个,占全部OTUs分布的42.3%。与对照(CK)相比,添加外源根系分泌碳溶液后,Chao1丰富度指数(Chao1 richness estimator, Chao1)和ACE指数无显著差异,表明凋落叶表面细菌群落丰富度无显著差异。中高浓度(M和H)的外源根系分碳输入后,Shannon多样性指数(Shannon’s Diversity Index, SHDI)和Simpson多样性指数与CK相比具有显著差异,说明中高浓度碳输入提高了凋落叶表面细菌群落的多样性,结果见表1。
Table 1. Statistical analysis of bacterial community alpha diversity of leaf litter
表1. 凋落叶表面细菌群落α-多样性指数
为进一步分析各组之间共有和特有的OTUs的数量情况,根据等量重抽样数据(每处理组抽样序列为62,870)绘制了韦恩图(图1A)。根据平均丰度大于0.1%进行筛选,共检测到234个OTUs,4种处理(H, M, L, CK)中特有细菌OTUs水平存在差异,分别为14.1%、5.1%、1.7%、13.2%。以Bray-Curtis距离进行限制性主坐标(CPCoA)分析不同浓度模拟根系分泌碳输入后凋落叶表面细菌群落结构的差异。结果显示
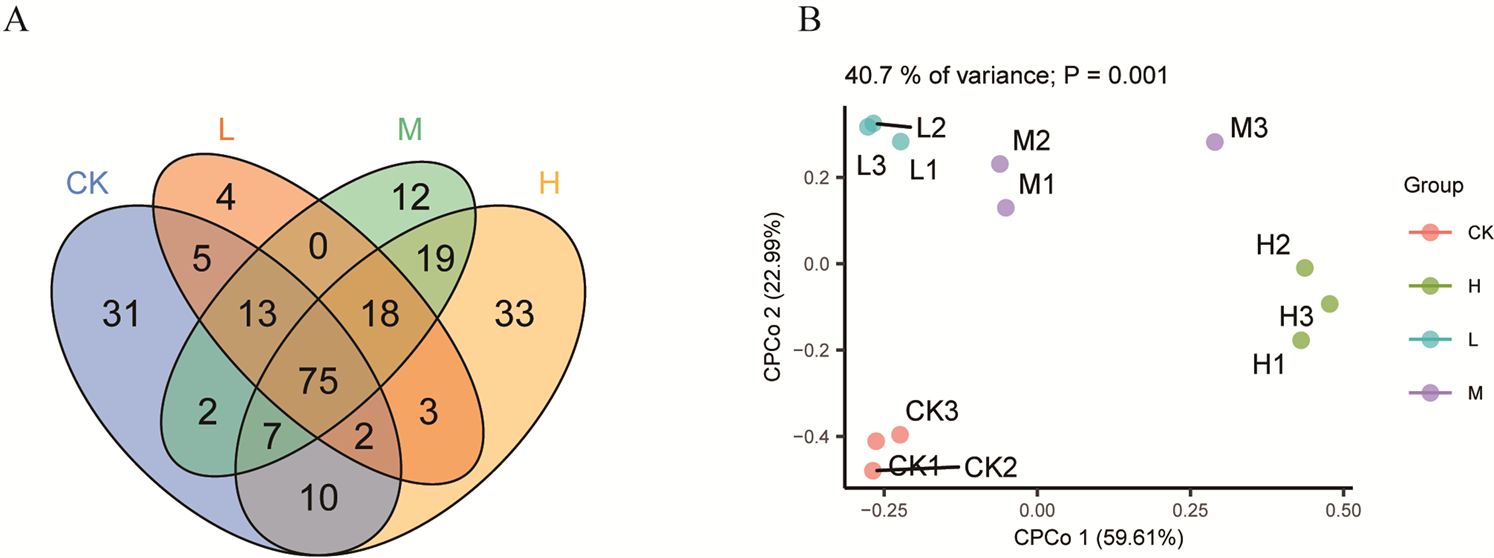
Figure 1. Diversity data analysis of bacteria community on the surface of leaf litter; A. Venn diagram based on OTUs in each treatment; B. Constrained principal coordinate analysis of different treatments based on beta diversity matrix distances (Bray-Curtis)
图1. 凋落叶表面细菌的多样性数据分析图;A、不同处理组独有及共有OUTs韦恩图;B、不同处理组基于β-多样性矩阵距离(Bray-Curtis)的限制性主坐标图
2个主坐标可以有效地解释各组间40.4%的差异(P = 0.0001) (图1B)。第一主坐标方向表明高浓度的碳输入(H)显著影响了凋落叶表面细菌群落结构,解释了59.61%的变异(CPCoA1),此外,中低浓度碳输入(L、M)相比对照组(CK)差异较小,只解释了22.99%的变异(CPCoA2)。
3.2. 凋落叶表面细菌群落组成分析
系统发育分析表明,本研究中凋落叶表面细菌群落分属19个门54纲97目180科343属1647种,其中变形菌门(Proteobacteria,相对丰度41.77%~63.1%)、浮霉状菌门(Planctomycetes,相对丰度5.57%~12.25%)、放线菌门(Actinobacteria,相对丰度4.83%~12.99%)、拟杆菌门(Bacteroidetes,相对丰度2.30%~6.85%)和酸杆菌门(Acidobacteria,相对丰度1.64%~3.72%)为优势菌门(图2A)。与CK处理相比,M和H处理显著增加拟杆菌门的相对丰度。属水平上,H处理中假单胞菌属(Pseudomonas)比例显著低于其他处理组,而莱朗杆菌属(Reyranella)、野野村氏菌属(Nonomuraea)、外硫红弯菌属(Ectothiorhodosinus)、金黄线菌属(Chryseolinea)和链霉菌属(Streptomyces)等则无显著差异(图2B)。
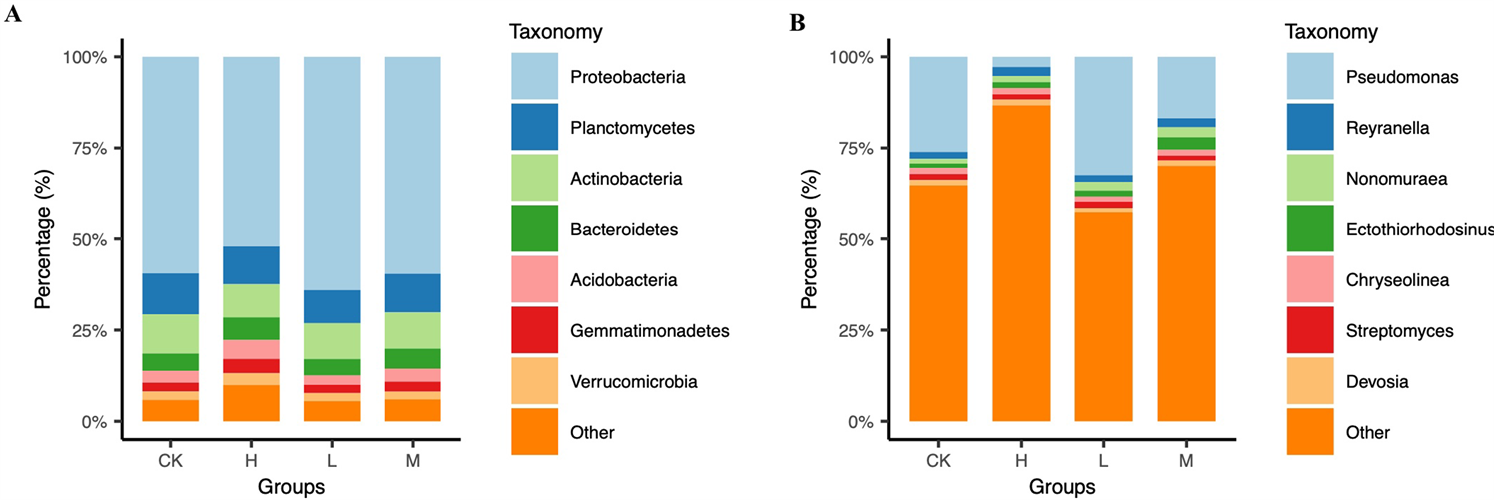
Figure 2. Bacterial composition of different treatments at the phylum level (A) and genus level (B)
图2. 不同处理组在门水平(A)和属水平(B)的细菌群落结构
3.3. 凋落叶表面细菌群落结构差异分析
在OTU水平上,采用火山图分析不同碳浓度输入处理下群落结构差异。采用edgeR筛选各组代表性OTUs (阈值为0.1),共筛选出各处理组中146个共有OTUs进行相对丰度差异比较。结果分析表明,与CK处理相比,L处理下(5个上调,5个下调,图3A);M处理下(1个上调,8个下调,图3B);H处理下(27个上调,15个下调,图3D)。与L和M处理相比,H处理下分别上调OTU 18个和12个,显著下调OTU有8个和1个(图3E和图3F)。L和M处理组间上调和下调的OTU均为1个。进一步通过曼哈
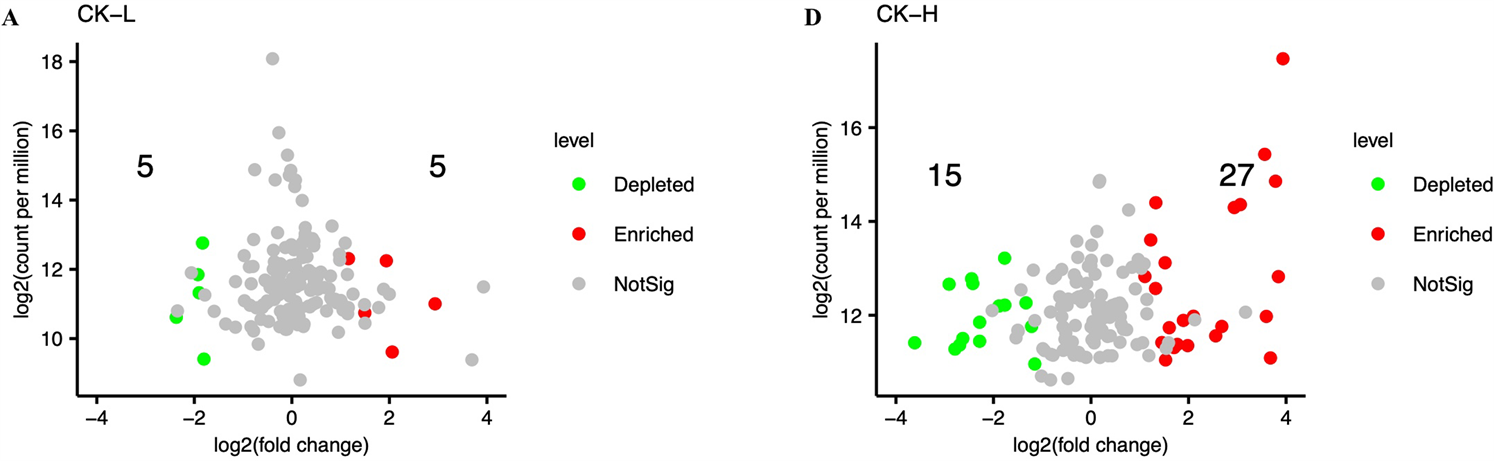
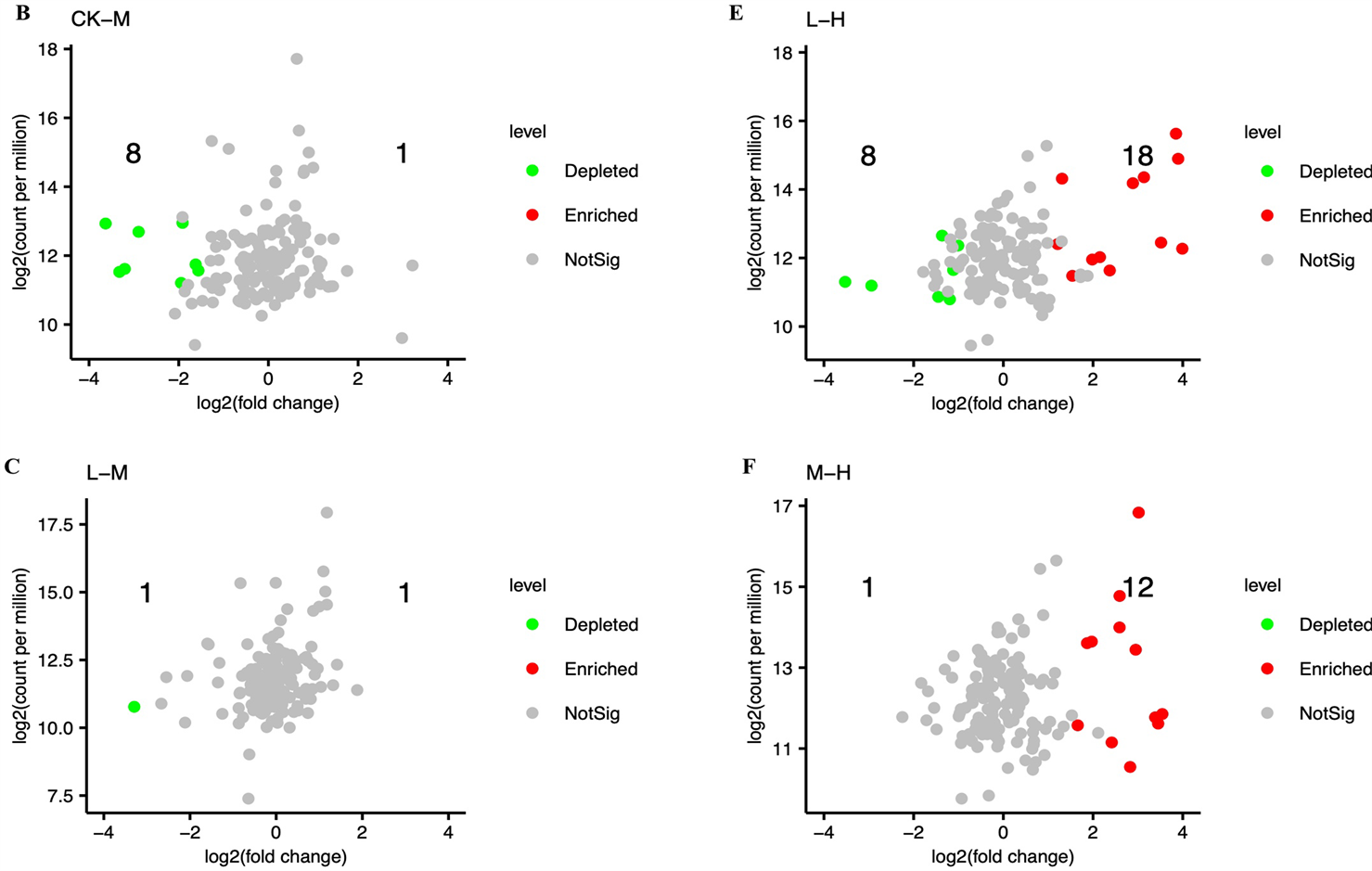
Figure 3. Volcano plot based on the OTU abundance variation of leaf litter between different treatments
图3. 基于凋落叶细菌OTU丰度变化的不同处理组间火山图
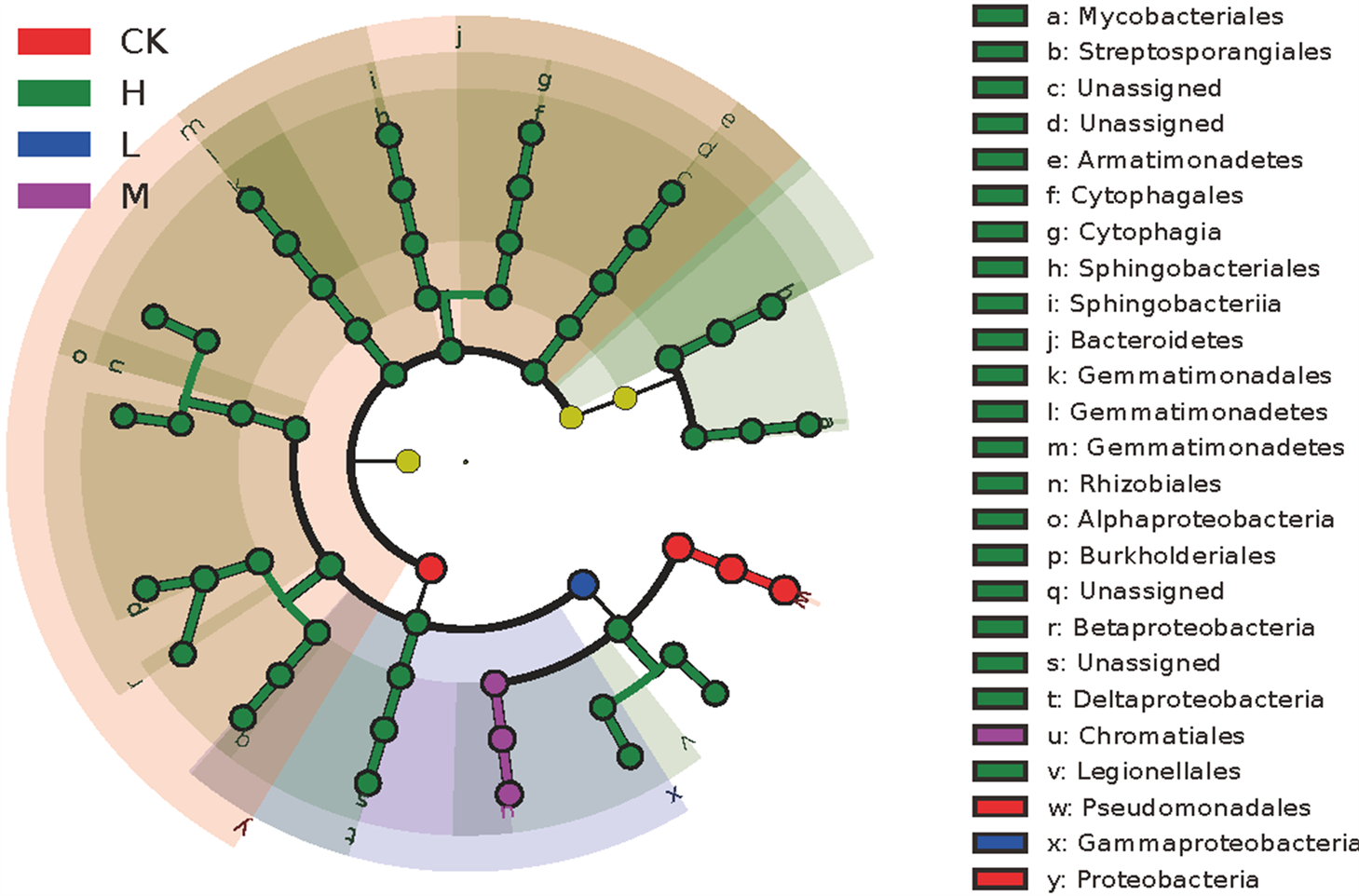
Figure 4. LEfSe analysis of genus level of leaf litter bacteria between different treatments
图4. 不同处理下凋落叶细菌属水平LEfSe分析
顿图及相关性热图分析发现,在H处理组中主要富集上调的OTUs为拟杆菌纲(Bacteroidia)、伽玛变形菌纲(Gammaproteobacteria)、贝塔变形菌纲(Betaproteobacteria)、浮霉状菌纲(Planctomycetia)等,显著下调的则为阿尔法变形菌纲(Alphaproteobacteria)和出芽单胞菌纲(Gemmatimonadetes)等。
为进一步比较对不同浓度根系分泌碳输入处理下的凋落叶表面细菌群落差异特征,利用LEfSe这种对统计学差异更为敏感的生物学标记工具进行挖掘。分析结果显示(见图4),共鉴定40种标志性细菌富集类群,其中CK组3种,L组1种,M组2种,H组34种。假单胞菌科(Pseudomonadaceae)、假单胞菌目(Pseudomonadales)和变形菌门(Proteobacteria)在CK处理具有显著优势,伽玛变形菌纲(Gammaproteobacteria)在L处理具有显著优势,外硫红螺菌科(Ectothiorhodospiraceae)和着色菌目(Chromatiales)在M处理具有显著优势,拟杆菌门(Bacteroidetes)等则在H处理中具有更高的相对丰度,可作为其区分标记。
3.4. 凋落叶表面细菌群落功能的预测分析
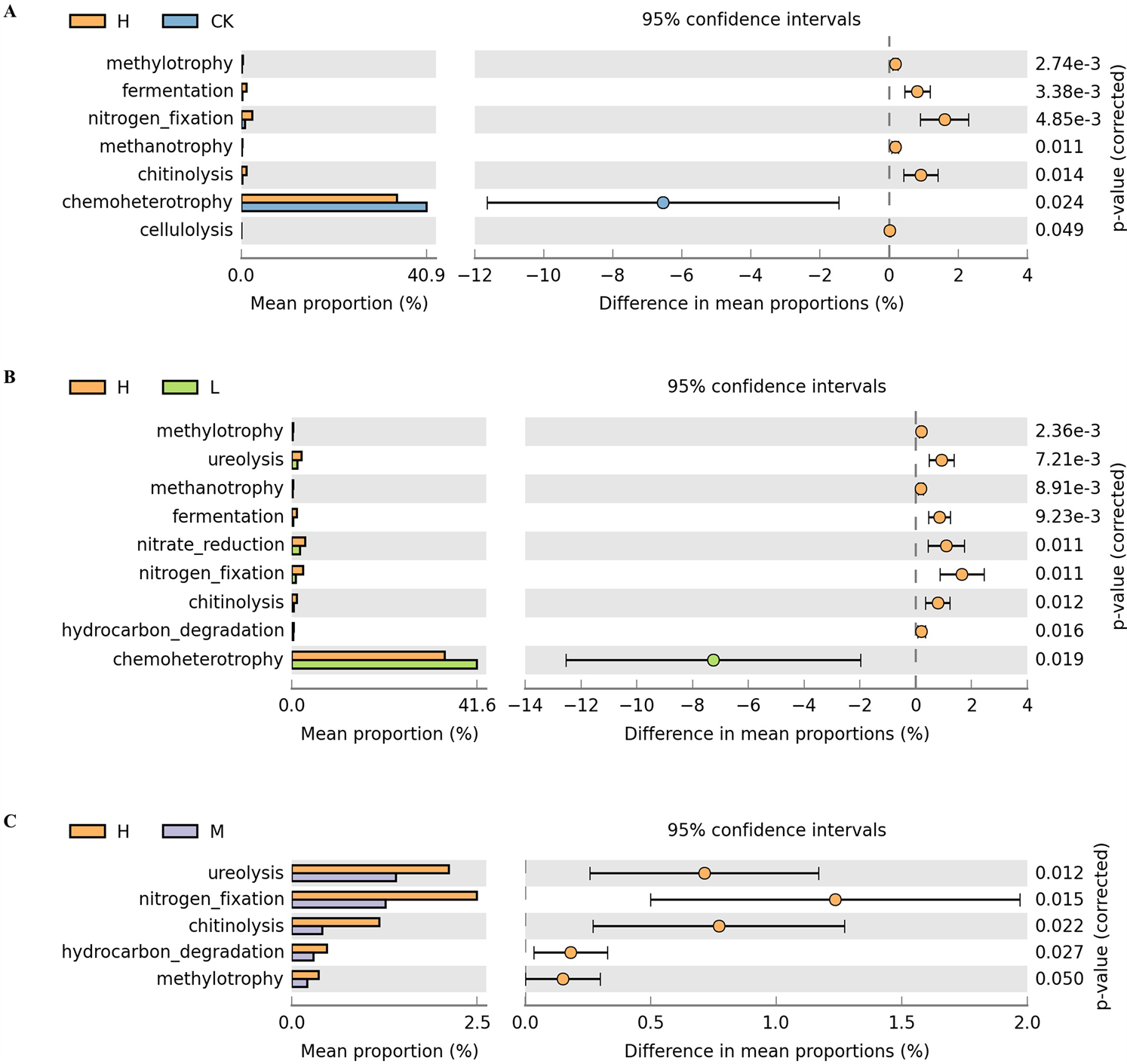
Figure 5. Functional prediction of bacterial community of leaf litter based on FAPROTAX database
图5. 基于FAPROTAX数据库预测的凋落叶表面菌群的功能
利用微生物功能预测数据库FAPROTAX对各处理组凋落物表面细菌类群进行功能预测分析,总共获得了45个功能预测分类。各处理组中共包括化学异养(38.68%)、好氧化学异养(37.28%)、发酵(2.7%)、细胞内寄生虫(2.69%)、硝酸盐还原(2.30%)、光合异养(1.98%)、厌氧光合自养(1.84%)、光合自养(1.80%)、尿素分解(1.50%)、固氮(1.45%)和几丁质分解(0.5%)、碳氢化合物降解(0.45%)等功能类群,各功能预测分类总体分布没有显著差异。为进一步分析凋落物表面细菌参与凋落物分解中碳氮元素循环功能细菌类群丰度差异,利用STAMP软件对各细分功能群进行比较(统计检验采用Welch’s t-test,多重检验为Benjamini-hochberg FDR),结果如图5所示。CK和L处理下化能异养类(chemoheterotrophy)相对丰度更高;发酵类(fermentation)、固氮类(nitrogen_fixation)、几丁质降解类(chitinolysis)、碳氢化合物降解类(hydrocarbon degradation)、纤维素分解类(cellulolysis)功能群在高浓度分泌碳处理组(H)中丰度显著提高。
4. 讨论
本研究利用外源模拟根系分泌碳添加实验,探讨在植物根系持续分泌有机碳条件下凋落叶表面细菌群落结构的变化特征。结果表明外源分泌碳输入情况下,Chao1指数和ACE指数在处理组与对照组间无显著性差异,这与一些研究中观察到微生物数量容易受到底物激发而丰度显著增加不一致 [19] [20] [21] 。其原因可能是刺槐凋落叶经过45 d分解后其剩余成分主要为纤维素和木质素,其表面营养物质匮乏,无法承载大量微生物同时增殖,外源分泌碳输入并不能显著改变细菌群落的总体丰富度。以前的一些研究中也观察到微量根际分泌物并不能满足凋落物分解微生物的营养需求,分解环境营养条件才是影响根际微生物丰富度的关键因素 [22] [23] 。相对于对照组,Shannon指数和Simpson指数在中高浓度(M、H处理)分泌碳处理组中有显著提高,说明根系分泌碳输入可以增加凋落物表面细菌多样性及物种丰富度,这与以往的实验结果一致 [24] 。持续输入的分泌碳溶液所提供的营养打破相对贫瘠环境下各细菌物种之间的平衡,驱使其开始对养分展开激烈竞争 [25] ,导致凋落物表面细菌群落结构发生改变。通过β多样性主坐标分析,发现中、高浓度分泌碳输入处理(M和H)是影响各组距离的最大因素,说明分泌碳对凋落物表面细菌具有大规模的选择塑造作用 [12] 。
优势物种很大程度上决定了凋落物表面微生物群落的结构和功能。本研究发现凋落物表面细菌群落在门水平上组成主要包括变形菌门、放线菌门、浮霉状菌门、拟杆菌门和酸杆菌门等,这与路颖等研究结果一致 [26] 。变形菌门和放线菌门是森林凋落物分解的主要细菌类群,放线菌门的部分细菌种群能够产生分解木质素的酶,具有分解木质素和纤维素的能力 [27] 。分解45 d后的刺槐凋落叶含有丰富的纤维素和木质素导致变形菌门及放线菌门在凋落物表面细菌群落中具有显著优势。在不同处理组中能观察到变形菌门和放线菌门的相对丰度在中低浓度(L和M)中高于H处理组,其丰度对于分泌碳输入浓度的响应特征具有低促高抑的现象。其主要原因是变形菌门和放线菌门是营养依赖性细菌,持续输入根系分泌碳溶液后导致凋落叶表面C/N升高,由于N逐渐缺乏,细菌繁殖效应从促进逐渐转换为抑制,这与以往在温带森林 [28] 、亚热带森林 [29] 等研究中去除植物根系后放线菌生物量增加相对应一致。丁鹏元等证实浮霉菌门具有降解多环芳烃类化合物的作用,促进有机碳的矿化 [30] 。拟杆菌门的细菌能破坏复杂的生物大分子,直接参与木质素的分解 [31] 。本研究中H组中拟杆菌门丰度显著高于其他处理,显示较高浓度的根系分泌碳输入促进了拟杆菌门的繁殖,更有利于刺槐凋落叶中剩余木质素和纤维素的分解。此外,Sul等 [32] 研究表明,森林土壤有机物中氮含量的增加促使酸杆菌门的多样性增加。在属分类水平上,假单胞菌属和野野村氏菌属在不同处理中同样表现出低促高抑的现象,中、低浓度的分泌碳溶液促进假单胞菌属代表的变形菌门和野野村氏菌属代表的放线菌门快速生长,而高浓度分泌碳输入则抑制这二者的丰度。LEFse的分析结果也表明,以假单胞菌为代表的变形菌门随着外源根系分泌碳输入浓度的增加而逐渐降低被富集对照组中;拟杆菌门中多类细菌种群则更多富集在中、高浓度(M和H)处理组中。
碳、氮的分解和固定是凋落物分解过程中的两个关键过程。在本研究中,采用FAPROTAX分析预测模拟分泌碳输入下凋落物表面参与碳、氮元素循环的微生物功能组合。刺槐凋落物表面细菌群落被预测分为45个功能分类,包括化学异养(38.68%)、好氧化学异养(37.28%)等主要功能基因,这与Leonardo等 [33] 在智利森林凋落物层下根际细菌功能预测结果类似。本研究4种处理之间各功能组合总体差异不显著,这可以用土壤微生物区系的功能冗余来解释。当环境压力作用于土壤微生物区系时,将导致某些功能物种的生态作用丧失 [34] ,然而,具有相似生态功能的物种可以立即填补和占据这一生态位 [35] 。因此,土壤功能基因的丰度总体上没有受到影响。本研究中利用FAPROTAX预测结果进一步对比各组碳、氮循环元素基因的丰度差异,结果表明高浓度根系分泌碳溶液输入显著提高了凋落物分解相关功能基因的丰度,固氮类、碳氢化合物降解类和纤维素分解类功能基因的丰度随着输入分泌碳浓度增加而逐步提高,促进了刺槐凋落叶的分解。固氮类和纤维素分解类功能基因丰度同步提高的现象与Yang等 [36] 对红树林碳、氮循环功能基因的FAPROTAX和Q-PCR比较分析具有相同的变化规律。其原因是固氮菌与纤维素分解菌存在着互利共生关系,前者为后者提供氮元素,后者为前者提供丰富的碳源 [37] 。本研究中高浓度组中外源根系分泌碳持续输入为凋落物表面微生物提供了丰富的碳源,整体提高了氮代谢微生物丰度;同时由于高浓度分泌碳的输入导致凋落物表面可利用氮暂时匮乏,进一步促使固氮类细菌加快繁殖速度,相对丰度显著增加。
5. 结论
本研究采用细菌16s rRNA高通量测序技术,对输入不同浓度的模拟根系分泌碳后刺槐凋落物表面细菌群落结构进行测定,揭示根系分泌物对凋落物降解微生物群落的影响机理。结果表明:
1) 外源分泌碳输入不能显著改变细菌群落的总体丰富度,但分泌碳输入浓度提高能显著增加凋落物表面细菌群落的多样性。
2) 变形菌门、浮霉状菌门、放线菌门、拟杆菌门和酸杆菌门是本研究中刺槐凋落物的主要分解细菌类群。较高浓度的根系分泌碳输入能提高拟杆菌门的丰度,促进刺槐凋落叶中木质素的分解。
3) 凋落物表面细菌功能群中固氮类、碳氢化合物降解类和纤维素分解类功能基因的丰度随着输入分泌碳浓度增加而逐步提高,促进了刺槐凋落物的分解。
基金项目
国家自然科学基金项目(31700539)和重庆市自然科学基金项目(CSTC2019jcyj-msxmX0822, CSTC 2021jcyj-msxmX1019)资助。
文章引用
胡 凯,王 微. 根系分泌碳输入对刺槐凋落叶细菌群落结构的影响
Effects of Root Exudation Carbon Inputs on the Structure of Bacterial Microbial Communities during Symplocos Lucida Litter Decomposition[J]. 土壤科学, 2023, 11(03): 157-167. https://doi.org/10.12677/HJSS.2023.113020
参考文献
- 1. Noguchi, K., Nagakura, J., Konôpka, B., Sakata, T., Kaneko, S. and Takahashi, M. (2013) Fine-Root Dynamics in Sugi (Cryptomeria japonica) under Manipulated Soil Nitrogen Conditions. Plant and Soil, 364, 159-169. https://doi.org/10.1007/s11104-012-1354-9
- 2. 尹华军, 张子良, 刘庆. 森林根系分泌物生态学研究: 问题与展望[J]. 植物生态学报, 2018, 42(11): 1055-1070.
- 3. 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310.
- 4. de Graaff, M.A., Classen, A.T., Castro, H.F. and Schadt, C.W. (2010) Labile Soil Carbon Inputs Mediate the Soil Microbial Community Composition and Plant Residue Decomposition Rates. New Phytologist, 188, 1055-1064. https://doi.org/10.1111/j.1469-8137.2010.03427.x
- 5. Yin, H., Li, Y., Xiao, J., Xu, Z., Cheng, X. and Liu, Q. (2013) Enhanced Root Exudation Stimulates Soil Nitrogen Transformations in a Subalpine Coniferous Forest under Experimental Warming. Global Change Biology, 19, 2158-2167. https://doi.org/10.1111/gcb.12161
- 6. Lv, C., Wang, C., Cai, A. and Zhou, Z. (2023) Global Magnitude of Rhizosphere Effects on Soil Microbial Communities and Carbon Cycling in Natural Terrestrial Ecosystems. Science of the Total Environment, 856, Article ID: 158961. https://doi.org/10.1016/j.scitotenv.2022.158961
- 7. Sayer, E.J., Tanner, E.V.J. and Cheesman, A.W. (2006) In-creased Litterfall Changes Fine Root Distribution in a Moist Tropical Forest. Plant and Soil, 281, 5-13. https://doi.org/10.1007/s11104-005-6334-x
- 8. Wang, W., Hu, K., Huang, K. and Tao, J. (2021) Mechanical Fragmentation of Leaf Litter by Fine Root Growth Contributes Greatly to the Early Decomposition of Leaf Litter. Global Ecology and Conservation, 26, e01456. https://doi.org/10.1016/j.gecco.2021.e01456
- 9. Wang, W., Wu, X., Hu, K., Liu, J. and Tao, J. (2016) Under-storey Fine Root Mass and Morphology in the Litter and Upper Soil Layers of Three Chinese Subtropical Forests. Plant and Soil, 406, 219-230. https://doi.org/10.1007/s11104-016-2878-1
- 10. 刘瑞强, 黄志群, 何宗明, 万晓华, 余再鹏, 郑璐嘉, 肖好燕. 根系去除对米老排和杉木凋落物分解的影响[J]. 林业科学, 2015, 51(9): 1-8.
- 11. Wu, L.K., Lin, X.M. and Lin, W.X. (2014) Advances and Perspective in Research on Plant-Soil-Microbe Interactions Mediated by Root Exudates. Chinese Journal of Plant Ecology, 38, 298-310. https://doi.org/10.3724/SP.J.1258.2014.00027
- 12. 胡凯, 陶建平, 黄科, 胡靖, 王微. 模拟根系分泌物碳输入对凋落叶分解中微生物群落动态的影响[J]. 应用与环境生物学报, 2020, 26(2): 417-424.
- 13. 胡凯, 陶建平, 何丹妮, 黄科, 王微. 林下植物根系对森林凋落物分解过程中微生物及酶活性的影响[J]. 应用生态学报, 2019, 30(6): 1993-2001.
- 14. de Graaff, M.A., Jastrow, J.D., Gillette, S., Johns, A. and Wullschleger, S.D. (2014) Differen-tial Priming of Soil Carbon Driven by Soil Depth and Root Impacts on Carbon Availability. Soil Biology and Bio-chemistry, 69, 147-156. https://doi.org/10.1016/j.soilbio.2013.10.047
- 15. 费裕翀, 叶义全, 郑宏, 路锦, 游云飞, 黄樱, 陈爱玲, 曹光球. 外源氮素调控C/N比对杉木林凋落叶细菌群落结构的影响[J]. 生态学报, 2021, 41(5): 2011-2023.
- 16. Liu, Y., Chen, L., Ma, T., Li, X., Zheng, M., Zhou, X., et al. (2023) EasyAmplicon: An Easy‐to‐Use, Open‐Source, Repro-ducible, and Community-Based Pipeline for Amplicon Data Analysis in Microbiome Research. iMeta, 2, e83. https://doi.org/10.1002/imt2.83
- 17. Segata, N., Izard, J., Waldron, L., Gevers, D., Miropolsky, L., Garrett, W.S. and Huttenhower, C. (2011) Metagenomic Biomarker Discovery and Explanation. Genome Biology, 12, R60. https://doi.org/10.1186/gb-2011-12-6-r60
- 18. Louca, S., Parfrey, L.W. and Doebeli, M. (2016) Decoupling Function and Taxonomy in the Global Ocean Microbiome. Science, 353, 1272-1277. https://doi.org/10.1126/science.aaf4507
- 19. Eisenhauer, N., Lanoue, A., Strecker, T., Scheu, S., Steinauer, K., Thakur, M.P. and Mommer, L. (2017) Root Biomass and Exudates Link Plant Diversity with Soil Bacterial and Fungal Biomass. Scientific Reports, 7, Article No. 44641. https://doi.org/10.1038/srep44641
- 20. Zhalnina, K., Louie, K.B., Hao, Z., Mansoori, N., Da Rocha, U.N., Shi, S., et al. (2018) Dynamic Root Exudate Chemistry and Microbial Substrate Preferences Drive Patterns in Rhizosphere Microbial Community Assembly. Nature Microbiology, 3, 470-480. https://doi.org/10.1038/s41564-018-0129-3
- 21. Adamczyk, M., Rüthi, J. and Frey, B. (2021) Root Exudates In-crease Soil Respiration and Alter Microbial Community Structure in Alpine Permafrost and Active Layer Soils. Envi-ronmental Microbiology, 23, 2152-2168. https://doi.org/10.1111/1462-2920.15383
- 22. Kuzyakov, Y., Hill, P.W. and Jones, D.L. (2007) Root Exudate Components Change Litter Decomposition in a Simulated Rhizosphere Depending on Temperature. Plant and Soil, 290, 293-305. https://doi.org/10.1007/s11104-006-9162-8
- 23. Mitter, E.K., De Freitas, J.R. and Germida, J.J. (2017) Bacterial Root Microbiome of Plants Growing in Oil Sands Reclamation Covers. Frontiers in Microbiology, 8, Article No. 849. https://doi.org/10.3389/fmicb.2017.00849
- 24. 冯慧琳, 徐辰生, 何欢辉, 曾强, 陈楠, 李小龙, 任天宝, 姬小明, 刘国顺. 生物炭对土壤酶活和细菌群落的影响及其作用机制[J]. 环境科学, 2021, 42(1): 422-432.
- 25. Ratzke, C., Barrere, J. and Gore, J. (2020) Strength of Species Interactions Determines Biodiversity and Stability in Microbial Communities. Nature Ecology & Evolution, 4, 376-383. https://doi.org/10.1038/s41559-020-1099-4
- 26. 路颖, 李坤, 梁强, 李传荣, 张彩虹. 泰山4种优势造林树种叶片凋落物分解对凋落物内细菌群落结构的影响[J]. 生态学报, 2019, 39(9): 3175-3186.
- 27. Crawford, D.L. (1978) Lignocellulose Decomposition by Selected Streptomyces Strains. Applied and Environmental Microbiology, 35, 1041-1045. https://doi.org/10.1128/aem.35.6.1041-1045.1978
- 28. Schimel, J.P. and Schaeffer, S.M. (2012) Microbial Control over Carbon Cycling in Soil. Frontiers in Microbiology, 3, Article No. 348. https://doi.org/10.3389/fmicb.2012.00348
- 29. Xia, M., Talhelm, A.F. and Pregitzer, K.S. (2015) Fine Roots Are the Dominant Source of Recalcitrant Plant Litter in Sugar Maple-Dominated Northern Hardwood Forests. New Phytologist, 208, 715-726. https://doi.org/10.1111/nph.13494
- 30. 丁鹏元, 初里冰, 张楠, 王星, 王建龙. O池溶解氧水平对石化废水A/O工艺污染物去除效果和污泥微生物群落的影响[J]. 环境科学, 2015, 36(2): 604-611.
- 31. Lydell, C., Dowell, L., Sikaroodi, M., Gillevet, P. and Emerson, D. (2004) A Population Survey of Members of the Phylum Bacteroidetes Isolated from Salt Marsh Sediments along the East Coast of the United States. Microbial Ecology, 48, 263-273. https://doi.org/10.1007/s00248-003-1068-x
- 32. Sul, W.J., Asuming-Brempong, S., Wang, Q., Tourlousse, D.M., Penton, C.R., Deng, Y., et al. (2013) Tropical Agricultural Land Management Influences on Soil Microbial Communities through Its Effect on Soil Organic Carbon. Soil Biology and Biochemistry, 65, 33-38. https://doi.org/10.1016/j.soilbio.2013.05.007
- 33. Almonacid-Muñoz, L., Herrera, H., Fuentes-Ramírez, A., Vargas-Gaete, R., Larama, G., Jara, R., Fernández-Urrutia, C. and da Silva Valadares, R.B. (2022) Tree Cover Species Modify the Diversity of Rhizosphere-Associated Microorganisms in Nothofagus obliqua (Mirb.) Oerst Temperate For-ests in South-Central Chile. Forests, 13, Article No. 756. https://doi.org/10.3390/f13050756
- 34. Jia, Y. and Whalen, J.K. (2020) A New Perspective on Functional Re-dundancy and Phylogenetic Niche Conservatism in Soil Microbial Communities. Pedosphere, 30, 18-24. https://doi.org/10.1016/S1002-0160(19)60826-X
- 35. Grządziel, J. (2017) Functional Redundancy of Soil Microbiota—Does More Always Mean Better? Polish Journal of Soil Science, 50, 75-81. https://doi.org/10.17951/pjss.2017.50.1.75
- 36. Yang, Z., Peng, C., Cao, H., Song, J., Gong, B., Li, L., Wang, L., He, Y., Liang, M., Lin, J. and Lu, L. (2022) Microbial Functional Assemblages Predicted by the FAPROTAX Analysis Are Impacted by Physicochemical Properties, but C, N and S Cycling Genes Are Not in Mangrove Soil in the Beibu Gulf, China. Ecological Indicators, 139, Article ID: 108887. https://doi.org/10.1016/j.ecolind.2022.108887
- 37. 高思齐, 宋艳宇, 宋长春, 马秀艳, 蒋磊. 增温和外源碳输入对泥炭地土壤碳氮循环关键微生物功能基因丰度的影响[J]. 生态学报, 2020, 40(13): 4617-4627.
