Journal of Organic Chemistry Research
Vol.05 No.02(2017), Article ID:21046,6
pages
10.12677/JOCR.2017.52015
Progress of Phenylethanol Glycosides in Plants
Gang Xue, Chenghong Ma, Yujuan Chen*
School of Life Science and Technology, Changchun University of Science and Technology, Changchun Jilin
*通讯作者。

Received: May 21st, 2017; accepted: Jun. 18th, 2017; published: Jun. 21st, 2017

ABSTRACT
Phenylethanol glycoside compounds have a strong biological activity and significant pharmacological activity characteristics. They are widely distributed in plants, mainly distributed in Scrophulariaceae, Rosaceae, Orobanchaceae, Plantaginaceae, Verbenaceae and so on. These compounds have significant activity, which are Potential drugs. There are many researches about their activity and medical structures. In this paper, the recent studies on phenylethanol glycoside compounds are reviewed. The main sources, extraction, separation and synthesis methods, chemical structures, physical and chemical properties of phenylethanoid glycosides are studied in this paper. Pharmacological mechanism of the mechanism are descript in detail. It is useful to study phenylethanol glycosides in the further.
Keywords:Phenylethanoid Glycoside, Activity, Structure, Content Determination, Research Progress
苯乙醇苷类化合物的研究进展
薛刚,马成红,陈玉娟*
长春理工大学生命科学技术学院,吉林 长春

收稿日期:2017年5月21日;录用日期:2017年6月18日;发布日期:2017年6月21日

摘 要
苯乙醇苷化合物具有较强的生物活性且具有显著的药理活性特性。广泛的存在于植物中,主要分布于玄参科、蔷薇科、列当科、车前科、马鞭草科等高等植物中。这类化合物的药用价值较高,来源较广泛,因此研究比较多。本文对国内外有关苯乙醇苷类化合物的研究作一综述,主要综合研究苯乙醇苷类化合物的植物主要来源、提取、分离及合成方法、化学结构、理化性质,同时对苯乙醇苷类化合物的药理作用机制做了较详细介绍,对苯乙醇苷的进一步研究提供理论基础。
关键词 :苯乙醇苷,药理活性,结构分类,含量测定,研究进展

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
苯乙醇苷是一类酚苷类化合物,由苯乙醇和糖组合形成。母核通常为β-葡萄糖,其中苯乙基和羟基被羟基或甲氧基取代,肉桂酰基被甲氧基取代,通过酯键或糖苷键形成天然糖苷类化合物,该类化合物广泛存在于双子叶植物中。1950年Stoll等研究人员从松果菊的根部分离得到了松果菊苷,这是具记载以来第一次获得苯酚类化合物。1963年Scarpati M [1] 等研究人员从玄参科地中海毛蕊花中分离得到第一个苯乙醇苷毛蕊花苷后,目前从自然界分离得到的苯乙醇苷类化合物己近200多种 [2] ,大多数来自于民间药用植物中并在世界各地均有分布。由于该类化合物结构广泛相似,有较强的生物活性等特点。引起了广泛关注。
2. 苯乙醇苷类化合物在植物中的分布
植物中苯乙醇苷类化合物分布广泛,在较进化的科目中集中分布:玄参科、木樨科、马钱科、车前科、木兰科、菊科、蔷薇科、列当科、唇形科、苦苣苔科、马鞭草科、小檗科、马齿笕科、爵床科,玄参目和唇形目等多种植物中均发现苯乙醇苷类化合物,药用植物地黄、红药、醉鱼草、石胆草、女贞、独一味、肉苁蓉、连翘、玄参、广防风、车前草、小蜡树等 [3] 中也均含有苯乙醇苷类化合物的成分。
3. 苯乙醇苷类化合物的提取分离及合成方法
苯乙醇苷类化合物的提取分离:由于该类化合物结构类型相近,极性也非常接近,所以一般的分离方法很难将其全部分离获得单体化合物。该类化合物通过传统的柱色谱法得到的产率很低,因为其中所含有的酚羟基的基团在固体色谱柱上容易吸附。但采用溶剂提取法提取分离的效果较佳。一般选用水、甲醇、乙醇等萃取溶剂浓缩后萃取,转溶,除去如树脂等不能溶于水的杂质;脂质通过选用石油醚脱去,然后选用乙酸乙酯提取,去除脂溶性杂质;正丁醇萃取水层,得到苯乙醇苷,水洗除去水溶性杂质;然后用有机溶剂洗脱,得到粗苷。粗苷通过使用色谱法进行纯化。崔言坤 [4] 等通过大孔吸附树脂和动态轴向分离技术,建立最佳分离制备工艺进行苯乙醇苷类化合物麦角甾苷(acteoside)、异麦角甾苷(isoacteoside)、torenoside B的分离。董贝涛 [5] 等利用超声辅助双水相提取、大孔树脂扩张床吸附分离及聚酰胺树脂、反相硅胶及葡聚糖凝胶等柱层析技术,建立了荒漠肉苁蓉苯乙醇糖苷高效、规模化的提取分离方法。聂韡 [6] 等以X-5型大孔树脂为吸附剂,获得所选用树脂的最佳吸附能力,用水洗脱除去水溶性杂质,然后使用乙醇洗脱,得到提取物中含有苯乙醇苷。成功有效的分离纯化了广东紫珠中的苯乙醇苷类成分。李丽 [7] 等利用电喷雾多级串联质谱技术确定相应化合物的分子量,从而将肉苁蓉中的苯乙醇苷类化合物进行了分离纯化。刘影 [8] 等以LC-MS和H NMR为分析手段,分别对系列混合物样品进行数据采集,结合化学计量学方法对连翘活性提取物进行分析和纯化。
苯乙醇苷类化合物的合成研究:苯乙醇苷类化合物广泛分布在植物群落中,但含量均较低(0.02%~0.40%),与环烯醚萜苷、木质体苷及其他的糖苷共存,分离提取较为困难,样品量提取较少,难以满足科学研究的需要,因此进行苯乙醇苷类化合物的全合成研究是非常重要和必要的。1) 生物合成:植物中生物合成苯乙醇苷类化合物的生物合成己被证实,盛长忠 [9] 等通过不同培养基、光照、pH值、植物生长物质配比条件下培养愈伤组织,用紫外分光光度法检测苯乙醇苷类化合物,用HPLC法进行指纹谱图分析,pH值为6.0,25℃黑暗培养时愈伤组织中苯乙醇苷类化合物含量最高,达9.1%。得到的荒漠肉苁蓉愈伤组织可以用于替代天然的肉苁蓉中提取的苯乙醇苷类化合物。郭志刚 [10] 等利用肉苁蓉组织培养技术生产苯乙醇苷类活性成分,并成功得出盐生肉苁蓉的愈伤组织或细胞可以代替肉苁蓉生产苯乙醇苷类活性成分。王金芳 [11] 依据肉苁蓉植物中苯乙醇苷类成分谱学数据及特征,对苯乙醇苷类化合物可能的生物合成途径进行了初步探讨。2) 化学合成:至今己有40多年对于第一个苯乙醇苷类化合物的发现至今,但关于苯乙醇苷类化合物化学合成的报道并不多见,可以预见此类化合物的化学合成有较高的难度。Howard [12] 等首次报道了Acteoside的全合成,使得化学合成走入研究学者的视野。叶新山 [13] 等利用生物电子等药物设计原理改造类叶升麻苷获得了具有神经保护活性的苯乙醇苷衍生物。周峰岩 [14] 选择Arenarioside作为研究对象,通过新的化学合成策略,进行了Arenarioside及其类似物的合成研究。
4. 苯乙醇苷类化合物的化学结构
苯乙醇苷类化合物的天然产物结构为:通过酯键和糖苷键与β-吡喃葡萄糖将苯丙烯酸和部分苯乙醇连接。苯乙醇化合物可根据其母核中糖的数量和不同类型的糖分为苯乙醇单糖苷、双糖苷、三糖苷和四糖苷。图1为单糖苷苯乙醇苷类化合物,苯乙醇单糖苷类化合物母体糖苷为β-吡喃葡萄糖糖苷。其他位连接其他的糖。图2为双糖苷苯乙醇苷类化合物 [15] 。图3为三糖苷苯乙醇苷类化合物 [16] 。四糖苷类苯乙醇苷类化合物较为少见,目前已知的有lunaroside,marruboside,magnolioside C,ballotetroside,trichosanthoside B,and velutinosides I and II [17] ,Raduloside为目前已知的第7种四糖苷类苯乙醇类化合物,是从马樱丹属植物中分离得到的,图4为以上六种苯乙醇苷类化合物的化学结构 [18] 。
 R1 = OH or OMe; R2 = OH or OMe; R3 = H or Caff or Feru or Ara; R4 = H or Rha or Api or Glu; R5 = H or Kna or Api R6 = H or Kna or Api.
R1 = OH or OMe; R2 = OH or OMe; R3 = H or Caff or Feru or Ara; R4 = H or Rha or Api or Glu; R5 = H or Kna or Api R6 = H or Kna or Api.
Figure 1. Chemical structure of monoglycoside
图1. 单糖苷类苯乙醇苷化学结构
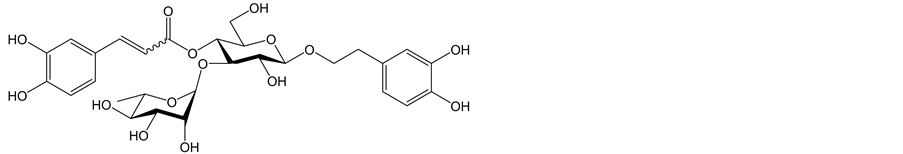
Figure 2. Chemical structure of diglucoside
图2. 双糖苷类苯乙醇苷化学结构

Figure 3. Chemical structure of trisglycoside
图3. 三糖苷类苯乙醇苷化学结构
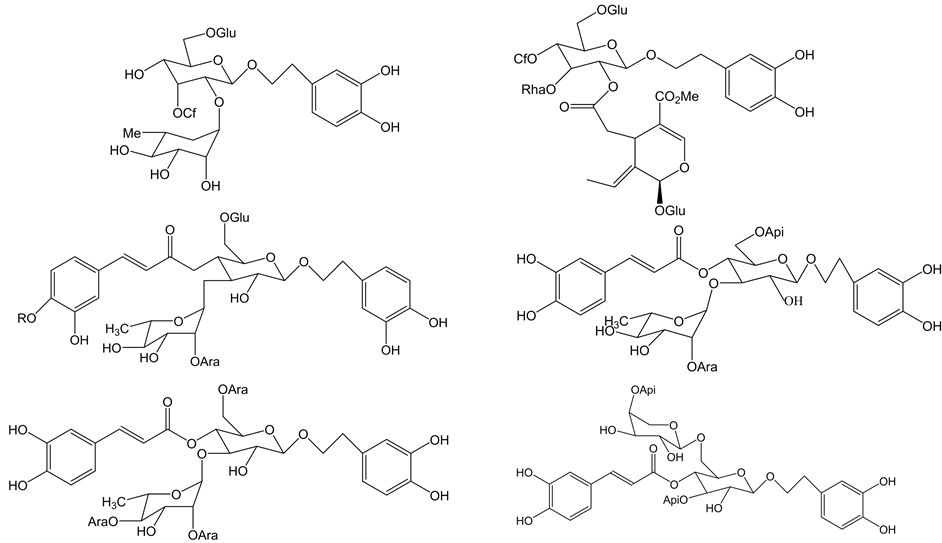
Figure 4. Chemical structure of tetramide glycoside
图4. 四糖苷类苯乙醇苷化学结构
该类化合物通常的分子结构由四部分组成:1) 苷元:一般情况下为苯乙醇或其衍生物,也通常会有酚羟基、甲氧基或脂基进行取代;2) 中心葡萄糖:苯乙醇上的α-羟基一般与1位的糖苷或苯乙二醇的α-羟基与β-羟基和1位和2位的糖苷形成六元环的结构。其中葡萄糖的2, 6位一般被取代基进行取代;3) 苯丙烯酰基:中心葡萄糖的2、3、4、5、6位通常与该基团连接,苯环结构酚常被羟基、甲氧基或脂基进行取代;4) 其他取代糖基:,2、3、4、5、6位的中心葡萄糖通常与葡萄糖、鼠李糖等糖基连接。另外,只存在苷元和中心葡萄糖的化合物,没有苯丙酰基。郑晓珂 [19] 等通过色谱技术,根据理化性质及光谱数据。分离、鉴定了4种苯乙醇苷类化合物结构。
5. 苯乙醇苷类化合物的理化性质
苯乙醇苷类化合物是一种白色或淡黄色无定形粉末,通过苯乙醇和糖结合形成的糖苷,通常与环烯醚萜类共同存在。这类化合物具有吸湿性和可溶于甲醇、水、乙醇、稀醇等极性较大的溶剂,在极性较小的有机溶剂中不溶,可在UV365下显蓝色荧光,在FeCl3-K3 [Fe(CN)6]和具有Fe离子的FeCl3水溶液中显蓝色,在10% KOH或NaOH水溶液中会变为深黄色,因此可以作为碱试剂。其中的酚羟基,可通过薄层色谱酸水解,检测识别到糖。
6. 苯乙醇苷类化合物的药理作用
近几年许多的研究表明,苯乙醇苷类化合物具有抗菌、抗病毒、抗炎、抗肿瘤、抗氧化、免疫调节、增强记忆力、保肝、强心等作用,具有显著的抗菌作用。为了进一步研究苯乙醇苷类化合物,现对其药理作用做一综述。1) 抗菌作用:苯乙醇苷类化合物大多数都具有抗菌的活性。何文君 [20] 等从鹿茸草中提取分离鉴定了4种苯乙醇苷类化合物。首先考察TPG的抑菌作用,确定了TPG的最小抑菌浓度(MIC)和最低杀菌浓度(MBC)。2) 抗炎作用:白蓉等 [21] 采用热板法和扭体法研究独一味中苯乙醇苷类提取物(L-PhGs)的镇痛作用;用角叉菜胶和新鲜鸡蛋清致炎模型来观察了其抗炎的作用。3) 免疫调节作用:赵锦媛 [22] 对铁破锣中已分离鉴定出的单体皂苷类化合物进行了免疫调节作用研究,通过药物经典途径抗补体活性测定表明,Bia-4、Bia-5、Bia-103单体化合物的抗补体活性与阳性药相比效价相当,其IC50值为200~250 μM期间。4) 增强记忆作用:肉苁蓉中的类叶升麻具有改良正常小鼠学习记忆的功能。5) 抗肿瘤作用:聂安政 [23] 发现秦皮中主要含苯乙醇苷类化学成分。并主要研究了其抗肿瘤作用。6) 抗氧化作用:聂韡等 [24] 通过超声提取广东紫珠中连翘酯苷B和金石蚕苷,用HPLC法测定其含量,并研究了其抗氧化活性的相关性,并确定苯乙醇苷类为广东紫珠中主要的抗氧化成分,与自由基清除率和总还原力相关。Ijaz Ahmad [25] 等在Buddleja davidii分离出的n-BuOH-soluble具有抗氧化的作用并进行深层次的研究。7) 保肝作用:马蓉 [26] 研究了螃蟹甲总苯乙醇苷在四氯化碳诱导的肝损伤大鼠体内发挥保肝的作用及其作用机理,并得到螃蟹中螃蟹甲总苯乙醇苷能够显著降低四氯化碳中毒大鼠血清中的ast,alt(p0.01),是其产生保肝作用的主要活性部位。8) 抗辐射作用:闫瑶 [27] 研究了6种苯乙醇苷单体对X射线辐射损伤人皮肤成纤维细胞(Human Skin Fibroblasts, HSF)的体外辐射防护活性,从中筛选出辐射防护作用最强的苯乙醇苷单体并进一步筛选其最佳体外辐射防护剂量。9) 抑制弹性蛋白酶活力作用。10)抗病毒作用:禹玉洪等 [28] 研究表明连翘中苯乙醇苷类和木质素苷类组分对化脓性链球菌、变形链球菌、流行性感冒病毒等多种病毒、细菌有抑制作用。11) 强心作用:宋光西 [29] 等研究了苯乙醇苷具有强心的作用,并得出该类化合物具有很强的药理活性。
通过对苯乙醇苷类化合物深入研究和其药理作用不同功效的挖掘,对于苯乙醇苷类化合物治疗人类的各项疾病有重大的参考意义和解决效果。也对探索这类化合物的药理学特性起到了指导性的作用。
基金项目
吉林省科技厅科技攻关重点项目(NO.20140204052YY)资助项目。
文章引用
薛 刚,马成红,陈玉娟. 苯乙醇苷类化合物的研究进展
Progress of Phenylethanol Glycosides in Plants[J]. 有机化学研究, 2017, 05(02): 114-119. http://dx.doi.org/10.12677/JOCR.2017.52015
参考文献 (References)
- 1. Scarpati, M.L. and Monache, D. (1963) Article title. Annali di Chimica, 53, 356.
- 2. Fu, G., Fang, H. and Wong, Y.H. (2008) Naturally Occurring Phenylethanoid Glycosides Potential Leads for New Therapeutics. Current Medicinal Chemistry, 15, 2592-2613. https://doi.org/10.2174/092986708785908996
- 3. 吴培培, 闫明, 霍仕霞. 苯乙醇苷类化合物的研究进展[J]. 药学导报, 2011, 30(10): 1316-1319.
- 4. 崔言坤, 杨世林, 许琼明, 李笑然, 张苏, 高红伟, 李冀. 鹿茸草中3种苯乙醇苷的分离制备工艺研究[J]. 中草药, 2017, 48(2): 288-293.
- 5. 董贝涛. 肉苁蓉苯乙醇糖苷分离纯化研究[D]: [硕士学位论文]. 北京: 中国科学院, 2015.
- 6. 聂韡, 房海灵, 黄宝祥, 朱培林. 大孔树脂分离纯化广东紫珠中苯乙醇苷的工艺研究[J]. 中草药, 2013, 44(18): 2547-2550.
- 7. 李丽, 刘春明, 刘志强, 吕磊, 刘淑莹. 肉苁蓉中苯乙醇苷类化合物的分离提取及电喷雾质谱研究[J]. 质谱学报, 2006, 27(4): 232-236.
- 8. 刘影, 贺玖明, 孙瑞祥, 刘超, 张瑞萍, 石建功, 再帕尔•阿不力孜, 核磁共振和液相色谱-质谱平行动态谱学方法对连翘活性提取物的同步结构分析[J]. 分析化学, 2011, 39(3): 323-329.
- 9. 盛长忠, 聂立影, 田宝静, 高峰, 姜燕. 荒漠肉苁蓉组织培养与苯乙醇苷类物质的合成[C]//中国药学会. 第三届肉苁蓉暨沙生药用植物学术研讨会论文集, 杭州: 中国药学会, 2005.
- 10. 郭志刚, 于金梅, 刘瑞芝, 巨勇, 肖强. 盐生肉从蓉愈伤组织培养与苯乙醇普类化合物合成的研究[J]. 中草药, 2004, 35(2): 204-207.
- 11. 王金芳. 肉苁蓉不同部位苯乙醇苷类成分的定性定量研究[D]: [硕士学位论文]. 北京: 北京协和医学院, 2014.
- 12. Duynstee, H.I., et al. (2000) Chemlnform Abstract: Synthesis of Verbascoside: A Dihydroxyphenylethyl Glycoside with Diverse Bioactivity. European Journal of Organic Chemistry, 31, 2623-2632.
- 13. 叶新山, 刘颖果, 熊德彩, 蒲小平, 李夏溪. 苯乙醇苷类似物及其合成方法和应用[P]. 中国专利: CN201510101527.8, 2016-10-05.
- 14. 周峰岩. 苯丙素苷类化合物的合成[D]: [博士学位论文]. 杭州: 浙江大学, 2005.
- 15. Mulani, S.K., Guh, J.-H. and Mong, K.-K.T. (2014) A General Synthetic Strategy and the Anti-Proliferation Properties on Prostate Cancer Cell Lines for Natural Phenylethanoid Glycosides. Organic & Biomolecular Chemistry, 12, 2926- 2937. https://doi.org/10.1039/c3ob42503g
- 16. Gao, B.B., She, G.M. and She, D.M. (2013) Chemical Constituents and Biological Activities of Plants from the Genus Ligustrum. Chemistry & Biodiversity, 10, 96-128. https://doi.org/10.1002/cbdv.201100269
- 17. Sena Filho, J.G., Nimmo, S.L., Xavier, H.S., Barbosa-Filho, J.M. and Cichewicz, R.H. (2009) Phenylethanoid and Lignan Glycosides from Polar Extracts of Lantana, a Genus of Verbenaceous Plants Widely Used in Traditional Herbal Therapies. Journal of Natural Products, 72, 1344-1347. https://doi.org/10.1021/np900086y
- 18. Taskva, R., Kokubun, T., Ryan, K., et al. (2010) Phenylethanoid and Iridoid Glycosides in the New Zealand Snow Hebes (Veronica, Plantaginaceae). Chemical and Pharmaceutical Bulletin, 58, 703-711. https://doi.org/10.1248/cpb.58.703
- 19. 郑晓珂, 刘云宝, 李军, 冯卫生. 石胆草中的一个新苯乙醇苷[J]. 药学学报, 2004, 39(9): 716-718.
- 20. 何文君, 刘艳丽, 莫莉, 师梦凡, 潘舒, 等. 鹿茸草中苯乙醇苷类化合物的抗菌抗炎作用[C]//中国药理学会. 全国中药药理学会联合会学术交流大会, 2012.
- 21. 白蓉, 郭延伟. 独一味中苯乙醇苷提取物的镇痛抗炎作用及毒性研究[J]. 华西药学杂志, 2015, 30(3): 384-385.
- 22. 赵锦媛. 铁破锣的化学成分和免疫调节作用初探[D]: [硕士学位论文]. 北京: 中国人民解放军总医院, 2015.
- 23. 聂安政, 林志健, 张冰. 秦皮化学成分和药理作用研究进展[J]. 中草药, 2016, 47(18): 3332-3341.
- 24. 聂韡, 房海灵, 邓绍勇, 朱培林. 不同产地广东紫珠药材苯乙醇苷类成分含量与抗氧化能力的相关性[J]. 江苏农业科学, 2016, 44(3): 273-275.
- 25. Ahmad, I., Ahmad, N. and Wang, F. (2009) Antioxidant Phenylpropanoid Glycosides from Buddleja davidii. Journal of Enzyme Inhibition and Medicinal Chemistry, 24, 993-997. https://doi.org/10.1080/14756360802565072
- 26. 马蓉. 藏药螃蟹甲对四氯化碳诱导大鼠肝损伤保护作用的研究[D]: [硕士学位论文]. 兰州: 兰州大学, 2016.
- 27. 闫瑶. 苯乙醇苷单体抗辐射活性筛选及其机制研究[D]: [硕士学位论文]. 乌鲁木齐: 新疆医科大学, 2013.
- 28. 禹玉洪, 孙彦珂. 连翘(果实或叶)中苯乙醇苷类和木质素苷类组分的应用[P]. 中国专利: CN200710121327.4, 2007-9-4.
- 29. 宋光西, 马玲云, 魏锋, 马双成. 苯乙醇苷的分布及药理活性研究进展[J]. 亚太传统医药, 2011, 7(4): 169-171.