Advances in Psychology
Vol.
09
No.
05
(
2019
), Article ID:
30245
,
11
pages
10.12677/AP.2019.95103
Atypical Functional Connectivity in Autism Spectrum Disorder Children
—A Resting-State EEG Study
Xinran Xu, Shuye Zhang
School of Psychology, South China Normal University, Guangzhou Guangdong

Received: Apr. 23rd, 2019; accepted: May 9th, 2019; published: May 16th, 2019

ABSTRACT
Autism spectrum disorder (ASD) is a neurodevelopmental disorder mainly by difficulties in social interaction and communication. Studies have suggested mixed patterns of intrahemispheric long-range and short-range functional connectivity. Anomalies in EEG coherence and power have been associated with deficits in executive function and mental activity. The current study aimed to access the patterns of spectral EEG power and intrahemispheric long-distance and local coherence in ASD. The present study examined neuronal activation and functional connectivity with EEG, in 21 ASD and 17 typical developing (TD) children ages 6 - 13, during an eyes-closed resting state. Differences in cerebral functioning were examined using measurements of absolute and relative power and intrahemispheric long-range and short-range coherence. Children with ASD demonstrated reduced absolute and relative alpha power and reduced absolute theta power. ASD children also displayed greater relative power in delta and gamma bands compared with the controls, which supports the previous U-shaped pattern of spectral power in ASD. In addition, the patterns of intrahemispheric long-range under connectivity in alpha band and local over connectivity in alpha and gamma bands were revealed in the current study. Thus, the results suggest that children with ASD exhibit atypical patterns of brain activity and functional connectivity compared to TD children.
Keywords:Autism Spectrum Disorder (ASD), Resting-State, EEG, Functional Connectivity, Coherence
自闭症谱系障碍儿童异常的脑功能连接
——来自静息态EEG的证据
徐昕然,张树烨
华南师范大学心理学院,广东 广州
收稿日期:2019


摘 要
自闭症谱系障碍(Autism Spectrum Disorder, ASD)是一种特殊的神经发育障碍,近年来其发病率陡增,但病因成谜。现有的脑功能连接研究发现,ASD患者的半球间的长距离连接普遍降低,但半球内的长距离连接和短距离连接模式仍存在较大争议。因此本研究采用时间分辨率高、预测力较高的脑电技术,探究ASD儿童大脑半球内长距离连接和短距离连接异常模式。本研究采集了21名ASD和17名正常儿童的闭眼静息状态下的脑电数据,结果显示,ASD儿童Alpha频段的绝对功率和相对功率减弱,而Delta和Gamma频段的相对功率增强,总体呈现U型曲线趋势。此外,本研究发现ASD儿童Alpha频段的半球内长距离连接降低,Alpha和Gamma频段的短距离连接增强,呈现出低频段长距离连接增强,高频段短距离连接减弱的模式。该结果揭示ASD儿童存在异常的神经震荡和大脑连接模式,为全面了解ASD群体认知加工底层神经机制提供一定基础。
关键词 :自闭症谱系障碍,静息态,脑电图,功能连接,相干性

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
自闭症谱系障碍(Autism Spectrum Disorder, ASD)是一种神经发育障碍,以社会交往和交流障碍、狭隘兴趣与刻板行为为主要特征(American Psychiatric Association, 2013),这些症状在幼儿三岁之前就会表现出来,往往伴随不同程度的言语交流障碍,比如在语音、语言理解、语言表达等方面存在问题(柯晓燕,2014)。
然而遗憾的是,到目前为止,仍然没有一个统一的理论框架可以清楚地解释ASD的症状表现以及ASD障碍成因。以往研究主要用弱中央一致理论(Weak Central Coherence, WCC)和知觉增强理论(Enhanced Perceptual Functioning, EPF)来解释ASD的症状表现。随着分散性障碍(distributed disorder)观点的提出,部分研究者开始从大脑网络异常等神经生物学机制角度对ASD进行研究。大量研究表明,ASD大脑在功能和结构上面都与正常人不同(Kana et al., 2014; Park & Friston, 2013; Zhu et al., 2014)。除了功能和结构不同之外,ASD大脑功能连接与正常人相比也表现出很大的差异,并且呈现出混乱的模式。
大脑活动的支持对于个体的认知活动而言至关重要。和正常人相比,ASD认知加工过程中神经振荡存在异常。在某些加工过程中,ASD表现出增强的神经振荡活动;在另外一些加工过程中ASD表现出减弱的神经振荡活动,比如,在语义违反的研究中,ASD对存在语义违反和不存在语义违反的口述句子诱发增强的Gamma波(Braeutigam et al., 2008);在一项简单的听觉研究中,ASD对纯音和处理过的噪音均表现出减弱的Gamma波(Wilson et al., 2007)。甚至同一认知加工过程中,不同研究出现增强和减弱两种不同的研究结果。比如,在视觉研究中同时发现了增强和减弱的Gamma波(Brown et al., 2005; Milne et al., 2009; Isler et al., 2010; Stroganova et al., 2012)。在进行某项认知活动时,负责该认知活动的大脑区域激活;同时,大脑负责同一类认知加工的网络内部与不同认知网络之间又进行相互联结。因此,ASD认知方式的异常不仅与局部的脑区活动相关,同时也与大脑网络连接的正常运作也有着十分紧密的关系。
同样,在不需要认知加工的静息状态下,ASD的神经震荡和大脑网络连接与正常人相比也表现出了显著差异。大脑皮层在没有外界刺激或认知任务的状态下,处于自发活动并进行复杂的神经元放电的状态,称为静息态。静息态的脑电信号包含了复杂的生理信息,反映了大脑在静息状态下的信息整合和信息处理过程(孙金秀,2016)。研究ASD静息态的功能连接模式可以排除任务的干扰,有利于发现ASD和正常人群的神经震荡和大脑网络连接的本质区别。另外,对于具有沟通障碍的ASD人群而言,尤其是年龄较小的 ASD 儿童,其认知水平和任务配合程度较低,基于任务态采集脑电非常困难,因此,静息态研究对于探究ASD儿童的脑功能连接模式更具优势。
频谱分析技术可以将脑电信号被分解为不同的频段,对各个频段的功率进行分析,从而了解ASD和正常人在各频段功率上的差异。频谱功率的计算方法可以分为绝对功率和相对功率两种方法:绝对功率反映的是每个频段固有的神经激活程度,难以避免受到个体差异的限制;而相对功率以比值的形式,反映各个频段之间的关系,作为衡量脑电的有效指标,被广泛应用于脑电特征的提取(孙金秀,2016)。通过总结以往研究结果,可以发现ASD在低频段(Delta, Theta)和高频段(Beta, Gamma)的激活增强,而在中频段(Alpha)的激活减弱,总体呈现U型曲线(Wang et al., 2013)。目前对U型曲线是否广泛存在仍然存在争议。
另外,以往的ASD脑功能连接研究结果发现,无论是在静息态下还是任务态下,ASD脑功能连接模式都存在异常。其中,跨半球的远距离连接的结果较为一致,基本都表现出减弱的趋势;而半球内的远距离连接结果则尚未统一。在静息态中的经典网络——默认网络(default mode network, DMN)发现远距离的脑区之间的连接减弱,例如后扣带回与额上回、颞叶之间(Weng et al., 2010)。在认知、执行控制相关任务时,ASD大脑额–顶之间远距离功能连接显著低于正常组(Just, Cherkassky, Keller, Kana, & Minshew, 2007)。而近距离脑功能连接的结果未表现出明显的趋势。Keown (2013)等人使用静息态功能连接和图论(graph theory)的分析方法,发现ASD大脑后侧区域的局部功能连接显著强于正常人群,两侧颞叶-枕叶区域表现尤为明显,这种过度连接的程度和ASD症状的严重程度呈正相关。而Coben (2008)等人研究发现额叶-中部之间局部功能连接在Delta和Alpha频段都呈现减弱趋势。因此,与正常群体相比,静息态下ASD在远距离脑功能连接和近距离脑功能连接方面均存在异常,其中跨半球的长距离连接普遍降低,但半球内的长距离连接和短距离连接模式尚存在争议。
相对于大量使用fMRI技术进行ASD脑功能连接研究而言,EEG技术可以记录到大脑皮层的电生理现象,精准的表现出大脑整体神经系统活动。首先,EEG良好的时间分辨率和利于计算不同神经信号随时间变化的一致性可以弥补fMRI时间分辨率很差的缺陷,将空间变化与时间变化进行有效的整合。其次,EEG脑功能连接研究指标丰富。其中,频段一致性(coherence)指标主要用于推论出在认知功能中不同脑区可能存在的功能连接,而频段耦合主要计算不同频段之间信号同步性。
2. 方法
2.1. 被试
从广州康纳学校(广州儿童ASD康复研究中心)选取23名(男孩18名,女5名)被诊断患有ASD的儿童,平均年龄10.3岁。ASD儿童诊断符合《美国精神障碍诊断与统计手册(第5版)》(DSM-V),无其他神经、精神障碍或疾病。从广州永兴小学选取20名(男孩15名,女孩5名)正常儿童,平均年龄为10.1岁。
共有43名被试参与实验,由于实验设备技术问题以及后期数据质量问题,有5名被试的数据被剔除,最终有38名被试的数据被保留下来。其中,ASD儿童有21名(男孩18名,女孩3名),平均年龄9.98 ± 1.94岁;正常儿童有17名(男孩12名,女孩5名),平均年龄8.94 ± 3.66岁,两组被试年龄不存在显著差异(t = 1.052,p = .304),性别分布也不存在显著差异(p = .426)。
2.2. 数据采集
脑电数据采集统一安排在一间舒适安静且无过大外界噪音干扰的房间内完成。室内摆放一套桌椅,对38个儿童一一进行数据采集实验。首先要求被试安静2到3分钟,以便进入放松状态。采集开始时,要求被试以舒服的方式坐在椅子上,开始10分钟的静息态闭眼EEG数据采集。同时通过实时监控的方式监测实验过程中采集到的脑电信号质量,作为后续数据选用与否的参考。
使用Brainproduct公司生产的ERP记录与分析系统,按国际10-20系统扩展的32导电极帽记录EEG。滤波带通为0.05~100 Hz。信号经DC放大,采样频率为500 Hz/导,电极与头皮之间的电阻小于5 kΩ。采集过程中其他人员保持安静,减少周围环境的干扰。监控摄像以视频的形式同步记录受试儿童的行为状态。
2.3. 数据分析
2.3.1. EEG数据预处理
采用Matlab R2015a软件下的工具箱EEGLAB中完成EEG数据的预处理:1) 手动去除含有明显漂移或伪迹的数据;2) 通过带通滤波去除噪声,保留1 Hz到60 Hz的信号,另外通过陷波滤波器去除50 Hz的信号以消除电力传输产生的噪声;3) 将连续数据分为若干个时长2秒的片段(epoch);4) 以TP10为重新参考点进行重新参考(re-reference);5) 通过独立主成分分析(Independent Component Analysis, ICA)剔除存在明显伪迹的成分。最后筛选出无伪迹的EEG数据。
2.3.2. 频谱分析
通过EEGLAB中的插件Darbeliai进行频谱分析,完成绝对功率、相对功率和功率谱密度的计算。采用快速傅里叶变换(Fast Fourier Transform, FFT)进行频谱分析,汉宁窗(Hanning window) 长度为2 s,将时域的EEG信号转换为频域的相关信息,划分频带,导出各个频带各个通道的绝对功率和相对功率结果。其中,Delta频段定义为1 Hz至4 Hz,Theta频段定义为4 Hz至8 Hz,Alpha频段定义为8 Hz至12 Hz,Beta频段定义为12 Hz至32 Hz,Gamma频段定义为32 Hz至60 Hz。将28个通道划分为六个区域:左侧前额(Fp1, F3, F7),右侧前额(Fp2, F4, F8),左侧中部(T3, C3),右侧中部(T4, C4),左侧后部(P7, P3, O1),右侧顶部(P8, P4, O2) (Dickinson et al., 2018)。
2.3.3. 功能连接分析
通过Fieldtrip计算各电极点之间的频段一致性系数 (coherence)进行ASD儿童的脑连接分析。频段一致性系数通过两个电极点电位的相位一致性来反映两点间皮层电活动的同步性,从而体现功能连接的强度,其值在0和1之间,其中接近于0的值表示在两个电极位置点的皮层电活动之间几乎没有同步,接近1的值表示两个电极位置点基本上同步。为了探究ASD半球内的长距离和短距离功能连接模式,本研究将半球内跨脑区的一致性定义为长距离连接:额–枕连接(F3-O1, F4-O2),额–顶连接(F3-P3, F4-P4),颞–顶连接(T7-P3, T8-P4),颞–中连接(T7-C3, T8-C4);脑区内电极点的一致性定义为短距离连接:额叶内部(F7-F3, F8-F4),顶叶内部(P7-P3, P8-P4),枕叶内部(O1-Oz, O2-Oz),见图1。
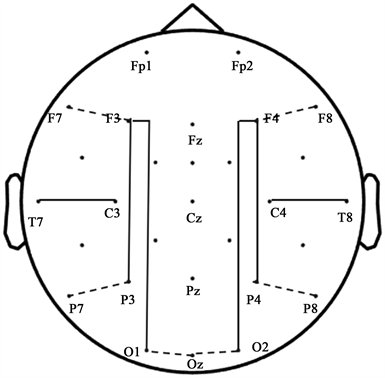
Figure 1. A top view of electrode pairs for long-range and short-range coherence
图1. 长距离连接和短距离连接电极示意图
3. 结果
3.1. 频谱分析结果
3.1.1. 绝对功率结果
以脑区(左侧前额,右侧前额,左侧中部,右侧中部,左侧后部和右侧顶部)和被试类型(ASD组,正常组)为自变量对全频段(1~60 Hz)及五个频段(Delta, Theta, Alpha, Beta, Gamma)的绝对功率分别进行重复测量方差分析。方差分析结果显示,被试类型对全频段绝对功率的主效应显著,F(1, 36) = 4.22, p = .047, = .105,ASD儿童在全频段的绝对功率显著低于正常儿童。进一步分析显示,ASD儿童全频段的绝对功率在左侧中部显著低于正常儿童(p = .040)。
分频段方差分析结果显示:被试类型对Delta频段的绝对功率的主效应不显著;Theta频段绝对功率的被试类型主效应显著,F(1, 36) = 4.82, p = .035, = .185,其中,ASD儿童在右侧前额(p = .045)和右侧顶部(p = .046)的绝对功率显著低于正常儿童。Alpha频段绝对功率的被试类型主效应显著,F(1, 36) = 10.34, p = .003, = .223,ASD被试的Alpha频段绝对功率在六个区域都显著低于正常儿童;而被试类型在Beta和Gamma频段绝对功率上的主效应均不显著。
3.1.2. 相对功率结果
同样以脑区和被试类型为自变量对分别五个频段的相对功率进行重复测量方差分析。结果显示,被试类型在Delta频段相对功率的主效应显著,F(1, 36) = 18.11, p < .001, = .335,事后检验结果显示,ASD儿童Delta频段的相对功率在六个区域均显著低于正常儿童,具体见表3;而ASD被试与正常儿童相比Beta和Theta频段相对功率在六个区域均未出现显著差异。Alpha频段相对功率的被试类型主效应显著,F(1, 36) = 11.66, p = .002, = .245,ASD组在Alpha频段的相对功率在六个区域均显著低于正常儿童,具体见表3。另外,ASD儿童Gamma频段的相对功率在右侧顶部区域显著高于正常儿童(F = 8.097, p = .007),详见表4。以上结果表明ASD儿童EEG相对功率在低频段(Delta)和高频段(Gamma)的激活增强,而在中频段(Alpha)的激活减弱,见图2。

Figure 2. Mean and standard error of posterior relative power in each frequency bandwidth
图2. 各频段后部区域相对功率条形图
3.2. 功能连接分析结果
3.2.1. 跨脑区长距离连接结果
对各频段的半球内跨脑区的长距离连接一致性系数以连接区域(额–枕连接,额–顶连接,颞–顶连接,颞–中连接)和被试类型(ASD组和正常组)为自变量进行重复测量方差分析。结果发现,被试类型对Alpha频段的长距离连接一致性系数的主效应显著,F(1, 36) = 8.76, p = .005, = .196,其中,ASD儿童在Alpha频段的额–枕和额–顶连接显著低于正常儿童(p = .017, p = .001),见图3。除Alpha频段外,被试类型在其他频段的长距离连接的主效应均不显著。对Alpha频段的长距离一致性系数进行独立样本t检验,结果显示,ASD儿童在额–枕(左右两侧),额–顶(左右两侧),颞–顶(左侧)的长距离连接都显著低于正常儿童,符合ASD跨脑区长距离连接减弱的假设。

Figure 3. Mean and standard error of long-rage alpha coherence
图3. Alpha频段各区域长距离连接强度条形图
3.2.2. 脑区内短距离连接结果
同样,对各频段的脑区内的短距离连接一致性系数以连接区域(枕叶内部,额叶内部,顶叶内部)和被试类型为自变量进行重复测量方差分析。结果显示,Alpha频段的短距离连接的被试类型与连接区域的交互作用显著,F(1.75, 63.06) = 6.15, p = .005, = 0.146,进一步分析发现,ASD儿童在Alpha频段的额叶内部连接强度显著高于正常儿童 (p = .003),见图4。另外,被试类型与连接区域的交互作用同样在Gamma频段的短距离一致性系数表现出显著差异,F(1.14, 41.04) = 4.02, p = .047, = .100,其中,ASD组在额叶和顶叶内部的Gamma频段短距离连接强度显著高于正常儿童 (p = .043, p = .024)。除此之外,ASD被试的短距离连接与正常对照组相比在其他频段均未出现显著差异。

Figure 4. Mean and standard error of short-rage alpha coherence
图4. Alpha频段各区域短距离连接强度条形图
对各频段短距离一致性系数进行独立样本t检验,结果发现,Alpha频段ASD儿童在额叶内部(左右两侧)连接显著高于正常儿童(p = .032, p = .049),在顶叶内部(右侧)连接显著低于正常儿童(p = .042);Beta频段ASD儿童在顶叶内部(右侧)连接显著低于正常儿童 (p = .047);Gamma频段ASD儿童在额叶内部(左右两侧)和顶叶内部(左右两侧)连接都显著高于正常儿童 (p = .046, p = .036, p = .018, p = .037),见图5。以上结果表明,ASD儿童在脑区内短距离连接结果存在不一致,低频段(Alpha)短距离连接减弱,高频段(Gamma)短距离连接增强。

Figure 5. Mean and standard error of short-rage gamma coherence
图5. Gamma频段各区域短距离连接强度条形图
4. 讨论
本研究采用静息态EEG的技术手段,采集正常儿童和ASD儿童闭眼状态下的脑电数据进行比较,考察了ASD群体与正常群体相比在各频段的绝对功率和相对功率的差异,并进一步考察了ASD大脑半球内长距离和短距离功能连接的模式。结果显示,ASD儿童全频段的功率谱分布存在明显异常,ASD儿童全频段的绝对功率显著低于正常儿童,尤其在左侧中部区域。对各频段的绝对功率进行分析发现,Alpha频段上ASD儿童全脑的绝对功率均显著降低;而Theta频段上ASD儿童在右侧前部和右侧顶部的绝对功率显著低于正常儿童;对各频段的相对功率进行分析发现,Delta和Alpha频段上ASD儿童和正常儿童的相对功率在全脑均存在显著差异,ASD儿童的相对功率在Delta频段上增强,在Alpha频段降低,另外,Gamma频段上ASD儿童的相对功率在右侧顶部高于正常儿童。这一结果为Wang et al. (2013)综述提出的ASD连接频段功率异常的U型趋势提供了支持。大脑功能连接的结果显示,与正常儿童相比,ASD儿童在Alpha频段上的半球内长距离连接强度显著降低,短距离连接强度显著增强。另外,ASD群体在Gamma频段的短距离连接强度同样呈现出了显著增强的趋势。该结果揭示了ASD大脑半球内低频段长距离连接降低,高频段短距离连接增强的异常模式,支持了ASD长距离连接降低、短距离连接增强的经典模型。
值得注意的是,以绝对功率或相对功率进行分析,Alpha频段上ASD儿童与正常儿童相比均显著降低,且这种差异在全脑普遍存在,前人也有大量的研究证实这一结果(Cantor & Chabot, 2009; Cantor, Thatcher, Hrybyk, & Kaye, 1986; Dawson, Klinger, Panagiotides, Lewy, & Castelloe, 1995)。Alpha频段与注意力,感知处理和语义记忆相关,并且被认为间接地反映了皮层兴奋性水平,如高Alpha功率意味着皮层系统对复杂信息处理的积极准备,所以由此,高Alpha功率也同积极的行为后果相关,包括认知任务,如目标检测和心理操纵(Mathewson et al., 2012)。另外,Alpha频段与自上而下的加工有关(Klimesch, Sauseng, & Hanslmayr, 2007)。根据弱中央一致理论,ASD群体在认知活动中对复杂信息的整合能力较弱,表现为注意局部、忽略整体,无法提取整体的形式和含义,但在局部和细节加工方面具有特殊的优势。例如,在阅读中过分关注细节,忽略情境主题(李松泽等,2017)。这部分体现了ASD群体自下而上的加工存在优势,而自上而下加工存在缺陷,与本研究结果相一致。
本研究的目的之一在于验证Wang (2013)等人综述中提出的频段功率U型曲线模型,研究结果显示相对功率和绝对功率出现了不一致的结论:ASD儿童的绝对功率在各频段上的趋势并不符合U型曲线;而ASD儿童的相对功率在低频Delta和高频Gamma都高于正常儿童,中频Alpha频段低于正常儿童,支持了U型曲线模型。出现这种现象可能是因为绝对功率反映的是每个频段固有的神经激活度,所以难免受到个体差异的限制,总结前人的研究可以发现,针对ASD群体的研究呈现出的绝对功率结果之间存在较大差异。以Delta频段为例,ASD群体在额叶区的绝对功率既有显著降低结果(Coben, Clarke, Hudspeth, & Barry, 2008; Daoust et al., 2004),也存在显著增强的结果(Pop-Jordanova et al., 2010; Stroganova et al., 2007)。
大脑功能连接结果显示,与正常儿童相比,ASD儿童Alpha频段的半球内长距离连接降低;Alpha和Gamma频段的短距离连接增强。支持了O’Reilly等(2017)在综述中提出的观点,即ASD 群体的长距离低频段连接存在不足,而短距离高频段连接呈现过度趋势。O’Reilly等人认为ASD群体的大脑网络连接不应单从距离进行分析,应同时结合频段进行综合分析。长距离连接一般看作和自上而下的加工有关,一般涉及的主要是高频段较慢的信号传输(Delta, Theta, Gamma),而短距离连接一般被认为与自下而上的加工过程有关,从能量传输的经济角度考虑,一般涉及的是低频段较快的信号传输(Beta, Gamma),(Uhlhaas & Singer, 2010; Von Stein, Chiang, & König, 2000)正如上文提到的,ASD群体的自下而上的加工存在优势,而自上而下加工存在缺陷,该特点和本研究中ASD儿童Alpha频段长距离连接不足,短距离连接在Alpha、Gamma频段较正常儿童增强的结果相一致,支持了弱中央一致理论。
本研究对长距离和短距离的定义主要参考Elhabashy (2018)等的研究,将半球内跨脑区的一致性定义为长距离连接,脑区内部的一致性定义为短距离连接。长距离功能连接结果显示,ASD群体在Alpha频段的额–枕连接和额–顶连接显著降低,颞–顶连接和颞–中连接无显著差异。值得注意的是,额–枕和额–顶之间的距离明显长于颞–顶和颞–中之间的距离,而距离较长的两个连接区域出现了显著差异,距离较短的两个连接区域则未呈现显著差异。因此,前人研究中针对长距离连接出现的不一致结果或许与长距离的操作性定义有关。另外,也有研究将连接按长度分为长距离,中距离和短距离三类。长距离定义为额叶至后顶叶,额叶至枕叶,或左右颞叶的连接;短距离定义为10~20个小系统内邻近的电极点连接;其他定义为中距离连接,最终也呈现了不一致的结果(Schwartz, Kessler, Gaughan, & Buckley, 2016)。因此对功能连接距离的操作定义还需要进一步的统一,以获得ASD群体较为一致的脑功能连接模式。
除此之外,本研究还存在一定的局限性。与前人对ASD群体静息态脑电的研究一样,本研究的被试量较少,对于ASD儿童和正常儿童性别、智商等变量的平衡程度有待提高。另外本研究中被试儿童的年龄从6岁至12岁,年龄跨度较大。有研究指出,随着年龄的增长和发育的成熟,高危ASD和正常儿童不同频段的功率强度会发生变化,呈现出不同的趋势(Tierney, Gabard-Durnam, Vogel-Farley, Tager-Flusberg, & Nelson, 2012)。未来的研究方向可以考虑,对ASD儿童和正常儿童进行长期的追踪研究,了解ASD群体异常神经震荡和网络连接的发展轨迹,以达到全面了解ASD群体认知加工底层神经机制,促进ASD认知发展的目的。
5. 结论
本研究发现ASD儿童神经震荡相对功率较正常儿童在低频段(delta)和高频段(gamma)的激活增强,而在中频段(alpha)的激活减弱,总体呈现的U型曲线趋势。另外,本研究还发现ASD儿童大脑网络呈现出低频段长距离连接增强,高频段短距离连接减弱的模式。该结果揭示ASD儿童存在异常的神经震荡和大脑连接模式,为全面了解ASD群体认知加工底层神经机制提供一定基础。
基金项目
本研究由2018年“攀登计划”广东省大学生科技创新培育专项资金(pdjhb0143)项目资助。
文章引用
徐昕然,张树烨. 自闭症谱系障碍儿童异常的脑功能连接——来自静息态EEG的证据
Atypical Functional Connectivity in Autism Spectrum Disorder Children—A Resting-State EEG Study[J]. 心理学进展, 2019, 09(05): 840-850. https://doi.org/10.12677/AP.2019.95103
参考文献
- 1. 柯晓燕(2014). 孤独症谱系障碍临床解析. 中国实用儿科杂志, (7), 481-484.
- 2. 孙金秀(2016). 基于静息态脑电的孤独症谱系障碍儿童脑网络研究. 硕士学位论文, 天津: 天津医科大学.
- 3. Braeutigam, S., Swithenby, S. J., & Bailey, A. J. (2008). Contextual Integration the Unusual Way: A Magnetoencephalographic Study of Responses to Semantic Violation in Individuals with Autism Spectrum Disorders. European Journal of Neuroscience, 27, 1026-1036. https://doi.org/10.1111/j.1460-9568.2008.06064.x
- 4. Brown, C., Gruber, T., Boucher, J., Rippon, G., & Brock, J. (2005). Gamma Abnormalities during Perception of Illusory Figures in Autism. Cortex, 41, 364-376. https://doi.org/10.1016/S0010-9452(08)70273-9
- 5. Cantor, D. S., & Chabot, R. (2009). Qeeg Studies in the Assessment and Treatment of Childhood Disorders. Clinical EEG and Neuroscience, 40, 113-121. https://doi.org/10.1177/155005940904000209
- 6. Cantor, D. S., Thatcher, R. W., Hrybyk, M., & Kaye, H. (1986). Computerized EEG Analyses of Autistic Children. Journal of Autism and Developmental Disorders, 16, 169-187. https://doi.org/10.1007/BF01531728
- 7. Coben, R., Clarke, A. R., Hudspeth, W., & Barry, R. J. (2008). EEG Power and Coherence in Autistic Spectrum Disorder. Clinical Neurophysiology, 119, 1002-1009. https://doi.org/10.1016/j.clinph.2008.01.013
- 8. Daoust, A. M., Limoges, E., Bolduc, C., Mottron, L., & Godbout, R. (2004). EEG Spectral Analysis of Wakefulness and REM Sleep in High Functioning Autistic Spectrum Disorders. Clinical Neurophysiology, 115, 1368-1373. https://doi.org/10.1016/j.clinph.2004.01.011
- 9. Dawson, G., Klinger, L. G., Panagiotides, H., Lewy, A., & Castelloe, P. (1995). Subgroups of Autistic Children Based on Social Behavior Display Distinct Patterns of Brain Activity. Journal of Abnormal Child Psychology, 23, 569-583. https://doi.org/10.1007/BF01447662
- 10. Dickinson, A., DiStefano, C., Lin, Y. Y., Scheffler, A. W., Senturk, D., & Jeste, S. S. (2018). Interhemispheric Alpha-Band Hypoconnectivity in Children with Autism Spectrum Disorder. Behavioural Brain Research, 348, 227-234. https://doi.org/10.1016/j.bbr.2018.04.026
- 11. Isler, J. R., Martien, K. M., Grieve, P. G., Stark, R. I., & Herbert, M. R. (2010). Reduced Functional Connectivity in Visual Evoked Potentials in Children with Autism Spectrum Disorder. Clinical Neurophysiology, 121, 2035-2043. https://doi.org/10.1016/j.clinph.2010.05.004
- 12. Just, M. A., Cherkassky, V. L., Keller, T. A., & Minshew, N. J. (2007). Functional and Anatomical Cortical Underconnectivity in Autism: Evidence from an FMRI Study of an Executive Function Task and Corpus Callosum Morphometry. Cerebral Cortex, 17, 951-961. https://doi.org/10.1093/cercor/bhl006
- 13. Kana, R. K., Uddin, L. Q., Kenet, T., Chugani, D., & Mãller, R.-A. (2014). Brain Connectivity in Autism. Frontiers in Human Neuroscience, 8, 349. https://doi.org/10.3389/fnhum.2014.00349
- 14. Keown, C. L., Shih, P., Nair, A., Peterson, N., Mulvey, M. E., & Müller, R. A. (2013). Local Functional Overconnectivity in Posterior Brain Regions Is Associated with Symptom Severity in Autism Spectrum Disorders. Cell Reports, 5, 567-572. https://doi.org/10.1016/j.celrep.2013.10.003
- 15. Klimesch, W., Sauseng, P., & Hanslmayr, S. (2007). EEG Alpha Oscillations: The Inhibition-Timing Hypothesis. Brain Research Reviews, 53, 63-88. https://doi.org/10.1016/j.brainresrev.2006.06.003
- 16. Mathewson, K. E., Prudhomme, C., Fabiani, M., Beck, D. M., Lleras, A., & Gratton, G. (2012). Making Waves in the Stream of Consciousness: Entraining Oscillations in EEG Alpha and Fluctuations in Visual Awareness with Rhythmic Visual Stimulation. Journal of Cognitive Neuroscience, 24, 2321-2333. https://doi.org/10.1162/jocn_a_00288
- 17. Milne, E., Scope, A., Pascalis, O., Buckley, D., & Makeig, S. (2009). Independent Component Analysis Reveals Atypical Electroencephalographic Activity during Visual Perception in Individuals with Autism. Biological Psychiatry, 65, 22-30. https://doi.org/10.1016/j.biopsych.2008.07.017
- 18. O’Reilly, C., Lewis, J. D., & Elsabbagh, M. (2017). Is Func-tional Brain Connectivity Atypical in Autism? A Systematic Review of EEG and MEG Studies. PLoS ONE, 12, e0175870. https://doi.org/10.1371/journal.pone.0175870
- 19. Park, H.-J., & Friston, K. (2013). Structural and Functional Brain Networks: From Connections to Cognition. Science, 342, 1238411. https://doi.org/10.1126/science.1238411
- 20. Pop-Jordanova, N., Zorcec, T., Demerdzieva, A., & Gucev, Z. (2010). QEEG Characteristics and Spectrum Weighted Frequency for Children Diagnosed as Autistic Spectrum Disorder. Nonlinear Biomedical Physics, 4, 1-7. https://doi.org/10.1186/1753-4631-4-4
- 21. Schwartz, S., Kessler, R., Gaughan, T., & Buckley, A. W. (2016). Electroencephalogram Coherence Patterns in Autism: An Updated Review. Pediatric Neurology, 67, 7-22. https://doi.org/10.1016/j.pediatrneurol.2016.10.018
- 22. Stroganova, T. A., Nygren, G., Tsetlin, M. M., Posikera, I. N., Gillberg, C., Elam, M. et al. (2007). Abnormal EEG Lateralization in Boys with Autism. Clinical Neurophysiology Official Journal of the International Federation of Clinical Neurophysiology, 118, 1842. https://doi.org/10.1016/j.clinph.2007.05.005
- 23. Stroganova, T. A., Orekhova, E. V., Prokofyev, A. O., Tsetlin, M. M., Gratchev, V. V., Morozov, A. A., & Obukhov, Y. V. (2012). High-Frequency Oscillatory Response to Illusory Contour in Typically Developing Boys and Boys with Autism Spectrum Disorders. Cortex, 48, 701-717. https://doi.org/10.1016/j.cortex.2011.02.016
- 24. Tierney, A. L., Gabarddurnam, L., Vogelfarley, V., Tagerflusberg, H., & Nelson, C. A. (2012). Developmental Trajectories of Resting EEG Power: An Endophenotype of Autism Spectrum Disorder. PLoS ONE, 7, e39127. https://doi.org/10.1371/journal.pone.0039127
- 25. Uhlhaas, P. J., & Singer, W. (2010). Abnormal Neural Oscillations and Synchrony in Schizophrenia. Nature Reviews Neuroscience, 11, 100. https://doi.org/10.1038/nrn2774
- 26. Von Stein, A., Chiang, C., & König, P. (2000). Top-Down Processing Me-diated by Interareal Synchronization. Proceedings of the National Academy of Sciences, 97, 14748-14753. https://doi.org/10.1073/pnas.97.26.14748
- 27. Wang, J., Barstein, J., Ethridge, L. E., Mosconi, M. W., Takarae, Y., & Sweeney, J. A. (2013). Resting State EEG Abnormalities in Autism Spectrum Disorders. Journal of Neurodevelopmental Disorders, 5, 24. https://doi.org/10.1186/1866-1955-5-24
- 28. Weng, S. J., Wiggins, J. L., Peltier, S. J., Carrasco, M., Risi, S., Lord, C., & Monk, C .S. (2010). Alterations of Resting State Functional Connectivity in the Default Network in Adolescents with Autism Spectrum Disorders. Brain Research, 1313, 202-214. https://doi.org/10.1016/j.brainres.2009.11.057
- 29. Wilson, T. W., Rojas, D. C., Reite, M. L., Teale, P. D., & Rogers, S. J. (2007). Children and Adolescents with Autism Exhibit Reduced MEG Steady-State Gamma Responses. Biological Psychiatry, 62, 192-197. https://doi.org/10.1016/j.biopsych.2006.07.002
- 30. Zhu, H., Fan, Y., Guo, H., Huang, D., & He, S. (2014). Reduced Interhemispheric Functional Connectivity of Children with Autism Spectrum Disorder: Evidence from Functional near Infrared Spectroscopy Studies. Biomedical Optics Express, 5, 1262-1274. https://doi.org/10.1364/BOE.5.001262