Material Sciences
Vol.4 No.05(2014), Article
ID:14158,6
pages
DOI:10.12677/MS.2014.45031
Preparation of Nanoparticles of Metallic Nickel with Different Morphology
1Beijing Key Lab of Green Recycling and Extraction of Metals, Beijing
2School of Metallurgical and Ecological Engineering, University of Science and Technology Beijing, Beijing
Email: d_fishier@163.com, *shaoboshen@metall.ustb.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Jul. 20th, 2014; revised: Aug. 18th, 2014; accepted: Aug. 29th, 2014
ABSTRACT
Some anhydrous eutectics composed of nickel chloride and sodium chloride were obtained by chlorinating the mixtures of sodium chloride and row nickel (average particle size 24.6 μm) with different molar ratios at 700°C. The eutectics were smelt and vaporized at 900°C and the vaporized eutectics were reduced by H2 into nickel powders of high purity with different shapes and different particle sizes. When the molar ratio of NaCl/Ni was 4.0, some spherical nanoparticles of nickel with average particle size 97.42 nm were synthesized. When the molar ratio of NaCl/Ni was 2.0, some cubic superfine particles of nickel with average particle size 101.92 nm were synthesized. Without addition of NaCl, some sintered nickel particles of irregular shape were synthesized. The plausible reasons were given to explain above phenomena.
Keywords:Nanoparticle of Ni, Spherical, Cubic, Eutectic of NiCl2-xNaCl, Gas Phase Synthesis

不同形貌纳米镍粉的制备
刘龙辉1,2,沈少波1,2*,赵天骄1,2,成 瑶1,2,陈小雨1,2
1稀贵金属绿色回收与提取北京市重点实验室,北京
2北京科技大学,冶金与生态工程学院,北京
Email: d_fishier@163.com, *shaoboshen@metall.ustb.edu.cn
收稿日期:2014年7月20日;修回日期:2014年8月18日;录用日期:2014年8月29日

摘 要
以粗镍粉(平均粒径为24.6 μm)和氯化钠为原料,将两者按不同的摩尔比混合,700℃下氯化得到氯化镍与氯化钠的低共熔混合物。在900℃加热使低共熔物熔化挥发,氢气还原挥发物即得到不同形貌和粒径的高纯镍粉。当NaCl/Ni摩尔比为4.0,制备出了平均粒径为97.42 nm的球形钠米镍粉;当NaCl/Ni摩尔比为2.0,制备出了平均粒径为101.92 nm的立方体形超细镍粉;没有氯化钠添加,制备出的镍粉颗粒是烧结在一起的,并且没有规则形状。导致以上现象的可能原因被探讨了。
关键词
纳米镍粉,球形,立方体形,NiCl2-xNaCl低共熔物,气相合成

1. 引言
镍是一种硬而具有延展性并且耐腐蚀的铁磁性金属材料。纳米镍粉不但具备普通金属镍材料的优良特性,而且还因表面效应、体积效应、量子效应等具备了许多优异的电学、磁学、热学、力学性能,广泛应用于电极材料、导电浆料、电池材料、吸波材料、高效催化剂、高密度磁记录材料、活化烧结添加剂、火箭燃料助燃剂、润滑油添加剂、硬质合金、陶瓷增韧等领域[1] -[3] 。纳米镍粉用途涉及军工、微电子工业、石油、化工等许多重要行业,因此,纳米镍粉的制备生产及应用技术受到各个国家的重视。纳米镍粉制备方法众多,主要有机械粉碎法、真空蒸馏冷凝法、羰基镍粉热分解法、化学气相还原法、电爆炸丝法、浆化氢还原法、微乳液法、溶胶–凝胶法、电解法、喷雾–热解法和液相还原法等[4] 。其中液相还原法研究得最多,液相还原法可以制备纳米级的镍粉,且形貌粒度可控,成本低,但是制备出的镍粉容易被氧化,制备高纯度的镍粉比较难。羰基镍分解法工艺先进,成本低,质量稳定,但是羰基镍是剧毒物质,污染环境。并且这项技术已经被欧美国家取得专利并实现工业化生产。化学气相反应法是直接利用气态反应物或者借助其他手段,使一种或多种反应物变成气态,在气相中发生化学反应析出超细粉体的合成方法。其中气相氢还原法就是高温下氯化镍蒸汽被氢气还原为金属镍原子,通过形核、长大,形成超细镍粉晶体。这种方法制备出的超细镍粉纯度高,结晶性好[5] 。在严格控制工艺条件的情况下可以制备出高分散、形貌一致、粒度分布窄的超细镍粉。化学气相还原法是制备多层陶瓷电容器(MLCC)内电极用超细镍粉的常用方法,这种方法已在日本实现产业化,主要生产公司有日本川铁公司(Kawatetsu)和东邦钛公司(Toho)[6] 。东邦钛公司拥有一项生产球形超细镍粉的美国专利[7] ,即在1200 K左右汽化NiCl2固体,然后用H2逆流还原NiCl2蒸汽,制得粒径为0.1~1.0 μm的球形超细镍粉。这项专利中指出,只有粒径在0.1~1.0 μm的球形超细镍粉才最适合制备MLCC内电极。如果球形镍粉颗粒小于100 nm,在烧结时,镍粉容易收缩产生间隙并与电介质分离,从而降低了电极的电导率。如果镍粉颗粒大于1 μm,就很难制备薄电极层,降低MLCC内电极的层数。这项专利中通过在反应过程中添加硫单质或硫化物或两者,控制镍粉硫质量分数为0.02% wt~1% wt,诱导形成球形超细镍粉。本文通过自主研发的中国专利方法[8] ,制备出了与美国专利[7] 类似的球形超细镍粉,但合成的镍粉没有硫,纯度较高。本文通过在氯化镍中添加氯化钠,控制氯化镍的挥发速率,从而控制镍粉形核长大速率。气氛中的NaCl蒸气还充当表面活性剂的作用,抑制了镍粉颗粒之间的团聚烧结[5] ,从而能够制备出高分散、形貌规则统一的镍粉颗粒,而且不降低镍粉的纯度。这项技术将有助于我国摆脱国外技术垄断现状,独立自主研发生产MLCC,缩短与国外水平的差距,促进我国微电子工业的快速发展。本研究制备出的立方体形超细镍粉的特殊性质还有待研究,相信具有巨大的潜在运用价值。
2. 实验
2.1. 实验材料
高纯氯气(纯度 > 99.99%),高纯氩气(纯度 > 99.99%),高纯氢气(纯度 > 99.99%),氯化钠(分析纯)。粗镍粉化学成分如表1所示,其粒度由激光粒度仪(LMS-30, Japan)测出其平均粒度为23.4 μm。
2.2. 实验设备
实验设备主要有可开启式管式电阻加热炉,台式干燥箱,循环式多用真空泵,电子天平,质量流量控制器。气相合成镍粉实验装置如图1所示。
2.3. 球形超细镍粉的制备
按照物质摩尔比n(Ni):n(NaCl) = 1:4称取镍粉和预先灼烧干燥(500℃, 3 h)的NaCl,研磨混匀后平铺于石英管中。将石英舟置于石英管2中,按图1连接好气路,通氩气检查装置气密性,确保不漏气后。将系统接到真空泵上抽真空,排除体系中的残留空气,防止升温过程中镍粉被氧化。抽真空完成后,将气路2氩气流量设为100 ml/min。然后将炉温升至700℃。然后气路3通氯气,流量为100 ml/min,此时气路2的氩气流量维持在100 ml/min。2小时后氯化结束,气路3停止通氯气并切换成氩气,流量设为200 ml/min,气路2氩气流量改为400 ml/min,驱赶管道中残余的氯气15 min。然后关闭气路3,气路2的氩气流量改为100 ml/min。气路2氩气流量维持在100 ml/min的条件下,将炉温升至900℃。然后气路1通氢气20 min,流量为60 ml/min,让体系中氢气浓度富集起来。然后将气路2、气路3氩气流量分别设为400 ml/min、200 ml/min。还原2 h后停止通氢气,停止加热,气路1和3关闭,气路2的氩气流量改为100 ml/min,在此条件下,冷却至室温。待加炉温冷却至室温后拆开反应器,确保体系打开时镍粉不被空气氧化。将粘在石英管3上的镍粉用无水乙醇冲洗下来,再反复洗涤几次,然后用丙酮分散,
表1. 粗镍粉化学成分

Figure 1. Schematic diagram of the reactor used to synthesize Ni powder in gas phase
图1. 气相合成镍粉实验装置示意图
超声振荡几分钟,密封保存在玻璃瓶里。
2.4. 立方体形超细镍粉的制备
在与制备球形超细铜粉相同的反应条件下,改变Ni与NaCl的物质的摩尔比为n(Ni):n(NaCl) = 2,气路2、3氩气流量分别为350 ml/min、200 ml/min,氢气流量为60 ml/min,H2还原温度为900℃,还原时即可制备出形貌规则的立方形超细镍粉。
2.5. 粉末的表征
采用ZEISS Ultra 55扫描电镜做形貌检测。制样之前,将镍粉-丙酮分散液超声振荡。将碳导电胶贴在导电性良好的紫铜样品台上,把已超声振荡的镍粉-丙酮分散液滴在碳导电胶上制成样品,然后观察形貌。采用日本理学公司TTRIII多功能衍射仪做XRD分析,波长为CuKα (λ = 0.15405 nm)。用Nano Measurer 1.2测量粒径,用original作粒径分布图。
3. 结果
当原料中Ni与NaCl物质的摩尔比n(Ni):n(NaCl) = 1:4,H2还原温度为900℃时,由SEM照片可知,制备出的镍粉均为规则球形或椭球形(图2(a)、图2(b)),对多张镍粉SEM照片用软件统计,可得粒径分布图(图3(a)),并计算出镍粉平均粒径为97.4 nm,因此为球形纳米镍粉。图2(c)为球形纳米镍粉的EDS能谱,从中可以看出除了镍,没有其它杂质元素。图2(d)为球形纳米镍粉的XRD谱,除了Ni,没有NiO等其它杂质衍射峰。这些说明制备出来的镍粉纯度高。
 (a)
(a) (b)
(b) (c)
(c) (d)
(d)
Figure 2. (a), (b) SEM, (c) EDS, (d) XRD of spherical nanoparticles of nickel (Molar ratio of n(Ni):n(NaCl) = 1:4 in the precursor; H2 reduction temperature 900˚C)
图2. 球形纳米镍粉(a)、(b)SEM图,(c)EDS图,(d)XRD图(原料中Ni与NaCl物质的摩尔比n(Ni):n(NaCl) = 1:4; H2还原温度为900℃)
当原料中Ni与NaCl物质的摩尔比n(Ni):n(NaCl) = 1:2,H2还原温度为900℃时,由SEM可知,制备出的镍粉均为规则立方体形(图4(a)、图4(b)),对多张镍粉SEM照片用软件统计,可得粒径分布图(图3(b)),并计算出镍粉平均粒径为101.92 nm。图4(c)为立方体形纳米镍粉的EDS能谱,从中可以看出除了镍,
 (a)
(a) (b)
(b)
Figure 3. The statistical chart of particle size distribution of (a) spherical nanoparticles of nickel, (b) cubic nanoparticles of nickel
图3. 粒径分布统计图(a)球形纳米镍粉,(b)立方体形纳米镍粉
 (a)
(a) (b)
(b)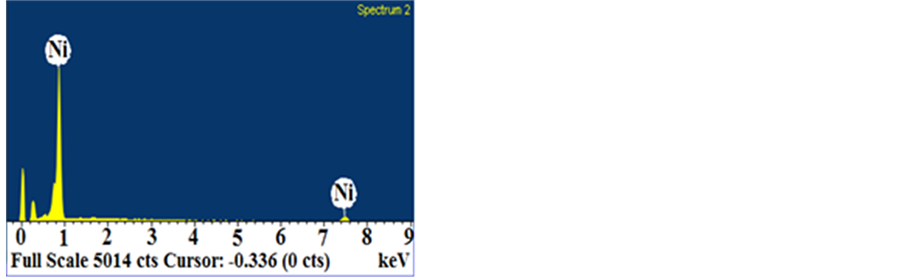 (c)
(c)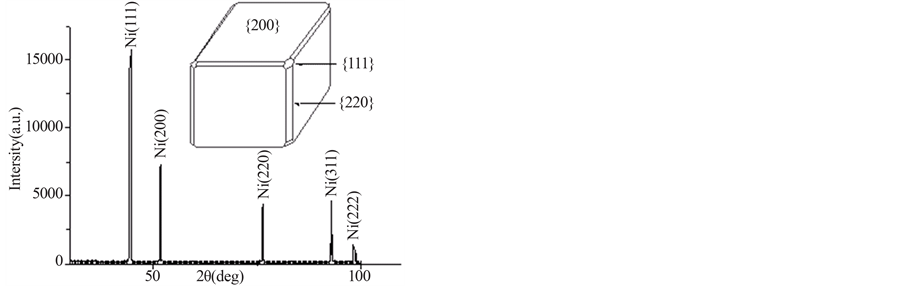 (d)
(d)
Figure 4. (a), (b) SEM, (c) EDS, (d) XRD of cubic nanoparticles of nickel (Molar ratio of n(Ni):n(NaCl) = 1:2 in the precursor; H2 reduction temperature 900˚C)
图4. 立方体形纳米镍粉(a)、(b)SEM图,(c)EDS图,(d)XRD图(原料中Ni与NaCl物质的摩尔比n(Ni): n(NaCl) = 1:2,H2还原温度为900℃)
没有其它杂质元素。图4(d)为立方体形超细镍粉的XRD谱,除了Ni,没有其它杂质衍射峰。
当原料中只有Ni,没有NaCl,H2还原温度为900℃时,制备出的镍颗粒烧结在一起,形成无规则的形状(图5(a)、图5(b))。
4. 讨论
采用先氯化粗镍粉,后H2还原的方式,能够有效除去粗镍粉中的一些杂质元素。因为那些比氯化镍–氯化钠低共熔物易挥发的氯化物(如三氯化铁)在700℃氯化过程中就已挥发离开氯化镍–氯化钠低共熔物所在基体。氯化镍–氯化钠低共熔物在900℃氢气还原时才挥发得比较快,这样就提高了氯化镍的纯度,从而能还原得到高纯的超细镍粉。原料中加入氯化钠可以促进镍粉的氯化,提高镍粉的氯化率。其次氯化钠和氯化镍可能会形成一种复杂的低共熔氯化络合物[5] ,这种络合物的挥发性显著低于氯化镍的挥发速率,从而减慢了氯化镍的挥发速率,氯化镍还原速率也减慢,镍晶体的形核速率、长大速率都减慢,从而能够形成形状比较规则的分散的纳米晶体。而且镍粉与氯化钠摩尔配比不同,氯化镍的挥发速率也不同。氯化钠比例越高,氯化镍挥发速率越慢,制备的镍粉颗粒就越小。颗粒越小,表面张力就会越大,在大的附加压力(△P = 2σ/r)作用下,镍粉颗粒就趋于形成球形形状,以降低表面能。在无氯化钠添加剂的对比实验中,得到的镍粉大部分都烧结成团块状(图5(a)、图5(b)),究其原因,可能是900℃挥发到气相的氯化钠会像表面活性剂一样覆盖在新生成的气相纳米镍晶体表面,降低了纳米镍晶体表面能,从而避免了颗粒烧结[5] ;而没有气相的氯化钠存在时,新生成的气相纳米镍晶体,就会烧结在一起,以降低其表面能。
5. 结论
1) 以平均粒径为23.4 μm的粗商业镍粉和氯化钠按摩尔比1:4的混合物为原料,700℃氯气氯化2 h,900℃氢气还原2 h,制备出了平均粒径为97.42 nm,分散的,表面光滑球形高纯纳米镍粉。
2) 以平均粒径为23.4 μm的粗商业镍粉和氯化钠按摩尔比1:2的混合物为原料,700℃氯气氯化2 h,900℃氢气还原2 h,制备出了平均粒径为101.92 nm,形貌规则的立方体形纳米镍粉。
3) 仅以平均粒径为23.4 μm的粗商业镍粉为原料,700℃氯气氯化2 h,900℃氢气还原2 h,制备出了烧结在一起的,无规则形状的镍粉。
致 谢
感谢北京科技大学本科生科技创新基金(项目号13020107)和北京市教委“废弃印刷电路板中回收金


Figure 5. (a), (b) SEM of nickel powder synthesized in the absence of NaCl (Only Ni without NaCl in the precursor; H2 reduction temperature 900˚C)
图5. 无氯化钠添加时制备出的镍粉(a)、(b)SEM图(原料中仅有粗Ni粉,无NaCl,H2还原温度为900℃)
和银等贵金属的应用研究”项目对此研究工作的资助。
参考文献 (References)
- [1] 张有新, 赵中伟, 陈爱良, 霍广生 (2008) 纳米镍粉的研究进展. 湿法冶金, 27, 131-137.
- [2] 牛明勤, 吴介达 (2003) 超细镍粉的制备进展. 精细化工, 20, 715-717.
- [3] 张磊, 葛洪良, 钟敏 (2008) 金属镍纳米材料研究进展. 材料导报, 22, 2-4.
- [4] 李启厚, 张程, 王红军, 刘志宏, 刘智勇 (2009) 超细镍粉的制备、应用现状及发展趋势. 湿法冶金, 28, 193-197.
- [5] Gao, W., Shen, S. and Cheng, Y. (2013) Synthesis of dispersed superfine fcc nickel single crystals in gas phase. The Journal of Physical Chemistry C, 117, 9223-9228.
- [6] 郭顺, 王东新, 李军义 (2012) MLCC用超细镍粉的制备方法及发展趋势. 材料导报, 26, 212-215.
- [7] Katayama, H., Salto, K., Ogasawara, S. and Hamada, T. (2003) Ultrafine nickel powder. US Patent US6596052.

NOTES
*通讯作者。
