Material Sciences
Vol.
09
No.
02
(
2019
), Article ID:
28917
,
7
pages
10.12677/MS.2019.92022
A Biosensor for Hydrogen Peroxide Based on Myoglobin Immobilized on Calcium Alginate Microspheres
Na Hu1, Hong Sun2*
1College of Chemistry and Chemical Engineering, Qingdao University, Qingdao Shandong
2College of Materials Science and Engineering, Qingdao University, Qingdao Shandong

Received: Jan. 31st, 2019; accepted: Feb. 13th, 2019; published: Feb. 20th, 2019

ABSTRACT
In this research, by using sodium alginate, calcium chloride, polyethylene glycol and polyvinyl alcohol, a novel calcium alginate (CA) microsphere was prepared and used to construct a hydrogen peroxide (H2O2) biosensor by assembly with myoglobin (Mb) on the electrode surface. The electrochemical property of biosensor was investigated by cyclic voltammetry and chronoamperometry. In phosphate buffer solution (pH = 7) Mb-CA film modified electrode showed a pair of well-defined and nearly reversible cyclic voltammetry peaks at around −0.358 V versus saturated calomel electrode (SCE). Moreover, the biosensors could still maintain their good activity and the sensitivity after 30 days. The results confirmed that the biosensors exhibit electrocatalytic behavior to H2O2. The biosensor with a linear range of from 6.25 μM to 50 μM (R2 = 0.996) and a detection limit of 1.25 μM (S/N = 3) showed good stability, reproducibility, and selectivity. The resulting biosensors are suitable for the precise determination of environmental pollutants in actual environment.
Keywords:Calcium Alginate, Microspheres, Myoglobin, Electrochemistry, Electrocatalysis
基于肌红蛋白/海藻酸钙微球修饰的过氧化氢生物传感器
胡娜1,孙红2*
1青岛大学化学化工学院,山东 青岛
2青岛大学材料科学与工程学院,山东 青岛

收稿日期:2019年1月31日;录用日期:2019年2月13日;发布日期:2019年2月20日

摘 要
在该研究中,通过使用海藻酸钠,氯化钙,聚乙二醇和聚乙烯醇,制备了新型的海藻酸钙微球(CA MS),并通过在电极表面上与肌红蛋白(Mb)组装构建了Mb/CA微球过氧化氢(H2O2)生物传感器。用循环伏安法和计时电流法检测了该生物传感器的电化学性能。在磷酸盐缓冲溶液(pH = 7)中,Mb/CA微球膜修饰电极在约−0.358 (vs饱和甘汞电极(SCE))显示出一对明显且对称性良好的氧化还原峰。此外,该生物传感器在30天后仍可保持良好的活性和灵敏度。实验结果表明,该生物传感器对H2O2的还原表现出了良好的电催化性能,在信噪比(S/N)等于3的情况下该生物传感器的线性扫描范围为6.25 μM到50 μM,线性相关系数R2 = 0.996,检测限为1.25 μM,并具有良好的稳定性、重现性、选择性等优点。因此,该构建的生物传感器可以用于实际环境中污染物的精确测定。
关键词 :海藻酸钙,微球,肌红蛋白,电化学,电催化

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
氧化还原蛋白质在电极上的直接电化学行为在生物电化学领域备受关注 [1] [2] ,可为研究电活性中心在生物分子,生物系统以及生物催化过程中的直接电子转移机制提供模型,从而有利于构建生物反应器和生物传感器 [3] [4] 。然而由于氧化还原蛋白质的分子结构较大,电化学活性中心被深埋在蛋白中,在裸电极上实现直接电化学是比较困难的 [5] [6] 。研究发现,通过向氧化还原蛋白质中掺入适当的改性剂可以加速其电子转移速率,因为改性剂的存在可以缩短电极与氧化还原蛋白质的电活性中心之间的距离 [7] 。肌红蛋白(Mb)是一种氧化还原蛋白质,由于其中心的铁离子而具有独特的氧化还原性质,另外它具有过氧化物酶的活性,可用于检测过氧化氢(H2O2),在临床研究和细胞机制中发挥着重要作用 [8] 。
海藻酸钠(SA)是从植物藻类中提取的天然多糖,它可以用于制造明确的三维网络,用于固定生物分子和生物体 [9] [10] 。许多基于SA的传感器和生物传感器已经在电分析化学和电化学领域成功开发 [11] [12] 。众所周知,在Ca2+存在下,SA会在室温下形成稳定的凝胶。因为在形成薄膜的过程中Ca2+可与SA发生交联反应产生一种新的复合物海藻酸钙(CA)。在电化学领域,海藻酸钙(CA)凝胶被合成并用于生物催化剂封装基质。我们已经用氯化钙溶液作为交联剂,聚乙二醇(PEG)作为致孔剂,合成了多孔CA,并用它来固载肌红蛋白,改善肌红蛋白的电子转移能力 [13] 。在这种新型的多孔Mb/CA薄膜中,肌红蛋白保留了其天然结构,并显示出其良好的直接电化学和电催化性能 [14] 。与用普通形状(例如,单层)纳米材料构建的那些相比,微球结构具有更多的化学活性位点,可以负载较多的酶。聚电解质涂层的CA微球具有较大的表面积和较高的酶负载能力,在电化学生物传感器中具有良好的应用前景 [15] 。例如宣等人 [16] 利用静电液滴技术在CA微球中包封凝血酶,产生了新的栓塞剂。这些文献表明了CA微球具有广泛的潜在应用。
在这篇研究中,我们使用了海藻酸钠,氯化钙,聚乙二醇和聚乙烯醇,采用了滴注法成球的方式制备了新型的海藻酸钙微球。聚乙烯醇(PVA)在此作为非胶凝聚合物用于调节阳离子溶液的粘度和密度,以便确保海藻酸钙微球的球形。我们把多孔海藻酸钙微球膜涂在电极上用于固载肌红蛋白,从而构建Mb/CA微球生物传感器。
2. 实验部分
2.1. 仪器及试剂
肌红蛋白(Mb,Sigma公司);海藻酸钠(SA, MW = 100,000~200,000),购自天津远航化学公司;聚乙二醇(PEG, MW = 4000)购自上海化学试剂公司;聚乙烯醇(PVA)购自天津广富精细化工研究所;H2O2 (质量浓度为30%,分析纯),精确浓度经高锰酸钾溶液标准溶液滴定;医用消毒剂(含3% H2O2)购自合肥天帆医药科技有限公司;其它试剂为分析纯;实验水均为二次蒸馏水。pH 7.0的缓冲液是由0.050 M磷酸二氢钠,0.10 M溴化钾配制。用HCl或NaOH溶液调节缓冲液的pH。
CHI-660a型工作站(中国上海晨华);SK520HP型超声清洗仪;BSA124S-CN电子天平。使用标准三电极系统,其包括作为工作电极的改性玻碳电极(GCE),作为辅助电极的铂丝电极和作为参比电极的饱和甘汞电极。所有的测量在缓冲溶液中进行。实验前通入高纯氮气鼓泡至少10分钟排除缓冲溶液中的氧气,并在测量时保持氮气氛围。所有实验均在环境温度(13℃ ± 2℃)下进行。
2.2. CA微球的制备
分别配制0.02 g/mL的SA溶液,0.1 g/mL的CaCl2溶液,0.02 g/mL的PEG溶液,以及0.02 g/mL的PVA溶液。将一定量的SA和PEG溶液混合均匀,PVA和CaCl2溶液混合均匀,分别超声处理30分钟。用注射器吸取PVA、CaCl2混合溶液,均匀滴加到正在被不断搅拌的SA、PEG混合溶液中,可以观察到有白色絮状沉淀物产生,该白色沉淀物即为海藻酸钙微球。微球的大小及形状可以通过搅拌的速度以及滴加的速度来控制。通过一系列的对比试验确定了这四种溶液的最佳体积比例为SA:CaCl2:PEG:PVA = 1:8:4:3。用布氏漏斗将获得的海藻酸钙微球过滤出来,并用二次水清洗多次除去多余的Ca2+,最后将过滤后的微球保存在二次水中备用,并通过扫描电子显微镜(SEM)进行表征。
2.3. 修饰电极的制备
将直径为3 mm的玻碳电极(GCE)分别用0.3 μm和0.05 μm的Al2O3抛光粉抛光,并分别用二次水和乙醇超声处理3分钟。取8 μL的CA微球溶液滴于GCE表面,室温下干燥。然后将5 μL的1 mg/mL的Mb溶液滴到CA微球修饰的电极表面,待其水分缓慢蒸发获得Mb/CA微球膜修饰电极。修饰电极的制备过程如图1所示。为了对比,同样做了Mb/CA复合膜,此复合膜构建过程中没有加入PVA,因此没有微球产生。

Figure 1. Fabrication processes for Mb/CA microspheres
图1. 构建Mb/CA微球膜修饰电极的过程
3. 结果与讨论
3.1. Mb/CA微球膜的SEM分析
图2是CA微球膜以及Mb/CA微球膜的扫描电镜图。图2(A)可以观察到CA微球具有较多的细孔结构,这是由于PEG致孔剂的作用。并且CA微球的开口非常粗糙,意味着CA微粒从底部粘附堆叠。图2(B)可以观察到Mb/CA微球膜表面是比较平滑的,说明Mb和CA微球之间存在一种相互作用力。此作用力有利于促进Mb与电极之间的电子转移。

Figure 2. (A) SEM images of the CA microspheres films; (B) The Mb-CA microspheres films; (C) The CA films without PVA
图2. SEM图(A) CA微球;(B) Mb/CA微球;(C) CA膜
3.2. Mb/CA微球膜修饰电极的直接电化学行为
通过循环伏安法(CV)研究了Mb/CA微球膜修饰电极的直接电化学行为。如图3所示,当将Mb/CA微球膜电极浸入pH 7.0缓冲液中时,在0.2 V~−0.8 V的电位范围内以不同的扫速对Mb/CA微球膜修饰电极循环扫描,可以观察到在电位约−0.358 V处出现了一对对称性良好的氧化还原峰。并且氧化还原峰值电流(Ip)随着扫速的增加而增加。阳极和阴极峰值电流随扫描速率线性增加,两个线性回归方程拟合为Ipc(μA) = 6.49 ν(V/s) + 0.99 (R2 = 0.999)和Ipa(μA) = −6.47 ν(V/s) − 0.95 (R2 = 0.998) (图3插图)。还原峰的积分显示出不同扫速下通过电极的电荷值是相等的,这一结果表明了这是一个典型的表面薄层控制电化学过程,其中薄膜中的所有电活性蛋白质在向阴极扫描中被还原,在逆向阳极扫描中再次将还原蛋白质完全转化为其氧化形式。
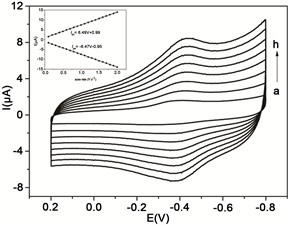
Figure 3. Cyclic voltammograms of Mb/CA microspheres films modified GCE in 0.1 M PBS solution (pH 7.0) at the scan rates of 0.2, 0.4, 0.6, 0.8, 1, 1.2, 1.4 and 1.6 V s−1 (from a to h). Inset is the plot of cathodic and anodic peak currents vs. scan rate
图3. Mb/CA微球膜修饰电极在0.1 M的磷酸盐溶液(pH = 7.0)中不同扫速下的循环伏安图
3.3. Mb/CA微球膜修饰电极的交流阻抗表征
电化学阻抗谱(EIS)是研究Mb/CA微球复合膜修饰电极的界面性质的有用手段。EIS图由高频区的半圆部分以及低频区的直线部分组成。半圆部分对应于电子转移过程,直线部分对应于扩散过程。半圆部分对应的电子转移速率较慢,而直线部分对应的电子转移速率较快。通常,电荷转移电阻(Rct)等于EIS图中半圆形部分的直径 [17] 。如图4所示,Mb/CA微球膜和Mb/CA膜的半圆形部分的直径明显大于空白玻碳电极,这可能是由于Mb对界面电荷转移过程的介电行为以及肌红蛋白分子结构较大,导致修饰电极电阻大大增加并且界面电荷转移的屏障更高。进一步证实Mb被固定在电极表面。另外,Mb/CA微球膜的Rct明显小于Mb/CA膜,说明了CA微球结构更有利于促进Mb的电子转移。
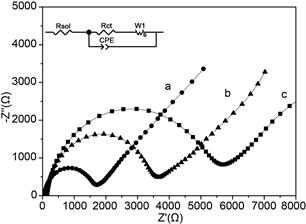
Figure 4. Nyquist plots of the different electrodes in a pH 7.0 PBS containing 5.0 mM [Fe(CN)6]3−/4−. The frequency range was from 10−2 to 105 Hz with perturbation amplitude of 5 mV. (a) Blank GC electrode; (b) Mb/CA microspheres films modified electrode; (c) The Mb/CA films without PVA modified electrode. Inset is the equivalent circuit. Curve: system result of standard experiment
图4. 不同修饰电极在5.0 mM铁氰化钾溶液中交流阻抗图
3.4. Mb/CA微球膜修饰电极对H2O2的检测
图5是Mb/CA微球膜修饰电极对H2O2的催化还原伏安图。在向pH 7.0的缓冲溶液中加入H2O2后,Mb/CA微球膜修饰电极上还原峰电流显著增加,氧化峰电流减少(图5(d))。并且还原峰电流强度会随着H2O2的浓度的增加而增加(图5(e))。在CA微球膜电极上没有电流响应(图5(b)),说明此电极上没有发生化学反应。Mb/CA微球膜修饰电极上发生的反应如下:
 (1)
(1)
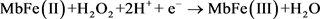 (2)
(2)
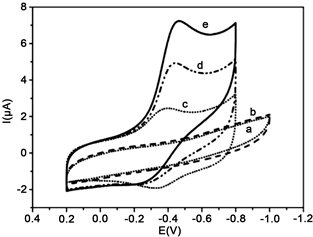
Figure 5. CVs at 0.2 V/s in 8 mL of pH 7.0 PBS for CA microspheres films electrode with (a) no H2O2; (b) 37.5 μM H2O2; and for Mb/CA microspheres films electrode with (c) no H2O2; (d) and (e) 37.5 μM, 75 μM H2O2 respectively
图5. Mb/CA微球膜修饰电极催化H2O2的循环伏安图
图6是Mb/CA微球膜修饰电极催化H2O2计时电流曲线。每隔40 s将6.25 μM的H2O2依次加入到pH为7.0的磷酸盐,可以观察到CA微球膜电极在加入H2O2后没有观察到电流响应(图6(a))。在Mb/CA微球膜修饰电极上催化H2O2的还原电流会随着缓冲液中H2O2浓度的逐步增加而相应增长(图6(b))。其线性检测范围为6.25 μM~150 μM (R2 = 0.996),计算的检测限为1.25 μM (S/N = 3)。
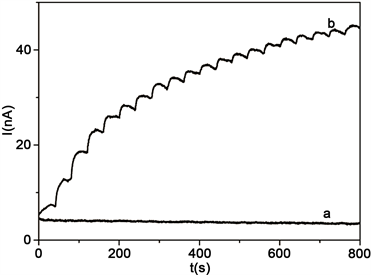
Figure 6. Typical amperometric current-time response curves of CA microspheres films modified electrode (a) and Mb/CA microspheres films modified electrode (b) at −0.17 V in pH 7.0 buffer solutions with 6.25 μM H2O2 injected every 40 s
图6. (A)Mb/CA微球膜修饰电极催化H2O2的计时电流曲线
在pH为7.0的磷酸盐缓冲溶液中,通过六次电催化还原75 μM H2O2的测量来研究该电化学生物传感器的重现性,相对标准偏差(RSD)为2.3%,说明该修饰电极具有良好的重现性。在含有200 μM干扰物和37.5 μM H2O2的pH 7.0 磷酸盐缓冲液中研究了Mb/CA膜修饰电极的选择性。发现催化H2O2电流响应和没有干扰物存在下的响应是一样的,说明无机离子(SO42−,Mg2+,Na+,K+,NH4+,Ni2+,Zn2+,Cl−),尿酸以及抗坏血酸对生物传感器响应没有干扰,表明修饰电极对H2O2具有良好的选择性。另外,还研究了电化学生物传感器的储存稳定性。对于75 μM H2O2的检测,电流响应在一周后没有明显的衰减,并且在一个月内保持原来的87%~95%。结果表明Mb/CA微球膜修饰电极具有优异的储存和操作稳定性。
3.5. 实际应用
如表1所示,将此传感器用于检测含有3% H2O2的医用消毒剂中的H2O2浓度。在实验前用二次水稀释医用消毒剂。将该生物传感器与常规高锰酸钾滴定进行比较,检测到的H2O2浓度结果基本一致,表明该传感器可用于分析实际的H2O2样品。
Table 1. Determination of H2O2 in the medical disinfectant
表1. 医用消毒剂中H2O2浓度的检测
4. 结论
在本文中,成功制备了CA微球,并用其固载Mb,从而制得Mb/CA微球生物传感器。该生物传感器对H2O2具有良好的电催化还原性能,并且具有较好的稳定性,线性范围宽,较低的检测限,可用于实际过氧化氢样品的分析。
文章引用
胡 娜,孙 红. 基于肌红蛋白/海藻酸钙微球修饰的过氧化氢生物传感器
A Biosensor for Hydrogen Peroxide Based on Myoglobin Immobilized on Calcium Alginate Microspheres[J]. 材料科学, 2019, 09(02): 170-176. https://doi.org/10.12677/MS.2019.92022
参考文献
- 1. Scheller, F.W., Lisdat, F., Lei, C., Ge, B. and Wollenberger, U. (2002) Communication between Redox Proteins and Modified Electrodes. Springer, Berlin Heidelberg, Germany.
- 2. Hu, N.F. (2001) Direct Electrochemistry of Redox Proteins or Enzymes at Various Film Electrodes and Their Possible Applications in Monitoring Some Pollutants. Pure and Applied Chemistry, 73, 1979-1991. https://doi.org/10.1351/pac200173121979
- 3. Paleček, E., Tkáč, J., Bartošík, M., Bertók, T., Ostatná, V. and Paleček, J. (2015) Electrochemistry of Nonconjugated Proteins and Glycoproteins. Toward Sensors for Biomedicine and Glycomics. Chemical Review, 115, 2045-2108. https://doi.org/10.1021/cr500279h
- 4. Bhakta, S.A., Evans, E., Benavidez, T.E. and Garcia, C.D. (2015) Protein Adsorption onto Nanomaterials for the Development of Biosensors and Analytical Devices: A Review. Analytica Chimica Acta, 872, 7-25. https://doi.org/10.1016/j.aca.2014.10.031
- 5. Huang, H., Hu, N.F., Zeng, Y.H. and Zhou, G. (2002) Electro-chemistry and Electrocatalysiswith Heme Proteins in Chitosan Biopolymer Films. Analytical Biochemistry, 308, 141-151. https://doi.org/10.1016/S0003-2697(02)00242-7
- 6. Jiang, X.E., Zhang, Z.L., Liu, X.Q., Huang, W.M., Wang, E.K. and Dong, S.J. (2005) In-Situ UV and CD Spectroelectrochemistry Investigation of the Electrochemical Reduction Reaction Inducing Conformational Transition of Microperoxidase-11. Chemical Journal of Chinese Universities, 185, 383-390.
- 7. Safavi, A. and Farjami, F. (2010) Hydrogen Peroxide Biosensor Based on a Myoglobin/Hydrophilic Room Temperature Ionic Liquid Film. Analytical Biochemistry, 402, 20-25. https://doi.org/10.1016/j.ab.2010.03.013
- 8. Eich, R.F., Li, T., Lemon, D.D., Doherty, D.H., Curry, S.R., Aitken, J.F., Mathews, A.J., Johnson, K.A., Smith, R.D., Phillips, G.N. and Olson, J.S. (1996) Mechanism of NO-Induced Ox-idation of Myoglobin and Hemoglobin. Biochemistry, 35, 6976-6983. https://doi.org/10.1021/bi960442g
- 9. Guisan, J.M. (2006) Immobilization of Enzymes and Cells. Methods in Molecular Biology, 25, 232-232. https://doi.org/10.1007/978-1-59745-053-9
- 10. Wei, S., Wang, D., Gao, R. and Jiao, K. (2007) Direct Electro-chemistry and Electrocatalysis of Hemoglobin in Sodium Alginate Film on a BMIMPF6 Modified Carbon Paste Electrode. Electrochemistry Communications, 9, 1159-1164. https://doi.org/10.1016/j.elecom.2007.01.003
- 11. Blandino, A., Macías, M. and Cantero, D. (1999) Formation of Calcium Alginate Gel Capsules: Influence of Sodium Alginate and CaCl2 Concentration on Gelation Kinetics. Journal of Bioscience & Bioengineering, 88, 686-689. https://doi.org/10.1016/S1389-1723(00)87103-0
- 12. Zhao, H., Zheng, W., Meng, Z., Zhou, H., Xu, X., Li, Z. and Zheng, Y.F. (2009) Bioelectrochemistry of Hemoglobin Immobilized on a Sodium Alginate-Multiwall Carbon Nanotubes Composite Film. Biosensors & Bioelectronics, 24, 2352-2357. https://doi.org/10.1016/j.bios.2008.12.004
- 13. Wu, L. and Ding, J. (2004) In Vitro Degradation of Three-Dimensional Porous Poly(D,L-lactide-co-glycolide) Scaffolds for Tissue Engineering. Biomaterials, 25, 5821-5830. https://doi.org/10.1016/j.biomaterials.2004.01.038
- 14. Li, Q.Q., Sun, H., Liu, X. and Zhao, X.S. (2012) Electroactive Porous Films of Myoglobin within Calcium Alginate. Journal of Solid State Electrochemistry, 16, 1651-1661. https://doi.org/10.1007/s10008-011-1580-8
- 15. Brown, J.Q., Srivastava, R. and Mcshane, M.J. (2005) Encapsulation of Glucose Oxidase and an Oxygen-Quenched Fluorophore in Polyelectrolyte-Coated Calcium Alginate Microspheres as Optical Glucose Sensor Systems. Biosensors & Bioelectronics, 21, 212-216. https://doi.org/10.1016/j.bios.2004.08.020
- 16. Xuan, F., Rong, J., Liang, M., Zhang, X., Sun, J., Zhao, L., Li, Y., Liu, D., Li, F., Wang, X. and Han, Y. (2017) Biocompatibility and Effectiveness Evaluation of a New Hemostatic Embolization Agent: Thrombin Loaded Alginate Calcium Microsphere. BioMed Research International, 8, 1-10. https://doi.org/10.1155/2017/1875258
- 17. Anusha, J.R., Kim, H.J., Fleming, A.T., Das, S.J., Yu, K.H. and Rai, C.J. (2014) Simple Fabrication of ZnO/Pt/Chitosan Electrode for Enzymatic Glucose Biosensor. Sensors and Actuators B: Chemical, 202, 827-833. https://doi.org/10.1016/j.snb.2014.06.024
NOTES
*通讯作者。
