Material Sciences
Vol.
10
No.
01
(
2020
), Article ID:
34029
,
9
pages
10.12677/MS.2020.101008
An Electrochemical Ascorbic Acid Sensor Based on Nanoporous Cu/Au Array Film
Gang Liu, Lirong Qin, Song Liu, Jianwei Zhao*
School of Physical Science and Technology, Southwest University, Chongqing

Received: Dec. 28th, 2019; accepted: Jan. 10th, 2020; published: Jan. 17th, 2020

ABSTRACT
A simple method based on sputtering of Au film and thermal evaporation of Cu film onto the surface of anodic aluminum oxide template is presented. The ordered nanoporous Cu/Au array film would be obtained after dissolving the template. The prepared porous film consisted of ordered hexagonal array of concave nanoholes with a mouth diameter of 60 nm, an inner hole diameter of 25 nm, and a periodic distance of 115 nm. The prepared Cu/Au nanoporous film can be transferred onto an ITO substrate to be used directly as an effectively non-enzymatic ascorbic acid sensor. It exhibited excellent electrocatalytic performance with a high sensitivity of 2207 μA mM−1∙cm−2, a wide linear range of 2 μM to 6 mM, and a low detection limit of 0.2 μM. The satisfactory results obtained indicated that the proposed sensor electrode was promising for the development of a novel strategy for AA detection.
Keywords:Metal, Nanostructures, Ascorbic Acid, Non-Enzymatic Sensor

基于Cu/Au纳米孔阵列薄膜的抗坏血酸传感器
刘刚,秦丽溶,刘松,赵建伟*
西南大学物理科学与技术学院,重庆

收稿日期:2019年12月28日;录用日期:2020年1月10日;发布日期:2020年1月17日

摘 要
以有序多孔氧化铝的表面为模板,借助直流溅射和热蒸发镀膜的方法分别沉积Au和Cu膜层,去除模板后获得Cu/Au纳米孔阵列薄膜。该薄膜由六方规则排列的凹型纳米孔构成,孔的开口直径约为60 nm,内孔直径约为25 nm,孔中心间距约115 nm。将该纳米孔阵列转移至ITO玻璃上封装后,可直接用作高灵敏的无酶抗坏血酸检测电极,灵敏度可达2207 μA/(mmol·cm2),线性范围为2~6000 μmol/L,检出限为0.2 μmol/L,同时具有优良的抗干扰性和稳定性。本文中所制备的薄膜型传感器电极,容易与微流控技术结合,为快速高灵敏的抗坏血酸检测提供新的途径。
关键词 :金属,纳米结构,抗坏血酸,无酶传感器

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 前言
抗坏血酸(AA)也被广泛称为维生素C,是一种重要的水溶性化合物,存在于各种水果、蔬菜、软饮料中 [1] [2]。AA在维持健康方面起着关键作用,如癌症预防、增强免疫和抗氧化能力等 [3] [4],坏血病就是由于缺乏AA引起的。正常成人体内的AA代谢活性池中约有1500 mg,将在体内经代谢分解成草酸或与硫酸结合生成抗坏血酸-2-硫酸由尿排出。中枢神经系统中AA的浓度在毫摩尔水平,远低于其他体液的浓度。因此,开发一种简便、快速、灵敏度高、检测水平低的AA检测方法是十分重要的。近年来,人们采用多种电化学方法、间接分光光度法、固相碘测定法和液相色谱法等分析方法,用于食品、药品和植物中AA含量的测定 [5] [6] [7] [8] [9]。其中电化学方法具有操作简单、选择性好、灵敏度高、响应迅速、成本低等优点,拥有广阔的应用前景。但是传统的酶生物传感器制备困难、价格昂贵,并且由于酶的固有性质表现出较差的稳定性 [10] [11]。随着纳米技术的不断发展,纳米材料在生物传感器的研制方面得到广泛应用,为生物传感器的研究开创了新的局面 [12]。将不同结构与形态的纳米材料引入生物敏感界面的构建中,除了能够增加电极材料的比表面积,从而使材料表面具有更多的功能基团,对AA及其他小分子化合物产生特有的电催化效应之外,还能够降低过电位,提高电化学反应的速率、增强电极的选择性和灵敏性 [13] [14]。
铜(Cu)及其氧化物纳米材料具有易于制备、成本低、比表面积大、无毒性、电化学活性高等优点,是一类很好的电化学传感材料,可以用于无酶生物传感器的制备。如马晓燕教授等将Cu纳米颗粒沉积在镍网上获得了性能优异的葡萄糖传感器 [15],杨瑜等利用胶体球模板法制备的Cu-Cu2O复合微纳阵列结构对过氧化氢具有很好的电化学检测性能 [16],王永鹏等成功制备出基于多孔泡沫状CuO微纳米纤维的无酶葡萄糖传感器 [17]。在本研究组之前的工作中,曾利用氧化铝模板法沉积制备了Cu2O纳米线阵列,该材料在碱性条件下显示出对AA的优异催化性能 [18]。此外,我们还以多孔氧化铝的表面作为模板,结合磁控溅射镀膜工艺合成了Fe2O3/Au纳米孔薄膜,获得了性能更好的AA无酶传感器电极 [19]。但Cu2O和Fe2O3都是氧化物材料,具有较高的电阻,不利于表面检测信号向基体电极的传递,若改用金属Cu纳米结构可望获得更好的AA探测性能(金属Fe在空气中易氧化锈蚀)。因此,本文中,我们继续以多孔氧化铝的表面为模板,借助成本更低的直流溅射和热蒸发镀膜的方法分别沉积Au和Cu膜层,其中Au膜具有优异的化学稳定性和导电性,用作薄膜材料的基层,Cu膜具有较高的催化活性,用作功能膜层。去除模板后获得Cu/Au纳米孔阵列薄膜,将该纳米孔阵列转移至ITO玻璃上封装后,可直接用作AA检测电极,显示出更高的灵敏度及更好的综合性能,这种高灵敏的薄膜电极也为发展微流控式的AA传感器提供了较好的电极基础。
2. 实验部分
2.1. 试剂与仪器
抗坏血酸、葡萄糖、尿酸等有机试剂购买于美国Sigma-Aldrich化学试剂公司,草酸、氢氧化钠、乙醇等无机试剂均为分析纯,购买于重庆川东化工有限公司,溶液用自制的去离子水配置。定制的ITO玻璃(0.5 × 2.5 cm2)用乙醇和去离子水超声清洗,放在干燥箱中60℃烘干待用。电化学性质是通过电化学分析仪(CHI 660E)测试的,并以所制备的电极为工作电极,Ag/AgCl电极作为参比电极,铂丝电极作为对电极。测试底液为10 mL浓度0.2 mol/L的NaOH溶液,测试时在底液中用微量进样器注入10 μL较高浓度的AA溶液,在搅拌作用下,稀释1000倍后得到对应的待测浓度。形貌表征和元素测定是通过场发射扫描电镜(SEM,JSM-7100F,附能谱仪)上进行的,物相结构则是通过X射线衍射仪(XRD,TD-350)测定的。
2.2. 实验过程
多孔氧化铝模板的制备过程与我们小组之前发表的工作完全相同 [19] [20],简述如下:首先将高纯铝片裁剪并清洗干净,真空退火后在高氯酸和无水乙醇混合液中恒压25 V进行电化学抛光,再以其为阳极,在0.3 mol/L的草酸电解液中进行一次氧化,时间为6 h。氧化后放入质量分数6%的磷酸和1.8%的铬酸混合液中,去除第一次氧化产生的无序氧化层。接下来重复上述步骤,进行二次氧化,二次氧化后的模板再通过SnCl4溶液去除底部未被氧化的铝层。接下来进行Cu/Au纳米孔薄膜的制备,相应流程如图1所示,先利用直流溅射仪(EDT-2000)在氧化铝模板的表面溅射沉积Au膜,沉积电流为4 mA,沉积时间为10 min。之后转移至真空热蒸发仪(常州鸿明定制)进行表层Cu膜的蒸镀,所用高纯铜丝蒸发料的直径为1 mm,长度约为5 mm。镀膜完成后将模板放入2 mol/L的NaOH水溶液表面漂浮10 min,多孔的氧化铝模板将被完全溶解而得以去除,分离出柔软而连续的Cu/Au纳米孔薄膜会漂浮在溶液表面,该薄膜可以被转移至不同材料和结构的物体表面,甚至可以是弯曲的柔性电极 [21],并且在自然晾干后,薄膜将会依靠范德瓦尔斯力与基底牢牢的结合在一起,再次浸泡到溶液中也不会发生脱离,说明两者之间的结合是非常稳固的。本文中,我们将其直接捞取转移至ITO玻璃表面,清水淋洗后自然晾干,最后在Cu/Au纳米孔薄膜的边沿和四周直接涂覆一薄层环氧树脂,防止多孔膜脱落的同时,避免ITO与测试溶液的接触,观测发现,ITO玻璃上Cu/Au纳米孔薄膜的有效使用面积约为0.04 cm2。
3. 结果与讨论
3.1. 材料表征
通过场发射扫描电镜(SEM)首先对沉积在多孔氧化铝模板表面的Cu/Au纳米孔阵列薄膜进行了形貌的表征,结果如图2所示。从低倍的SEM照片(图2(a)和图2(b))中可以看出纳米孔阵列薄膜的表面形貌非常均一,总体呈现出较为规则有序的排列,也反映出自制的氧化铝模板具有较好的有序性。进一步放大的照片可以更清楚的看到纳米孔的结构外形,可以发现所合成的材料并非平坦的表面和规整的圆孔,而是由六方规则排列的凹型纳米孔构成,孔的开口直径约为60 nm,内孔直径约为25 nm,孔中心间距约115 nm,每三个孔的中心部位都是一个圆球状的凸起,这让材料看起来如峰峦叠嶂般起伏,从顶端到底部的垂直高度测得约为100 nm。与平坦的表面相比,这种周期性起伏的凹孔形结构能够极大的增大材料的比表面积,进而增加电化学探测时的活性位点,提高探测的综合性能。通过研究氧化铝模板表面形貌可知(如图1中的模型所示),这种山峦起伏状的结构来源于模板本身的不平整表面 [19]。

Figure 1. Schematic illustration of the fabrication of Cu/Au nanoporous film and the corresponding AA sensor electrode
图1. 制备Cu/Au纳米孔阵列薄膜的过程示意图及所构建的传感器电极结构示意图

Figure 2. (a) and (b) Low magnification SEM images of the prepared Cu/Au nanoporous film, (c) and (d) high magnification SEM images.
图2. 图(a)和(b)为低倍的Cu/Au纳米孔阵列薄膜的扫描电镜照片,图(c)和(d)为高倍的Cu/Au纳米孔阵列薄膜的扫描电镜照片
我们还对第一步沉积合成的Au纳米孔阵列的形貌进行了分析,结果发现它的外形结构与Cu/Au纳米孔阵列薄膜较为相似,在此就不再进行具体的描述了。本文中所制备的氧化铝模板具有很好的可控性,如通过在NaOH溶液中浸泡一定时间就可以借助刻蚀反应得到更大孔径的模板,进而溅射金属薄膜后得到更大孔径的Cu/Au纳米孔阵列薄膜,其形貌如图3所示。电化学测试结果表明此时材料对AA的催化特性会显著降低,这是因为孔径变大后,有效的催化面积减少的缘故。通过改变Au和Cu的沉积时间还能够调控膜层的厚度,但这种调控对催化性能影响不大,本文中所给工艺参数为最优化的结果。
利用X射线衍射仪对Cu/Au纳米孔阵列薄膜进行了物相分析,结果如图4(a)所示,图中最强的衍射峰位于2θ = 38.3˚处,对应于立方结构的Au (JCPD No. 65-8601)。此外在2θ = 43.7˚处有一个明显的小衍射峰,对应于立方结构的Cu (JCPD No. 85-1326),衍射峰信号较弱说明热蒸发沉积的Cu膜层相对较薄。利用扫描电镜附带的能谱仪对纳米孔薄膜的元素组成进行了分析,结果如图4(b)所示,可以发现除了来自底部氧化铝模板的较强的Al元素峰和O元素峰之外,Au元素峰和Cu元素峰都明确可见,进一步证实经过两次沉积得到的是Cu/Au纳米孔阵列。图5显示了Au元素和Cu元素的面分布图及对应的纳米孔阵列的SEM图,可以看出Au元素和Cu元素都是非常均匀的分布在整个纳米孔薄膜上,在元素面分布图中,纳米孔也依稀可见,以上测试结果充分表明本文以多孔氧化铝表面作为模板,成功合成了Cu/Au纳米孔阵列薄膜。

Figure 3. (a) and (b) SEM images of the Cu/Au nanoporous film with bigger pore diameter.
图3. 图(a)和(b)为具有更大孔径的Cu/Au纳米孔阵列薄膜的扫描电镜照片
 (a) (b)
(a) (b)
Figure 4. (a) XRD pattern and (b) EDS spectrum of the Cu/Au nanoporous film.
图4. 所制备的Cu/Au纳米孔阵列薄膜的(a)X射线衍射图,(b)能谱图

Figure 5. SEM image of the product and the elemental chemical maps of Au and Cu
图5. 样品的扫描电镜图及样品中元素Au和Cu的面分布图
3.2. 传感器性能
将所制备的Cu/Au纳米孔阵列薄膜转移至ITO玻璃上封装后,可直接用作高灵敏的无酶AA检测电极,利用电化学分析仪对其探测性能进行了测定。图6(a)为Cu/Au阵列薄膜在0.2 mol/L NaOH溶液中扫描速率为100 mV/s时加入0.5 mmol/L的AA前后的循环伏安曲线对比图,可以明显看出加入AA后,循环伏安曲线发生显著变化,包括氧化峰在内的整个氧化电流值均变大,说明Cu/Au纳米孔薄膜对AA表现出了较强的电催化活性。考虑到热蒸发镀膜的过程中,外层的Cu膜会覆盖绝大部分的Au膜,因此电极所表现出的催化活性应主要来自于外层的Cu膜。值得注意的是,氧化峰的电位约为0.57 V,该电位下的氧化过程正对应于Cu(II)/Cu(III)的转换 [18],据此可推知,AA氧化过程的反应方程式应当为:
Cu0 + 2OH− → Cu(OH)2 + 2e− (1)
Cu(OH)2 ↔ CuO + H2O (2)
CuO + OH− → CuOOH + e− (3)
2CuOOH + C6H8O6 → 2CuO + C6H6O6 + 2H2O (4)
为了研究扫描速率的影响,我们对所制备的纳米孔薄膜电极在含有0.5 mmol/L的AA的NaOH溶液中测试了不同扫速下的循环伏安曲线,所得结果如图6(b)所示。该图显示出不同扫速下的氧化峰和还原峰的电流均与扫描速率的平方根呈线性关系(如图6(b)的插图所示),说明电极表面的反应是受扩散控制的过程。
 (a) (b)
(a) (b)
Figure 6. (a) CV curves of the prepared electrode in the absence and presence of AA in 0.2 mol/L NaOH solusion. (b) Typical CVs of the electrode at different scan rates (from 50 to 300 mV∙s−1). Inset: plots of peak currents vs. ν1/2.
图6. 图(a)所制备电极在0.2 mol/L NaOH溶液中加入AA前后的循环伏安曲线图,(b)不同扫描速度下的循环伏安曲线图,插图:峰电流与扫速平方根的线性关系图
我们利用安培计时电流技术进一步研究了Cu/Au纳米孔薄膜对AA的探测性能。图7(a)为0.7 V电位下,在持续轻微搅拌的0.2 mol/L NaOH溶液中连续滴加不同小浓度的AA所得到计时电流响应曲线。从图中可以看出,微量的AA的加入也能引起响应电流的快速明显增加,达到稳定时所需时间小于8秒,表明所制备的电极对AA有着较为灵敏的响应,按信噪比3:1计算可得Cu/Au纳米孔薄膜对AA的探测极限为0.2 μmol/L。图7(b)是在测试溶液中连续加入0.5 mmol/L的AA时所制电极的计时电流响应曲线,依据响应电流稳定时的数值,可绘出测试时AA浓度和响应电流之间的线性关系图(如图7(b)的插图所示)。根据该线性关系可计算得知我们制备的纳米孔薄膜电极的线性探测范围是2~6000 μmol/L,线性相关系数为0.9991,线性方程是I (μA) = 12.35 + 88.29 C (mmol/L),灵敏度为2207 μA/(mmol·cm2)。表1列出了最近报道的一些用于检测AA的电化学传感器电极及其性能数据,与这些文献中的结果相比 [18] [19] [22] [23] [24],本文制备的传感器电极具有更高的灵敏度,较宽的检测范围以及低的检测限。这些优异的性能得益于我们所制备电极的特殊结构和材料。如前所述,周期性起伏的凹孔形结构能够显著增大材料的比表面积,进而增加探测时电催化AA的活性位点,提高响应的电流值。同时,与常用的纳米氧化物等材料相比,金属Cu作为传感器电极的功能材料,不仅有着优异的电催化活性(图5(b)显示单独的Au纳米孔薄膜对AA的检测性能要差很多),其良好的导电性有利于表面电化学反应生成的信号电流向外电路的传输,我们设计制备的电极中基底ITO和中间层Au也均具有较好的导电性,为获得较高的探测性能提供了保障。除优异性能外,本文中所制备的AA传感器电极结构简单,制作过程无需大型设备,很容易大面积制备,若结合图形化的ITO电极并与有着微流体通道的PDMS盖片键合,就可以对流经芯片通道的样品进行实时的电化学分析,为快速高灵敏的AA检测提供了新的途径,这将是我们下一步研究的目标之一。
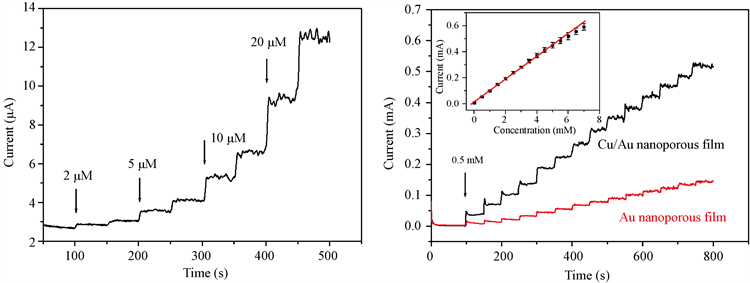 (a) (b)
(a) (b)
Figure 7. (a) and (b) Typical current-time response for the prepared electrode or the comparison electrode to successive additions of different concentrations of AA in 0.2 mol/L NaOH solution. Inset: The linear relationship between the catalytic current and the concentration (Error bar: n = 3)
图7. 图(a)和(b)所制备电极及对比电极在0.2 mol/L NaOH溶液中连续加入不同浓度的AA后相应的计时电流响应图。插图:响应电流与AA浓度的线性关系图(误差线: n = 3)
Table 1. Comparison of different electrode materials for determination of AA
表1. 用于探测AA浓度的不同电极材料的性能比较
本文中制备的Cu/Au纳米孔薄膜电极不使用时保存在干燥箱中即可,储存一个月后,电极的实验检测表明其探测灵敏度可以保持为原始值的91.4%,表明该电极有着很好的长期稳定性。利用计时电流法对所制电极进行了抗干扰测试,实验中,先滴加了0.5 mmol/L的AA,然后依次加入相同浓度的干扰物:葡萄糖(Glucose),多巴胺(Dopamine),过氧化氢(H2O2)和尿酸(UA)。从图8所示结果可以看出,这些常见的干扰物对电流响应几乎没有影响,说明本文中所制备的传感器具有良好的选择性。在以往的文献报道中,金属Cu的纳米结构还可以用来进行无酶的葡萄糖检测,我们认为这可能是不同的材料制备方法导致产物形貌结构和结晶程度上存在差异,从而改变了电化学催化的反应过程,具体机理还有待进一步的实验研究。在以上抗干扰试验中,我们还有意加入了利用维生素C药片溶解后获得的相同浓度的AA,从图中对比可以发现,相应的电流响应值与直接滴加AA试剂的响应值差别小于5%,表明该传感器电极可用于实际样品的检测。

Figure 8. Amperometric curve of addition of AA and some potential interference.
图8. 加入AA及一些干扰试剂后的计时电流响应图
4. 结论
利用直流溅射和热蒸发镀膜的方法在多孔氧化铝模板的表面分别沉积Au和Cu膜层,去除模板后获得Cu/Au纳米孔阵列薄膜。将该纳米孔薄膜转移至ITO玻璃上封装后,可直接用作无酶抗坏血酸检测电极。电化学测试结果表明本文制备的传感器电极具有优异的探测性能,如高的灵敏度、宽的线性探测范围以及较低的探测极限。本文中所制备的检测电极结构简单,易于大面积制备,有望与微流控技术融合,为快速高灵敏的AA检测提供新的途径。
致谢
这项工作得到了重庆市自然科学基金(No. cstc2019jcyj-msxmX0311)以及中央高校基本科研业务费(XDJK2018B033)的支持。
文章引用
刘 刚,秦丽溶,刘 松,赵建伟. 基于Cu/Au纳米孔阵列薄膜的抗坏血酸传感器
An Electrochemical Ascorbic Acid Sensor Based on Nanoporous Cu/Au Array Film[J]. 材料科学, 2020, 10(01): 54-62. https://doi.org/10.12677/MS.2020.101008
参考文献
- 1. Chavhan, P.M., Reddy, V. and Kim, C. (2012) Nanostructured Titanium Oxide Platform for Application to Ascorbic Acid Detection. International Journal of Electrochemical Science, 7, 5420-5428.
- 2. Villanueva, M.J., Tenorio, M.D., Sagardoy, M., Redondo, A. and Saco, M.D. (2005) Physical, Chemical, Histological and Microbiological Changes in Fresh Green Asparagus (Asparagus officinalis, L.) Stored in Modified Atmosphere Packaging. Food Chemistry, 81, 609-619. https://doi.org/10.1016/j.foodchem.2004.06.030
- 3. Kalimuthu, P. and John, S.A. (2009) Electropolymerized Film of Functionalized Thiadiazole on Glassy Carbon Electrode for the Simultaneous Determination of Ascorbic Acid, Dopamine and Uric Acid. Bioelectrochemistry, 77, 13-18. https://doi.org/10.1016/j.bioelechem.2009.04.010
- 4. Jin, L., Zhang, Z., Zhuang, Z., Meng, Z., Li, C. and Shen, Y. (2016) PdPt Bimetallic Alloy Nanowires-Based Electrochemical Sensor for Sensitive Detection of Ascorbic Acid. RSC Advances, 6, 42008-42013. https://doi.org/10.1039/C6RA05087E
- 5. Frenich, A.G., Torres, M.E.H., Vega, A.B., Vidal, J.L.M. and Bolanos, P.P. (2005) Determination of Ascorbic Acid and Carotenoids in Food Commodities by Liquid Chromatography with Mass Spectrometry Detection. Journal of Agricultural and Food Chemistry, 53, 7371-7376. https://doi.org/10.1021/jf050973o
- 6. Silva, F.O. (2005) Total Ascorbic Acid Determination in Fresh Squeezed Orange Juice by Gas Chromatography. Food Control, 16, 55-58. https://doi.org/10.1016/j.foodcont.2003.11.007
- 7. Lima, M.J.R., Toth, I.V. and Rangel, A.O.S.S. (2005) A New Approach for the Sequential Injection Spectrophotometric Determination of the Total Antioxidant Activity. Talanta, 68, 207-213. https://doi.org/10.1016/j.talanta.2005.06.058
- 8. Wang, B., Wang, X., Duan, L., Xu, L., Zhao, P., Jian, J. and Liu, Z. (2019) Spectral Detection for Vitamin C and H2O2 Based on the Reversible Color Change and Lu-minescent Switching Properties of P2Mo18O626-@ Tb3+ Mixed Solution. Chemical Journal of Chinese Universities, 40, 676-684.
- 9. Li, N.B., Ren, W. and Luo, H.Q. (2008) Simultaneous Voltammetric Measurement of Ascorbic Acid and Dopamine on Poly(Caffeic Acid)-Modified Glassy Carbon Electrode. Journal of Solid State Electrochemistry, 12, 693-699.https://doi.org/10.1007/s10008-007-0410-5
- 10. Qin, L., He, L., Zhao, J., Zhao, B., Yin, Y. and Yang, Y. (2017), Synthesis of Ni/Au Multilayer Nanowire Arrays for Ultrasensitive Non-Enzymatic Sensing of Glucose. Sensors and Actuators B: Chemical, 240, 779-784. https://doi.org/10.1016/j.snb.2016.09.041
- 11. Yu, Z., Li, H., Lu, J., Zhang, X., Liu, N. and Zhang, X. (2015) Hydrothermal Synthesis of Fe2O3/Graphene Nanocomposite for Selective Determination of Ascorbic Acid in the Presence of Uric Acid. Electrochimica Acta, 158, 264-270. https://doi.org/10.1016/j.electacta.2015.01.131
- 12. Wei, H. and Wang, E.K. (2013) Nanomaterials with En-zyme-Like Characteristics (Nanozymes): Next-Generation Artificial Enzymes. Chemical Society Reviews, 42, 6060-6093. https://doi.org/10.1039/c3cs35486e
- 13. Power, A.C., Gorey, B., Chandra, S. and Chapman, J. (2018) Carbon Nanomaterials and Their Application to Electrochemical Sensors: A Review. Nanotechnology Reviews, 7, 19-41. https://doi.org/10.1515/ntrev-2017-0160
- 14. Nehra, A. and Singh, K.P. (2015) Current Trends in Nanomaterial Embedded Field Effect Transistor-Based Biosensor. Biosensors and Bioelectronics, 74, 731-743. https://doi.org/10.1016/j.bios.2015.07.030
- 15. Ma, P.C., Ma, X.Y., Suo, Q. and Chen, F. (2019) Cu NPs@NiF Elec-trode Preparation by Rapid One-Step Electrodeposition and Its Sensing Performance for Glucose. Sensors and Actuators B: Chemical, 292, 203-209. https://doi.org/10.1016/j.snb.2019.04.132
- 16. Yang, Y., Zhao, J., Qin, L., Yin, Y. and He, L. (2016) Synthesis of Ordered Bowl-Like Cu-Cu2O Array Film for Non-Enzymatic Hydrogen Peroxide Sensor. Materials Letters, 179, 27-29. https://doi.org/10.1016/j.matlet.2016.05.004
- 17. Wang, Y., Xu, Z., Liu, M., Zhang, H. and Jiang, Z. (2019) Non-Enzymatic Glucose Sensor Based on the Electrospun Porous Foamy Copper Oxides Micro-Nanofibers. Chemical Journal of Chinese Universities, 40, 1310-1316.
- 18. Zhao, J.W., Yan, Z.K., Qin, L.R., Feng, X.N. and Wang, P. (2014) Application of Cuprous Oxide Nanowires in an Electrochemical Sensor for Ascorbic Acid. Chemistry Letters, 43, 814-816. https://doi.org/10.1246/cl.131200
- 19. Yin, Y.Y., Zhao, J.W., Qin, L.R., Yang, Y. and He, L.Z. (2016) Synthesis of an Ordered Nanoporous Fe2O3/Au Film for Application in Ascorbic Acid Detection. RSC Advances, 6, 63358-63364. https://doi.org/10.1039/C6RA12145D
- 20. Yan, Z., Zhao, J., Qin, L., Mu, F., Wang, P. and Feng, X. (2013) Non-Enzymatic Hydrogen Peroxide Sensor Based on a Gold Electrode Modified with Granular Cuprous Oxide Nanowires. Microchimica Acta, 180, 145-150.https://doi.org/10.1007/s00604-012-0916-0
- 21. Yin, Y.Y., Zhao, J.W., Qin, L.R., Yang, Y. and He, L.Z. (2017) Synthesis of Transferable Nanoporous PtFe/Au Film with Enhanced Electrocatalytic Activity. Micro & Nano Letters, 12, 128-132. https://doi.org/10.1049/mnl.2016.0539
- 22. Wang, B., He, J., Liu, F. and Ding, L. (2017) Rapid Synthesis of Cu2O/CuO/rGO with Enhanced Sensitivity for Ascorbic Acid Biosensing. Journal of Alloys and Compounds, 693, 902-908. https://doi.org/10.1016/j.jallcom.2016.09.291
- 23. Li, L., Zhang, P., Li, Z., Li, D., Han, B., Tu, L., Li, B., Wang, Y., Ren, L., Yang, P., Ke, S., Ye, S. and Shi, W. (2019) CuS/Prussian Blue Core-Shell Nanohybrid as an Electrochemical Sensor for Ascorbic Acid Detection. Nanotechnology, 30, 325501. https://doi.org/10.1088/1361-6528/ab1613
- 24. You, Q., Liu, T., Pang, J., Jiang, D., Chu, Z. and Jin, W. (2019) In Situ Fabrication of CuO Nanowire Film for High-Sensitive Ascorbic Acid Recognition. Sensors and Actuators B: Chemical, 296, Article ID: 126617. https://doi.org/10.1016/j.snb.2019.05.094
NOTES
*通讯作者。
