Hans Journal of Biomedicine
Vol.
09
No.
02
(
2019
), Article ID:
29827
,
7
pages
10.12677/HJBM.2019.92013
Research Progress of Chitosan and Its Derivatives in Biological Medicine
Yuechao Liu1,2, Hongmei Wang1, Zui Wu1, Xiaohua Zeng1*
1Hubei Key Laboratory of Wudang Local Chinese Medicine Research, College of Pharmacy, Hubei University of Medicine, Shiyan Hubei
2Renmin Hospital, Hubei University of Medicine, Shiyan Hubei

Received: Apr. 4th, 2019; accepted: Apr. 16th, 2019; published: Apr. 23rd, 2019

ABSTRACT
Chitosan, derived from chitin, is a natural high molecular polysaccharide that is second only to cellulose in nature. Because of its excellent biocompatibility, biodegradability, antibacterial activity, cytotoxicity and specific protein affinity, it has broad application prospects in biomedicine. In this paper, the biological characteristics of chitosan and its derivatives and their progress in medical applications are reviewed.
Keywords:Chitosan, Biocompatibility, Biodegradability, Protein Affinity, Application Progress
壳聚糖及其衍生物在生物医药领域的应用研究进展
柳岳超1,2,王红梅1,吴最1,曾小华1*
1湖北医药学院药学院武当特色中药研究湖北省重点实验室,湖北 十堰
2湖北医药学院附属人民医院,湖北 十堰

收稿日期:2019年4月4日;录用日期:2019年4月16日;发布日期:2019年4月23日

摘 要
壳聚糖衍生于甲壳素,是自然界中产量仅次于纤维素的天然高分子多糖。由于它具有生物相容性、生物可降解性、抗菌性、无细胞毒性以及非凡的蛋白亲和性等优异性能,在生物医药方面具有广阔的应用前景。此文对壳聚糖及其衍生物的生物特性以及在医药应用中的进展进行了综述。
关键词 :壳聚糖,生物相容性,生物降解性,蛋白亲和性,应用进展

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
甲壳素又名甲壳质,壳多糖,是存在于自然界中的、带阳离子的、能被生物降解的、分布极其广泛的高分子材料,大量存在于海洋节肢动物(虾,蟹)的甲壳中,也存在于低等动物菌类,昆虫,藻类细胞膜中。壳聚糖是甲壳素的脱乙酰产物,又名甲壳胺或可溶性甲壳质,是生物界唯一的碱性多糖。壳聚糖化学名称为β-1,4-2-氨基-2-脱氧-D-葡萄糖胺(结构式见图1),进一步解聚可生成水溶性壳聚糖和低分子壳寡糖。壳聚糖性质不活泼,不与体液和体内组织产生免疫反应,可被溶菌酶降解为对人体无毒的氨基葡萄糖。壳聚糖无毒性、不溶血、无刺激性、无热原性、无致突变性,具有很好的生物相容性和生物可降解性。由于壳聚糖与纤维素结构类似,故它具有与纤维素类似的用途,而且基于氨基多糖的特性,它又具有了许多优良的生物特性。因此它在医药领域具有十分广泛的用途。近年来已研究出了用壳聚糖制造医用缝合线,人造皮肤,人工眼泪,骨组织,神经组织修复剂等医用材料。
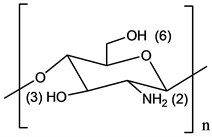
Figure 1. The structure of chitosan
图1. 壳聚糖结构式
2. 壳聚糖及其衍生物的生物特性
壳聚糖为阳离子聚合物,约180℃分解,不溶于普通有机溶剂,在碱液中稳定,有很强的亲水性,可在稀盐酸,稀醋酸溶液中膨胀形成凝胶,依次特性可制成各种缓稀和控制制剂。因制备工艺和需求的不同,脱乙酰度由60%~90%不等。脱乙酰度和平均分子量是它的两个主要性能指标。根据产品和粘度的不同又可分为高粘度,中粘度和低粘度3种不同的类型,一般来说分子量越大,粘度越大,而且用途也有所不同,但其主要的生物特性包括以下:
2.1. 抗肿瘤作用的特性
壳聚糖及衍生物具有抗肿瘤的作用,其机理主要包括:调节和增强机体的免疫功能、直接作用于肿瘤细胞、以及诱导细胞凋亡的作用 [1] 。一方面壳聚糖抗肿瘤的作用可以通过增强人体内巨噬细胞的吞噬功能与分泌水解酶的活性,刺激巨噬细胞产生淋巴因子,启动免疫系统,有效提高机体的抗肿瘤免疫功能。其机理是壳聚糖能激活巨噬细胞、T淋巴细胞、B淋巴细胞、NK细胞、补体系统并诱导许多细胞因子产生,这在其抗肿瘤中起重要作用 [2] 。壳聚糖能够使机体微环境保持弱碱性,以利于活化免疫细胞,增强机体抗癌效应,此外壳聚糖上含有的胺基碱性基团还可以适当地调节体内的化学平衡,可调节癌细胞周围的pH值,通过改变淋巴细胞的生理活性产生抗肿瘤增值的作用。而肿瘤细胞糖蛋白的糖链结构异常与肿瘤的发展也密切相关。沈力 [3] 等研究发现,壳聚糖可降低肺癌细胞株A549中的ppGalNAcT2和133GaLT7的mRNA的表达,抑制作用呈浓度依赖性,由此可表明,壳聚糖可影响肿瘤细胞的周期调控和增值的能力。另一方面壳聚糖可以通过化学改性形成的衍生物也表现出较好的抗肿瘤作用。例如何康等 [4] 进行硫酸壳聚糖体内抗肿瘤实验,发现硫酸壳聚糖高、低剂量组均可抑制小鼠体内移植性肿瘤S180肉瘤的生长,同时发现硫酸壳聚糖可延长艾氏腹水癌(EAC)小鼠的生存时间,且抗肿瘤的作用可能与调节免疫作用有关。
此外,壳聚糖能抑制血管内皮细胞生成,减少肿瘤组织血管生成,限制肿瘤生长,还可封闭血管内皮细胞黏附分子的黏附,从而限制肿瘤的生长与转移。
2.2. 降血压、降血脂、降血糖的特性
医学研究表明,血压的升高与食盐中的氯离子有关,与钠离子无关,而壳聚糖能中和体内氯离子和血液酸性物质并排除体外,可抑制血管紧张素转换酶的活性和减少血管紧张素II的形成,平稳降压 [5] 。
壳聚糖还能有效阻止消化系统吸收胆固醇和甘油三酯,防止胆固醇及脂肪酸在体内蓄积,促进这些物质从体内排出。而壳聚糖之所以能降脂和降胆固醇的机理包括:吸附作用、静电作用、包埋作用、调节脂肪酶活性,以及分子机制等 [6] 。通过一系列机理的变化起到了降脂和降胆固醇的作用。
壳聚糖还具有降血糖的作用,其作用机理为:一是壳聚糖在肠内为凝胶状,有极大的膨胀率,增加胃腹饱胀感,减少摄入食物量;增大肠液粘稠度,降低葡萄糖向肠壁的扩散速度;能在较高的葡萄糖浓度下吸附葡萄糖,降低其有效浓度;抑制α淀粉酶的催化活力,延长酶作用于淀粉的时间,减缓了葡萄糖的释放 [7] 。二是由胰岛素分泌不足而引起的糖尿病患者,其体液呈酸性,糖利用率降低,呈高血糖。壳聚糖的碱性可提高胰岛素利用率,pH每提高0.1,胰岛素敏感度上升30%,可以使pH调节到弱碱性,有利于糖尿病的防治 [8] 。三是壳聚糖具有调节内分泌系统的作用,能够促进胰岛β细胞恢复功能,通过双向调节,使胰岛素分泌量趋于正常,维持血糖正常代谢。陈建国等 [9] 对糖尿病小鼠的研究发现,壳聚糖能明显促进四氧嘧啶糖尿病小鼠症状的缓解,明显降低其空腹血糖、糖化血清蛋白和血糖曲线下面积,促进其体重恢复和降低肝体比、肾脏重和肾体比的作用,并以低剂量组效果最明显;高剂量壳聚糖还具有促进糖尿病小鼠血清胰岛素分泌的作用。
2.3. 抗菌作用的特性
壳聚糖及其衍生物具有较好的抗菌活性,能抑制一些细菌、真菌、以及病毒的生长繁殖 [10] 。壳聚糖的抑菌活性主要源于壳聚糖分子结构上的氨基,其可能的抗菌机理包括以下三个方面 [11] :一是壳聚糖具有多聚阳离子,带正电荷的壳聚糖易于与真菌、细菌和病毒细胞表面带负电荷的基团发生静电作用,从而改变细胞膜的流动性和通透性,阻断营养物质进入细胞而导致菌体死亡;或损坏细胞壁的完整性使细胞壁趋于溶解,导致胞内的蛋白质及其它细胞成分泄漏,促使细胞凋亡。李和平等 [12] 研究发现壳聚糖对真菌、细菌、酵母菌等微生物有不同程度的抑制作用,他们认为壳聚糖结构中的-NH2发生质子化作用转化为 ,使得壳聚糖带正电荷,因此能与细菌带负电荷的细胞膜作用,损害细胞膜基本功能,导致细胞质流失,从而造成细胞死亡。二是壳聚糖可渗入细菌的核中并和DNA结合,干扰DNA的复制与转录,抑制mRNA的合成,达到抗菌作用。朱旭明等 [13] 研究发现壳聚糖进入菌体后,既可以和DNA等核内物质结合,干扰遗传信息的复制和表达,也能与细胞器以及细胞质结合,通过干扰微生物细胞内的正常代谢,影响其生长繁殖,从而达到抗菌的作用。三是壳聚糖结合金属的能力很强,C2位上的-NH2是主要的作用位点。壳聚糖及其衍生物与金属离子螯合,抑制微生物对微量元素的摄取,并且与微生物生长所必需的营养物质结合,从而达到对微生物的抑制作用 [14] 。滕丽菊等 [15] 研究壳聚糖对大肠杆菌和金黄色葡萄球菌的作用机制,提出了壳聚糖可以与细菌所需的Mg2+相螯合,抑制其细菌内部酶活性,并且还可以与Ca2+结合,从而阻塞膜表面的离子通道,使细胞失活的假设。但当金属络合浓度达到饱和时,壳聚糖能够提供的作用就相对有限了。同时,有研究成果 [16] [17] [18] 说明壳聚糖与金属离子螯合,壳聚糖的抑菌效果是降低的。因此,关于壳聚糖的抗菌性与金属离子之间的关系还需进一步进行研究加以确定。
2.4. 抗凝血活性的特性
壳聚糖是自然界中唯一含有氨基的阳离子多糖,它能够吸引带负电荷的血小板和红细胞。由于氨基亲水性的原因,能够增加纤维蛋白原的吸附数量,从而可以增加血小板的聚集,激活凝血系统促进血栓形成 [19] 。研究还发现壳聚糖的止血作用不仅与血小板聚集有关,更与红细胞聚集有关。当血液与壳聚糖乙酸盐的生理盐水溶液混合时,红细胞发生聚集并变形,而在相对分子质量为1 × 105~1 × 106的范围内,低脱乙酰度的壳聚糖盐溶液中红细胞的异常聚集和变形更为显著 [20] 。红细胞膜的负电荷与壳聚糖的正电荷基团间的离子作用力可能就是壳聚糖止血活性的一个原因。因而,载正电荷的壳聚糖作为止血剂比甲壳素更为有效 [21] [22] [23] 。此外壳聚糖和甲壳素具有类似肝素的链结构,经磺化后其结构与肝素相似,具有抗凝血性,成为类肝素药物。壳聚糖的磺化酯抗凝活性与磺酸化程度有着密切关系,Yang Jianhong等 [24] 首次报告了以三甲基硅烷衍生物制备壳聚糖硫酸酯化衍生物,试验表明:活化部分凝血活酶时间(APTT),凝血酶时间(TT)均延长,但对凝血酶原时间(PT)没有影响。
3. 壳聚糖及其衍生物在医药领域的应用发展
3.1. 壳聚糖及其衍生物在医用材料上的应用
3.1.1. 医用敷料
壳聚糖具有较好的抑菌型、止血、生物相容性、表面活性、并可降解。利用壳聚糖制成的医用敷料,能够有效控制皮肤表层水蒸气的透过速率,以及伤口分泌物的排出,给病人冷爽之感以减轻其伤口疼痛,并可抵抗细菌的侵入;壳聚糖纤维具有极好的氧气通透性,并可通过体内酶自然降解,降解时产生的N-乙酰葡糖胺,极大地加快了伤口愈合速度 [25] 。
3.1.2. 硬组织修复材料
壳聚糖因其本身具有良好的生物降解性,抗菌性能,生物相容性,可塑性以及可修饰性,可形成多孔结构,适于细胞向内生长和骨传导。Chen等 [26] 设计了一种双层支架,一层为加入了转化生长因子β1质粒的壳聚糖–明胶支架用于修复软骨层,另一层为加入了骨形态发生蛋白2质粒的羟基磷灰石/壳聚糖–明胶支架用于软骨下骨的修复。
3.1.3. 抗凝血材料
相关研究 [27] [28] 表明,通过对壳聚糖进行化学改性(如烷基化、醚化、羧基化、硫酸/磺酸化)以及分子间作用力(如交联反应、自组装、接枝共聚)等方式,可使壳聚糖及其衍生物具备较强的抗凝血功能。高琦宽等 [29] 将壳聚糖硫酸酯接枝到经过活化的稀土元素钕,铕,镧和钪的纳米氧化物表面上制成杂化材料,抗凝血实验和复钙实验说明4种杂化材料比纳米稀土氧化物具有更好的抗凝血性。
3.2. 壳聚糖及其衍生物在抗肿瘤方面的应用
近年来的研究表明,对壳聚糖进行表面修饰,例如羧甲基化、硫酸化、乙酰化等可使改性后的壳聚糖的物理、化学性质均得到优化,在抑制肿瘤的生长和延长存活期方面起到了积极的作用。杨靖亚等 [30] 对羧甲基壳聚糖体外活性进行了研究,证明羧甲基壳聚糖可抑制肿瘤细胞的增值,抑制率约达27.9%~43.6%。另外许向阳等 [31] 制备了N-正辛基-N'-琥珀酰基壳聚糖,实验表明其对人肝癌细胞,人白血病细胞,人肺癌细胞和人胃癌细胞有较好的亲和性,并对这四种癌细胞有一定的抑制作用。
3.3. 壳聚糖及其衍生物在组织工程中的应用研究
3.3.1. 壳聚糖及其衍生物在骨组织工程中的应用
骨组织工程就是应用工程学和生命科学的原理和方法,将种子细胞与支架材料复合后进行培养,在体内形成具有生理功能的骨组织以替代或修复病变骨组织。天然生物高分子壳聚糖及其衍生物,由于具备独特的物理、化学性质,已成为骨组织工程中的热门支架材料之一,已有不少研究表明,壳聚糖与成骨细胞有很好的生物相容性,支持成骨细胞的黏附及增殖 [32] [33] ,但由于其机械强度较弱,且只能溶于酸性溶液,因此目前支架的研究主要着眼于复合其他材料的壳聚糖复合支架。Jiang等 [34] 采用冷冻干燥技术制得纳米羟基磷灰石/壳聚糖/羧甲基纤维素新型可降解复合支架,体外试验表明MG63及骨髓间充质干细胞种植于该支架后第7天时已铺满支架表面,生长状态良好。徐敬等 [35] 通过在软骨组织方面的研究,结果表明将壳聚糖与种子细胞进行共同体外培养可以获得正常形态的软骨细胞并能合成特异性的细胞外基质成分,在动物体内,壳聚糖支架与种子细胞所构建的组织工程软骨能够修复软骨损伤,形成与周围正常软骨相似的组织。
3.3.2. 壳聚糖及其衍生物在肝脏组织工程中的研究
壳聚糖与其他生物大分子的复合材料因其具有良好的柔韧性和强度,它可以与胶原蛋白、明胶、白蛋白结合以戊二醛为交联剂制备的材料作为细胞支架,促进肝细胞附着在骨架上。因此,壳聚糖与其他生物大分子的复合材料在肝组织工程中具有良好的应用前景。徐光翠等 [36] 通过给予大鼠壳聚糖后染毒镉,观察壳聚糖对镉致大鼠肝脏损伤的作用并探讨其机制,结果表明壳聚糖对镉致大鼠肝脏损伤有一定的拮抗作用。
3.3.3. 壳聚糖及其衍生物在皮肤组织工程中的研究
壳聚糖也具有潜在的使用在皮肤损伤或烧伤后的修复和再生。壳聚糖具有良好的弹性和透气性,能够防止水分和体液流失,能吸收创面渗出液,防止感染以及促进伤口愈合和抗菌的作用。壳聚糖与二氧化硅交联后,与L-929细胞共培养,24小时后无明显细胞毒性。此外,培养24和48小时后,支架材料表现出良好的促细胞粘附和增殖的能力,因此可以用于皮肤组织工程 [37] 。
4. 对壳聚糖及其衍生物的前景展望
壳聚糖及其衍生物是一类具有独特生物活性的高分子化合物,是近年来国内国际十分重视的来源广泛的新材料。由于壳聚糖及其衍生物的化学修饰方法不同,其分子质量大小也不同,故具有不同的作用和用途,对其研究的深度和广度还远远不能适应日益发展的医药事业。总之,随着科学技术的不断进步以及对壳聚糖及其衍生物研究的进一步深入,将有更多符合医药用标准的新型辅料得到广泛应用,进一步地推动医药的发展。
基金项目
湖北省教育厅科学研究计划项目(B2018111);湖北省省大学生创新创业项目(201810929061):十堰市科技局科学技术研究与开发项目(18K79和18Y01);湖北医药学院优秀中青年团队项目(2014CXZ01和2014QDJZR10)。
文章引用
柳岳超,王红梅,吴 最,曾小华. 壳聚糖及其衍生物在生物医药领域的应用研究进展
Research Progress of Chitosan and Its Derivatives in Biological Medicine[J]. 生物医学, 2019, 09(02): 89-95. https://doi.org/10.12677/HJBM.2019.92013
参考文献
- 1. 王晓霁, 杨靖亚, 刘建文. 壳聚糖衍生物在抗肿瘤方面的研究进展[J]. 中国临床药理学与治疗学, 2008, 13(8): 952-956.
- 2. 张爱英, 王学东, 程远征, 李明福. 壳聚糖及其衍生物抗肿瘤作用研究进展[J]. 现代生物医学进展, 2010, 10(5): 992-994.
- 3. 沈力, 闫石, 吴祁生, 吴士良. 壳聚糖对肝癌和肺癌细胞株糖基化作用的影响[J]. 江苏大学学报(医学版), 2008, 18(5): 400-402.
- 4. 何康, 冯有辉, 艾春媚. 硫酸壳聚糖体内抗肿瘤作用的实验研究[J]. 中国临床药理学与治疗学, 2008, 13(1): 103-106.
- 5. 本刊编辑部. 壳聚糖降血糖、降血脂、降血压的作用机理[J]. 中外健康文摘, 2008(24): 76.
- 6. 黎秋平, 王润莲, 张锐, 米雁, 王喜红. 壳聚糖的降脂作用及其机理研究进展[J]. 家禽科学, 2013(9): 45-49.
- 7. 吕朋, 李八方, 夏兰. 壳聚糖在医药保健中的应用[J]. 中国海洋药物, 2001, 20(5): 30-34.
- 8. 来水利, 韩武军, 王克玲, 袁丹. 壳聚糖及其衍生物用于降血糖的最新研究进展[J]. 食品工业科技, 2011, 32(2): 369-372.
- 9. 陈建国, 步文磊, 来伟旗, 等. 壳聚糖调节血糖及其作用机制的探讨[J]. 毒理学杂志, 2011(2): 96-99.
- 10. Atay, H.Y. and Çelik, E. (2016) Investigations of Antibacterial Activity of Chitosan in the Polymeric Composite Coatings. Progress in Organic Coatings, 102, 194-200. https://doi.org/10.1016/j.porgcoat.2016.10.013
- 11. 梁丽媚, 李思东, 李程鹏, 侯婷婷. 壳聚糖及其衍生物抗菌活性的研究进展[J]. 广州化工, 2017, 45(20): 6-9+15.
- 12. 李和平, 王月影, 高峰霞. 绿色抗菌剂——壳聚糖[J]. 畜牧与饲料科学, 2009, 30(6): 179-180.
- 13. 朱旭明, 郑铁生. 壳聚糖临床抗菌作用的研究进展[J]. 中国实用医药, 2007, 2(19): 80-81.
- 14. 叶磊, 何立千, 高天洲, 李丽云. 壳聚糖的抑菌作用及其稳定性研究[J]. 北京联合大学学报(自然科学版), 2004, 18(1): 79-82.
- 15. 滕丽菊, 张子勇, 唐书泽, 吴希阳. 壳聚糖的抗菌活性研究[J]. 中国调味品, 2008, 33(10): 48-51+55.
- 16. 韩永萍, 李可意, 杨宏伟, 林强. 壳聚糖的抗菌机理及其化学改性研究[J]. 化学世界, 2012, 53(4): 248-252.
- 17. 胡芳, 张惠君, 王亮, 佟淑敏. 壳聚糖的抗菌机理及其在抗菌纸中的应用[J]. 造纸科学与技术, 2013(5): 67-71.
- 18. Chung, Y.C., Yeh, J.Y. and Tsai, C.F. (2011) Antibacterial Characteristics and Activity of Water-Soluble Chitosan Derivatives Prepared by the Maillard Reaction. Molecules, 16, 8504-8514. https://doi.org/10.3390/molecules16108504
- 19. 倪天庆, 胡思源. 甲壳素及其衍生物壳聚糖的药理作用和临床应用研究进展[J]. 现代药物与临床, 2012, 27(3): 313-316.
- 20. Yang, J., Tian, F., Wang, Z., Wang, Q., Zeng, Y.-J. and Chen, S.-Q. (2010) Effect of Chitosan Molecular Weight and Deacetylation Degree on Hemostasis. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 84B, 131-137. https://doi.org/10.1002/jbm.b.30853
- 21. Edwards, J.V., Howley, P., Prevost, N., Condon, B., Arnold, J. and Diegelmann, R. (2009) Positively and Negatively Charged Ionic Modifications to Cellulose Assessed as Cotton-Based Protease-Lowering and Hemostatic Wound Agents. Cellulose, 16, 911-921. https://doi.org/10.1007/s10570-009-9302-4
- 22. Baldrick, P. (2010) The Safety of Chitosan as a Pharmaceutical Excipient. Regulatory Toxicology & Pharmacology, 56, 290-299. https://doi.org/10.1016/j.yrtph.2009.09.015
- 23. Kim, S.K. and Rajapakse, N. (2005) Enzymatic Production and Biological Activities of Chitosan Oligosaccharides (COS): A Review. Carbohydrate Polymers, 62, 357-368. https://doi.org/10.1016/j.carbpol.2005.08.012
- 24. Yang, J., Luo, K., Li, D., et al. (2013) Preparation, Characterization and in Vitro Anticoagulant Activity of Highly Sulfated Chitosan. International Journal of Biological Macromolecules, 52, 25-31. https://doi.org/10.1016/j.ijbiomac.2012.09.027
- 25. 孙晓婷, 郭亚. 壳聚糖的应用及发展[J]. 成都纺织高等专科学校学报, 2016, 33(2): 165-169.
- 26. Chen, J., Chen, H., Li, P., et al. (2011) Simultaneous Regeneration of Articular Cartilage and Subchondral Bone in Vivo Using MSCs Induced by a Spatially Controlled Gene Delivery System in Bilayered Integrated Scaffolds. Biomaterials, 32, 4793-4805. https://doi.org/10.1016/j.biomaterials.2011.03.041
- 27. Subhapradha, N., Ramasamy, P., Sudharsan, S., et al. (2013) Preparation of Phosphorylated Chitosan from Gladius of the Squid Sepioteuthis lessoniana (Lesson, 1830) and Its in Vitro Antioxidant Activity. Bioactive Carbohydrates & Dietary Fibre, 1, 148-155. https://doi.org/10.1016/j.bcdf.2013.03.001
- 28. Yang, J., Luo, K., Li, D., et al. (2013) Preparation, Characterization and in Vitro Anticoagulant Activity of Highly Sulfated Chitosan. International Journal of Biological Macromolecules, 52, 25-31. https://doi.org/10.1016/j.ijbiomac.2012.09.027
- 29. 高琦宽, 王坤杰, 王喜存. 纳米稀土氧化物/硫酸酯化壳聚糖杂化材料的制备及其抗凝血性能研究[J]. 化学学报, 2012, 70(2): 207-211.
- 30. 杨靖亚, 吴宏忠, 于有军, 刘建文. 羧甲基壳聚糖抗肿瘤及免疫增强活性研究[J]. 中国临床药理学与治疗学, 2007, 12(12): 1390-1394.
- 31. 许向阳, 周建平, 李玲, 卢是玥, 杨洁. N-正辛基-N'-琥珀酰基壳聚糖的制备及其对4种肿瘤细胞的亲和性[J]. 中国新药与临床杂志, 2007, 26(5): 355-359.
- 32. 季娟娟. 壳聚糖缓释膜的制备及其对成骨细胞的毒性研究[D]: [硕士学位论文]. 昆明: 昆明医科大学, 2007.
- 33. 金黎明, 魏长征, 田文杰, 赵小菁, 王雅玲, 范圣第. 壳寡糖及其衍生物对体外培养成骨细胞增殖的作用特点[J]. 中国组织工程研究与临床康复, 2008, 12(19): 3637-3640.
- 34. Jiang, L.-Y., Li, Y.-B. and Xiong, C.-D. (2009) Preparation and Biological Properties of a Novel Composite Scaffold of Nano-Hydroxyapatite/Chitosan/Carboxymethyl Cellulose for Bone Tissue Engineering. Journal of Biomedical Science, 16, 65. https://doi.org/10.1186/1423-0127-16-65
- 35. 徐敬, 赵建宁, 徐海栋, 张雷. 壳聚糖及其衍生物在软骨组织工程中的应用[J]. 中国组织工程研究, 2015, 13(25): 4081-4085.
- 36. 徐光翠, 赵英政, 高启禹, 韩光亮, 张合喜. 壳聚糖对镉致大鼠肝脏线粒体氧化损伤的拮抗作用[J]. 工业卫生与职业病, 2012, 38(5): 273-276..
- 37. Gobin, A.S., Butler, C.E. and Mathur, A.B. (2006) Repair and Regeneration of the Abdominal Wall Musculofascial Defect Using Silk Fibroin-Chitosan Blend. Tissue Engineering, 12, 3383-3394. https://doi.org/10.1089/ten.2006.12.3383
NOTES
*通讯作者。