Hans Journal of Chemical Engineering and Technology
Vol.
13
No.
02
(
2023
), Article ID:
63017
,
10
pages
10.12677/HJCET.2023.132014
间苯二酚杯[4]芳烃六聚体催化缩醛水解和 不对称转移氢化反应
孙梦,石艳慧,周新民,贾爱铨,张千峰*
安徽工业大学分子工程与应用化学研究所,安徽 马鞍山
收稿日期:2023年2月10日;录用日期:2023年3月17日;发布日期:2023年3月24日

摘要
本文合成了C-正丙基间苯二酚杯[4]芳烃、C-异丁基间苯二酚杯[4]芳烃、C-壬基间苯二酚杯[4]芳烃和C-癸烯基间苯二酚杯[4]芳烃四种原料,并在氯仿的水饱和溶液中制备相应的六聚体溶液,探究了其在缩醛水解和不对称转移氢化反应中的催化效果。结果表明,在间苯二酚杯[4]芳烃六聚体溶液的催化作用下,缩醛水解转化率在90%左右,不对称转移氢化反应转化率在70%左右,对映选择性在80%左右;六聚体为催化反应提供了合适的反应空腔,使反应发生在胶囊内部,打破了传统催化剂的局限性。由此可见,间苯二酚杯[4]芳烃六聚体在有机催化方面具有非常好的应用前景。
关键词
间苯二酚杯[4]芳烃,分子胶囊,催化作用,缩醛水解,不对称转移氢化反应

Catalytic Acetal Hydrolysis and Asymmetric Transfer Hydrogenation Reaction of Resorcinolcalix[4]arene Hexamer
Meng Sun, Yanhui Shi, Xinmin Zhou, Aiquan Jia, Qianfeng Zhang*
Institute of Molecular Engineering and Applied Chemistry, Anhui University of Technology, Ma’anshan Anhui
Received: Feb. 10th, 2023; accepted: Mar. 17th, 2023; published: Mar. 24th, 2023

ABSTRACT
In this paper, four raw materials, C-n-propyl resorcinolcalix[4]arene, C-iso-butyl resorcinolcalix[4]arene, C-n-nonyl resorcinolcalix[4]arene and C-decenresorcinolcalix[4]arene, were synthesized. The corresponding hexamer solutions were formed in the water-saturated solution of chloroform, and their catalytic effects were explored in acetal hydrolysis and asymmetric transfer hydrogenation reaction. The results show that, under the catalysis of resorcinolcalix[4]arene hexamer solution, the conversion rate of acetal hydrolysis reaction can reach about 90%, the conversion rate of asymmetric transfer hydrogenation is about 70%, and the enantioselectivity is about 80%. The hexamer provides a suitable reaction cavity for catalytic reactions which makes the reactions take place in the capsules and breaks the limitations of traditional catalysts. In conclusion, resorcinolcalix[4]arene hexamer has a very good application prospect in organic catalysis.
Keywords:Resorcinolcalix[4]arene, Molecular Capsules, Catalysis, Acetal Hydrolysis, Asymmetric Transfer Hydrogenation Reaction

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
作为继冠醚、环糊精之后的新一代超分子主体大环化合物,杯芳烃是一类引人注目的化合物,它不仅能与离子形成包合物 [1],也能与中性小分子形成包合物 [2]。杯芳烃独特的受体性质引起广大科研工作者的广泛关注,并对此进行了深入的研究。大环化合物杯芳烃,是苯酚单元中酚羟基的邻位通过亚甲基桥或硫桥连而成的一类环状低聚物,拥有富电子的环状疏水空腔,可对多种客体分子表现出有效的范德华力范围内键合作用。尤其是杯口上端的羟基容易形成分子间或者分子内的氢键作用,自组装连接自身或其他基团,形成超分子聚集体 [3]。研究表明,间苯二酚杯[4]芳烃六聚体可以作为一种相当强的布朗斯特酸(pKa约为5.5~6.0) [4]。所以,间苯二酚杯[4]芳烃六聚体的桥接水分子的供氢键能力是很强的,而且通过在超分子宿主系统中封装,可以实现对分子局部化学环境的控制。在超分子催化中,这种控制方法比传统的均相催化在载体溶液中具有优势。其中,两个主要的优点涉及在底物和产物选择性方面的影响反应 [5]。由于尺寸或形状识别,可以实现底物选择性转换。此外,与宿主环境的非共价相互作用有助于替代反应途径,并能产生不寻常的产物,可以催化很多有机反应 [6] [7] [8] [9],它提供了在常规的溶液实验中没有观察到的底物和产物选择性的潜力。尽管这些领域得到了大量的研究和关注,但将这些催化模式与超分子组装结合起来的例子非常有限,尤其在不对称催化方面,其存在非常大的挑战。本文探究了间苯二酚杯[4]芳烃六聚体对缩醛水解和不对称转移氢化反应的催化作用,并探究了六聚体空腔对该反应的催化作用。尤其是脯氨酸的不对称催化反应,进一步拓展了间苯二酚杯[4]芳烃六聚体在不对称催化领域的适用性。
2. 实验部分
2.1. 仪器与试剂
95%乙醇、无水甲醇、三氯甲烷等均为分析纯,购于上海化学试剂厂;间苯二酚、浓盐酸(含量36%~37%)、异戊醛、丁醛、癸醛、十一碳烯醛、乙缩醛、丙醛二乙基乙缩醛、3-氯丙醛二乙醇缩醛、丙烯醛缩二乙醇、氨基乙醛缩二乙醇均为分析纯,购于安耐吉平台安徽泽升科技有限公司;乙酰乙酸乙酯、乙酸铵、β-环柠檬醛、3-甲基-2-环戊烯-1-酮、3-甲基-2-环己烯-1-酮、L-脯氨酸、多聚甲醛均为分析纯,购于探索平台萨恩化学技术有限公司。UltraShield 400型核磁共振谱仪(NMR),德国Bruker公司;GC-2010 Plus气相色谱仪(GC),日本岛津公司;LC-2030 Plus高效液相色谱仪(HPLC),日本岛津公司。
2.2. 实验方法
2.2.1. 间苯二酚杯[4]芳烃原料的合成
关于间苯二酚杯[4]芳烃原料的合成,均在在无氧条件下按照参考文献 [10] [11] 制备。图1为间苯二酚杯[4]芳烃原料的合成路线。
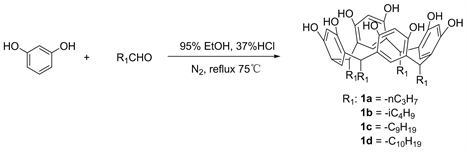
Figure 1. Synthesis of resorcinolcalix[4]arenes 1a~1d
图1. 间苯二酚杯[4]芳烃1a~1d的合成
2.2.2. 2,6-二甲基-1,4-二氢-3,5-吡啶二羧酸二乙酯(4)的合成
图2为2,6-二甲基-1,4-二氢-3,5-吡啶二羧酸二乙酯(4)的合成路线 [12]。
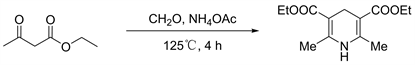
Figure 2. Synthesis of 2,6-dimethyl-1,4-dihydro-3,5-pyridinedicarboxylate (4)
图2. 2,6-二甲基-1,4-二氢-3,5-吡啶二羧酸二乙酯(4)的合成
2.2.3. 间苯二酚杯[4]芳烃六聚体催化缩醛水解
向25 mL CHCl3中加入1.5 mL蒸馏水,混合后彻底摇匀,静置直到两相完全分离。有机CHCl3相清晰可见,得到了氯仿的水饱和溶液。用该氯仿溶液配制杯芳烃浓度为3.3 mM的六聚体溶液 [12] (Ia (1a(H2O)8)、Ib (1b(H2O)8)、Ic (1c(H2O)8)和Id (1d(H2O)8))作为催化剂,六聚体胶囊结构见图3。
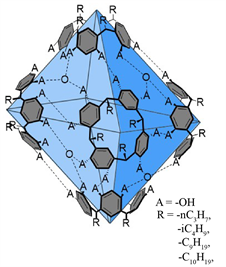
Figure 3. Structure diagram of hexamer capsule
图3. 六聚体胶囊结构图
以丙醛二乙基乙缩醛(2b)的水解作为缩醛水解(图4)的模板反应:Ib (3.3 mM, 5 mL)的溶液中加入20 μL的丙醛二乙基乙缩醛,密封后40℃水浴搅拌反应2 h。用气相色谱仪监测反应前后物质的变化情况,采用面积归一化法定量,柱箱温度为50℃。

Figure 4. Acetal hydrolysis reaction catalyzed by resorcinolcalix[4]arene hexamer
图4. 间苯二酚[4]芳烃六聚体催化的缩醛水解反应
2.2.4. 缩醛水解催化条件的优化
缩醛是由一分子醛与两分子醇缩合的产物,缩醛在碱性条件下稳定,但在弱酸性和温热的条件下易水解为原来的醛和醇,在缩醛的水解中通常使用难以分离与回收稀硫酸。本论文以间苯二酚杯[4]芳烃六聚体(Ia~d)为催化剂,相对于传统的酸试剂绿色环保无污染,更符合绿色化学的原则。所以我们选择以丙醛二乙基乙缩醛(2b)的水解作为模板反应:2b (20 μL, 33 mmol),催化剂5 mL,水浴密封搅拌2 h。分别通过控制催化剂种类(Ia、Ib、Ic和Id (5 mL, 3.3 mmol)),杯芳烃浓度(5%、10%、20%、30%和40%),反应温度(室温,30℃、40℃和50℃)来探究最佳反应条件,反应前后用气相色谱监测反应情况,采用定量方法为面积归一化法,柱箱温度为50℃。
在最佳反应条件下,探究了不同底物的缩醛水解转化率:分别选取2a、2b、2c、2d和2e五种底物(33 mmol)在最优催化浓度的最佳催化剂(5 mL)催化下,最佳反应温度水浴密封反应2 h。反应前后用气相色谱监测反应情况,采用定量方法为面积归一化法,柱箱温度为50℃。
2.2.5. 间苯二酚杯[4]芳烃六聚体催化α,β-不饱和醛、酮的不对称转移氢化反应
关于该反应的可能机理见图5:亚胺与六聚体胶囊优先结合,季铵盐由于离子–离子和阳离子-π相互作用,稳定在胶囊内,亲核试剂更易从阻碍较小的一边进攻,优先传递s-对映体 [13]。

Figure 5. Mechanism of asymmetric transfer hydrogenation reaction catalyzed by resorcinolcalix[4]arene hexamer
图5. 间苯二酚[4]芳烃六聚体催化的不对称转移氢化反应机理
通过文献 [14] 筛选反应条件为较为温和的温度30℃,较高的六聚体催化剂的量为30 mol%,目的为了保证脯氨酸(20 mol%)及其中间产物亚胺类物质的完全包封,化合物4为1.5倍过量。用气相色谱仪监测反应前后物质的变化情况,采用定量方法为面积归一化法,柱箱温度为50℃;为了直观地比较反应结果,我们做了空白对照实验。
在上述条件下,探究了不同底物的不对称转移氢化反应(图6):称取1d (94 mg, 0.080 mmol),用4 mL水饱和的CHCl3溶液在40℃水浴中搅拌10 min,加入脯氨酸(1.3 mg, 0.010 mmol),4 (108 mg, 0.41 mmol),分别加入3a、3b和3c (0.27 mmol),30℃水浴72 h。用气相色谱仪监测反应前后物质的变化情况,采用面积归一化法定量,柱箱温度为50℃;用液相色谱仪手性色谱柱测的对映异构体过量(ee值),采用定量方法为面积归一化法,异丙醇为流动相,柱箱温度为40℃,流动相速度:0.8 mL/min。

Figure 6. Asymmetric transfer hydrogenation reaction catalyzed by resorcinolcalix[4]arene hexamer
图6. 间苯二酚[4]芳烃六聚体催化的不对称转移氢化反应
2.2.6. 间苯二酚杯[4]芳烃六聚体空腔的作用探究
在最佳条件下,对缩醛水解反应进行催化控制探究,因六聚体对烷基铵盐有较高的结合力,所以选择体积较大的四烷基溴化铵为催化抑制剂。反应底物为2b (20 μL, 33 mmol),最优催化浓度的最佳催化剂(5 mL),四丁基溴化铵(0.013 g, 0.04 mmol),最佳反应温度下水浴密封搅2 h。反应前后用气相色谱监测反应情况,采用定量方法为面积归一化法,柱箱温度为50℃;用2b峰面积的变化计算转化率。
以β-环柠檬醛(3a)的反应为模板反应,加入四丁基溴化铵(0.013 g, 0.04 mmol)。反应前后用气相色谱监测反应情况,采用定量方法为面积归一化法,柱箱温度为50℃。
2.2.7. 间苯二酚杯[4]芳烃六聚体的稳定性测试
用氘代试剂配制1天的六聚体溶液,每隔48 h通过核磁进行分析。
配制10%的间苯二酚杯[4]芳烃六聚体溶液,每隔48 h取样进行乙缩醛水解的催化反应,用气相色谱仪监测反应前后物质的变化情况。
3. 结果与讨论
3.1. 间苯二酚杯[4]芳烃六聚体催化缩醛水解
2b保留时间为1.165 min,产物为一分子丙醛与两分子乙醇,我们用标准样品乙醇作为对照测得保留时间为0.469 min,丙醛为0.482 min,与谱图中的峰的位置一致。反应后测的产物丙醛和乙醇,这二者的峰非常接近融合为一个宽峰,产物的峰变化较为复杂,所以用原料2b峰面积的变化计算转化率。为了明确六聚体催化剂的作用,我们做了空白实验以此对照,表1中Group 1为空白对照组,由对比可知在不加入六聚体催化剂的情况下,2b因处于相对中性的环境中是几乎不发生水解反应的,以此说明间苯二酚六聚体在此反应中是不可缺少的酸性试剂。通过比较不同的六聚体溶液对2b的转化率,发现Id存在下,2b的转化率为97%,该催化剂催化效果最为理想。该催化剂的母体1d的支链癸烯基在这四种间苯二酚杯[4]芳烃是最长的,因此,形成的富电子疏水空腔最大,能最好地包裹反应物,提供足够的内部反应空间;而Ia和Ic由于其原料反应的差异性,在水饱和的氯仿中溶解度较差,催化效果也较差。因此,选用Id作为最佳催化剂溶液参与后续反应。
Table 1. Optimization of catalytic reaction conditions of acetal hydrolysisa
表1. 缩醛水解催化条件的优化a
a:所有反应均在40℃下,以5 mL氯仿为溶剂反应2小时;b:底物的物质的量均为33 mmol。
在表1中,条目5~9改变了催化剂Id的浓度,通过比较转化率可得:当1d的浓度为5%时,催化效果很差,转化率仅为14%,在1d的浓度为10%及以上时,在误差允许范围内2b的转化率都在90%以上,基本说明六聚体催化剂在10%就足够完全地包裹反应底物并提供足够的酸性环境,因此选择杯芳烃含量10%的六聚体溶液作为本反应的最佳催化剂浓度;在探究最佳反应温度时,每一组温度都做了空白对照实验以排除温度来的影响。条目9~16中通过转化率比较可得:室温下反应结果较差,2b的转化率仅为9%,随着温度的升高,催化效率也逐渐增大,在40℃时为97%,反应结果最好,后随着温度的上升,转化率开始下降。由此可见,40℃时催化效果最好且条件十分温和,因此最佳温度选择为40℃;不同底物缩醛的水解反应从条目17~20中结合条目52b的反应情况看,催化取代基为烃基类的效率较高,都在90%及以上,2c和2d的氯取代基和乙烯基为吸电子基,水解效率较高;2e的氨基取代基为给电子基,可能导致缩醛水解较难发生,水解转化率仅为8%。
3.2. 不同底物的不对称转移氢化反应
表2中展示了反应转化率和产物对映选择性,5a的保留时间为1.369 min,测得物质产率为62%;5b的保留时间为4.047 min,测得物质产率为64%;5c的保留时间为0.901 min,测得物质产率为73%;5a的ee值为77.73%,5b的ee值为77.11%,5c的ee值为88.28%。化合物4为供氢亲核试剂,L-脯氨酸在常规溶液中一般不能提供高的对映体选择性,在此次反应中,只有结合胶囊催化剂,才能观察到这些高选择性。六聚体胶囊催化剂对底物3c的催化效果较好,对映体选择性达到88.28%。对于催化反应产率和对映异构体的选择性都不高的原因,最有可能的原因是底物缺少促进π-π与胶囊壁相互作用的芳香部分。
Table 2. Asymmetric transfer hydrogenation reaction of different substratesa
表2. 不同底物的不对称转移氢化反应a
a:反应均在0.41 mmol 4存在下,在30℃氯仿中反应72小时,该反应的催化剂为L-脯氨酸(0.010 mmol)和Id (30%);b:反应底物均为0.08 mmol。
3.3. 间苯二酚杯[4]芳烃六聚体空腔的作用
Bergman小组 [15] 报告了在超分子容器内的亚胺离子的稳定性,但没有相应的转化发生。Gilmour团队 [16] 证实了分子内阳离子-π相互作用在催化中起着重要作用。本实验通过间苯二酚杯[4]芳烃六聚体胶囊稳定分子间阳离子、封装反应底物,以实现产物对映异构体的选择性。由S26和S34可得,在四丁基溴化铵存在在该反应体系中时,缩醛几乎不发生水解。因为间苯二酚杯[4]芳烃六聚体与烷基铵盐有很高的亲和力,极易封装烷基铵盐,通过加入四丁基溴化铵,铵盐先占据六聚体的空腔,使其无法包裹反应底物,无法发生水解。因此,通过该催化抑制反应可以表明催化反应发生在六聚体胶囊的内部。而且间苯二酚杯芳烃六聚体提供的酸性条件和内部空腔都起着非常重要的作用;而在四丁基溴化铵参与反应体系时,没有新的峰出现,即该反应几乎不进行。因为间苯二酚杯[4]芳烃六聚体与烷基铵盐有很高的亲和力,极易封装烷基铵盐。因此,通过该催化抑制反应可以表明催化反应发生在六聚体胶囊的内部。反应物与手性L-脯氨酸形成亚胺阳离子中间体,通过阳离子-π作用与六聚体空腔壁结合,在空腔内完成反应,最后水解,释放出催化剂与产物,完成催化循环。
3.4. 间苯二酚杯[4]芳烃六聚体的稳定性测试
该六聚体溶液配置后的8天内氢谱均无较大变化;催化效果如表3所示,八天内乙缩醛的水解程度都维持在88%~90%之间,且均在误差允许范围内。由此可见,杯芳烃的六聚体溶液的稳定性较好,保存时只需常温放置即可。
Table 3. Effect of catalyst standing time on acetal hydrolysisa
表3. 催化剂静置时长对缩醛水解的影响a
a:反应均为2a (33 mmol)在40℃氯仿(5 mL)下反应5 mL,该反应的催化剂为Id (10%)。
4. 结论
本论文用合成的四种杯芳烃原料(C-正丙基间苯二酚杯[4]芳烃(1a)、C-异丁基间苯二酚杯[4]芳烃(1b)、C-壬基间苯二酚杯[4]芳烃(1c)和C-癸烯基间苯二酚杯[4]芳烃(1d))制备了相应的六聚体催化溶液(Ia~d),催化了缩醛水解反应和不对称转移氢化反应并优化了反应条件。其中,缩醛水解以C-癸烯基间苯二酚杯[4]芳烃的六聚体溶液(Id)为催化剂,催化剂的量为10 mol%,在40℃水浴条件下搅拌2 h,转化率高达97%;不对称转移氢化反应以Id (30 mol%)和L-脯氨酸(20 mol%)为催化剂,α,β-不饱和醛、酮(3a、3b、3c)为底物,汉斯酯为供氢还原剂,获得了70%及以上的产率和88.28%的对映选择性,从催化剂抑制反应结果来看,六聚体胶囊不仅为缩醛水解反应提供酸性环境,还为这两个反应提供了合适的纳米反应空腔。六聚体胶囊内进行的缩醛水解表现出良好的反应性,这在常规溶液中是无法实现的。
此外,我们证明了不对称转移氢化反应可以在六聚体胶囊内进行,由于阳离子-π的相互作用,活性的亚胺离子被有效地包裹,并且必须在受限的环境中进行反应,这导致对映体选择性的增加。间苯二酚杯[4]芳烃六聚体胶囊被发现可作为有机反应的催化剂以来,打破了传统催化剂的局限性,使反应发生在胶囊内部,提供了反应所需的酸性环境和合适的反应空腔。但是关于胶囊催化在底物的适用性范围、催化反应的类型、胶囊种类的稀缺等方面还有很大的挑战性。本论文成功地运用间苯二酚杯[4]芳烃六聚体胶囊催化缩醛水解和不对称转移氢化反应,拓展了间苯二酚杯[4]芳烃六聚体催化的适用性和六聚体胶囊在不对称催化合成中的潜在应用。
基金项目
国家自然科学基金(No. 90922008)资助项目。
文章引用
孙 梦,石艳慧,周新民,贾爱铨,张千峰. 间苯二酚杯[4]芳烃六聚体催化缩醛水解和不对称转移氢化反应
Catalytic Acetal Hydrolysis and Asymmetric Transfer Hydrogenation Reaction of Resorcinolcalix[4]arene Hexamer[J]. 化学工程与技术, 2023, 13(02): 120-129. https://doi.org/10.12677/HJCET.2023.132014
参考文献
- 1. Twum, K., Rautiainen, J.M., Yu, S.Y., Truong, K.K.N., Feder, J., Rissanen, K., Puttreddy, R. and Beyeh, N.K. (2020) Host-Guest Interactions of Sodium Sulfonate Methylene Resorcinarene and Quaternary Ammonium Halides: An Experimental-Computational Analysis of the Guest Inclusion Properties. Crystal Growth & Design, 20, 2367-2376. https://doi.org/10.1021/acs.cgd.9b01540
- 2. Fujisawa, I., Kitamura, Y., Kato, R., Murayama, K. and Aoki, K. (2014) Crystal Structures of Resorcinarene and Pyrogallolarene Complexes with DL-Pipecolinic Acid. Model Compounds for the Recognition of Thepipecolinyl Ring, a key Fragment of FK506, through C-H∙∙∙π Interac-tion. Journal of Molecular Structure, 1056, 292-298. https://doi.org/10.1016/j.molstruc.2013.10.026
- 3. Kane, C.M., Banisafar, A., Dougherty, T.P., Barbour, L. and Holman, K.T. (2016) Enclathration and Confinement of Small Gases by the Intrinsically 0D Porous Molecular Solid, Me, H, SiMe2. Journal of the American Chemical Society, 138, 4377-4392. https://doi.org/10.1021/jacs.5b11395
- 4. Zhang, Q. and Tiefenbacher, K. (2013) Hexameric Resorcinarene Capsule Is a Brønsted Acid: Investigation and Application to Synthesis and Catalysis. Journal of the American Chemical Society, 135, 16213-16219. https://doi.org/10.1021/ja4080375
- 5. Richers, J., Heilmann, M., Drees, M. and Tiefenbacher, K. (2016) Synthesis of Lactonesvia C-H Functionalization of Nonactivated C(sp3)-H Bonds. Organic Letters, 18, 6472-6475. https://doi.org/10.1021/acs.orglett.6b03371
- 6. Caneva, T., Sperni, L., Strukul, G. and Scarso, A. (2016) Efficient Epoxide Isomerization within a Self-Assembled Hexameric Organic Capsule. RSC Advances, 6, 83505-83523. https://doi.org/10.1039/C6RA20271C
- 7. Catti, L., Pothig, A. and Tiefenbacher, K. (2017) Host-Catalyzed Cyclodehydration-Rearrangement Cascade Reaction of Unsaturated Tertiary Alcohols. Advanced Synthesis & Catalysis, 359, 1331-1338. https://doi.org/10.1002/adsc.201601363
- 8. Zhang, Q. and Tiefenbacher, K. (2015) Terpene Cyclization Catalysed inside a Self-Assembled Cavity. Nature Chemistry, 7, 197-202. https://doi.org/10.1038/nchem.2181
- 9. Catti, L., Pleiss, J. and Tiefenbacher, K. (2017) Terpene Cycliza-tions inside a Supramolecular Catalyst: Leaving-Group-Controlled Product Selectivity and Mechanistic Studies. Journal of the American Chemical Society, 139, 11482-11492. https://doi.org/10.1021/jacs.7b04480
- 10. Tunstad, L.M., Tucker, J.A., Dalcanale, E., Weiser, J., Bryant, J.A., Sherman, J.C., Helgeson, R.C., Knobler, C.B. and Cram, D.J. (1989) Host-Guest Complexation. 48. Octol Building Blocks for Cavitands and Carcerands. The Journal of Organic Chemistry, 54, 1305-1312. https://doi.org/10.1021/jo00267a015
- 11. Tanaka, Y., Miyachi, M. and Kobuke, Y. (1999) Selective Vesicle Formation from Calixarenes by Self-Assembly. Angewandte Chemie International Edition, 38, 504-506. https://doi.org/10.1002/(SICI)1521-3773(19990215)38:4<504::AID-ANIE504>3.0.CO;2-N
- 12. Brauer, T.M., Zhang, Q. and Tiefenbacher, K. (2016) Iminium Catalysis inside a Self-Assembled Supramolecular Capsule: Modu-lation of Enantiomeric Excess. Angewandte Chemie International Edition, 55, 7698-7701. https://doi.org/10.1002/anie.201602382
- 13. Pollok, C.H., Zhang, Q., Tiefenbacher, K. and Merten, C. (2017) Chirality Induction from a Chiral Guest to the Hydrogen-Bonding Network of Its Hexameric Resorcinarene Host Capsule. ChemPhysChem, 18, 1987-1991. https://doi.org/10.1002/cphc.201700610
- 14. Sokolova, D. and Tiefenbacher, K. (2021) Optimized Imini-um-Catalysed 1,4-Reductions inside the Resorcinarene Capsule: Achieving > 90% ee with Proline as Catalyst. RSC Advances, 11, 24607-24623. https://doi.org/10.1039/D1RA04333A
- 15. Dong, V.M., Fiedler, D., Carl, B., Bergman, R.G. and Raymond, K.N. (2006) Molecular Recognition and Stabilization of Iminium Ions in Water. Journal of the American Chemical Society, 128, 14464-14465. https://doi.org/10.1021/ja0657915
- 16. Holland, M.C., Metternich, J.B., Muck-Lichtenfelda, C. and Gilmour, R. (2015) Cation-π Interactions in Iminium Ion Activation: Correlating Quadrupole Moment & Enantioselectivity. Chemical Communications, 51, 5322-5325. https://doi.org/10.1039/C4CC08520E
附录
间苯二酚杯[4]芳烃原料(1a~1d)的合成:在氮气保护下,向二口圆底烧瓶中加入间苯二酚(5.2 g, 46 mmol),35 mL 95%乙醇和8.8 mL 37%浓盐酸,在冰水浴条件下分三次(间隔10 min左右)加入相应的醛(46 mmol),溶液呈黄色透明状,继续在冰浴条件下搅拌30 min,撤去冰浴1 h后恢复至室温,搅拌30 min后在75℃下回流6 h左右。反应过程中有少量沉淀生成,反应结束后缓慢降至室温,加蒸馏水,使沉淀完全。减压过滤,用体积比为1:1的冷甲醇水溶液洗涤数次,沉淀在甲醇中重结晶,真空干燥。产物为白色或淡黄色粉末,产率为89%~95%。
1a:C-丙基间苯二酚杯[4]芳烃:白色粉末11 g,产率89%。1H NMR (DMSO-d6, 400 MHz) δ: 0.76 (t, J = 7.55 Hz, 12H, CH2CH3), 1.03~1.07 (m, 8H, CH2CH3), 1.91~1.96 (m, 8H, CH2CH2CH3), 4.09 (t, J = 7.61 Hz, 4H, bridge CH), 6.01 (s, 4H, Ar-H, ortho to OH), 7.10 (s, 4H, Ar-H, meta to OH), 8.81 (s, 8H, OH); Anal. calcd for C40H48O8: C 73.15, H 7.37; found C 73.13, H 7.35.
1b:C-异丁基间苯二酚杯[4]芳烃:白色粉末11 g,产率91%。1H NMR (DMSO-d6, 400 MHz) δ: 0.88 (d, J = 6.51 Hz, 24H, CH(CH3)2), 1.30~1.33 (m, 4H, CH(CH3)2), 1.89 (t, J = 6.83 Hz, 8H, CH2CH(CH3)2), 4.38 (t, J = 7.74 Hz, 4H, bridge CH), 6.16 (s, 4H, Ar-H, ortho to OH), 7.13 (s, 4H, Ar-H, meta to OH), 8.91 (s, 8H, OH); Anal. calcd for C44H56O8: C 73.15, H 7.37; found C 73.13, H 7.35.
1c:C-壬基间苯二酚杯[4]芳烃:淡黄色粉末11 g,产率94%。1H NMR (DMSO-d6, 400 MHz) δ: 0.84 (t, J = 5.88 Hz, 12H, CH3), 1.15~1.21 (m, 56H, (CH2)7CH3), 1.94~1.96 (m, 8H, CH2(CH2)7CH3), 4.21 (t, J = 5.86 Hz, 4H, bridge CH), 6.13 (s, 4H, Ar-H, ortho to OH), 7.07 (s, 4H, Ar-H, meta to OH), 8.85 (s, 8H, OH); Anal. calcd for C64H96O8: C 77.38, H 9.74; found C 77.35, H 9.72.
1d:C-癸烯基间苯二酚杯[4]芳烃:淡黄色粉末11 g,产率95%。1H NMR (DMSO-d6, 400 MHz) δ: 1.03~1.16 (m, 56H, CH2(CH2)7CHCH2), 1.85~1.87 (m, 8H, CH2(CH2)7CHCH2), 4.10 (t, J = 6.83 Hz, 4H, bridge CH), 4.78~4.82 (m, 8H, CH=CH2), 5.61~5.67 (m, 4H, CH=CH2), 6.03 (s, 4H, Ar-H, ortho to OH), 6.97 (s, 4H, Ar-H, meta to OH), 8.76 (s, 8H, OH); Anal. calcd for C68H96O8: C 78.42, H 9.29; found C 78.39, H 9.27.
2,6-二甲基-1,4-二氢-3,5-吡啶二羧酸二乙酯(4)的合成:将乙酰乙酸酯(3.2 g, 25 mmol)、多聚甲醛(400 mg, 12 mmol)和乙酸铵(1.9 mg, 25 mmol)置于烧瓶中。将混合物放入125℃预热的油浴中搅拌4 h,冷却后形成黄色固体。混合物经过过滤,残渣用水冲洗。粗产物经甲醇重结晶纯化得到黄色固体4 (2.6 g, 82%)。1H NMR (CDCl3, 400 MHz) δ: 1.27 (t, J = 7.66 Hz, 6H, CH2CH3), 2.18 (s, 6H, CH3), 3.25 (s, 2H, CH2), 4.15 (t, J = 7.66 Hz, 4H, CH2CH3), 5.09 (s, 1H, NH).
化合物1a~1d和4的1H NMR,缩醛水解和不对称转移氢化反应前后的气相、手性高效液相图谱详见辅助材料(Supporting Information)。
NOTES
*通讯作者。
