Hans Journal of Agricultural Sciences
Vol.
10
No.
01
(
2020
), Article ID:
33916
,
9
pages
10.12677/HJAS.2020.101008
Spraying Glycinebetaine Enhances Photosynthesis against Drought Stress in Apple Plants
Guiping Wang*, Jinzheng Wang, Xiaomin Xue, Chao Lu, Ru Chen
Shandong Institute of Pomology, Tai’an Shandong

Received: Dec. 24th, 2019; accepted: Jan. 6th, 2020; published: Jan. 13th, 2020

ABSTRACT
In this study, One-year-old “Fuji” apple trees were used to study the effects of spraying glycinebetaine (GB) on the photosynthetic characteristic of apple under drought stress. The chlorophyll contents of the apple leaves, net photosynthesis rate, stomatal conductance, chlorophyll a fluorescence parameters and antioxidant system etc. were measured. The results indicated that under drought stress, the chlorophyll content of apple leaves pre-treated with GB was significantly higher than that of the control. GB pre-treated improved the stomatal conductance of apple leaves, at the same time, it was also found that the application of GB on the leaves could reduce the accumulation of active oxygen, improve the activity of antioxidant enzymes and maintain the function of PSII. The photosynthetic characteristics of GB pre-treated plants and those of the control plants showed were significant different (p < 0.05). GB pre-treated plants had higher photosynthetic capacity and showed better resistance to drought stress. The increase of these resistances is related to the increase of antioxidant enzyme activity and the protective function of GB.
Keywords:Fuji, Glycinebetaine, Drought Stress, Photosysnthesis, Chlorophyll Fluorescence Parameters, Active Oxygen

叶面喷施甜菜碱提高了苹果叶片光合作用 对干旱胁迫的抗性
王贵平*,王金政,薛晓敏,路超,陈汝
山东省果树研究所,山东 泰安

收稿日期:2019年12月24日;录用日期:2020年1月6日;发布日期:2020年1月13日

摘 要
本实验以一年生富士/平邑甜茶为实验材料,研究了叶面喷施甜菜碱对干旱胁迫条件下富士苹果叶片光合特性的影响,测定了叶片叶绿素含量、净光合速率、气孔导度、叶绿素a荧光参数及抗氧化系统等指标。结果表明,干旱胁迫下,叶面喷施甜菜碱预处理苹果叶片叶绿素含量明显高于对照,甜菜碱预处理提高了苹果叶片的气孔导度,同时还发现,叶面喷施甜茶碱能减轻活性氧的积累,提高抗氧化酶活性,维持PSII功能,甜菜碱预处理植株的光合特性与其对照植株的光合特性表现出显著差异(p < 0.05),甜菜碱预处理植株具有更高的光合能力,对干旱胁迫表现出更好的抗性。这些抗性的提高与抗氧化酶活性的提高有关,与甜菜碱的保护功能有关。
关键词 :富士,甜菜碱,干旱胁迫,光合,荧光,活性氧

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在我国北方地区,大陆性季风气候特征明显,尤其是丘陵山地,降水量少,无灌溉条件,果园旱害时有发生,据统计,1952~2006年,仅咸阳市苹果产区仅因干旱造成损失3.8亿元(马等,2008) [1]。光合作用是作物重要的代谢过程,是作物生长和产量形成的基础,逆境条件下作物光合作用的维持是其提高抗性的基础。干旱胁迫下,植物的光合作用会受到一定程度的限制,比如光合速率降低,光合作用光反应中原初光能转换、电子传递、光合磷酸化等反应过程受抑制 [2],光合作用下降。
甜菜碱(glycinebetaine, GB)是一种非常有效的渗透调节物质和胁迫抗性因子 [3],很多研究证明外源甜菜碱能提高植物对干旱等胁迫 [4] [5] [6] 的抗性,但这些研究主要针对一年生植物(作物)及少数木本植物 [5] [7] [8],而针对有重要经济性状的木本植物苹果(Malus domestica)的研究还很少,苹果在干旱胁迫下甜菜碱的合成与积累如何?甜菜碱与苹果的干旱抗性关系怎样?迄今鲜有研究。我们先前的研究已经证明外源甜菜碱能改善植株水分状况增加渗透调节物质来提高苹果抗性 [9],本试验研究干旱胁迫下,叶面喷施甜菜碱对苹果光合特性的影响,拟探讨甜菜碱在干旱胁迫下对果树光合功能的保护机制,同时为甜菜碱在果树抗逆栽培上可能的推广应用提供理论依据。
2. 材料与方法
2.1. 试验材料
试材为盆栽的1年生富士苹果,砧木为平邑甜茶(Malus hupehensis),春季萌芽前栽在大塑料盆里(盆直径45 cm、高30 cm),盆土为3份壤土混1份有机肥(兔粪与羊粪的混合物),装土量为15 kg/盆,常规管理。待至春稍停长时(5月底至7月初)挑选生长健康,长势一致的植株,放进山东省果树研究所苗圃基地的防雨棚(昼夜温度为25/20℃,光强600 µmol∙m−2∙s−1~800 µmol∙m−2∙s−1、12 h∙d−1,湿度为65%~70%)中进行甜菜碱预处理和自然脱水干旱处理;在处理前(0天)和处理的第3、6、9天进行有关生理生化指标测定,所有测定均为3次重复。
2.2. 甜菜碱(GB)预处理
选取长势基本一致的幼树,分为两组进行叶面喷施甜菜碱处理,叶面、叶背喷施均匀。一组用含有100 mmol/L (经预试为最佳浓度)甜菜碱(Sigma公司产品)的溶液(用去离子水配制,含2‰ Tween-20) (+GB),另一组以喷去离子水为对照(CK:含2‰ Tween-20) (−GB)。每天早晚各喷施溶液一次,以保持甜菜碱浓度相对稳定,连续处理3 d。
2.3. 胁迫处理
GB预处理后,取足够数量的对照材料和GB预处理的苹果植株材料,采用自然干旱的方式进行控水处理,分别于控水0、3、6、9天进行有关指标测定。选取枝梢上位置相同叶片(稍顶部向下第3~5片叶)进行测试。
2.4. 试验方法
2.4.1. 甜菜碱含量测定
主要参考Gorham等(1982) [10] 的方法提取和测定甜菜碱。以Sigma公司的甘氨酸甜菜碱(分析纯AR)为标样。
2.4.2. 叶绿素含量的测定
按赵世杰等(2002)的方法 [11]。
2.4.3. 净光合速率及气体交换参数的测定
净光合速率(Pn)、气孔导度(GS)、蒸腾速率(E)、细胞间隙CO2浓度(Ci)等参数用CIRAS-2便携式光合系统(PPSystems,英国)测定。胁迫处理后测定树中间位置同一方位长枝条中间叶片上净光合速率及气孔导度、蒸腾速率和胞间CO2浓度等气体交换参数。
2.4.4. 叶绿素荧光参数的测定
采用英国Hansatech公司的FMS-2型便携脉冲调制式荧光仪测定叶绿素荧光参数。测定暗适应最大荧光Fm及初始荧光时,叶片需暗适应30分钟,光适应下荧光参数及荧光猝灭曲线的测定与计算参见文献 [12] [13]。测量时,首先用测量光(2 µmol∙m−2∙s−1)照射测量Fo,然后用饱和脉冲光照射0.8 s,测定Fm,饱和脉冲光结束后,打开测量光和光化学光,每隔30 s照射1次饱和脉冲光,测量 ,关闭光化学光,同时打开远红光照射3 s,测量 ,远红光结束后,重新打开光化学光,开始新的一个循环的测量。 ,,,。作图时所用数据为3个重复的平均值。
2.4.5. 超氧阴离子自由基( )产生速率和和H2O2含量的测定
的产生速率测定按照王爱国和罗广华(1990)的方法 [14]。
H2O2的含量测定按照Sairam和Srivastava (2002)的方法 [15]。
2.4.6. 抗氧化酶活性测定
参照Bartoli等(1999)的方法 [16]。取0.5 g叶片放在预冷的研钵中,加5 ml预冷的磷酸缓冲液冰浴研磨,12,000 g、4℃离心10 min,上清液即为CAT、POD、SOD、APX粗提液。显色反应后计算其活性。结果以基于单位蛋白的酶活性表示,可溶性蛋白的测定测定系统含考马斯亮蓝G-250 2.8 ml及0.2 ml酶液,反应2 min,用UV-1601型分光光度计在595 nm比色。
2.5. 统计分析
所有实验测定均为3次或者3次以上重复。实验结果均为3次或3次以上重复的平均值±S.E.。利用DPS软件(浙江大学,中国)进行统计分析,利用Duncan新复极差法进行多重比较。
3. 结果与分析
3.1. 叶面喷施GB和干旱胁迫对苹果叶片甜菜碱含量的影响
如表1所示,甜菜碱预处理明显提高植株叶片甜菜碱含量。正常条件下(干旱胁迫0天),苹果叶片甜菜碱含量为22.4 µmol∙g−1 DW,叶面喷施甜菜碱预处理植株为65.2 µmol∙g−1 DW;随着干旱时间的延长,GB预处理组和对照组植株甜菜碱含量显著增加(p < 0.05),尤其是甜菜碱预处理植株的甜菜碱增加幅度更为显著(p < 0.05),干旱胁迫3 d、6 d和9 d后对照组分别增加7.1%、22.8%和67.7%,甜菜碱预处理组分别增加33.3%、40.2%和109.5%。
Table 1. Effect of GB and drought stress on the content of GB in apple leaves
表1. 叶面喷施甜菜碱和干旱胁迫对苹果叶片甜菜碱含量的影响
注:DW为叶干重;表中数值为三个重复的平均值±标准误差(S.E.)。数值后不同的字母表示在p < 0.05时有显著性差异。
3.2. 叶面喷施GB和干旱胁迫对苹果叶片叶绿素含量的影响
先前的研究发现,干旱胁迫下,甜茶碱预处理植株叶片明显比对照组叶片更浓绿,我们测定了对照组和GB预处理组植株叶片叶绿素含量,结果如表2,结果显示,干旱处理的0 d,GB预处理组叶绿色含量稍高于对照,干旱胁迫下,植株叶绿素含量显著降低,在胁迫后的第3 d,对照组为处理0 d时的80.8%,而GB预处理组为处理0 d时的96.8%;在胁迫后的第6天、第9天,叶绿素含量进一步降低,但是整个干旱过程中,GB预处理组明显高于对照组。叶面喷施甜菜碱能缓解干旱引起的叶绿素的降解,这对光合功能的维持是必不可少的。
Table 2. Effect of GB and drought stress on the content of chlorophyll in apple leaves
表2. 叶面喷施甜菜碱和干旱胁迫对苹果叶片叶绿色含量的影响
注:表中数值为三个重复的平均值±标准误差(S.E.)。数值后不同的字母表示在p < 0.05时有显著性差异。
3.3. 叶面喷施GB和干旱胁迫对苹果叶片气体交换参数的影响
对各处理光合相关参数的测定结果如图1所示。正常条件下,甜菜碱预处理和对照处理平邑甜茶叶片净光合速率(Pn)差别不显著,分别为10.6 µmol∙m−2∙s−1、10.2 µmol∙m−2∙s−1;干旱胁迫下,苹果叶片净光合速率呈下降趋势,干旱9天内,而对照植株的光合速率下降了56.9%,甜菜碱预处理植株的光合速率下降了27.3% (图1(A));叶片的气孔导度(Gs)结果如图1(B),在处理的第3天甜菜碱预处理和对照植株都略微上升,此后明显下降,但是甜菜碱预处理植株明显高于对照植株。蒸腾速率(E) (图1(D))变化趋势和气孔导度的趋势基本一致。胞间CO2浓度(Ci)在干旱9 d内(图1(C)),甜菜碱预处理植株变化较平缓,但是对照植株在胁迫的后期明显增加,这说明,甜茶碱预处理植株光合速率的下降是由气孔因素是引起二对照植株发生气孔限制的同时也出现了非气孔限制,导致光合功能的明显下降。
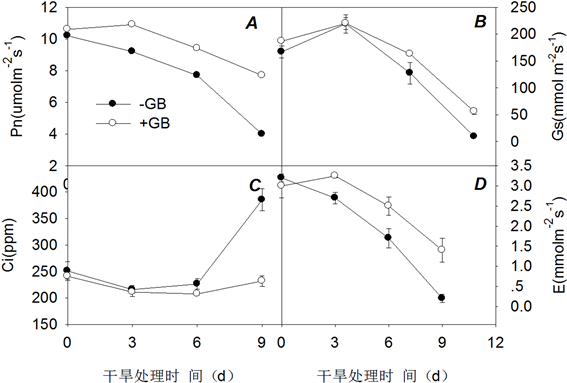
Figure 1. Effects of GB and drought stress on gas exchange parameters of apple leaves
图1. 叶面喷施甜菜碱和干旱胁迫对苹果叶片气体交换参数的影响
3.4. 干旱胁迫对苹果叶片PSII活性的影响
Fv/Fm是暗适应下PSII的最大光化学效率。如图2(A)所示,在正常情况下(处理的第0天),甜菜碱预处理植株和对照植株Fv/Fm的大小差别不大,在干旱胁迫过程中,均明显下降,在干旱胁迫的第9天,甜菜碱预处理植株Fv/Fm由0.834下降到0.804,下降了3.6%;对照植株由0.834下降到0.794,下降了4.8%。
ΦPSII是PSII实际光化学效率,它反映了在光照条件下PSII反映中心部分关闭情况下的光化学效率,ΦPSII的降低,说明从天线上捕获的光能用于光化学反应的分额减小,PSII反应中心的光化学活性变弱。从图2(B)可以看出,干旱9天内,苹果叶片的实际光化学效率呈下降趋势,甜菜碱预处理和对照植株的变化趋势基本

Figure 2. Effects of GB and drought stress on Fv/Fm (A), ΦPSII (B) of apple leaves
图2. 叶面喷施甜菜碱和干旱胁迫对苹果叶片Fv/Fm (A),ΦPSII (B)影响
一致,但下降幅度有所不同。甜菜碱预处理植株叶片ΦPSII下降幅度小,而对照组植株叶片ΦPSII下降幅度大;在干旱处理的第9天,甜菜碱预处理植株叶片ΦPSII为0.354,下降了26.2%;而对照组为0.225,下降了53.0%。干旱胁迫下,甜菜碱预处理明显减轻了Fv/Fm和ΦPSII的降低,叶面喷施甜菜碱提高了PSII对干旱胁迫的抗性。
3.5. 干旱胁迫对苹果叶片PSII激发能分配的影响
如图3(A)所示,甜菜碱预处理和对照组苹果叶片的qP值均呈先上升后下降趋势。对照植株下降明显,与干旱胁迫前相比,在干旱处理的第9天,对照下降了26.2%,甜菜碱预处理植株下降了16.4%。干旱胁迫过程中,苹果叶片PSII反应中心电子传递活性受到了不同程度的影响,而甜菜碱预处理植株受到的影响较对照组小。

Figure 3. Effects of GB and drought stress on (qP) (A), (qN) (B) of apple leaves
图3. 叶面喷施甜菜碱和干旱胁迫对苹果叶片光化学猝灭(qP) (A)和非光化学猝灭(qN) (B)的影响
从图3(B)可以看出,在干旱胁迫的第3天,qN值下降,可能因为植物刚感受到胁迫信号,但却未作出应急反应,即积累过剩光能较少,没有发生光抑制。在随着胁迫时间的延长,qN值上升,这表明PSII非辐射能量的耗散增加。图3(B)还可以看出,甜菜碱预处理植株在干旱胁迫过程中qN值上升较对照迅速切幅度大,尤其干旱胁迫的第9天,甜菜碱预处植株qN值明显高于对照组植株的,这说明,叶面喷施甜菜碱处理植株PSII有较强的非辐射耗散能力,从而避免过剩光能伤害光合器官。
3.6. 叶面喷施甜菜碱和干旱胁迫对苹果活性氧产生的影响

Figure 4. Effects of GB and drought stress on the production rate of (A) and H2O2 content (B) of apple leaves
图4. 叶面喷施甜菜碱和干旱胁迫对苹果叶片活性氧含量的影响
干旱胁迫过程中活性氧的产生和积累情况见图4。图4(A)所示,干旱胁迫下, 的产生速率呈上升趋势,甜菜碱预处理能减少 的产生速率;干旱胁迫过程中,H2O2的含量变化趋势和 的产生速率趋势基本一致。叶面喷施甜菜碱能降低活性氧积累(图4),这利于减轻膜脂过氧化程度,保持细胞膜完整性。
3.7. 叶面喷施甜菜碱和干旱胁迫对苹果活性氧清除系统的改善作用

Figure 5. Effects of GB and drought stress on the activities of superoxide dismutase (SOD) (A), catalase (CAT) (B), peroxidase (POD) (C), and ascorbate peroxidase (APX) (D) of of apple leaves
图5. 叶面喷施甜菜碱和干旱胁迫下对苹果叶片SOD (A)、CAT (B)、POD (C)和APX (D)活性的影响
图5结果表明,干旱胁迫下,抗氧化酶活性响应不同。干旱胁迫下,SOD (图5(A))和CAT (图5(B))活性先升高后降低;POD先降低后升高,而APX的活性大致呈先升高后降低的趋势。叶面喷施甜菜碱提高了苹果叶片抗氧化酶活性,尤其干旱胁迫的第9天,这和甜菜碱预处理组较低 和H2O2的含量相一致(图4)。
4. 讨论和结论
甜菜碱被认为是非常有效的渗透调节物质和胁迫抗性因子。逆境条件下,植株体内的甜菜碱含量会大大增加,且增加程度与植株胁迫抗性的增强呈正相关 [17] [18]。苹果合成甜菜碱的能力很低(表1),远远低于藜科、早熟禾科等抗逆植物 [19],这和在前人的研究结果相一致 [20]。通过叶面喷施的方法可以提高苹果叶片甜菜碱含量,叶面喷施甜菜碱可以被苹果叶片吸收并积累,并且甜菜碱的积累量可达到较高的水平且很长一段时间内不降解(表1)。这说明通过叶面喷施甜菜碱提高苹果抗性的方法是可行的。
干旱胁迫下,甜菜碱预处理和对照植株叶片叶绿素含量明显下降,这可能与干旱胁迫造成氧化胁迫有关。甜菜碱预处理植株叶片叶绿体色素含量明显高于对照植株(表2),这和在小麦 [21] 和烟草 [22] 上的研究结果相一致,叶面喷施甜菜碱能缓解干旱胁迫造成的氧化胁迫,因而能抑制氧化所造成的色素漂白,提高色素含量。干旱胁迫下叶面喷施甜菜碱植株光合速率的提高与甜菜碱缓解色素的降解有关。
干旱胁迫下,植株叶片光合的降低有气孔限制和非气孔限制两个方面的原因。本试验干旱处理的第3天,转基因植株Gs均呈上升趋势,推测与轻微干旱引起抗性机制的启动有关;干旱胁迫的第6天和第9天,气孔导度明显下降,这是发生了气孔限制的结果,但是甜菜碱预处理植株叶片的气孔导度下降的幅度明显低于对照植株(图1(B)),这说明叶面喷施甜菜碱能缓解植株叶片气孔导度的降低,这种效应在干旱胁迫的第9天更为显著;干旱处理的第9天,对照植株Ci值显著增加(图1(C)),推测对照植株可能是光合机构受损,叶肉细胞的同化能力降低,即发生了非气孔限制的结果 [23],而同时甜菜碱预处理植株叶片的Ci值几乎维持在同一水平。这说明,甜菜碱预处理植株的叶肉细胞的同化能力受影响比对照组植株小,推测其气孔导度明显高于对照植株(图1(B))起积极作用。
干旱胁迫下,植株叶片PSII反应中心的破坏与D1蛋白的降解有关 [24]。同时,干旱胁迫下产生的活性氧(ROS)也可以直接攻击PSII,造成D1蛋白的破坏 [25]。ROS清除系统是植物抗逆机制的重要组成部分,抗氧化系统的活性与植物抗旱性密切相关 [26] [27]。也可以说,提高植物的提高植物的抗氧化能力是提高植物抗逆性的一个重要方面。已有研究证明,甜菜碱不能直接清除活性氧 [21] [28],但我们的研究发现,在干旱胁迫下,甜菜碱预处理苹果植株可以维持较高抗氧化酶活性(图5),减缓光氧化,尤其是SOD、POD、APX活性明显高于对照植株,这有助于保护干旱胁迫下PSII光化学效率,提高植株的光合能力。
干旱胁迫下,叶面喷施甜菜碱提高了苹果叶片的光合作用,这种作用可能与减轻活性氧伤害有关,和增强PSII活性有关,和甜菜碱的保护功能有关。
基金项目
山东省果树研究所青年科研基金(2018KY07);山东省自然科学基金 (No. ZR2011CM034);国家苹果产业体系(CARS-27)。
文章引用
王贵平,王金政,薛晓敏,路 超,陈 汝. 叶面喷施甜菜碱提高了苹果叶片光合作用对干旱胁迫的抗性
Spraying Glycinebetaine Enhances Photosynthesis against Drought Stress in Apple Plants[J]. 农业科学, 2020, 10(01): 50-58. https://doi.org/10.12677/HJAS.2020.101008
参考文献
- 1. 马延庆, 刘长民, 朱海利, 刘玲珠, 马文, 王维. 陕西咸阳渭北旱塬地区优质苹果基地生态气候特征分析[J]. 干旱地区农业研究, 2008, 26(1): 146-153.
- 2. 卢从明, 张其德, 匡廷云. 水分胁迫对小麦PSII的影响[J]. 植物学报, 1994, 36(2): 93-98.
- 3. Kurepin, L.V., Ivanov, A.G., Zaman, M., Pharis, R.P., Allakhverdiev, S.I., Norman, V.H. and Hüner, P.A. (2015) Stress-Related Hormones and Glycinebetaine Interplay in Protection of Photosynthesis under Abiotic Stress Conditions. Photosynthesis Research, 126, 221-235. https://doi.org/10.1007/s11120-015-0125-x
- 4. Anjum, S.A., Xie, X.Y., Wang, L.C., et al. (2011) Morphological, Physiological and Biochemical Responses of Plants to Drought Stress. African Journal of Agricultural Research, 6, 2026-2032.
- 5. 高雁, 李春, 娄恺. 干旱胁迫条件下加工番茄对喷施甜菜碱的生理响应[J]. 植物营养与肥料学报, 2012, 18(2): 426-432.
- 6. Sorwong, A. and Sakhonwasee, S. (2015) Foliar Application of Glycine Betaine Miti-gates the Effect of Heat Stress in Three Marigold (Tagetes erecta) Cultivars. The Horticulture Journal, 84, 161-171.
- 7. Ahmad, R., Lim, C.J. and Kwon, S.Y. (2013) Glycine Betaine: A Versatile Compound with Great Poten-tial for Gene Pyramiding to Improve Crop Plant Performance against Environmental Stresses. Plant Biotechnology Re-ports, 7, 49-57. https://doi.org/10.1007/s11816-012-0266-8
- 8. Li, M.F., Li, Z.M., Li, S.F., et al. (2014) Genetic Engineering of Glycine Betaine Biosynthesis Reduces Heat-Enhanced Photoinhibition by Enhancing Antioxidative Defense and Allevi-ating Lipid Peroxidation in Tomato. Plant Molecular Biology Reporter, 32, 42-51. https://doi.org/10.1007/s11105-013-0594-z
- 9. 王贵平, 王金政, 薛晓敏, 路超, 聂佩显. 叶面喷施甜菜碱对干旱胁迫下苹果幼树生理指标的影响[J]. 北方园艺, 2014(12): 10-14.
- 10. Gorham, J., McDonnell, E. and Wyn Jones, R.G. (1982) Determination of Betaines as Ultraviolet-Absorbing Esters. Analytica Chimica Acta, 138, 277-283. https://doi.org/10.1016/S0003-2670(01)85311-3
- 11. 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002: 55-57.
- 12. Damming-Adams, B., Adams, W.W., Logan, B.A. and Verhoeven, A.S. (1995) Xanthophyll Cycle-Dependent Energy Dissipation and Flexible PSII Efficiency in Plants Acclimated to Light Stress. Australian Journal of Plant Physiology, 22, 294-260. https://doi.org/10.1071/PP9950249
- 13. Damming-Adams, B. and Adams, W.W. (1996) Xanthophyll Cycle and Light Stress in Nature: Uniform Response to Excess Direct Sunlight among Higher Plant Species. Planta, 198, 460-470. https://doi.org/10.1007/BF00620064
- 14. 罗广华, 王爱国. 植物体内氧自由基测定和清除[M]//汤章城, 编. 现代植物生理学实验指南. 北京: 科学出版社, 1999: 308-309.
- 15. Sairam, P.K. and Srivastava, G.C. (2002) Changes in Antioxidant Activity in Sub-Cellular Fractions of Tolerant and Susceptible Wheat Genotypes in Response to Long Term Salt Stress. Plant Science, 162, 897-904. https://doi.org/10.1016/S0168-9452(02)00037-7
- 16. Bartoli, C.G., Simontacchi, M., Tambussi, E., Beltrano, J., Montaldi, E. and Puntarulo, S. (1999) Drought and Watering-Dependent Oxidative Stress: Effect on Antioxidant Content in Triticum aestivum L. Leaves. Journal of Experimental Botany, 50, 375-383. https://doi.org/10.1093/jxb/50.332.375
- 17. Hanson, A.D., May, A.M., Grumet, R., Bode, J., Jamieson, G.C. and Rhodes, D. (1985) Betaine Synthesis in Chenopods: Localization in Chloroplasts. Proceedings of the National Academy of Sciences of the United States of America, 82, 3678-3682. https://doi.org/10.1073/pnas.82.11.3678
- 18. 赵勇, 马雅琴, 翁跃进. 盐胁迫下小麦甜菜碱和脯氨酸含量变化[J]. 植物生理与分子生物学学报, 2005, 31(1): 103-106.
- 19. McCue, K.F. and Hanson, A.D. (1990) Drought and Salt Tolerance: Towards Understanding and Appli-cation. Trends in Biotechnology, 8, 358-362. https://doi.org/10.1016/0167-7799(90)90225-M
- 20. 马双艳, 姜远茂, 彭福田, 孙建义. 水分胁迫对几种果树甜菜碱含量的影响[J]. 山西果树, 2003(5): 3-4.
- 21. Wang, G.P., Zhang, X.Y., Li, F., Luo, Y. and Wang, W. (2010) Overaccumulation of Glycine Betaine Enhances Tolerance to Drought and Heat Stress in Wheat Leaves in the Protection of Photosynthesis. Phtosynthetica, 48, 117-126. https://doi.org/10.1007/s11099-010-0016-5
- 22. Zhao, X.X., Ma, Q.Q., Liang, C., Fang, Y.Y., Wang, Q. and Wang, W. (2007) Effect of Glycinebetaine on Function of Thylakoid Membranes in Wheat Flag Leaves under Drought Stress. Biologial Plantarum, 51, 584-588. https://doi.org/10.1007/s10535-007-0128-3
- 23. Parry, M.A.J., Andrakojc, P.J., Khan, S., Lea, P.J. and Keys, A.J. (2002) Rubisco Activity: Effects of Drought. Annals of Botany, 89, 833-839. https://doi.org/10.1093/aob/mcf103
- 24. Giardi, M.T., Cona, A., Geiken, B., Kucera, T., Masojidek, J. and Mattoo, A.K. (1996) Long-Term Drought Stress Induces Structure and Dunctional Reorganization of Photo System II. Planta, 199, 118-125. https://doi.org/10.1007/BF00196888
- 25. Asada, K. (1996) Radical Production and Scavenging in the Chloroplasts. In: Baker, N.R., Ed., Advance in Photosynthesis. Photosynthesis and the Environment, Springer, Dordrecht, 123-150. https://doi.org/10.1007/0-306-48135-9_5
- 26. Sairam, R.K. and Saxima, D.C. (2000) Oxidative Stress and Anti-oxidant in Wheat Genotypes: Possible Mechanisms of Water Stress Tolerance. Journal of Agronomy and Crop Science, 184, 55-61. https://doi.org/10.1046/j.1439-037x.2000.00358.x
- 27. Sairam, R.K. and Srivastava, G.C. (2001) Water Stress Tolerance of Wheat (Triticum aestivum L.): Variations in Hydrogen Peroxide Accumulation and Antioxidant Activity in Tolerance and Susceptible Genotypes. Journal of Agronomy and Crop Science, 186, 63-70. https://doi.org/10.1046/j.1439-037x.2001.00461.x
- 28. Smirnoff, N. and Cumbes, Q. (1989) Hydroxyl Radical Scavenging Activity of Compatible Solutes. Photochemistry, 28, 1057-1060. https://doi.org/10.1016/0031-9422(89)80182-7
