Botanical Research
Vol.
10
No.
03
(
2021
), Article ID:
42480
,
13
pages
10.12677/BR.2021.103035
东北阔叶林下早春开花植物的生理与代谢特性研究
闫雪1,刘佳2,吴可心3,唐玉情4,刘洋3*,唐中华1
1东北林业大学化学化工与资源利用学院,黑龙江 哈尔滨
2东北林业大学材料科学与工程学院,黑龙江 哈尔滨
3东北林业大学林学院,黑龙江 哈尔滨
4东北林业大学园林学院,黑龙江 哈尔滨

收稿日期:2021年4月21日;录用日期:2021年5月11日;发布日期:2021年5月21日

摘要
早春开花植物是在寒冷的早春季节开花并快速完成其生命周期的一类特殊植物,但对其的研究很少。为了更好地认识和开发利用这类特殊植物,我们采集了五种早春开花植物和五种未开花植物进行该研究,采用吸光光度法和气相色谱与质谱联用技术,对两类植物的生理与代谢物进行测定。结果表明:早春开花植物的叶绿素含量和可溶性蛋白含量较低,可溶性糖含量升高,揭示出早春开花植物的碳代谢增强,氮代谢降低。此外,通过比较早春开花植物和未开花植物的代谢组学分析表明,早春开花植物的氨基酸代谢途径是与未开花植物的主要区别,是区分早春开花植物的特征,关键途径中的富马酸、丙氨酸、色氨酸、苯丙氨酸、苯乙酸差异化合物在早春开花植物中显著积累,说明早春开花植物的氮代谢减弱,消耗大量的碳水化合物以满足开花过程的能量损耗。这些研究结果有助于对早春开花植物的认识,并为今后早春开花植物的鉴定、人工生产栽培和开发利用提供了理论基础。
关键词
早春开花植物,生理指标,代谢组学,气相色谱–质谱联用

Study on Physiological and Metabolic Characteristics of Early Spring Flowering Plants in Northeast Broad-Leaved Forest
Xue Yan1, Jia Liu2, Kexin Wu3, Yuqing Tang4, Yang Liu3*, Zhonghua Tang1
1College of Chemistry, Chemical Engineering and Resource Utilization, Northeast Forestry University, Harbin Heilongjiang
2College of Materials Science and Engineering, Northeast Forestry University, Harbin Heilongjiang
3College of Forestry, Northeast Forestry University, Harbin Heilongjiang
4College of Landscape Architecture, Northeast Forestry University, Harbin Heilongjiang

Received: Apr. 21st, 2021; accepted: May 11th, 2021; published: May 21st, 2021

ABSTRACT
Early spring flowering plants are a special kind of plants that bloom in the cold early spring and complete their life cycle quickly, but there are few studies on them. In order to better understand and develop and utilize such special plants, we collected five early spring flowering plants and five unflowered plants for this study. Using absorbance spectroscopy and gas chromatography and mass spectrometry combined techniques, measure the physiology and metabolites of two types of plants. The results showed that the chlorophyll content and soluble protein content of early spring flowering plants were lower, and the soluble sugar content increased, revealing that early spring flowering plants had increased carbon metabolism and decreased nitrogen metabolism. In addition, comparing the metabolomics analysis of early spring flowering plants and unflowered plants, it is shown that the amino acid metabolism pathway of early spring flowering plants is the main difference from unflowered plants. It is the characteristic of early spring flowering plants. Differential compounds of fumaric acid, alanine, tryptophan, phenylalanine, and phenylacetic acid in the key pathways accumulated significantly in early spring flowering plants, indicating that the nitrogen metabolism of early spring flowering plants is weakened, and a large number of carbohydrates are consumed to meet the energy loss during flowering. These research results are helpful to the understanding of early spring flowering plants, and provide a theoretical basis for the identification, artificial production, cultivation and development and utilization of early spring flowering plants in the future.
Keywords:Early Spring Flowering Plants, Physiological Indicators, Metabolomics, Gas Chromatography-Mass Spectrometry

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
早春开花植物一般为生长在落叶阔叶林下的一些多年生植物,其生命周期极短,在早春冰雪初融时迅速展开叶子,经过短暂的营养生长后在早春开花,并在上层植物展开叶片前完成生命史然后进入休眠状态 [1]。早春开花植物不仅有很高的观赏价值;同时早春开花植物大多数为蜜源植物,还有许多为药用植物、野菜植物,具有很高的经济价值;早春开花植物还用于食品、工业等方面,它们还可以吸收灰尘和清洁空气,具有较高的环境效益 [2]。但是由于早春开花植物是一种特殊的植物类型,导致人们对这类植物的研究不多。前人主要是对早春开花植物的种类进行了简单的统计分析 [3],促进了早春开花植物在园林建设中的应用;而对早春开花植物生理方面的研究则主要集中在花粉形态及其萌发 [4];另外,近几年对早春开花植物抗寒性的研究日益增多 [5],目前还没有对早春开花植物的代谢组学方面的研究。
早春草本植物主要分布在百合科、堇菜科、毛茛科等。本研究所用实验材料:早春开花植物冰凌花(Adonis amurensis Regel et Radde)、黑水银莲花(Anemone amurensis (Korsh.) Kom)、平贝母(Fritillaria ussuriensis Maxim)、鹿药(Smilacina japonica A. Gray)、顶冰花(Gagea lutea (L.) Ker-Gawl)以及未开花植物耧斗菜(Aquilegia viridiflora Pall)、升麻(Cimicifuga foetida L)、乌头(Aconitum carmichaeli Debeaux)、藜芦(Veratrum nigrum L)、东北百合(Lilium distichum Nakai),都分布在百合科和毛茛科,是东北地区代表性早春植物,且都具药用价值。目前对这些植物的研究主要集中在形态学研究、开花特性、繁殖与栽培、分子生物学和药用成分研究。对这些植物的形态解剖研究,了解其耐寒特性的形态特征 [6] [7] [8];并对其传粉生物学进行初步探索,为植物保护奠定基础 [9] [10];关于这些植物药用成分的研究相对较多,如升麻属植物中含有三联及其苷类、酚酸类、挥发油类等多种活性成分,具有广泛的药理作用 [11];张岩等采用RP-HPLC等色谱技术对黑水银莲花根茎化学成分进行了鉴定,结构分别为4’-O-methylequisetumpyrone、α-D-呋喃果糖甲酯、β-D-葡萄糖、α-D-葡萄糖、半乳糖醇和胡萝卜苷 [12];赵淑杰等发现从鹿药中分离得到3个甾体皂苷均具有一定的抗肿瘤活性 [13];同时,在贝母中已分离并确定结构的生物碱成分有100余种,主要分为甾体生物碱和异甾体生物碱 [14]。
代谢组学是一种检测整体复杂性和测定代谢物基本变化的有效技术,该技术提供了生物系统中代谢物的图谱,已被认为是代谢研究的理想选择 [15]。气相色谱–质谱(GC-MS)是代谢组学中使用最广泛的技术之一,因为它的功能强大且灵敏,而且具有高通量,从而增加了可以处理的样品数量以及可以检测和鉴定的极性和非极性代谢物的范围 [16]。目前,基于GC-MS的代谢组学技术有许多新的发展,在我们以前的研究中,我们使用GC-MS检测了许多植物,在人参物种的不同组织中共发现149种初级代谢产物 [17],在皂角中鉴定出了82种初级代谢产物 [18]。
本研究对早春开花植物和未开花植物的叶绿素含量、可溶性糖以及可溶性蛋白的含量进行测定,并利用GC-MS分析和代谢组学研究方法对两种植物的初生代谢产物进行了综合比较,填补了对早春开花植物代谢方面研究的空白。本研究关于早春开花植物的生理及代谢特性的结果,对早春开花植物的鉴定、人工生产栽培和开发利用有重要意义。
2. 材料与方法
2.1. 实验材料
本实验选取的10种早春植物:冰凌花、黑水银莲花、平贝母、鹿药、顶冰花、升麻、乌药、耧斗菜、藜芦、东北百合,于2019年4月中旬在东北林业大学帽儿山实验林场同一样地采集。本实验所选样地为帽儿山林区老山地区,地理坐标为东经127˚34'35.67'',北纬45˚16'23.94'',海拔287 m。帽儿山区域属大陆性季风气候,四季分明,冬长夏短,年平均气温为2℃~6℃,年日照时数2471.3 h,年平均降水400~650 mm,年平均相对湿度70%,取样时早春开花植物均处于开花期,而未开花植物还在营养生长阶段。本实验中所用材料是每个植物的叶子,用蒸馏水清洗每个植物样品的表面杂质和沉淀物,迅速冷冻至−80℃冰箱,每组样品收集3个生物重复。
2.2. 实验方法
2.2.1. 生理指标的测定
总叶绿素含量根据山雨思的方法 [19] 采用丙酮–无水乙醇混合液(2:1)进行浸提,用紫外分光光度计在450 nm、645 nm和663 nm波长处测定叶绿素a、叶绿素b、总叶绿素的含量。
采用蒽酮比色法 [20] 对植物可溶性糖含量进行测定;植物可溶性糖含量应用考马斯亮蓝法测定 [21]。
2.2.2. 代谢产物的测定
精密称90 mg植物样本放入1.5 mL的离心管中;加入540 μL的冷甲醇和 60 μL的内标,研磨机中研磨(60 Hz, 2 min)后超声提取30 min;加入300 μL的氯仿,涡旋(20 Hz, 2 min)后加入600 μL的水,再涡旋(20 Hz, 2 min),超声提取30 min;然后低温离心10 min (14,000×g, 4℃),取700 μL的上清液,用快速离心浓缩仪挥干,衍生化处理后进行GC/MS分析。
本实验使用Agilent 7890A系列自动取样器(Agilent Technologies, USA)与Agilent 5975C气相色谱-质谱仪,样品经非极性DB-5MS毛细管色谱柱(30 m × 250 μm I.D., J&W Scientific, Folsom, CA)分离后进入质谱检测。用初始温度为60℃,初始时间为2分钟的温度程序进行分离,然后以8℃/min升温至125℃,4℃/min升温至210℃,5℃/min升温至270℃,以10℃/min升温至305℃,在305℃保持3分钟。质谱电离源维持在260℃,四极杆维持在150℃,电压为−70 V。在使用制造商自动调谐宏优化质谱参数和质量校准之后,在50~600 m/z区间扫描的同时记录质谱信号,延迟5 min开始采集,采集速度为20谱/秒 [17]。
2.3. 数据处理
使用SPSS 24.0软件进行统计分析,进行单因素(One-way ANOVA)方差分析,并进行Tukey检验,当P < 0.05时认为具有统计学意义。采用GraphPad Prism 8软件进行图片绘制。GC-MS归一化数据采用SIMCA-P 14.1软件(Umetrics, Umea, Sweden)进行偏最小二乘判别分析(PLS-DA),再以据变量对分组贡献得分(VIP 得分)大于1和组间变化的差异检验(学生t检验)显著性(P < 0.05)为差异性代谢产物的筛选标准 [22]。并将差异代谢物输入到kegg数据库和MetaboAnalyst (http://www.metaboanalyst.ca)数据库进行代谢途径的富集和筛选。
3. 结果与分析
3.1. 植物类型及生态学特性
本实验所用的早春植物分布在百合科和毛茛科,都是多年生草本植物,且生长环境都在林下或灌丛,早春开花植物的花期都在4~5月,而采集的未开花植物花期都在7~9月,其主要生物学特性和药用价值见表1。
3.2. 光合色素含量比较分析
叶绿素是植物体内最重要的光合色素,大量存在于绿色植物的组织中 [23]。高等植物叶绿素主要有叶绿素a (Chl a)和叶绿素b (Chl b)两种,早春开花植物和未开花植物的叶绿素a、叶绿素b和总叶绿素(Chla + b)含量的测定结果如图1。由图可知,早春开花植物的叶绿素a、叶绿素b和总叶绿素均低于未开花植物,结果表明,早春开花植物的叶绿素含量在开花过程中显著下降,光合作用降低。
3.3. 可溶性糖和可溶性蛋白含量比较分析
早春开花植物与未开花植物的可溶性糖含量的测定结果见图2,结果显示:早春开花植物的可溶性糖含量均高于未开花植物,表明早春开花植物的可溶性糖代谢较活跃,早春植物在开花期间的整体调控与可溶性糖含量增加关系密切。
可溶性蛋白通常是参与各种代谢过程的酶,其含量是衡量植物整体代谢的重要指标。早春开花植物与未开花植物的可溶性蛋白含量的测定结果如图3,早春开花植物的可溶性蛋白含量均低于未开花植物。
Table 1. Information sheet of ten early spring plants
表1. 十种早春植物信息表
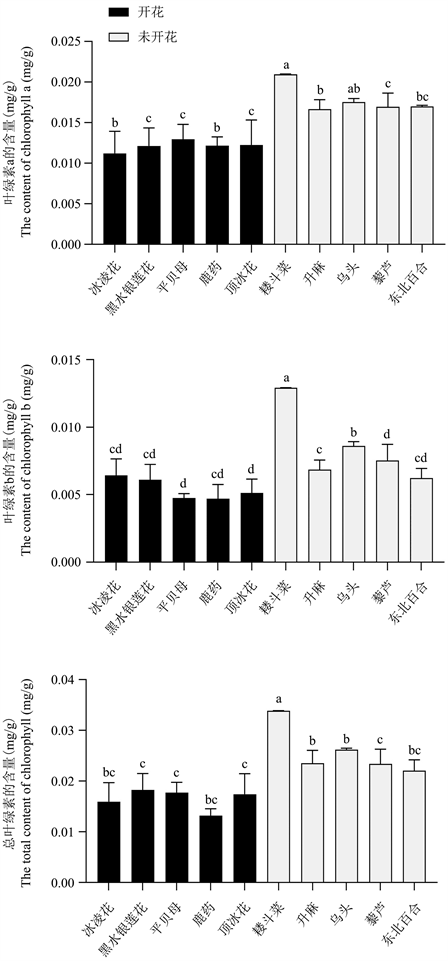
Figure 1. Results of chlorophyll content of early spring flowering plants and unflowered plants, different lowercase letters indicate significant difference at P < 0.05 level
图1. 早春开花植物与未开花植物的叶绿素含量测定结果,不同小写字母表示差异显著,P < 0.05
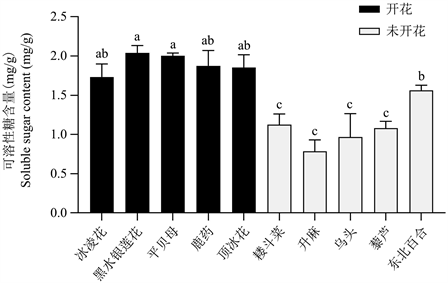
Figure 2. Results of the soluble sugar content of early spring flowering plants and unflowered plants, different lowercase letters indicate significant difference at P < 0.05 level
图2. 早春开花植物与未开花植物的可溶性糖含量测定结果,不同小写字母表示差异显著,P < 0.05
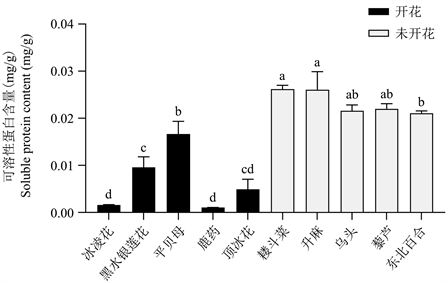
Figure 3. Results of soluble protein content in early spring flowering plants and unflowered plants, different lowercase letters indicate significant difference at P < 0.05 level
图3. 早春开花植物与未开花植物的可溶性蛋白含量测定结果,不同小写字母表示差异显著,P < 0.05
3.4. 早春开花植物的代谢特性分析
3.4.1. 样品间的差异代谢物确定
为判别早春开花植物和未开花植物两类植物的代谢物累积差异,使用有监督的偏最小二乘-判别分析对代谢物进行分析,PLS-DA模型分析可以有效过滤掉与分类无关的信息以更为准确地发现代谢物在两类植物中的差异情况 [24]。从图4可以看出,通过PLS-DA方法能较好的将两类早春植物区分开(R2 = 0.987,Q2 = 0.514),早春植物样品主要分布在置信区间的左侧,而未开花植物样品分布在置信区间的右侧。
根据PLS-DA分析得到的投影变量权重值(VIP)来反映代谢物对分组的贡献大小,并结合t检验的结果值P值来筛选差异代谢物。当VIP > 1且P < 0.05时表明差异显著,数据处理后结果如图5,筛选出132种差异标志代谢物,包括18种氨基酸、18种糖和50种有机酸。
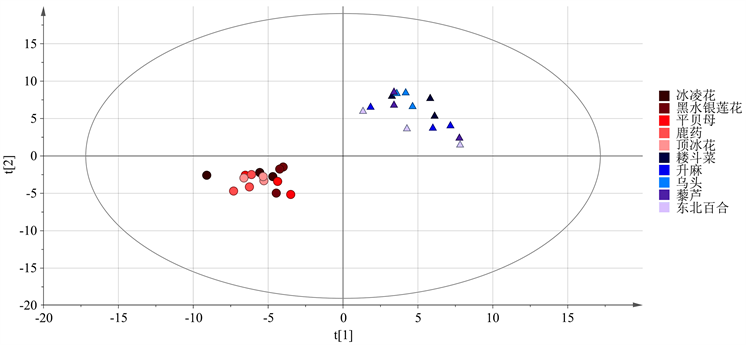
Figure 4. PLS-DA score map of two types of plant metabolites
图4. 两类植物代谢物PLS-DA得分图
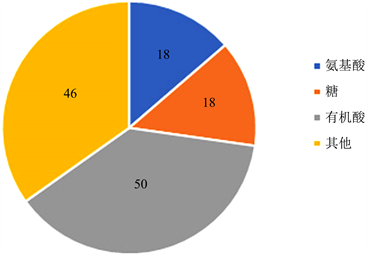
Figure 5. Number of different metabolites
图5. 各类差异代谢物数量
3.4.2. 差异代谢产物通路分析
为了探索两类植物的潜在差异代谢途径,我们将差异化合物导入到MetaboAnalyst数据库进行分析得到气泡图(图6),其中气泡大小代表影响因子大小,气泡越大影响因子越大;颜色深浅代表P值大小,颜色越深P值越大,差异代谢物积累程度越高 [25]。根据-log P值和途径影响得分,确定了与差异代谢物相关的代谢通路5条:氨酰-tRNA生物合成、丙氨酸,天冬氨酸和谷氨酸代谢、氰氨基酸代谢、甘氨酸,丝氨酸和苏氨酸代谢和苯丙氨酸代谢并标记在图6中,我们发现两类植物差异化合物影响较大的途径都与氨基酸代谢相关。
在表2和图7中显示的是参与代谢途径的主要代谢物的含量差异。其中,在丙氨酸,天冬氨酸和谷氨酸代谢途径中的差异代谢物富马酸、丙氨酸和甘氨酸,丝氨酸和苏氨酸代谢途径中的色氨酸,以及苯丙氨酸代谢途径中的苯丙氨酸、苯乙酸在早春开花植物中积累较多;氨酰-tRNA生物合成和氰氨基酸代谢途径中的差异代谢物在早春开花植物中都较少或几乎没有,同时甘氨酸,丝氨酸和苏氨酸代谢途径中的苏氨酸也在未开花植物中积累较多。
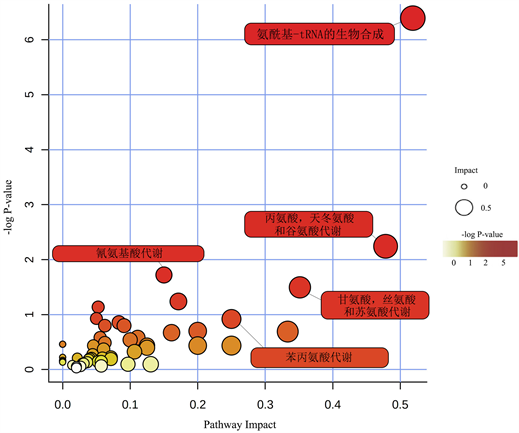
Figure 6. Number of different metabolites
图6. 各类差异代谢物数量
Table 2. Number of different metabolites
表2. 各类差异代谢物数量
注:↑和↓表明早春开花植物比未开花植物代谢物的上调和下调。
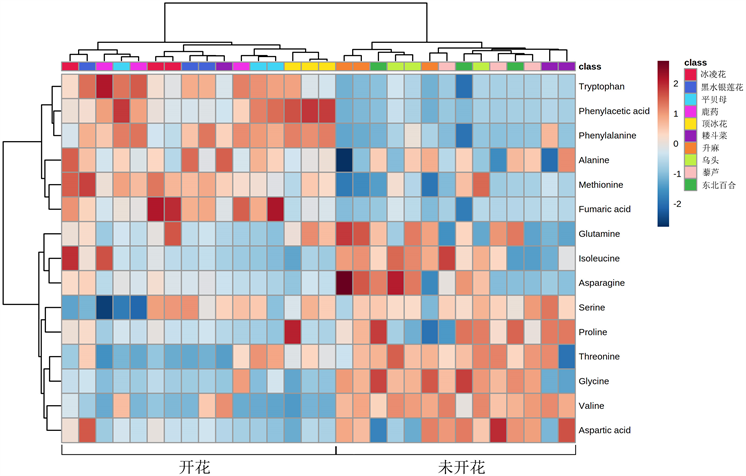
Figure 7. Differential metabolite heat map
图7. 差异代谢物热图
4. 讨论
早春植物作为落叶阔叶林下的特殊层具有指示性。它们能够适应寒冷的环境,同时,早春开花植物在独特的生存环境中能够诱导开花,完成营养生长到生殖生长的过程,因此,对早春开花植物的研究有助于更好地了解和利用这类特殊的植物类型。过去几十年的研究表明,植物的开花调控是一个复杂的过程,受许多因素调节 [26]。影响开花的环境胁迫因素主要包括光强、光质和光周期、高低温、干旱、营养元素和盐分等 [27]。对早春开花植物来说,早春林下低温潮湿的环境使得它们完成了开花诱导,在夏季到来之前结束生命周期进入休眠状态。已有研究证明,低温能够促进部分植物的开花,在拟南芥的一个祖先近源种Boechera stricta中,在25℃下的开花时间明显比在18℃下生长的植物开花时间要晚 [28];温度对开花的影响在野生草莓(Fragaria vesca L.)中也有报道,生长在低温下植株会提前开花 [29]。而对未开花植物来说,它们虽然在早春生存,但是花期都在7~9月份,它们在更高的环境温度下才能开花结实。
光合作用是植物生长发育的基础,为其生长发育提供了物质与能量 [30]。叶绿素含量的测定是一种间接估算植物生产力的方法,能够了解植物的光合作用能力。在大多数植物中,叶子是主要的光合作用组织,因此本实验对10种早春植物叶片的叶绿素含量进行测定,结果发现早春开花植物的叶绿素a、叶绿素b和总叶绿素均低于未开花植物(图1),植物在开花期间光合作用降低。影响叶绿素生物合成的因素有很多,例如,原叶绿素代谢还原为叶绿素替代物需要原叶绿素氧化物氧化还原酶的催化,这一步需要光。同时,叶绿素的生物合成需要一系列的酶促反应,过高的高温和低温都会抑制酶促反应,甚至破坏诱发的叶绿素 [31]。另外,叶绿体内的pH值以及酶反应所需要的是NADPH和ATP的类型和浓度也会影响叶绿素的合成。早春开花植物叶绿素含量的大量减少可能是由于植物将更多的能量用于对开花的调控,或许为早春植物的研究提供新资料。
糖与植物激素一样可以作为信号分子存在,并在植物生长、成熟和衰老等许多过程中发挥调节作用 [32]。早春开花植物的可溶性糖含量显著高于未开花植物的可溶性糖含量(图2),这表明早春开花植物在开花过程中消耗大量的养分,例如碳水化合物等营养物质。许多研究也表明,碳水化合物和其他营养物质的含量与花芽分化有关,这个过程使植物开花 [33] [34]。早春开花植物的可溶性蛋白质含量较未开花植物显著降低(图3),表明早春开花植物的氮代谢降低,这可能是早春开花植物在低温环境下诱导开花的策略。刘连涛等人 [35] 认为缺乏氮营养会导致植物中叶绿素和可溶性蛋白的含量减少。部分学者研究了开花期间的碳和氮代谢,如王小红等 [36] 的研究得出,水竹在开花后其碳代谢增强,与此同时氮代谢降低。从本研究早春开花植物开花与未开花植物的可溶性糖和可溶性蛋白质的含量变化(图2和图3)中也揭示出植物开花后碳代谢增强,氮代谢降低。另外,本研究结果还显示早春开花植物的可溶性糖含量显著高于未开花植物,而可溶性蛋白质含量较未开花植物表现出显著降低。推测可溶性糖含量和可溶性蛋白质含量之间存在一定的相关性,戴庆敏等人 [37] 认为可溶性糖和氮含量之间存在非常显著的负相关。
当植物从营养生长转变为生殖生长时,它们的代谢活跃,并发生一系列生理和生化变化 [15]。探索早春开花植物适应外部低温环境的开花机制,是更好地开发利用早春植物的必要条件。代谢组学是一种有用的方法,能够获得整个有机体影响途径的概述。通过差异代谢物确定的代谢途径代表了早春开花植物的典型特征 [38]。在本研究中,我们利用GC-MS技术及非靶向代谢组学的研究策略研究了早春开花植物和未开花植物样品的初生代谢差异,由图5可以看出,在两种植物样品中共筛选出132种差异标志代谢物,包括18种氨基酸、18种糖和50种有机酸。富集分析初步确定了早春开花植物的5个关键代谢途径:氨酰-tRNA生物合成、丙氨酸,天冬氨酸和谷氨酸代谢、氰氨基酸代谢、甘氨酸,丝氨酸和苏氨酸的代谢和苯丙氨酸代谢(图6),这些代谢途径都与氨基酸相关。通常,氨基酸代谢与能量和碳水化合物代谢、碳氮平衡以及蛋白质合成、次级代谢需求密切相关 [39]。由图7结果显示,在参与代谢途径的15种氨基酸中,富马酸、丙氨酸、色氨酸、苯丙氨酸、苯乙酸在早春开花植物中显著积累,其他10种氨基酸积累很少。早春开花植物氨酰-tRNA生物合成途径中的谷氨酰胺、蛋氨酸、异亮氨酸等差异代谢物积累很少,氨酰-tRNA生物合成是形成蛋白质的重要通路,在蛋白质的生物合成中,氨酰-tRNA是氨基酸转移到肽链过程的中间物,有着许多重要的生理作用 [40],早春开花植物中谷氨酰胺等差异化合物的较低含量与可溶性蛋白含量的结果一致。我们发现,富马酸和丙氨酸,天冬氨酸和谷氨酸代谢途径中的丙氨酸在早春植物中积累较多,表明早春开花植物需要消耗更高的能量 [41],以确保早春开花植物的开花,这也是一种早春植物低温诱导开花的适应策略。另外,甘氨酸,丝氨酸和苏氨酸的代谢途径中的色氨酸在早春开花植物中显著积累,色氨酸不仅是蛋白质合成的重要组成部分,还是合成许多生物活性分子(如植物生长素,色胺衍生物,萜类吲哚生物碱)中必不可少,在调节植物生长发育中起关键作用 [42]。此外,脯氨酸在早春开花植物中积累较少,脯氨酸是代谢产物中重要的渗透调节物质,还可作为含氮的储藏物质 [43]。苯丙氨酸代谢途径中的苯丙氨酸和苯乙酸在早春开花植物中积累较多,在植物中,苯丙氨酸是蛋白质生物合成和细胞存活所必需的,还充当大量多功能次级代谢产物的前体,促进植物芳香族化合物的合成 [44]。总之,外界的低温环境诱导早春开花植物完成对开花的调控,使早春开花植物的氮代谢减弱,并消耗大量的碳水化合物以满足开花过程的能量损耗,产生大量多功能次级代谢产物。这从初生代谢的角度为早春开花植物的认识提供了一定的理论依据。
5. 结论
本研究通过对早春开花植物的生理和代谢组学数据的分析,探究了早春开花植物的生理与代谢特性:早春开花植物的叶绿素含量和可溶性蛋白含量较低,可溶性糖含量升高,揭示出早春开花植物的碳代谢增强,氮代谢降低。此外,通过比较早春开花植物和未开花植物的代谢组学分析表明,早春开花植物的氨基酸代谢途径是与未开花植物的主要区别,是区分早春开花植物的特征,关键途径中的富马酸、丙氨酸、色氨酸、苯丙氨酸、苯乙酸差异化合物在早春开花植物中显著积累,说明早春开花植物的氮代谢减弱,消耗大量的碳水化合物以满足开花过程的能量损耗。这些研究结果有助于对早春开花植物的了解,并为今后早春开花植物的技术栽培、开发利用提供了理论基础。
基金项目
感谢科技基础性资源调查专项(2019FY100500)的资助。
文章引用
闫 雪,刘 佳,吴可心,唐玉情,刘 洋,唐中华. 东北阔叶林下早春开花植物的生理与代谢特性研究
Study on Physiological and Metabolic Characteristics of Early Spring Flowering Plants in Northeast Broad-Leaved Forest[J]. 植物学研究, 2021, 10(03): 246-258. https://doi.org/10.12677/BR.2021.103035
参考文献
- 1. 李盼华. 低温胁迫对早春开花植物花器官抗寒性及花色的影响[D]: [硕士学位论文]. 保定: 河北农业大学, 2011.
- 2. 刘晓铃, 强玉丰, 刘加, 谢树莲. 太原市早春开花植物的初步研究[J]. 山西大学学报(自然科学版), 2001, 24(3): 251-254.
- 3. 刘景强. 浑河源地区野生早春开花草本植物资源的初步调查及开发利用[J]. 防护林科技, 2015(11): 78-79.
- 4. 李群, 王萌, 阮成江. 五种早春开花木本植物花粉萌发的研究[J]. 北方园艺, 2013(21): 73-76.
- 5. 李晓靖. 10种早春开花树种抗寒性研究[J]. 安徽农学通报, 2018, 24(10): 98-100+112.
- 6. 韩立群. 野生东北百合生殖生态学研究[D]: [硕士学位论文]. 哈尔滨: 东北林业大学, 2011.
- 7. 赵亮. 毛茛族(毛茛科)的系统学研究[D]: [硕士学位论文]. 西安: 陕西师范大学, 2008.
- 8. 唐自慧, 逄云莉, 何兴金, 刘海艳. 鹿药属植物叶表皮特征及其系统学意义[J]. 武汉植物学研究, 2007, 25(6): 550-557.
- 9. 王阿香. 侧金盏(Adonis amurensis Regel et Radde)花芽分化和胚胎发育特性研究[D]: [硕士学位论文]. 哈尔滨: 东北林业大学, 2016.
- 10. 韩立群, 王晓丽, 刘杰, 周蕴薇. 野生东北百合开花生物学研究[J]. 北方园艺, 2011(13): 91-93.
- 11. 黄广欣, 龚苏晓, 许浚, 姚奕, 张铁军, 刘昌孝. 升麻研究进展及其质量标志物的预测分析[J]. 中草药, 2020, 51(10): 2651-2660.
- 12. 张岩, 黄晓君, 王英, 叶文才. 黑水银莲花根茎中的非皂苷类成分研究[J]. 食品工业, 2014, 35(3): 99-101.
- 13. 赵淑杰, 洪波, 韩忠明, 杨利民. 鹿药化学成分及其抗肿瘤活性[J]. 中成药, 2016, 38(2): 332-335.
- 14. 徐孝琦, 徐孝玮. 贝母的研究综述[J]. 求医问药(下半月), 2013, 11(2): 319-320.
- 15. Obata, T. and Fernie, A. (2012) The Use of Metabolomics to Dissect Plant Responses to Abiotic Stresses. Cellular and Molecular Life Sciences, 69, 3225-3243. https://doi.org/10.1007/s00018-012-1091-5
- 16. Hao, R., Wang, Z., Yang, C., Deng, Y., Zheng, Z. and Wang, Q. (2018) Metabolomic Responses of Juvenile Pearl Oyster Pinctada maxima to Different Growth Performances. Aquaculture, 491, 258-265. https://doi.org/10.1016/j.aquaculture.2018.03.050
- 17. Liu, J., Liu, Y., Wu, K., Pan, L. and Tang, Z.H. (2020) Comparative Analysis of Metabolite Profiles from Panax Herbs in Specific Tissues and Cultivation Conditions Reveals the Strategy of Accumulation. Journal of Pharmaceutical and Biomedical Analysis, 188, Article ID: 113368. https://doi.org/10.1016/j.jpba.2020.113368
- 18. Liu, J., Kang, R., Liu, Y., Wu, K.X. and Tang, Z.H. (2020) Differential Metabolite Accumulation in Different Tissues of Gleditsia sinensis under Water Stress and Rehydration Conditions. Forests, 11, 542. https://doi.org/10.3390/f11050542
- 19. 山雨思, 代欢欢, 何潇, 辛正琦, 吴能表. 外源茉莉酸甲酯和水杨酸对盐胁迫下颠茄生理特性和次生代谢的影响[J]. 植物生理学报, 2019, 55(9): 63-74.
- 20. 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 21-22.
- 21. 曲春香, 沈颂东, 王雪峰, 崔永华, 宋卫平. 用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究[J]. 苏州大学学报: 自然科学版, 2006, 22(2): 82-85.
- 22. Styczynski, M.P., Moxley, J.F., Tong, L.V., Walther, J.L., Jensen, K.L. and Stephanopoulos, G.N. (2007) Systematic Identification of Conserved Metabolites in GC/MS Data for Metabolomics and Biomarker Discovery. Analytical Chemistry, 79, 966-973. https://doi.org/10.1021/ac0614846
- 23. 潘瑞炽, 董愚得. 植物生理学[M]. 第3版. 北京: 高等教育出版社, 1995: 54-56.
- 24. Westerhuis, J.A., van Velzen, E.J., Hoefsloot, H.C. and Smilde, A.K. (2010) Multivariate Paired Data Analysis: Multilevel PLSDA versus OPLSDA. Metabolomics, 6, 119-128. https://doi.org/10.1007/s11306-009-0185-z
- 25. 刘海叶. 基于代谢组学的养阴益肺方治疗慢性阻塞性肺疾病稳定期肺气阴两虚证作用机制研究[D]: [博士学位论文]. 石家庄: 河北医科大学, 2017.
- 26. Chen, Y., Shen, Q., Lin, R., Zhao, Z., Shen, C. and Sun, C. (2017) De Novo Transcriptome Analysis in Dendrobium and Identification of Critical Genes Associated with Flowering. Plant Physiology and Biochemistry, 119, 319-327. https://doi.org/10.1016/j.plaphy.2017.09.008
- 27. Wada, K.C. and Takeno, K. (2010) Stress-Induced Flowering. Plant Signaling & Behavior, 5, 944-947. https://doi.org/10.4161/psb.5.8.11826
- 28. Anderson, J.T., Lee, C.R. and Mitchell-Olds, T. (2011) Life-History QTLS and Natural Selection on Flowering Time in Boechera stricta, a Perennial Relative of Arabidopsis. Evolution, 65, 771-787. https://doi.org/10.1111/j.1558-5646.2010.01175.x
- 29. Rantanen, M., Kurokura, T., Jiang, P., Mouhu, K. and Hytnen, T. (2015) Strawberry Homolog of TERMINAL FLOWER1 Integrates Photoperiod and Temperature Signals to Inhibit Flowering. The Plant Journal, 82, 163-173. https://doi.org/10.1111/tpj.12809
- 30. Peng, C., Yan, K., Shao, H., Zhao, S. and Gomes, F.P. (2013) Physiological Mechanisms for High Salt Tolerance in Wild Soybean (Glycine soja) from Yellow River Delta, China: Photosynthesis, Osmotic Regulation, Ion Flux and antioxidant Capacity. PLoS ONE, 8, e83227. https://doi.org/10.1371/journal.pone.0083227
- 31. Babu, S.M. and Ranganathan, S. (2014) The Total Synthesis of Chlorophyll. Resonance, 19, 645-648. https://doi.org/10.1007/s12045-014-0066-2
- 32. He, C., Liu, X., Silva, J., Liu, N. and Duan, J. (2020) Transcriptome Sequencing and Metabolite Profiling Analyses Provide Comprehensive Insight into Molecular Mechanisms of Flower Development in Dendrobium officinale (Orchidaceae). Plant Molecular Biology, 104, 529-548. https://doi.org/10.1007/s11103-020-01058-z
- 33. 张莹婷, 杨秀莲, 何岭, 王良桂. 2种石蒜花芽分化与碳水化合物,抗氧化物酶及内源激素变化的关系[J]. 安徽农业大学学报, 2019, 46(2): 342-349.
- 34. 吴玲利, 李建安, 王楠. 低温胁迫对两个油茶品种开花结实及生理特性的影响[J]. 植物生理学报, 2020, 56(4): 681-692.
- 35. 刘连涛, 李存东, 孙红春. 氮素营养水平对棉花不同部位叶片衰老的生理效应[J]. 植物营养与肥料学报, 2007, 13(5): 910-914.
- 36. 王小红, 周祖基. 水竹开花期间碳氮代谢特性[J]. 林业科学, 2008, 44(4): 35-40.
- 37. 戴庆敏, 徐传保. 大花蕙兰花芽发育期开花株与不开花株可溶性糖含量比较[J]. 山东林业科技, 2010, 40(3): 39-40+21.
- 38. Ma, Q.Q., et al. (2017) The Metabolomics Responses of Chinese Mitten-Hand Crab (Eriocheir sinensis) to Different Dietary Oils. Aquaculture, 479, 188-199. https://doi.org/10.1016/j.aquaculture.2017.05.032
- 39. Zhao, Y., Zhao, J. and Zhao, C. (2015) A Metabolomics Study Delineating Geographical Location-Associated Metabolic Changes in the Leaves of Growing Tobacco Plants. Scientific Reports, 5, Article No. 16346. https://doi.org/10.1038/srep16346
- 40. 唐小涵, 刘世家, 刘喜. 色氨酰-tRNA合成酶基因WRS1调控水稻种子发育[J]. 中国水稻科学, 2020, 34(5): 3-16.
- 41. Zhang, Y., Swart, C. and Alseekh, S. (2018) The Extra-Pathway Interactome of the TCA Cycle: Expected and Unexpected Metabolic Interactions. Plant Physiology, 177, 966-979. https://doi.org/10.1104/pp.17.01687
- 42. 苗玉焕. 色氨酸代谢与棉花抗黄萎病免疫调控[D]: [博士学位论文]. 武汉: 华中农业大学, 2019.
- 43. 刘红玲, 张新婉, 黄玮, 张艳鸽, 赵华. 植物氨基酸转运子研究进展[J]. 植物科学学报, 2018, 36(4): 623-631.
- 44. Kim, H.J., Chen, F., Wang, X. and Rajapakse, N.C. (2006) Effect of Methyl Jasmonate on Secondary Metabolites of Sweet Basil (Ocimum basilicum L.). Journal of Agricultural and Food Chemistry, 54, 2327-2332. https://doi.org/10.1021/jf051979g
NOTES
*通讯作者。
