Botanical Research
Vol.
11
No.
05
(
2022
), Article ID:
56288
,
7
pages
10.12677/BR.2022.115072
黍子愈伤组织诱导与再生分化最适条件探究
史慎奎1,王春芳1*,祁东梅1,王玉芳1,王冰嵩2,栾素荣2,姜海红3,张温典1,李瑞来4, 高颖1
1河北民族师范学院生物与食品科学学院,河北 承德
2承德市农林科学院,河北 承德
3平泉市林业草原局,河北 承德
4河北省农业广播电视学校承德县分校,河北 承德
收稿日期:2022年8月19日;录用日期:2022年9月16日;发布日期:2022年9月26日

摘要
本研究以龙黍21茎尖为实验材料,不受环境、地域影响,通过植物组织培养,统计愈伤组织诱导率、发芽率等,探究诱导愈伤及分化再生苗的最适激素种类和浓度,为今后黍子茎尖愈伤组织再生体系的建立提供参考数据。研究表明,在激素2,4-D、NAA、ZT中,最适合龙黍21茎尖诱导愈伤组织的激素种类是2,4-D,最适合的2,4-D诱导浓度为3 mg/L;NAA及ZT均不适宜其诱导。在激素KT、6-BA、TDZ中,最适合龙黍21茎尖愈伤组织再分化生苗的激素种类是2,4-D+KT,最适合的KT诱导浓度为4 mg/L;2,4-D+TDZ次之,偶有出芽现象;2,4-D+6-BA不曾诱导出苗,最不适宜。在激素KT、6-BA、TDZ中,最适合龙黍21茎尖愈伤组织再分化生苗的激素种类是2,4-D+TDZ,最适合的TDZ诱导浓度为1 mg/L。
关键词
黍子,组织培养,激素配比,最适条件

Investigation of Optimal Conditions for Induction and Regeneration Differentiation of Proso Millet Callus
Shenkui Shi1, Chunfang Wang1*, Dongmei Qi1, Yufang Wang1, Bingsong Wang2, Surong Luan2, Haihong Jiang3, Wendian Zhang1, Ruilai Li4, Ying Gao1
1School of Biology and Food Science, Hebei Normal University for Nationalities, Chengde Hebei
2Chengde Academy of Agriculture and Forestry Sciences, Chengde Hebei
3Chengde Forestry and Grassland Administration, Chengde Hebei
4Chengde County Branch of Hebei Agricultural Radio and Television School, Chengde Hebei
Received: Aug. 19th, 2022; accepted: Sep. 16th, 2022; published: Sep. 26th, 2022

ABSTRACT
In this experiment, the stem tips of Longshu 21 were used as experimental materials, which were not affected by the environment and region. Through plant tissue culture, the induction rate and germination rate of callus were counted, and the optimal hormone types and concentration of callus induction and differentiation regeneration seedlings were explored, which provided reference data for the establishment of the callus regeneration system of proso millet stem tips in the future. Among hormones 2,4-D, NAA and ZT, 2,4-D was the most suitable hormone for callus induction from the shoot tip of Longshu21, and the most suitable concentration of 2,4-D was 3 mg/L; NAA and ZT were not suitable for callus induction. Among hormones KT, 6BA and TDZ, KT was the most suitable hormone for regeneration of shoot tip callus of Longshu 21, and the most suitable concentration of KT was 4 mg/L; followed by 2,4-D+TDZ, there were occasional budding phenomena; 2,4-D+6BA did not induce seedling emergence, which was the most inappropriate. Among hormones KT, 6-BA and TDZ, the most suitable hormone for regeneration of shoot-tip callus was 2,4-D+TDZ, and the most suitable concentration of TDZ was 1 mg/L.
Keywords:Proso Millet, Tissue Culture, Hormone Ratio, Optimal Conditions

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
黍子(Panicum miliaceum L.)起源于中国,属“五谷”之一,是我国重要的杂粮作物 [1],栽培历史悠久,种植区域广泛,尤其在我国的华北、西北等地栽培甚广,其早熟、耐瘠、耐旱的特点使其成为主要的粮食作物和重要的抗旱救灾作物,但生产上品种混杂单一、效益较低等问题仍然存在 [2] [3] [4]。
随着黍子资源的需求日益增长,然而目前种植的黍子优质品种资源有限,其遗传育种仍然处于传统育种阶段,尚未进入到分子育种阶段,阻碍了其遗传改良的进度。为了推动黍子育种水平的提升,增强基因的利用效率,建立稳定高效的黍子遗传转化体系是提高黍子育种效率的重要一步,其中的再生体系的构建是遗传转化体系的重要组成部分,因此,有必要建立黍子高效的再生体系。目前,尽管黍子有关此方面的研究比较少,但王寒玉等优化了与黍子类似,同属禾本科植物的谷子的组培条件,得出激素2,4-D对其重要性 [5];黄娟等探究了不同外植体对组织培养的影响,从中可见选用茎尖的优势 [6];刘琴等说明了激素对营养繁殖的重要性 [7];多项研究显示利用茎尖作为外植体,对再生体系的建立进行探究,并得到不错的效果 [8] [9] [10]。目前,在黍子再生体系构建上,激素是最关键的影响因素之一,由于有关激素种类与浓度的调配还不成熟,未见到高效的黍子愈伤组织再生体系的研究报道 [11]。
利用黍子茎尖作为外植体的一个很大的优点就是不受环境、地域影响 [12],本研究采用适合本地区栽培的黍子品种龙黍21为实验材料,利用茎尖对诱导黍子愈伤组织及分化再生苗的最适条件进行初步探究,主要通过统计愈伤组织诱导率、发芽率等,找到其最适激素种类和浓度,为今后黍子茎尖愈伤组织再生体系的建立提供参考数据,为功能基因和基因工程的研究打下基础。
2. 材料和方法
2.1. 材料
本研究采用的黍子品种是龙黍21,为本地区搜集到的适合承德地区栽培的现代育成种,其愈伤组织诱导的种子材料由黑龙江农林科学院提供。
2.2. 方法
2.2.1. 种子的消毒及接种
先用75%的乙醇润洗种子2次(每次时间不超30 s),将不饱满的种子及杂质漂洗倒掉。然后,将种子浸泡在0.1%升汞中5 min,期间不断摇晃,在连续振荡期间,升汞溶液对种子和烧杯内壁进行充分消毒。最后,将种子用消毒蒸馏水洗涤3次,洗去残余升汞,灭菌完成 [13]。而后进行接种,用镊子将种子在MS培养基平板中整齐排布。接种结束后,火焰迅速灼烧封口处后密封,放入培养箱中培养。
2.2.2. 外植体的获得
外植体的获得要在种子茎尖长到1 cm左右时,在超净工作台上进行操作,用镊子将其放到大培养皿滤纸上并轻轻按住一端,用解剖刀将茎尖平切成小段,放入小烧杯。为保证无菌环境,解剖刀、镊子不可过长时间不间断使用,使用过程中约每两盘后用消毒器消毒,冷却后使用,防止损伤茎尖。
2.2.3. 茎尖的消毒与愈伤组织的诱导
本步骤和种子的消毒及接种其步骤大致相同,不同之处在于需在各锥形瓶中加入激素,摇晃混匀。灭菌步骤也略有不同,灭菌第二步换用2% NaClO浸泡25 min,其他步骤相同。灭菌完成后,用镊子将茎尖从小烧杯中移入到滤纸上,吸去多余水分后接种到各培养皿上,灼烧封口、做好记录工作并放入培养箱中培养,每两周继代1次,及时切去幼芽和根状体,继代2次最终得到愈伤组织 [14]。
2.2.4. 苗与根的分化
对于黍子苗与根的生长,在操作时要选用优质的愈伤组织,进行再分化。依据细胞分裂素和细胞生长素的不同比例,可促进植物根与苗在不同方向上的分化,从而设置不同配比 [14] [15]。在无菌条件下,将优质黍子愈伤组织分别接种到各不同分化培养基上。用灭菌好的镊子在生长培养基上轻轻夹起愈伤,将其放入到小瓶中,每瓶可放1~2颗,尽可能的不碰到瓶壁,防止污染,外焰灼烧瓶口后用盖子盖上。放入光照培养箱中进行培养,约20天后进行观察,并统计其分化情况 [14] [15]。
2.2.5. 所用激素种类及浓度
诱导愈伤组织选用激素2,4-D、NAA及ZT;愈伤组织再分化苗激素浓度的选择:培养皿中添加2,4-D浓度3.0 mg/L,TDZ、KT和6-BA浓度分别从3.25 mg/L以0.25 mg/L为1个梯度至7.5 mg/L;分化根激素浓度的选择:培养皿中添加2,4-D浓度3.0 mg/L,TDZ、KT和6-BA浓度分别从0.25 mg/L以0.25 mg/L为1个梯度至2.75 mg/L [14] [15] [16]。
2.2.6. 数据统计与分析
用激素对黍子品种龙黍21进行诱导,测定它在不同浓度条件下的愈伤组织诱导率及分化率,数据统计方法如下 [15] [16]:
愈伤组织诱导率(%) = 诱导出愈伤组织茎尖数/接种茎尖总数 × 100%
芽分化率(%) = 产生绿芽的愈伤组织块数/接种愈伤组织总块数 × 100%
根分化率(%) = 产生根的愈伤组织块数/接种愈伤组织总块数 × 100%
3. 结果与分析
3.1. 黍子茎尖消毒最适时间
在实验过程中,由于黍子茎尖的消毒效果总是不够理想,本研究的消毒方式是采用与黍子非常类似的谷子的消毒方式:先75%的乙醇润洗2次(每次时间不超30 s),然后2% NaClO浸泡15 min,最后用已灭菌好的蒸馏水清洗3次,洗去残余NaClO,灭菌完成。但在实验进程中,消毒效果不够理想,染菌的现象时有发生,对实验的进一步操作带来严重影响,故以5分钟为1个梯度,对消毒时间从10 min至30 min的消毒效果进行探究。发现龙黍21茎尖消毒时间为25 min时,最不易染菌,消毒效果最为理想,愈伤生长质量最好。
3.2. 不同种类及浓度激素对诱导愈伤组织的影响
本研究选用激素2,4-D、NAA及ZT,激素浓度以0.5 mg/L为1个梯度从1 mg/L至4 mg/L (表1)。在不同种类及浓度激素的培养基上接种黍子茎尖,每个浓度每次做3~5盘,培养2周后,将愈伤继代培养,进一步观察愈伤生长状态,重复试验3次,统计结果保证实验的准确性。发现添加2,4-D为3.0 mg/L,愈伤组织诱导率最高(40%),其他激素种类及浓度效果均不理想(图1)。
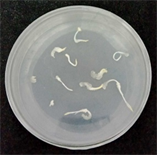 (a) TDZ 2.0 mg/L
(a) TDZ 2.0 mg/L
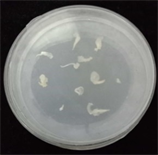 (b) 1.0 mg/L 2,4-D
(b) 1.0 mg/L 2,4-D
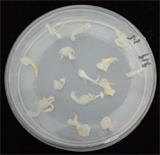 (c) 2.0 mg/L 2,4-D
(c) 2.0 mg/L 2,4-D
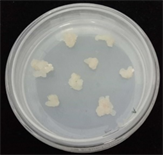 (d) 2,4-D 3.0 mg/L
(d) 2,4-D 3.0 mg/L
Figure 1. Effects of 2,4-D and TDZ on callus induction
图1. 2,4-D、TDZ对愈伤诱导的影响
Table 1. Callus induction rate of different concentrations of 2,4-D
表1. 不同浓度2,4-D的愈伤诱导率
3.3. 不同种类及浓度激素对愈伤诱导芽的影响
测定各激素条件下,优质愈伤分化苗的百分率。无菌条件下,设置不同细胞分裂素和生长素的配比,2,4-D+KT,2,4-D+TDZ,2,4-D+6BA设置浓度梯度(表2),激素浓度以0.5 mg/L为1个梯度从3.5 mg/L至7.5 mg/L,每梯度5瓶,重复3次,将龙黍21号愈伤接种在培养瓶中,暗培养25℃,8 h;光培养28℃,16 h,发现添加2,4-D+6BA对龙黍21号愈伤再分化的效果不明显,没有明显的出芽现象,2,4-D+TDZ次之,2,4-D浓度为3 mg/L + KT浓度为4 mg/L时出现明显的嫩芽,愈伤分化率最高(10%),并且愈伤组织褐化较轻,质地紧密,生长状况良好(图2)。
 (a) 4.0 mg/L KT培养瓶图
(a) 4.0 mg/L KT培养瓶图
 (b) 4.0 mg/L KT细节放大图
(b) 4.0 mg/L KT细节放大图
Figure 2. Effects of KT on bud differentiation rate of callus buds
图2. KT激素对愈伤芽分化率的影响
Table 2. Differentiation rate of callus buds with different concentrations of KT
表2. 不同浓度KT的愈伤芽分化率
注:“*”表示愈伤组织的褐化程度。
3.4. 不同种类及浓度激素对愈伤诱导根的影响
测定各激素条件下,优质愈伤分化根的百分率。无菌条件下,设置不同细胞分裂素和生长素的配比,2,4-D+KT,2,4-D+TDZ,2,4-D+6BA设置浓度梯度,激素浓度以0.5 mg/L为1个梯度从0.5 mg/L至4 mg/L,每梯度5瓶,重复3次,将龙黍21号愈伤接种在培养瓶中,暗培养25℃,8 h;光培养28℃,16 h,将愈伤组织接种于不同种类及浓度激素的培养基上,经多次操作,发现在TDZ为1 mg/L有生根情况(图3)。

Figure 3. Effects of TDZ on induced root differentiation rate
图3. 激素TDZ对诱导根分化率的影响
4. 讨论
4.1. 愈伤组织诱导的条件
本研究在探究诱导黍子愈伤组织的最适条件时,参考本实验室诱导谷子愈伤组织最适激素种类均为生长素,故而采用生长素2,4-D,ZT,NAA对与谷子类似的黍子进行探究,激素ZT与NAA对黍子愈伤组织诱导状况不佳,激素浓度以0.5 mg/L为1个梯度,从0.5 mg/L至4 mg/L,均诱导率极低,且愈伤生长状况差,不适宜龙黍21愈伤的诱导,激素2,4-D相比上两种激素来讲,对龙黍21愈伤的诱导情况则大为好转,诱导率大大提高,愈伤质量更为优质,更适于龙黍21愈伤组织的诱导,这与本实验室对谷子愈伤组织诱导情况的探究基本类似 [14] [15]。
4.2. 愈伤组织再分化的条件
关于龙黍21愈伤组织芽的再分化,本研究设置了较为广泛的测定范围,和较为细致的浓度梯度,发现添加2,4-D+6BA对龙黍21号愈伤再分化的效果不佳,重复实验多次,均没有明显的出芽现象;2,4-D+TDZ次之,在2,4-D浓度为3 mg/L + TDZ浓度为4.5 mg/L时偶有类似出芽现象,但芽苗极短,细弱,且并不是每次都会发生;2,4-D浓度为3 mg/L + KT浓度为4 mg/L时出现明显的嫩芽,愈伤分化率最高(10%),并且愈伤组织质地紧密,生长状况良好 [15]。
关于龙黍21愈伤组织根的再分化,同样为了保证实验的准确性,设置了较为宽泛的测定范围和较为细致的浓度梯度,且重复实验多次,与生芽类似,生根同样采用KT、TDZ及6BA三种激素,发现在TDZ为1 mg/L有生根情况,但多次按照同样情况操作未能重复出现生根现象,可能有以下几种原因:① 愈伤生长状况不同,影响根的分化;② 培养条件与出现生根情况时略有不同,影响根的分化;③ 本研究所设置的激素种类组合及浓度配比不够细化 [16]。
综上所述,对于龙黍21根部的再分化,本研究发现在TDZ为1 mg/L时有生根现象,但现象难以重复,具体原因及条件仍需要进一步的探究。
5. 结论
通过探究不同种类激素浓度对黍子龙黍21茎尖愈伤组织诱导及再分化的影响,发现愈伤组织诱导的最适合激素为2,4-D,诱导浓度为3 mg/L,诱导率达到40%;愈伤组织再分化苗最适合激素为2,4-D+KT,最适KT浓度为4 mg/L,分化率为10%,生长状况最佳;愈伤组织再分化生根的最适合激素为2,4-D+TDZ,最适TDZ浓度为1 mg/L,但重复效果不佳,具体原因及条件仍需进一步的探究。本研究为黍子再生体系的建立提供了初步的依据,为进一步建立黍子再生体系奠定基础。
基金项目
本研究得到2020年承德市科学技术研究与发展计划项目(202002A054)、2021年承德市基础研究项目(202109A196)、2020年度承德高新区“汇智领创空间”项目(HZLC2021008)和2016年河北民族师范学院青年基金项目(QN201601)的资助。
文章引用
史慎奎,王春芳,祁东梅,王玉芳,王冰嵩,栾素荣,姜海红,张温典,李瑞来,高 颖. 黍子愈伤组织诱导与再生分化最适条件探究
Investigation of Optimal Conditions for Induction and Regeneration Differentiation of Proso Millet Callus[J]. 植物学研究, 2022, 11(05): 597-603. https://doi.org/10.12677/BR.2022.115072
参考文献
- 1. 傅永斌, 许建铭, 奚玉银, 任全军, 赵海洋, 王建文. 冀北黍子产业生产概况及发展对策[J]. 河北北方学院学报(自然科学版), 2012, 28(4): 56-58.
- 2. 胡兴雨, 王纶, 张宗文, 陆平, 张红生. 中国黍稷核心种质的构建[J]. 中国农业科学, 2008, 41(11): 3489-3502.
- 3. 杨如达, 杨富, 李海, 林凤仙. 山西省黍子产业现状及发展对策[J]. 农业科技通讯, 2014(5): 10-12.
- 4. 温兰杰. 北方糜子高产优质栽培技术[J]. 科学种养, 2013(3): 15.
- 5. 王寒玉. 谷子愈伤诱导优化及转化影响因素分析[D]: [硕士学位论文]. 保定: 河北农业大学, 2012.
- 6. 黄娟. 杉木不同外植体愈伤组织诱导及植株再生[D]: [硕士学位论文]. 福州: 福建农林大学, 2017.
- 7. 刘琴. 山葵(Wasabi japonica Matsum)组培快繁的关键技术研究[D]: [硕士学位论文]. 南京: 南京农业大学, 2002.
- 8. 徐启红, 王之成, 任平国, 张胜, 侯凯. 影响草莓茎尖快繁因素的分析[J]. 安徽农业科学, 2008, 36(22): 9403-9404+9407.
- 9. 牛俊乐, 黄斌政, 潘彩娟, 苏仕林, 晋文金. 百香果茎段培养技术探究[J]. 安徽农学通报, 2018, 24(15): 24-25+28.
- 10. 周利利. 蝴蝶兰组培快繁体系的建立[D]: [硕士学位论文]. 杭州: 浙江农林大学, 2017.
- 11. 乔治军. 糜子产业发展现状与思路[J]. 作物杂志, 2013(5): 25-27.
- 12. Neuman, R.E. and Mccoy, T.A. (1955) A Simple Assay Procedure for Materials and Conditions in Tissue Culture. Experimental Cell Research, 9, 212-220. https://doi.org/10.1016/0014-4827(55)90095-1
- 13. 丰锋, 陈建国, 李洪波. 植物组织培养无菌操作技术[J]. 中国花卉盆景, 2002(1): 30-31.
- 14. 王节之, 张海风, 郑向阳, 等. 常用激素对谷子幼穗组培的影响[J]. 山西农业科学, 1998, 26(3): 40-43.
- 15. 王春芳, 刘晶晶, 李伟, 等. 糜子愈伤诱导及再分化最适条件研究[J]. 中国农学通报, 2020, 36(9): 94-99.
- 16. 刁现民, 段胜军, 赵连元, 等. 金色狗尾草的组织培养和植株再生[J]. 植物生理学通讯, 1997, 33(2): 128-129.
NOTES
*通讯作者。
