Journal of Advances in Physical Chemistry
Vol.04 No.02(2015), Article ID:15362,6
pages
10.12677/JAPC.2015.42010
A Liquid Phase Method Combined with Freeze-Drying Technique to Lithium Silicate Materials and Their Carbon Dioxide Absorption Properties at High Temperatures
Yi Tong, Xueqin Huang, Chunhui Xu, Qiang Xiao, Yijun Zhong, Weidong Zhu
Key Laboratory of the Ministry of Education for Advanced Catalysis Materials, Institute of Physical Chemistry, Zhejiang Normal University, Jinhua Zhejiang
Email: 824838212@qq.com
Received: May 9th, 2015; accepted: May 25th, 2015; published: May 29th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
A liquid phase method combined with the freeze-drying technique was developed to synthesize Li4SiO4 materials using LiOH∙H2O, LiNO3, Li2CO3 and silica sol as the lithium and silicon sources, respectively. The weight loss behaviors of the prepared Li4SiO4 precursors were investigated by the thermal gravimetric analysis (TGA). The structure and morphology of the prepared Li4SiO4 materials were characterized by XRD and SEM, respectively. The CO2 absorption properties of prepared Li4SiO4 were investigated by thermal gravimetric analysis (TGA). The results show that the Li4SiO4 material prepared using LiOHH2O as the lithium source presents the best CO2 absorption property among the prepared Li4SiO4 materials. The CO2 absorptions at different temperatures and different CO2 partial pressures have been performed on the optimized Li4SiO4 material. The absorbed amount of CO2 reaches 24.1 wt.% within 5 min and an equilibrium amount of 29.9 wt.% is achieved within 10 min at 550˚C and a partial pressure of 0.25 bar. Additionally, after five absorption-desorption cycles, the sorbent still maintains its original properties in terms of capture rate and absorption amount.
Keywords:Lithium Silicate, Freeze-Drying, High-Temperature CO2, Absorption
液相法结合冷冻干燥技术制备Li4SiO4材料 及其高温二氧化碳吸收性能
童沂,黄雪芹,许春慧,肖强,钟依均,朱伟东
浙江师范大学,物理化学研究所,先进催化材料省部共建教育部重点实验室,浙江 金华
Email: 824838212@qq.com
收稿日期:2015年5月9日;录用日期:2015年5月25日;发布日期:2015年5月29日

摘 要
选用LiOH∙H2O、LiNO3、Li2CO3为锂源,硅溶胶为硅源,采用液相法结合冷冻干燥技术制备了Li4SiO4材料,采用热重分析(TGA)研究了Li4SiO4前躯体的失重行为,采用X射线粉末衍射仪(XRD)和扫描电子显微镜(SEM)对Li4SiO4材料的结构和形貌进行分析。在热重分析仪(TGA)上考察了制备材料的高温CO2吸收性能,发现以LiOH∙H2O为锂源时,合成材料的吸收性能最好。考察了该材料在不同温度、不同CO2分压下的高温CO2吸收性能,结果表明,在吸收温度为550℃,CO2分压为0.25 bar时,样品在5 min时吸收量为24.1 wt%,10 min内即可达到吸收平衡,平衡吸收量为29.9 wt%。经过5次吸收-解吸后,吸收速率、吸收量都没有出现明显下降。
关键词 :硅酸锂,冷冻干燥,高温二氧化碳,吸收

1. 引言
随着温室效应的日益加剧,CO2作为主要的温室气体,其排放受到世界范围的广泛关注,控制碳排放已经深入到国家政治经济活动和人类生活中[1] [2] 。大量化石能源的使用是导致近几十年来大气中CO2浓度不断增加的元凶[3] 。火力发电厂和工业过程中产生的烟道气是CO2的重要来源[4] ,其特点是气体温度高、CO2浓度低。发展高温CO2捕集技术,研发在低CO2分压下具备较好吸收性能的高温CO2捕获材料对降低碳排放具有重要意义。
Li2ZrO3材料具有CO2吸收容量高、再生温差小、抗水蒸气影响等优点引起了人们的广泛关注[5] ,但基于气固相化学反应的CO2捕集机理限制了CO2在Li2ZrO3材料上的吸收速率。课题组前期工作采用多种法制备了Li2ZrO3和K-Li2ZrO3纳米颗粒[6] -[8] ,大幅提高了Li2ZrO3的CO2吸收速率,并将其用于吸收强化水煤气变换制氢反应中[9] 。但在较低CO2分压(<0.02 MPa)时,Li2ZrO3纳米颗粒对CO2的吸收速率仍不够理想。
相比于Li2ZrO3,Li4SiO4表现出更高的CO2吸收容量和吸收速率[10] ,但传统固相法制备的Li4SiO4材料存在颗粒尺寸不均匀、粒径大,CO2吸收性能不佳等问题[11] -[13] 。虽然金属元素(Fe和Ce)掺杂可提高硅酸锂的CO2吸收速率,但固相法制备的样品依旧存在颗粒尺寸不均匀、粒径大等问题。本文采用液相法结合冷冻干燥技术[14] -[16] ,采用不同锂源制备Li4SiO4材料。并研究了在不同CO2分压和吸收温度下的CO2吸收性能及其循环稳定性能。
2. 实验
2.1. 实验材料
氢氧化锂(LiOH∙H2O)、硝酸锂(LiNO3),分析纯,阿拉丁试剂(上海)有限公司。碳酸锂(Li2CO3),分析纯,国药集团化学有限公司。硅溶胶(SiO2),分析纯,Sigma-Aldrich Co.,美国。
2.2. 材料制备
按照摩尔配比n(SiO2):n(Li) = 1:4,准确称取硅源和锂源,置于聚四氟乙烯内衬中,加入30 ml去离子水,在90℃下水浴搅拌4小时,然后在冷冻干燥机内冷冻干燥,得到粉末状的前驱体,将粉末置于马弗炉中焙烧6 h得到样品。
2.3. 表征
X射线粉末衍射实验是在荷兰Philips公司生产的PW3040/60型全自动X射线衍射仪上进行。样品形貌通过HITACHI S-4800型场发射扫描电子显微镜观察,电压5 kV,电流5 mA,样品观察前对材料表面进行喷金处理以增强样品的导电性。用NETZSCH STA 449 C型热分析仪表征样品在100℃~800℃的失重,升温速率10℃/min,空气流速:40 ml/min。
2.4. CO2吸收
用NETZSCH STA 449 C型热分析仪追踪材料吸收或解吸CO2过程中的重量变化来获得材料的高温CO2吸收或解吸速率曲线。吸收过程:样品在N2气氛中以升温速率为10℃/min升至所需的吸收温度(500℃~700℃),在此温度下恒温30 min;然后将气氛切换成N2和CO2混合气体,进行CO2吸收,获得吸收速率曲线。解吸过程:将气氛切换回N2,以10℃/min的速率,升温到解吸温度(650℃~700℃),进行CO2解吸。循环稳定性测试是进行多次重复吸收和解吸实验。
3. 结果与讨论
3.1. 样品前驱体的热重分析(TG)
分别以LiOH∙H2O、LiNO3、Li2CO3为锂源,硅溶胶为硅源,制得Li4SiO4前驱体,其热重曲线如图1所示。LiOH∙H2O和LiNO3为锂源制备的前躯体在150℃前均有明显失重,这是由样品中少量结晶水和游离水挥发引起的;三个样品在500℃~650℃间均有明显失重,对应于原料反应生成Li4SiO4,以Li2CO3为锂源制备的前躯体最大失重速率对应的温度最高,说明其作为Li源制备Li4SiO4要较LiOH∙H2O和LiNO3困难。众所周知,在高温下长时间煅烧会使材料发生严重的团聚,材料团聚会大大影响高温CO2吸收材料的反应速率,因此我们选用600℃下煅烧前躯体。
3.2. X射线粉末衍射分析(XRD)
从XRD图(图2)中可以看出,以三种锂源制备的前躯体在600℃下焙烧均能制备出Li4SiO4材料。除了Li4SiO4外,三个样品中均出现了少量Li2SiO3的衍射峰。以LiOH∙H2O和LiNO3为锂源制得的样品中并未观察到明显的LiOH和LiNO3衍射峰,而以Li2CO3为锂源制得的样品,则观察到较明显的Li2CO3衍射峰,说明在该焙烧温度下Li2CO3没有和硅源充分反应生成Li4SiO4。
3.3. 样品SEM谱图
从样品的SEM图(图3)看出,不同锂源制备的Li4SiO4样品形貌均为颗粒聚集体,以LiOH∙H2O为锂

Figure 1. TG curves of precursors prepared from different lithium sources in an air flow
图1. 不同锂源制备的前驱体样品在空气气氛中的TG曲线

Figure 2. XRD patterns of the Li4SiO4 sorbents prepared from different lithium sources
图2. 不同锂源制备Li4SiO4材料的XRD图
 (a) LiOH·H2O为锂源 (b) LiNO3为锂源(c) Li2CO3为锂源
(a) LiOH·H2O为锂源 (b) LiNO3为锂源(c) Li2CO3为锂源
Figure 3. SEM images of the Li4SiO4 sorbents synthesized from different lithium sources. (a) LiOH·H2O; (b)LiNO3; (c) Li2CO3
图3. 不同锂源制备Li4SiO4样品的SEM。 (a) LiOH∙H2O;(b) LiNO3;(c) Li2CO3
源制备的样品,颗粒分散较好,大小在100 nm左右。
3.4. CO2吸收性能
制得的材料在CO2分压为0.25 bar,吸收温度550℃下对CO2进行吸收。从图4中可知,以LiNO3为锂源制得的样品,5 min的吸收量可达18.6 wt%,15 min左右达到吸收饱和,饱和吸收量为23 wt%,其吸收速率较快,但是总吸收量较低;以Li2CO3为锂源制得的样品,吸收速率较慢,在60 min内,并没有达到吸收平衡;而以LiOH∙H2O为锂源制备的材料,5 min的吸收量可达27.89 wt%,7.5 min左右达到吸收饱和,饱和吸收量为29.8 wt%,表现出了非常出色的高温CO2吸收性能。因此我们选用LiOH∙H2O为锂源制备Li4SiO4材料。
3.5. 不同CO2分压下的吸收性能
图5为以LiOH·H2O为锂源制备的Li4SiO4材料在550℃,不同CO2分压下的CO2吸收曲线。由图可知,制备的Li4SiO4材料在低CO2分压下仍具有良好的吸收性能。即使CO2分压为0.1 bar,在5 min内CO2吸收量可达到饱和平衡吸收量的80%,15min左右达到吸收平衡。随着CO2分压的升高,CO2在Li4SiO4材料上的吸收速率越快。
3.6. 不同温度下的吸收性能
由图(图6)可知,在吸收温度为500℃时,材料的吸收速率较低,60 min内仍然没有达到吸收平衡;

Figure 4. CO2 uptakes of Li4SiO4 prepared from different lithium sources at a CO2 partial pressure of 0.25 bar and 550˚C
图4. 不同锂源制备Li4SiO4样品的CO2吸收曲线,CO2分压0.25 bar,吸收温度550℃

Figure 5. CO2 uptakes of the Li4SiO4 at different CO2 partial pressures and 550˚C.
图5. 550℃,在不同CO2分压下Li4SiO4材料的CO2吸收曲线
升高吸收温度,材料CO2吸收速率都有了很大的提高,55℃时,样品的CO2吸收速率最快,5 min左右,吸收量可达27.89 wt%,且7.5 min内达到吸收平衡。而进一步升高温度,CO2吸收速率和平衡吸收量均有所下降,这可能是由于在较高的温度下,CO2解吸速率有了较大增加。
3.7. 材料的循环稳定性能
图7为以LiOH∙H2O为锂源制备的Li4SiO4材料进行5次吸收–解吸曲线。在第一个循环中,样品在7.5 min内可达到吸收饱和,60 min的总吸收量为30.0 wt%,第五个循环中样品在7.5 min也可达到吸收饱和,总吸收量为29.8 wt%,吸收速率,吸收量都没有出现明显变化。从图中我们可以清楚看到样品随着循环次数的增多,吸收性能一直保持在较高的水平,表现出很高的吸收速率、吸收量,且在5次循环过程中的解吸阶段,吸收的CO2均可完全解吸。说明通过该法制备的Li4SiO4材料在相对较低的温度下可以实现快速完全的解吸,具有很好的循环稳定性能。
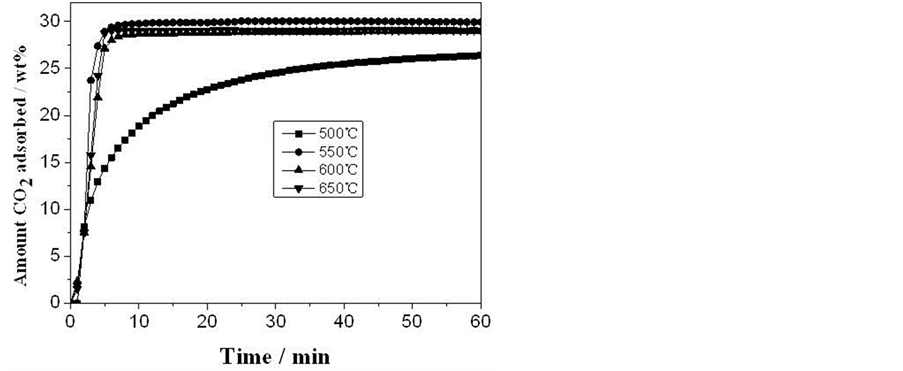
Figure 6. CO2 uptakes of the Li4SiO4 at different temperatures and a CO2 partial pressure of 0.25 bar
图6. Li4SiO4样品在不同温度下的吸收曲线,CO2分压为0.25 bar

Figure 7. Five cycles of CO2 capture-regeneration in Li4SiO4 sample. Absorption at 550˚C and a CO2 partial pressure of 0.25 bar and regeneration at 600˚C and in a pure N2
图7. Li4SiO4样品的CO2吸收–解吸五次循环曲线。吸收阶段:550℃,CO2分压0.25 bar;解吸阶段:600℃,N2
将原料放大5倍后,合成材料,将材料在CO2分压为0.25 bar,吸收温度为550℃,解吸温度为600℃的条件下进行五次吸收–解吸,制备的Li4SiO4样品,经过五次吸收–解吸后,还能表现出较好的吸收性能。在循环5次后,吸收速率,吸收量都没有出现明显变化。样品随着循环次数的增多,吸收性能一直保持在较高的水平,表现出很好的吸收性能,且在5次循环中60 min内吸收的CO2均可完全解吸,表现出很好的再生能力。
4. 结论
本文选用不同的锂源,采用液相法结合冷冻干燥技术合成材料,发现以LiOH∙H2O为锂源时,制得的样品具有较好的高温CO2吸收性能,且得到的材料基本为纯相的Li4SiO4。考察了以LiOH∙H2O为锂源制备的Li4SiO4材料在不同CO2分压、不同温度下的吸收性能,结果表明在较低CO2分压(0.1 bar)、较宽的温度(550℃~650℃)范围,材料都具有很好的吸收性能。考察其吸收-再生循环稳定性能,发现样品经多次循环再生使用,吸收性能一直保持在较高的水平,表现出很好的循环使用稳定性。将原料放大5倍后,制得的材料仍具有很好的CO2吸收性能,说明该方法具有较好的重复性且易于放大。
文章引用
童 沂,黄雪芹,许春慧,肖 强,钟依均,朱伟东, (2015) 液相法结合冷冻干燥技术制备Li4SiO4材料及其高温二氧化碳吸收性能
A Liquid Phase Method Combined with Freeze-Drying Technique to Lithium Silicate Materials and Their Carbon Dioxide Absorption Properties at High Temperatures. 物理化学进展,02,77-83. doi: 10.12677/JAPC.2015.42010
参考文献 (References)
- 1. Figueroa, J.D., Fout, T., Plasynski, S., McIlvried, H. and Srivastava, R.D. (2008) Advances in CO2 capture technolo-gy—The US Department of Energy’s Carbon Sequestration Program. International Journal of Greenhouse Gas Control, 2, 9.
- 2. 《联合国气候变化框架公约》京都议定书. 联合国, 日本京都 (1998).
- 3. Song, C. (2006) Global challenges and strategies for control, conversion and utilization of CO2 for sustainable development involving energy, catalysis, adsorption and chemical processing. Catalysis Today, 115, 2.
- 4. 陈长虹, 鲍仙华 (1999) 全球能源消费与CO2排放量. 上海环境科学, 2, 62-64.
- 5. 刘叶凤, 于兹瀛, 肖强, 等 (2009) 溶胶–凝胶法制备Li2ZrO3纳米颗粒及其高温二氧化碳吸收性能. 现代化工,增刊1, 62-64.
- 6. Xiao, Q., Liu, Y.F., Zhong, Y.J., et al. (2011) A citrate sol-gel method to synthesize Li2ZrO3 nanocrystals with improved CO2 capture properties. Journal of Materials Chemistry, 21, 3838-3842.
- 7. Xiao, Q., Tang, X.D., Liu, Y.F., et al. (2011) Citrate route to prepare K-doped Li2ZrO3 sorbents with excellent CO2 capture properties. Chemical Engineering Journal, 174, 231-235.
- 8. Xiao, Q., Tang, X.D., Zhong, Y.J., et al. (2012) A facile starch-assisted sol-gel method to synthesize K-doped Li2ZrO3 sorbents with excellent CO2 capture properties. Journal of the American Ceramic Society, 95, 1544-1548.
- 9. 张元卓, 于兹瀛, 张富民, 等 (2012) 纳米Li2ZrO3吸收剂原位移除CO2强化水煤气变换反应制氢. 催化学报, 9, 1572-1577.
- 10. Kudo, H., Okuno, K. and O’Hira. S. (1988) Tritium release behavior of ceramic breeder candidates for fusion reactors. Journal of Nuclear Materials, 155, 524-528.
- 11. 王银杰, 其鲁, 江卫军 (2002) 高温下硅酸锂吸收CO2的研究. 无机化学学报, 2, 268-272.
- 12. Essaki, K., Kato, M. and Uemoto, H. (2005) Influence of temperature and CO2 concentration on the CO2 absorption properties of lithium silicate pellets. Journal of Materials Science, 40, 5017-5019.
- 13. 悦灵丽, 肖强, 钟依均, 朱伟东 (2014) 金属元素掺杂对硅酸锂材料二氧化碳吸收性能的影响. 现代化工, 8, 70-73.
- 14. Abdelwahed, W., Degobert, G., Stainmesse, S. and Fessi, H. (2006) Freeze-drying of nanoparticles: Formulation, process and storage considerations. Advanced Drug Delivery Reviews, 58, 1688-1713.
- 15. Liu, H., Wang, Y., Yang, W. and Zhou, H. (2011) A large capacity of LiV3O8 cathode material for rechargeable Lithium-based batteries. Electrochimica Acta, 56, 1392-1398.
- 16. Minaberry, Y. and Jobbagy, M. (2011) Macroporous bioglass scaffolds prepared by coupling sol-gel with freeze drying. Chemistry of Materials, 23, 2327-2332.