Advances in Microbiology
Vol.
09
No.
03
(
2020
), Article ID:
37648
,
8
pages
10.12677/AMB.2020.93019
不同AMF对两种生态修复植物生长生理的影响
曾宪军,何曦,万飞,杨霆
航天凯天环保科技股份有限公司,湖南 长沙

收稿日期:2020年8月19日;录用日期:2020年9月10日;发布日期:2020年9月17日

摘要
以枸树和盐肤木为材料,通过盆栽试验分别接种摩西菌根(A)、根内球囊霉(B)、幼套球囊霉(C)、混合菌剂(AB、AC、BC、ABC)对枸树和盐肤木的生长生理特性的影响。结果表明,单菌剂A对构树的侵染率最高,其平均侵染率为79.11%。单菌剂C对盐肤木的侵染率最高,其平均侵染率为81.67%。7种菌剂均能增加盐肤木的地上部干质量,促进效应呈现A > B > ABC > C > AC > BC > AB趋势。混合剂菌剂ABC处理组中的构树的Pn、Gs、Tr和Ci是7种AMF处理组中最大的。本研究初步证实了混合菌剂ABC适合应用于构树种植,同时筛选出单菌剂A和C是适合盐肤木的优良菌种。AMF-植物共生体技术在筛选边坡植物生态修复方面具有良好的应用前景。
关键词
丛枝菌根真菌,构树,盐肤木,生长生理,边坡
Study on Growth Effect of Two Ecological Restoration Plants Species Infected with Different AMFs
Xianjun Zeng, Xi He, Fei Wang, Ting Yang
Aerospace Kaitian Environmental Technology Company Limited, Changsha Hunan
Received: Aug. 19th, 2020; accepted: Sep. 10th, 2020; published: Sep. 17th, 2020

ABSTRACT
An experiment was conducted to analyze the effects of arbuscular mycorrhizal fungi (AMF) on the growth and physiology of slope plant species (Broussonetia papyrifera and Rhus chinensis Mill.) under greenhouse conditions. Slope plant species were inoculated with Glomus mosseae (A), Glomus intraradices (B), Glomus etunicatum (C) and mixed AMFs (AB, AC, BC, ABC), and the AMF-infection rate, biomass, photosynthetic parameters were studied. The results showed that the highest AMF-infection rate was the Glomus mosseae-Broussonetia papyrifera symbiont (A) and Glomus etunicatum-Rhus chinensis Mill. symbiont (C), which average AMF-infection rate reached 79.11% and 81.67%. It also proved that these seven AMFs could enhance the underground biomass of Rhus chinensis Mill. The photosynthetic efficiency results showed that AMFs (ABC)-Rhus chinensis Mill. symbiont was the best. Thus, the AMF-plant symbiont technology has good application prospects in the slope plant species screening for ecological restoration.
Keywords:AMF, Broussonetia papyrifera, Rhus chinensis Mill., Growth and Physiology, Slops

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
近年来,随着城市化进程的加快,各种工程项目的大规模建设引发了一系列的环境问题,开挖出来的大量边坡破坏了原有的植被覆盖层,进而增加了发生水土流失、滑坡、泥石流的概率,恶化城市环境的同时也易打破局部的生态环境平衡 [1]。采用土工工程措施虽然能够有效地解决边坡稳定性问题,但自然植被的严重破坏影响了边坡的生态效益,破坏了周围环境的美观,与周围环境格格不入 [2] [3]。这些边坡的自然修复时间相当漫长,因此,在保持边坡稳定的前提下,对边坡进行人工绿化显得极其重要。人工植入植被在增加边坡稳定性、防止水土流失以及改善生态环境方面具有非常重要的作用 [4]。但多数情况下,边坡土壤理化性质差,营养单一,气候条件多变,一般植物生长困难,这就需要选择能够适应边坡恶劣环境的绿化植物。因此,筛选出具有一定抗旱性、适性强的抗逆性植物作为边坡修复的先锋植物具有重大的意义 [5]。只有这样,在后期无人为养护条件下才能实现边坡植物的自我维持。
丛枝菌根真菌(Arbuscular mycorrhiza fungi)简称AMF,是一类特别的共生真菌,绝大多数AMF不能纯培养,广泛存于自然界的各类生态环境中,并能够与地球上绝大多数的植物形成菌根,与宿主植物形成一种互惠共生的关系 [6]。相关研究表明,AMF与植物的根共生后,可以提高宿主植物的耐旱、耐盐、耐高温和抗病害能力 [7] [8] [9],同时也可以改良土壤的理化性状 [10] [11],增强宿主植物根系的活力和吸收水分及营养物质的能力。
本研究选用了菌根依赖性高、经济价值高的两种边坡植物(构树和盐肤木)作为AM真菌菌种筛选的目的植物,通过盆栽接种试验,研究了3种单一AM菌种和4种混合AM菌种对构树和肤盐木的影响,旨在筛选出对构树或盐肤木促生效应明显的菌株,为AMF应用于边坡植物的筛选与种植提供指导。
2. 材料与方法
2.1. 试验材料
2.1.1. 菌根菌剂来源
供试菌种:摩西球囊霉(Glmous mosseae,A菌)、根内球囊霉(Glmous intraradices,B菌)、幼套球囊霉(Glmous etunicatum,C菌)。购买于北京市农林科学院植物营养与资源研究所丛枝菌根资源种质资源库,用盆栽沙培法扩繁后获得菌种。
2.1.2. 栽培基质
栽培基质消毒:将栽培基质(河沙:红壤:泥炭 = 1:1:1)分装于折角无菌塑料袋中并至于全自动灭菌锅中采用高温高压消毒,121℃灭菌30 min。灭菌结束后至于阴凉的无菌环境处自然冷却,备用。
2.1.3. 供试植物
植物处理:本实验选的植物盐肤木采用种子育苗方式;构树采用扦插育苗方式。
种子处理:将试验用植物种子使用1%次氯酸钠溶液浸泡30 min,采用无菌水清洗种子后至于灭菌土壤中进行催芽。
扦插处理:将植物插条或根块使用无菌水反复冲刷多次,尽量减少AMF菌种的污染,于灭菌土壤种扦插催芽,得出无菌苗木。待苗木发芽后(长出4片真叶),选取长势均匀的幼苗,移摘于12 cm × 12 cm的实验花盆中,并记录苗木的高度及叶片数量,作为实验前的背景数据。
2.2. 试验设计
试验于2019年6月19日在航天凯天环保温室大棚进行。将3种菌种分别编号为A、B、C,并进行排列组合,分别得到A、B、C、AB、AC、BC、ABC,共7个接种处理组。另设一组空白对照组CK,总共8个实验处理组。
接种处理:将灭菌基质至于灭菌实验花盆中,每盆混入30 g处理菌种后将无菌植物移栽于种植盆中,对照处理组混入30 g灭菌基质,每处理5个重复,每种实验植物共80盆。接种完毕后,苗木按常规管理,定期浇水补充营养液,观察并记录植物生长状况(株高和叶片数),筛选植物生长最好的处理组。待植物生长3个月后取样测定菌根侵染率及各项生长生理指标。
2.3. 测定方法
2.3.1. 生物量的测定
随机选取植物,洗净植物根系,分开地上、地下部分,装于牛皮信封袋中,在105℃下杀青30 min,然后在80℃下烘至恒重,称量地上、地下生物量,计算总生物量 [12]。
2.3.2. 生理指标的测定
光合速率测定采用美国LICOR公司生产的LI-6400便携式光合测定仪,测定时光量子密度为1000 µmol/(m2∙s),为避免测定时环境CO2浓度的变化对测定结果的干拢,将仪器的进气口与装有恒定CO2浓度的钢瓶相接,钢瓶CO2浓度配制成400 µmol/mol。分别测定构树和盐肤木的净光合速率(Pn)、气孔导度(Gs)、蒸腾作用(Tr)和胞间CO2浓度(Ci)。
叶绿素含量的测定采用LI-6400便携式叶绿素测定仪测定。
2.3.3. 菌根侵染率的测定
菌根侵染率采用根染色–镜检法 [13]。根系处理按以下步骤:植物根系剪成1 cm小段→10% KOH,60℃水浴1 h→放冷,水洗→2%盐酸酸化5 min→曲利苯蓝染色30 min (60℃水浴)→乳酸甘油溶液脱色。从染好的根段中随机挑取30条根段制片,在显微镜下进行侵染率测定。
2.4. 数据处理
采用Excel软件对试验数据进行处理及制图;采用SPSS 24.0软件对不同处理的相关指标差异显著性检验。
3. 结果与分析
3.1. 不同AMF对植物生物量的影响
如表1所示,接种不同AMF对构树和盐肤木的地上部、地下部干质量和总干质量有一定的影响。从地上部干质量结果可以看出,7种菌剂均能增加盐肤木的地上部干质量,促进效应呈现A > B > ABC > C > AC > BC > AB趋势。而从地下部干质量结果可以看出,7种菌剂对构树和盐肤木均有一定的影响。其中BC菌剂对构树的地下部干质量影响最明显,而A菌剂对盐肤木地下部干质量影响最大。
Table 1. The biomass of two slope plants in different treatments (g)
表1. 两种边坡植物不同处理间生物量比较(g)
3.2. 不同AMF对植物叶绿素的影响
从图1可以看出,7种AMF菌剂对构树和盐肤木叶素含量有一定的影响。其中,对构树的影响不是很明显,而对盐肤木的影响较大。单一菌剂处理组中,菌剂C处理组中的盐肤木的叶绿素相对含量最高,为CK组的1.42倍;混合菌剂处理组中,混合菌剂AC处理组中的盐肤木的叶绿素相对含量最高,为CK组的1.42倍;综上分析,单一菌剂C和混合菌剂AC对盐肤木的叶叶绿素相含量影响基本一致。
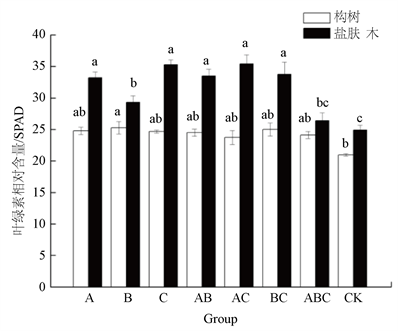
Figure 1. The Chlorophyll content of two slope plants in different treatments
图1. 两种边坡植物不同处理间叶绿素含量比较
3.3. 不同AMF对构树和盐肤木光合指标的影响
3.3.1. 不同AMF对构树和盐肤木净光合速率的影响
从净光合速率(Pn)变化来看,如表2所示,单一菌剂处理组中,菌剂B处理组中的构树的Pn最大,为CK组的1.11倍;菌剂A处理组中的盐肤木Pn最大,为CK组的2.01倍。混合菌剂处理组中,混合菌剂ABC处理组中的构树的Pn最大,为CK组的1.42倍;混合菌剂AC处理组中的盐肤木的Pn最大,为CK组的1.80倍。综上分析,混合剂菌剂ABC处理组中的构树的Pn是7种AMF处理组中最大的;而菌剂A处理组中的盐肤木的Pn是7种AMF处理组中最大的。
Table 2. The Net photosynthetic rate of two slope plants in different treatments
表2. 两种边坡植物不同处理间净光合速率的影响
3.3.2. 不同AMF对构树和盐肤木气孔导度的影响
从气孔导度(Gs)变化来看,如表3所示,单一菌剂处理组中,菌剂B处理组中的构树的Gs最大,为CK组的1.29倍,菌剂A处理组中的盐肤木Gs最大,为CK组的1.67倍;混合菌剂处理组中,混合菌剂ABC处理组中的构树的Gs最大,为CK组的1.54倍。混合菌剂BC处理组中的盐肤木的Gs最大,为CK组的1.83倍。综上分析,混合剂菌剂ABC处理组中的构树的Pn是7种AMF处理中最大的;而菌剂A处理组中的盐肤木的Gs是7种AMF处理组中最大的。
Table 3. The Stomatal conductance effect of two slope plants in different treatments
表3. 两种边坡植物不同处理间气孔导度的影响
3.3.3. 不同AMF对构树和盐肤木净胞间CO2浓度的影响
从胞间CO2浓度(Ci)变化来看,如表4所示,单一菌剂处理组中,菌剂C处理组中的构树的Ci最大,为CK组的1.06倍。但盐肤木的单一菌剂的处理组Ci均低于CK组,不具有统计意义;混合菌剂处理组中,混合菌剂ABC处理组中的构树的Ci最大,为CK组的1.06倍。混合菌剂BC处理组中的盐肤木的Ci最基本上CK组一致,不具有可比性。综上分析,混合剂菌剂ABC处理组中的构树的Ci是7种AMF处理中最大的。本次实验研究发现7种AMF对盐肤的Ci影响不大。
Table 4. The Net intercellular CO2 concentration of two slope plants in different treatments
表4. 两种边坡植物不同处理间净胞间CO2浓度的影响
3.3.4. 不同AMF对构树和盐肤木蒸腾速率的影响
从蒸腾速率(Tr)变化来看(表5),单一菌剂处理组中,菌剂C处理组中的构树的Tr 最大,为CK组的1.06倍,菌剂A处理组中的盐肤木Tr最大,为CK组的1.48倍;混合菌剂处理组中,混合菌剂ABC处理组中的构树的Tr最大,为CK组的1.32倍。混合菌剂BC处理组中的盐肤木的Tr最大,为CK组的1.74倍。综上分析,混合剂菌剂ABC处理组中的构树的Tr是7种AMF处理中最大的;混合菌剂BC处理组中的盐肤木的Tr是7种AMF处理组中最大的。
Table 5. The transpiration rate of two slope plants in different treatments
表5. 两种边坡植物不同处理对蒸腾速率的影响
3.4. 不同AMF对植物根系侵染率的影响
AMF对构树和盐肤木的影响见图2,接种菌剂的构树和盐肤木根系均被侵染,而未接种菌剂的根系发现了少量的丛枝菌根结构。结果表明,3种单菌剂和4种混合菌剂对构树和盐肤木的侵染效果不同,单一菌剂侵染率高,混合菌剂侵染率略低。其中,单菌剂A对构树的侵染率最高,其平均侵染率为79.11%。单菌剂C对盐肤木的侵染率最高,其平均侵染率为81.67%。由此可见,就菌根侵染率而,单接菌种高于混合接种。
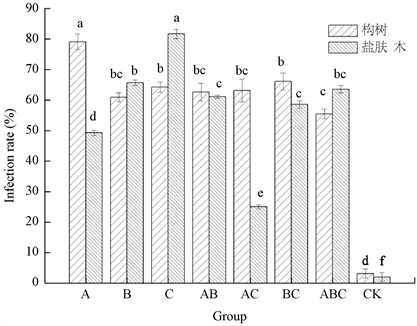
Figure 2. The mycorrhizal infection rate of two slope plants under different AMF treatments
图2. 不同AMF处理对两种边坡植物的菌根侵染率的影响
4. 结论与讨论
在自然界中,大多数植物和微生物之间形成了一种互利共生的关系,而丛枝菌根真菌是其中最代表性的一类共生真菌 [9],它既具有一般植物根系的特征,又具有专性真菌的特性。AMF有利于提高植物抗御不良环境的能力,促进植物生长,也有利于菌根真菌的生存。
AMF对植物的侵染率是菌根效应的基础,菌剂是否与植物根系产生有效侵染是其发挥生态功能的基础,但不同AMF对植物的侵染率不同 [14]。本研究结果表明,3种单菌剂和4种混合菌剂对构树和盐肤木的侵染效果不同,单一菌剂侵染率高,混合菌剂侵染率略低。其中,单菌剂A对构树的侵染率最高,其平均侵染率为79.11%。单菌剂C对盐肤木的侵染率最高,其平均侵染率为81.67%。由此可见,就菌根侵染率而言,单接菌种高于混合接种。
AMF通过影响宿主植物的生长状态及其根系的形态来增强宿主植物吸收水分、营养物质和微量元素的能力,但不同菌剂的促生效应不一致 [15]。本研究结果表明,7种不同AMF对构树和盐肤木的地上部、地下部干质量和总干质量有一定的影响。从地上部干质量结果可以看出,7种菌剂均能增加盐肤木的地上部干质量,促进效应呈现A > B > ABC > C > AC > BC > AB趋势。而从地下部干质量结果可以看出,BC菌剂对构树的地下部干质量影响最明显,而A菌剂对盐肤木地下部干质量影响最大。
光合作用是植物最重要的生理生化活动,为植物提供有机营养物质和能量,是生物界赖以生存的基础。研究表明,AMF可以提高植物叶绿素含量,促进植物的光合作用 [16]。本研究结果表明,单一菌剂C和混合菌剂AC对盐肤木的叶叶绿素相含量影响基本一致。混合剂菌剂ABC处理组中的构树的Pn、Gs、Tr和Ci是7种AMF处理组中最大的。菌剂A处理组中的盐肤木的Pn和Gs是7种AMF处理组中最大的,混合菌剂BC处理组中的盐肤木的Tr是7种AMF处理组中最大的。
综上所述,混合菌剂ABC适合应用于构树种植,而单菌剂A和C是适合盐肤木的优良菌种。未来将继续开展AMF应用于构树和盐肤木用于边坡修复的工程示范试验。
文章引用
曾宪军,何 曦,万 飞,杨 霆. 不同AMF对两种生态修复植物生长生理的影响
Study on Growth Effect of Two Ecological Restoration Plants Species Infected with Different AMFs[J]. 微生物前沿, 2020, 09(03): 133-140. https://doi.org/10.12677/AMB.2020.93019
参考文献
- 1. 赵入臻. 城市破损山体景观修复研究[D]: [硕士学位论文]. 济南: 山东建筑大学, 2012.
- 2. 刘毅, 吴生平. 对高速公路边坡生态恢复的探讨[J]. 中国水土保持, 2009(9): 23-24.
- 3. 邓辅唐, 吕小玲, 邓辅商. 高速公路边坡生态恢复研究进展[J]. 中国水土保持, 2005(11): 48-50.
- 4. 胡波, 张平仓, 任红玉, 等. 三峡库区消落带植被生态学特征分析[J]. 长江科学院院报, 2010(11): 81-85.
- 5. Colard, A., Angelard, C. and Sanders, I.R. (2011) Genetic Exchange in an Arbuscular Mycorrhizal Fungus Results in Increased Rice Growth and Altered Mycorrhiza-Specific Gene Transcription. Applied and Environmental Microbiology, 77, 6510-6515. https://doi.org/10.1128/AEM.05696-11
- 6. 徐建霞, 王建柱, 李磊, 等. 边坡先锋植物新银合欢幼苗抗旱能力研究[J]. 江苏农业科学, 2017, 45(18): 134-138.
- 7. Bethlenfalvay, G.J. and Linderman, R.G. (1992) Mycorrhizae in Sustainable Agriculture. The American Phytopathological Society, Saint Paul, 124. https://doi.org/10.2134/asaspecpub54
- 8. Tobar, R., Azcon, R. and Barea, J.M. (1994) Improved Nitrogen Uptake and Transport from 15N-Labelled Nitrate by External Hyphae of Arbuscular Mycorrhiza under Water-Stressed Conditions. New Phytologist, 126, 119-122. https://doi.org/10.1111/j.1469-8137.1994.tb07536.x
- 9. Subramanian, K.S., Charest, C. and Hamilton, L.M.D.I. (2010) Arbuscular Mycorrhizas and Water Relations in Maize under Drought Stress at Tasselling. New Phytologist, 129, 643-650. https://doi.org/10.1111/j.1469-8137.1995.tb03033.x
- 10. Miller, R.M. and Jastrow, J.D. (2000) Mycorrhizal Fungi Influence Soil Structure. In: Arbuscular Mycorrhizas: Physiology and Function, Springer, Berlin, 4-18. https://doi.org/10.1007/978-94-017-0776-3_1
- 11. Jeffries, P., Gianinazzi, S., Perotto, S., et al. (2003) The Contribution of Arbuscular Mycorrhizal Fungi in Sustainable Maintenance of Plant Health and Soil Fertility. Biology and Fertility of Soils, 37, 1-16. https://doi.org/10.1007/s00374-002-0546-5
- 12. 莫惠芝, 曾宪军, 何新杰, 等. 不同AMF接种两种湿地植物的生长效应研究[J]. 江西农业学报, 2019, 31(1): 8-13.
- 13. Phillips, J.M. and Hayman, D.S. (1970) Improved Procedures for Clearing Roots and Staining Parasitic and Vesicular-Arbuscular Mycorrhizal Fungi for Rapid Assessment of Infection. Transactions of the British Mycological Society, 55, 158-161. https://doi.org/10.1016/S0007-1536(70)80110-3
- 14. Heijden, M.G.A.V.D., Wiemken, A. and Sanders, I.R. (2010) Different Arbuscular Mycorrhizal Fungi Alter Coexistence and Resource Distribution between Co-Occurring Plant. New Phytologist, 157, 569-578.
- 15. Hu, S., Chen, Z., Vosatka, M., et al. (2020) Arbuscular Mycorrhizal Fungi Colonization and Physiological Functions toward Wetland Plants under Different Water Regimes. The Science of the Total Environment, 716, Article ID: 137040. https://doi.org/10.1016/j.scitotenv.2020.137040
- 16. Sohrabi, Y., Heidari, G., Weisany, W., et al. (2012) Some Physiological Responses of Chickpea Cultivars to Arbuscular Mycorrhiza under Drought Stress. Russian Journal of Plant Physiology, 59, 708-716.
