Advances in Microbiology
Vol.
10
No.
01
(
2021
), Article ID:
41203
,
12
pages
10.12677/AMB.2021.101008
极端嗜盐菌筛选鉴定及诱导碳酸盐矿化研究
王甜甜1,2*,何声龙1*,刘明珠1,闫华晓1,3,赵辉1,3#
1山东科技大学化学与生物工程学院生物工程系,山东 青岛
2山东科技大学安全与环境工程学院环境工程系,山东 青岛
3山东省非粮乙醇生物炼制技术创新中心(筹),山东 青岛

收稿日期:2021年2月23日;录用日期:2021年3月11日;发布日期:2021年3月25日

摘要
以胶南尹家山盐场采集的盐泥样品为基础,用标准方法筛选得到7株到耐25%盐度的菌,选取生长较好的嗜盐菌LMZ2作为研究对象,分别对菌株进行了形态学、生理生化和分子生物学鉴定,并测定了生长曲线,pH曲线及碳酸酐酶曲线,设置不同镁钙比(分别为0、3、5、7、9),以嗜盐菌LMZ2为工作菌株,在25%盐度,pH 7.2条件下进行了较系统的碳酸盐微生物诱导矿化实验。结果表明,嗜盐菌LMZ2 (Genbank登录号:MH430039)为革兰氏阴性菌,不产芽孢,产氨气,产接触酶,经综合鉴定LMZ2为一株以色列色盐杆菌(Chromohalobacter israelensis)。LMZ2在150小时后OD值可达到0.8,在225小时pH上升至8.0左右,不产碳酸酐酶。镁钙比为0时只有方解石,镁钙比在3、5、7可以诱导出组合为单水方解石、富镁方解石和碳酸钙镁石等含镁碳酸盐矿物,镁钙比9时为单水方解石。当有镁离子存在的情况下,嗜盐菌诱导的矿物晶粒和结晶度更好。该研究表明极端嗜盐菌在高盐环境中和高镁因素叠加有力促进了含镁碳酸盐矿物和亚稳定碳酸盐矿物的生成,为解释地质记录中相关碳酸盐矿物的形成机理提供了重要的参考。
关键词
极端嗜盐菌,色盐杆菌,16SrDNA,含镁碳酸盐矿物,单水方解石

Study on Isolation and Identification of an Extreme Halophilic Bacterium and Its Induction of Carbonates Mineralization
Tiantian Wang1,2*, Shenglong He1*, Mingzhu Liu1, Huaxiao Yan1,3, Hui Zhao1,3#
1Department of Bioengineering, College of Chemical and Biological Engineering, Shandong University of Science and Technology, Qingdao Shandong
2Department of Environmental Engineering, College of Safety and Environmental Engineering, Shandong University of Science and Technology, Qingdao Shandong
3Shandong Technology Innovation Center of Non-Grain Ethanol Biorefinery, Qingdao Shandong
Received: Feb. 23rd, 2021; accepted: Mar. 11th, 2021; published: Mar. 25th, 2021

ABSTRACT
Based on the salt mud samples collected from Yinjiashan Salt Farm in Jiaonan Qingdao. The standard method was used to screen 7 strains that could tolerate 25% salinity. A better-growing halophilic strain named LMZ2 was selected and carried out morphological, physiological and biochemical, and molecular biology identified. And the growth, pH changed and carbonic anhydrase curves were also tested and drawn. Then different magnesium-calcium ratios (0, 3, 5, 7, 9, respectively), LMZ2 halophilic bacteria, at 25% salinity, more systematic experiments of carbonate microorganism induced mineralization were carried out under pH 7.2 conditions. The results showed that strain LMZ2 of halophilic bacteria (Genbank No.: MH430039) is one kind of gram-negative bacteria, not producing spores, producing ammonia and contact enzymes, and therefore can be identified as Chromohalobacter israelensis. Chromohalobacter israelensis LMZ2 can reach up to 0.8 of OD600 value after 150 hours culture. However, at about pH 8.0 225 hours, it does not produce carbonic anhydrase. When the ratio of magnesium to calcium is 0, there is only calcite. When the ratio of magnesium to calcium is 3, 5, and 7, it can induce a combination of magnesium-containing carbonate minerals such as monohydrate calcite, magnesium-rich calcite, and magnesia carbonate. When the ratio of magnesium to calcium is 9, it is single Monohydrocalcite. In the presence of magnesium ions, the mineral grains and mineralization degree induced by halophilic bacteria are better. This study shows that extreme halophilic bacteria can positively promote the formation of magnesium-bearing carbonate minerals and unstable calcium carbonate minerals in high salt environment. This study provides an important reference for explaining the formation mechanism of related carbonate minerals in geological records.
Keywords:Extreme Halophilic Bacteria, Chromohalobacter israelensis, 16SrDNA, Magnesium-Bearing Carbonate Mineral, Monohydrocalcite

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
嗜盐菌是极端微生物中的重要类群 [1],特殊的细胞结构和代谢机制使得嗜盐菌在高盐环境下生存 [2],嗜盐菌菌体表面由于特定类型氨基酸组分含量的差异而存在大量负电荷,能够吸引水体中的金属盐离子(Na+离子等)围绕在菌体周围形,同时氨基酸能够调节溶质浓度,保护菌体免受盐浓度损害。嗜盐菌具有独特的生理学、生物化学和细胞学等特征,当前及未来在生物技术领域都具有重要价值,受到国内外学者广泛关注 [3],陆续成为热点研究对象。
科学家发现微生物在地质过程中的作用,并将碳酸盐矿物的沉淀与微生物联系起来 [4]。近年来,微生物对碳酸盐矿物沉积的研究已成为生物矿化领域的热点 [5]。生物矿化是指由生物体通过生物大分子的调控生成无机矿物的过程 [6]。生物矿化产生的碳酸盐矿物,广泛地分布在海洋和湖泊环境中 [7] [8] [9] [10] [11],是沉积环境中最常见也是最重要的矿物之一。
据报道,地球上的原始生命可能起源于高盐环境 [12]。一些研究人员还分析了大自然中的白云岩和灰岩,得出的结论是,形成这些碳酸盐岩的古地质环境是海洋 [13] [14] [15]。因此,对现代盐环境中微生物生存能力和适应性的研究将有助于深入了解地球早期生物圈的演化。在地球微生物学领域,筛选耐盐的嗜盐细菌以一定的盐浓度诱导碳酸盐矿物,有助于分析过去的微生物岩的形成机理 [16] [17] [18] [19]。嗜盐菌生存环境和其自身的独特性,引起的生物矿化现象获得广泛关注 [20]。因为自然条件下难以直接形成的矿物——白云石,在高盐环境下相对更容易观察到,如夏威夷高盐土壤 [21],加利福尼亚盐湖 [22],迪拜撒布哈环境等 [23]。研究者认为除了盐浓度的作用外,嗜盐菌也可能参与了白云石的关键形成过程。目前对嗜盐菌微生物矿化的研究集中于在高盐浓度环境下诱导矿物的研究,实际上仍然无法确认嗜盐菌微生物矿化的机制。
2. 材料与方法
2.1. 材料和试剂
2.1.1. 样品的定点采集
本实验所用的样品取自黄岛尹家山盐场的晒盐池底泥,该底泥处在高盐环境中,可判定此处具有丰富的嗜盐菌菌群。在该处盐场随机收集样品,并用过滤法去除样品中的杂质并编号。
2.1.2. 培养基
1) 富集培养基:牛肉膏5 g/L,胰蛋白胨10 g/L,NaCl 200 g/L;
2) 纯化培养基1:牛肉膏5 g/L,胰蛋白胨10 g/L,NaCl 200 g/L;
3) 纯化培养基2:牛肉膏5 g/L,胰蛋白胨10 g/L,NaCl 250 g/L;
4) 固体纯化培养基1:牛肉膏5 g/L,胰蛋白胨10 g/L,NaCl 150 g/L,琼脂20 g/L;
5) 固态纯化培养基2:牛肉膏5 g/L,胰蛋白胨10 g/L,NaCl 200 g/L,琼脂20 g/L。
2.1.3. 实验试剂
牛肉膏、胰蛋白胨、琼脂、酵母浸粉、NaCl、CaCl2∙2H2O、MgCl2∙6H2O、NaHCO3、Na2CO3、CaCO3、30%过氧化氢、无水乙醇、蛋白胨、浓盐酸、KOH、甲基红、十六烷基三乙基溴化烷、十二烷基硫酸钠、乙二胺四乙酸二钠。
2.1.4. 试验设备仪器
SW-CJ-ID型单人净化工作台:苏州净化设备厂;FC204电子分析天平:上海精密天平有限公司;LD2X-50FBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;101-1SB型电热鼓风干燥箱:龙口市电炉制造厂;TG16-W微型高速离心机:长沙湘仪离心机仪器有限公司;DHP-9050B智能型电热恒温培养箱:上海琅琊实验设备公司;THGX台式恒温培养箱:上海跃进医疗器械有限公司PHS-3EpH计:江苏江分电分析仪器有限公司;TCT3梯度基因扩增仪:上海领成生物科技有限公司;YS2-H1112438偏振光显微镜:Nikon CHINA;X射线衍射(XRD) (UltimaIV2036E202);722型分光光度计:上海精密仪器仪表有限公司;测序仪(3730XL):Applied Biosystems;恒温培养箱(DHP-9162):太仓市科教器材厂。
2.2. 试验方法
2.2.1. 菌种的富集和纯化
1) 菌株的富集培养
取样品的土壤浸出液20 ml接种10 ml于200 mL盐度20%的富集培养基进行富集培养,然后置于28℃120 r/min条件下震荡培养。当培养基变浑浊时,说明此时已经有大量的优势嗜盐菌存在。
2) 菌株的纯化培养
经过富集后的细菌培养液中仍含有大量的杂菌,需要进行细菌固液交替培养,使菌种得到分离和纯化,主要步骤如下:
① 制备梯度菌悬液,在无菌条件下向已灭菌的PE管中加入0.1 mL菌液和0.9 mL浓度为20%的盐水,充分震荡后制备10−1、10−2、10−3、10−4、10−5、10−6和10−7个稀释度的菌悬液。
② 平板涂布,首先向培养皿分别中加入约三分之一培养皿体积的盐度为15%纯化培养基1,待其冷凝后,向平板培养皿中分别加入10−3、10−5、10−7梯度的菌悬液100 μL,均匀涂布等到培养基表面涂干后,盖上皿盖,编号,每个梯度涂三个平板,最后用封口膜封住皿口,然后放恒温培养箱28℃静置培养。
③ 当平板培养皿上出现单菌落时,在无菌环境下用接种环画线,三区划线法,固体培养两代后,在平板培养皿上挑取单菌落,在无菌环境下用接种环挑取单菌落接种于25%盐度的液体培养基中,封口后置于摇床培养箱中震荡培养,测量其OD值。
④ 液体培养基变浑浊后,制备梯度菌悬液,涂布于盐度为20%的固体培养基中,划线分离,重复步骤③④,培养三代后保种。
以上,考虑到固体培养基有水分损失。所以将盐度下降5%。
2.2.2. 细菌16SrDNA的鉴定
将保藏的菌株重新活化涂布后得到单菌落,将其送往上海生工生物工程技术公司测序中心进行测序。获得序列后,利用DNAMAN6.0软件进行序列拼接,并将拼接结果上传到NCBI网站,进行Blast,获得该菌株16SrDNA同源性(identity)检索结果,通常认为同源性大于99%定义为种,在95%和99%之间,则定义为属,小于95%则定义为科。下载与待测菌株16SrDNA相近属的内外群菌株16SrDNA基因序列。利用MEGA6.0软件根据菌株的比对结果进行16SrDNA遗传距离分析,采用邻接法(Neighbor-Joining method)获得系统进化树 [24],并通过自举分析(Bootstrap)进行置信度检测,自举数据集为1000次。并构建系统发育树,确定LMZ2的种属。
2.2.3. LMZ2菌株的形态学及生理生化鉴定
1) 革兰氏染色实验
取少量菌液涂抹固定于载玻片上,通过草酸铵结晶紫初染和碘液媒染,酒精进行脱色,番红染色液复染后,蒸馏水冲洗。干燥,镜检。革兰氏阳性菌呈蓝紫色,革兰氏阴性菌呈红色。
2) 芽孢染色实验
吸取培养至对数生长期的待测菌株的菌液2滴涂抹在载玻片上,干燥、固定。滴加3~5滴孔雀绿染液于已固定的涂片上。夹住载玻片在火焰上加热,使保持染液冒蒸汽但不沸腾状态4~5 min。倾去染液,待玻片冷却后用蒸馏水将多余孔雀绿染液冲洗掉。用番红水溶液复染,再用蒸馏水冲洗干净。待玻片干燥后,置于油镜观察,芽孢呈绿色,菌体呈红色。
3) 接触酶活性鉴定实验
吸取4 mL菌液于EP管中,转速4000 r/min,4℃离心5 min,弃掉上清液,留下菌体细胞。在离心管中加入3%的过氧化氢2 mL,观察有无气泡产生以及产生气泡的速率大小。若立即出现大量气泡为阳性,无气泡为阴性。
4) 氨气定性实验
配置成分为蛋白胨0.5%、K2HPO4 0.05%、MgSO4 0.05%、pH 7.0~7.2的培养基。对照组不接菌,实验组按1%的比例接种液体种子液恒温30℃培养24~48 h。在培养液中加入3~5滴纳氏试剂,出现黄色(或棕红色)沉淀则为阳性反应,未接菌的培养基加入纳氏试剂后无黄色(或棕红色)沉淀出现。
2.3. 碳酸盐矿物功能初步探究
2.3.1. 诱导矿化培养基
碳酸盐矿物沉积研究所用培养基含量见表1。
Table 1. Gradient concentration in Mg/Ca ratio for inducing mineralization
表1. 诱导矿化梯度浓度Mg/Ca比含量
方法:
i) 配制不含Mg、Ca的富集培养基,121℃,灭菌20 min;
ii) 配制NaHCO3母液,使培养基终浓度为0.01 mol∙L−1,过滤灭菌;
iii) 配制MgCl2和CaCl2母液,121℃,灭菌20 min。
2.3.2. 微生物诱导矿化培养
根据表1设置Mg/Ca比梯度0、3、5、7、9,每个梯度设置2个平行样,分两组,分别为实验组和对照组。实验组接菌量为1%,对照组作无菌空白对照。培养液总体积为200 mL。接种完毕后,将实验组和对照组置于30℃恒温培养箱中静置培养。定期观察锥形瓶中是否有矿物沉淀。
2.3.3. 偏光显微镜的观察
取培养基底部沉淀于离心管中,静置10 min后弃去上清液,然后每个离心管中各加入1 mL蒸馏水,振荡、混匀,静置10 min后,弃去上清液,如此用蒸馏水洗涤三次。最后加入1 mL酒精,振荡、混匀后,弃去上清液,如此清洗2次。最后加入大约300 μL酒精,振荡、混匀后,取少量混匀液滴于载玻片上,置于偏光显微镜下观察。
2.3.4. XRD分析
取培养基底部沉淀于离心管中,取培养基底部沉淀于离心管中,静置10 min后弃去上清液,然后每个离心管中各加入10 ml蒸馏水,振荡、混匀,静置10 min后,弃去上清液,如此用蒸馏水洗涤三次。静置10 min后弃去上清液,然后每个离心管中各加入6 ml无水乙醇,振荡、混匀,静置10 min后,弃去上清液,如此用无水乙醇洗涤三次。之后晾干,放入凹槽内,进行XRD的观察分析。XRD扫描角度为10˚~90˚,步长为0.02,扫描速度8˚/min。
2.4. LMZ2生长曲线,pH曲线及碳酸酐酶曲线的测定
2.4.1. 生长曲线的测定
用移液枪移取2.00 mL种子液的过夜培养液(培养10~12 h)转入盛有200 mL培养液的锥形瓶中,在相应的培养时间(0 h、1.5 h、3 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、20 h、24 h、26 h、30 h等)在无菌环境中取出4 mL培养液于离心管中,最后同比浊测定其光密度值;用未接种的培养液作空白对照,选用600 nm波长进行光电比浊测定。将所得的OD600值与培养时间作图,绘制生长曲线。
2.4.2. pH变化曲线
用移液枪移取2.00 mL菌种的过夜培养液(培养10~12 h)转入盛有200 mL培养液的锥形瓶中,在相应的培养时间(0 h、1.5 h、3 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、20 h、24 h、26 h、30 h等)在无菌环境中取出4 mL培养液于离心管中,测定培养液的pH值。将所得的pH与培养时间作图,绘制pH变化曲线。
2.4.3. 碳酸酐酶曲线
根据Zhuang等人分析微生物碳酸酐酶活性的方法进行测定 [25]:将菌液和工作液1:1混合(各取1.5 mL),取适量在400 nm处测定反应前吸光度;放在35度水浴锅中反应30 min,迅速置于冰浴中冷却(可以放置在冰箱中进行冷却),取适量在400 nm处测定反应后吸光度;得到数据,后期对数据进行处理。
3. 结果与分析
3.1. LMZ2菌株的16SrDNA序列分析及其分类学地位
利用BLAST将所测得的序列(Genbank登录号:MH430039)与GenBank/NCBI数据库中已登录的16SrDNA序列进行同源性比较,通过邻接(Neighbour Joining)法构建系统发育树(MEGA6.0)。该菌株命名LMZ2,利用GenBank数据库进行同源序列搜索,搜索到与其同源性较高的菌株,选取同源性较高的菌株和同科异属的其他种的16SrDNA序列与菌株LMZ2的16SrDNA序列进行对比,确定与其最接近的种系群体。通过邻接法构建的系统发育树,见图1。
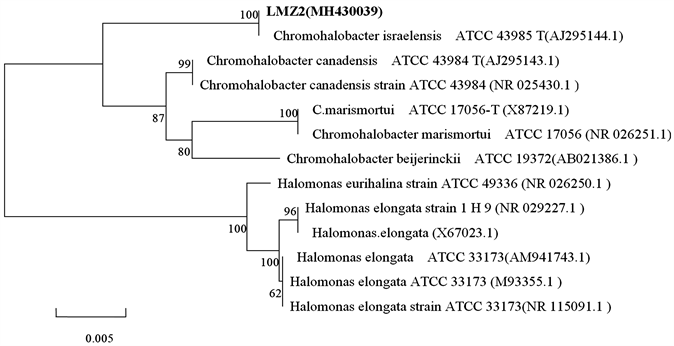
Figure 1. LMZ2 strain phylogenetic tree drawn from Neighbor-Joining analysis based on the sequence alignment
图1. 菌株LMZ2基于序列比对邻接法构建的系统发育树
测得的LMZ2菌株的16SrDNA序列长度为1398 bp。通过对LMZ2菌株的16SrDNA序列和Genebank中已登录的16SrDNA序列进行核苷酸同源性比较发现与Chromohalobacter israelensis的16SrDNA核苷酸序列同源性均在100%,再通过基于16SrDNA序列构建的系统发育树来看,LMZ2菌株与Chromohalobacter israelensis亲缘关系最近,因而此菌株LMZ2初步鉴定为以色列色盐杆菌(Chromohalobacter israelensis)。
3.2. LMZ2菌株的生理生化鉴定结果分析
进行菌株形态学分析、革兰氏染色试验、芽孢染色试验、接触酶活性鉴定试验、氨气定性试验。

Figure 2. Physiological and biochemical characterization of LMZ2 bacteria (a) Bacterial colony morphologyof LMZ2, (b) Gram stain of LMZ2, (c) Spore staining of LMZ2, (d) Catalase test results, (e) Ammonia qualitative test results
图2. LMZ2细菌的生理生化鉴定(a) LMZ2菌落形态,(b) LMZ2革兰氏染色,(c) LMZ2芽孢染色,(d) 接触酶试验,(e) 氨气定性试验
形态学鉴定白色,半透明,圆形,边缘整齐3~4 mm凸形,表面光滑,与培养基结合不紧密,如图2(a)。细菌经革兰氏染色后,进行光学显微镜观察,LMZ2的结果如图2(b)所示,染色后为红色,即为革兰氏染色阴性。细菌经芽孢染色后,经过显微镜观察,LMZ2的结果如图2(c)所示,菌体内无芽孢。将细菌离心清洗,所得菌体加于EP管中并加入3%的过氧化氢溶液,所得结果如图2(d)所示,从图中可以看出加有LMZ2菌体的过氧化氢溶液有气泡产生,说明该菌株含有过氧化氢酶,试验结果为阳性。图2(e)加入纳氏试剂后,实验组变为深黄色沉淀,对照组无黄色沉淀。实验表明,LMZ2在培养过程中会产生氨气,这进一步为研究LMZ2细菌生长过程中pH变化提供了前提条件。
1) 生理性状
LMZ2菌株,革兰氏阴性菌,不形成芽孢,耐盐。
2) 生化特征
LMZ2:接触酶为阳性;氨气定性为阳性。
LMZ2与同种菌的生理生化鉴别,见表2。
Table 2. The comparison of identification of LMZ2 and Chromohalobacter
表2. LMZ2与同种色盐杆菌的鉴别结果比较
通过以上生理生化特征分析,结合上述16SrDNA分析结果分析,菌株LMZ2是一种以色列色盐杆菌。
3.3. LMZ2生长曲线、pH曲线和碳酸酐酶曲线测定
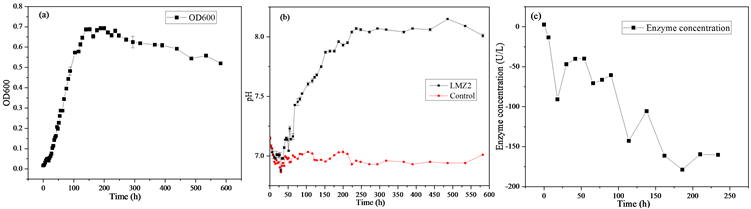
Figure 3. (a) Growth curve of LMZ2, (b) pH curve of LMZ2, (c) CA curve of LMZ2
图3. (a) LMZ2生长曲线,(b) LMZ2 pH曲线,(c) LMZ2碳酸酐酶曲线
LMZ2生长状况及pH变化分别如图3所示。由图3(a)可以看出,LMZ2在25%浓度下的生长情况,在0~20 h期间,LMZ2生长缓慢,在20~150 h生长迅速,150 h~250 h为稳定期,250 h以后数量下降。由图3(b)可知,LMZ2在0~30 h期间pH下降,在,30~225 h期间上升,在225~450 h期间平稳,450~600 h期间下降。由图3(c)可知,LMZ2没有碳酸酐酶活性,故不产生碳酸酐酶。根据pH曲线以及碳酸酐酶曲线分析,我们可以得知,由于菌株LMZ2不产生碳酸酐酶,但是产生氨气,所以,pH在菌株生长后期没有上升很高,有的研究表明,产碳酸酐酶的菌pH可以达到9以上,而本株菌,pH最高在8左右。
3.4. LMZ2诱导矿化结果验证
3.4.1. 偏光结果分析
诱导矿化16天后,对矿物进行偏振光显微镜观察,见图4。


Figure 4. Observation by polarized light microscope of minerals induced by LMZ2 under the concentrations of 25% NaCl (Mg/Ca = 0, 3, 5, 7, 9)
图4. LMZ2在25% NaCl浓度下诱导矿物的偏振光显微镜观察(Mg/Ca = 0、3、5、7、9)
由上图4显示,当镁钙比为0时,对照组形成哑铃型,以及很多不规则形状的矿物。实验组矿物晶型比较整齐多为哑铃型。当镁钙比为3时,对照组形成哑铃型,以及少量不规则形状的矿物,比较分散,无较多集中的矿物。实验组矿物晶型比较整齐多为哑铃型,且较为集中,有多个矿物相连。镁钙比为5时,对照组形成的矿物进行单一,多为不规则椭圆形。实验组矿物晶型比较丰富,有长椭圆形,哑铃型以及不规则形状。镁钙比为7时,对照组形成主要有两种晶型稍大的哑铃型,以及条形矿物。镁钙比为9时,对照组矿物比较单一,只有一种晶型,为双球形。实验组晶型稍多,除了双球形矿物,还有少量的方形矿物以及不规则形状的矿物。
3.4.2. XRD分析
为了进一步分析LMZ2诱导的碳酸盐矿物沉淀的物相和结构特征,使用XRD分析在25% NaCl浓度、不同镁钙比下培养16天后生成的碳酸盐沉淀,矿物XRD分析结果如下图5所示。


Figure 5. XRD analysis of mineral induced by LMZ2 under the concentrations of 25% NaCl (Mg/Ca = 0, 3, 5, 7, 9)
图5. LMZ2在25% NaCl浓度下诱导矿物的XRD分析(Mg/Ca = 0、3、5、7、9)
从图5可以看出,对照组和实验组中镁钙比为0时,所诱导出的矿物为方解石;镁钙比是3时,对照组为单水方解石,实验组A是富镁方解石,实验组B是富镁方解石和Karshunovskite (Mg2Cl(OH)3∙4H2O,四水合三羟基氯化镁);镁钙比是5时,实验组和对照组都是单水方解石;镁钙比是7时,对照组是单水方解石,实验组A是单水方解石,实验组B是单水方解石和碳酸钙镁石(huntite);镁钙比是9时,实验组和对照组都是单水方解石。
为了探讨镁钙比为分别为0,5,9时的差异,对同种矿物(104)珠峰的半峰宽(FWMH)做了系统比对,结果如下图6所示。
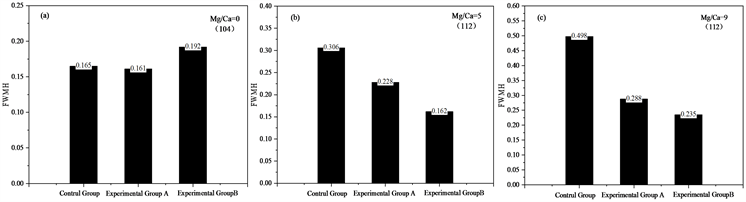
Figure 6. (a) FWMH (104) of caltite induced by LMZ2 in the concentrations of 25% NaCl (Mg/Ca = 0), (b) FWMH (112) of Monohydrocalcite induced by LMZ2 in the concentrations of 25% NaCl (Mg/Ca = 5, 9)
图6. (a) LMZ2在25% NaCl浓度下诱导方解石的晶型半峰宽(104) (Mg/Ca = 0),(b) LMZ2在25% NaCl浓度下诱导的单水方解石晶型半峰宽(112) (Mg/Ca = 5,9)
对比图6(a)中方解石(104)晶型的衍射峰的半峰宽(FWHM),我们中可以看出,其中Mg/Ca = 0时,实验组与对照组衍射峰的半峰宽相差较小,通过偏振光显微镜观察到的矿物也呈现出不规则形状,说明菌株LMZ2在此镁钙比下对诱导矿物的影响较小。
对比图6(b)和图6(c)中单水方解石(112)晶型的衍射峰的半峰宽(FWHM),Mg/Ca = 5,9时,诱导出的矿物单水方解石(112)晶型的衍射峰的半峰宽都小于对照组的(112)晶型衍射峰的半峰宽,表明经菌株LMZ2所诱导出的矿物的晶粒更小,结晶度更好,微生物起到了诱导调控作用。
同时,对比图6(c)中单水方解石(112)晶型的衍射峰的半峰宽(FWHM),Mg/Ca = 9时实验组与对照组的衍射峰的半峰宽相差十分大,说明与Mg/Ca = 5时相比,Mg/Ca = 9时在LMZ2的诱导下对单水方解石矿物的结晶影响更大。
4. 结论
本研究以盐场污泥为研究对象,采用高盐浓度培养基等培养方法,筛选出一株嗜盐菌,对其进行鉴定。并利用本株菌在25%盐度下诱导矿物,通过偏振光显微镜和XRD初步分析了该嗜盐菌在高盐度、不同镁钙比下对诱导碳酸盐矿物的影响。
1) 对获得的LMZ2菌株进行了较系统的分子鉴定和生理生化特征鉴定,结果表明,LMZ2菌株为一种嗜盐能力较强的以色列色盐杆菌。
2) 利用以色列色盐杆菌LMZ2在25%盐浓度和不同镁钙比下诱导碳酸盐矿物成矿,镁钙比为0时只有方解石,镁钙比在3、5、7可以诱导出组合为单水方解石、富镁方解石和碳酸钙镁石等含镁碳酸盐矿物,镁钙比9时为单水方解石。镁离子进入矿物晶格结构,替换了部分钙离子,产生多种含镁碳酸盐矿物。
3) 该研究表明极端嗜盐菌在高盐环境中和高镁因素叠加有力促进了含镁碳酸盐矿物和亚稳定碳酸盐矿物的生成,镁钙比较低时,生物因素对成矿影响较小,实验组和对照组矿物种类一样;随镁钙比中逐渐升高,实验组和对照组矿物的晶胞结构开始有明显差异;镁钙达到比较高时,实验组和对照组矿物结晶程度差异较明显。当有镁离子存在的情况下,嗜盐菌诱导的矿物晶粒和结晶度更好,嗜盐菌能有效提高矿物结晶度。
基金项目
国家自然科学基金项目(42072136,41772095),山东省自然基金项目(ZR2019MD027),山东省重大科技创新工程项目(2019JZZY020808),海藻活性物质国家重点实验室开放基金项目(SKL-BASS1722)。
文章引用
王甜甜,何声龙,刘明珠,闫华晓,赵 辉. 极端嗜盐菌筛选鉴定及诱导碳酸盐矿化研究
Study on Isolation and Identification of an Extreme Halophilic Bacterium and Its Induction of Carbonates Mineralization[J]. 微生物前沿, 2021, 10(01): 62-73. https://doi.org/10.12677/AMB.2021.101008
参考文献
- 1. 崔恒林. 嗜盐古菌分类学研究进展[J]. 微生物学通报, 2016, 43(5): 1113-1122.
- 2. 张英杰, 廖子亚, 赵百锁. 嗜盐菌中甘氨酸甜菜碱的合成途径及其生物学功能[J]. 微生物学报, 2020, 60(6): 1074-1089.
- 3. Han, Z., Yu, W., Zhao, H., et al. (2018) The Significant Roles of Mg/Ca Ratio, Cl− and SO42− in Carbonate Mineral Precipitation by the Halophile Staphylococcus epidermis Y2. Minerals, 8, 594. https://doi.org/10.3390/min8120594
- 4. Harder, E.C. (1919) Iron-Depositing Bacteria and Their Geologic Relations. Gov’t Print, U.S., 45-48. https://doi.org/10.3133/pp113
- 5. 王红梅, 吴晓萍, 邱轩, 等. 微生物成因的碳酸盐矿物研究进展[J]. 微生物学通报, 2013, 40(1): 180-189.
- 6. Spadafora, A., Perri, E., Mckenzie, J.A. and Vasconcelos, C. (2010) Microbial Biomineralization Processes Forming Modern Ca:Mg Carbonate Stromatolites. Sedimentology, 57, 27-40. https://doi.org/10.1111/j.1365-3091.2009.01083.x
- 7. Chen, J.T., Van Loon, A., Han, Z.Z. and Chough, S.K. (2009) Funnel-Shaped, Breccia-Filled Clastic Dykes in the Late Cambrian Chaomidian Formation (Shandong Province, China). Sedimentary Geology, 221, 1-6. https://doi.org/10.1016/j.sedgeo.2009.09.006
- 8. Yang, R.C., Fan, A.P., Han, Z.Z., Chi, N.J. and Han, Y. (2013) Characteristics and Genesis of Microbial Lumps in the Maozhuang Stage (Cambrian Series 2), Shandong Province, China. Science China Earth Sciences, 56, 494-503. https://doi.org/10.1007/s11430-012-4539-4
- 9. Han, Z.Z., Meng, R.R., Yan, H.X., Zhao, H., Han, M., Zhao, Y.Y., Sun, B., Sun, Y.B., Wang, J. and Zhuang, D.X. (2016) Calcium Carbonate Precipitation by Synechocystis sp. PCC6803 at Different Mg/Ca Molar Ratios under the Laboratory Condition. Carbonates and Evaporites, 32, 561-575. https://doi.org/10.1007/s13146-016-0322-5
- 10. Chen, J.T., Chough, S.K., Han, Z.Z. and Lee, J.-H. (2011) An Extensive Erosion Surface of a Strongly Deformed Limestone Bed in the Gushan and Chaomidian Formations (Late Middle Cambrian to Furongian), Shandong Province, China: Sequence-Stratigraphic Implications. Sedimentary Geology, 233, 129-149. https://doi.org/10.1016/j.sedgeo.2010.11.002
- 11. Lee, J.-H., Chen, J.T. and Chough, S.K. (2010) Paleoenvironmental Implications of an Extensive Maceriate Microbialite Bed in the Furongian Chaomidian Formation, Shandong Province, China. Palaeogeography, Palaeoclimatology, Palaeoecology, 297, 621-632. https://doi.org/10.1016/j.palaeo.2010.09.012
- 12. Douglas, S. and Yang, H.X. (2002) Mineral Biosignatures in Evaporites: Presence of Rosickyite in an Endoevaporitic Microbial Community from Death Valley, California. Geology, 30, 1075-1078. https://doi.org/10.1130/0091-7613(2002)030<1075:MBIEPO>2.0.CO;2
- 13. Chen, J., Chough, S.K., Lee, J.-H. and Han, Z.Z. (2012) Sequence-Stratigraphic Comparison of the Upper Cambrian Series 3 to Furongian Succession between the Shandong Region, China and the Taebaek Area, Korea: High Variability of Bounding Surfaces in an Epeiric Platform. Geosciences Journal, 16, 357-379. https://doi.org/10.1007/s12303-012-0040-5
- 14. Han, Z.Z., Zhang, X.L., Chi, N.J., Han, M., et al. (2015) Cambrian Oncoids and Other Microbial-Related Grains on the North China Platform. Carbonates and Evaporites, 30, 373-386. https://doi.org/10.1007/s13146-014-0209-2
- 15. Zhang, X.G., Lin, C.Y., Zahid, M.A., Jia, X.P. and Zhang, T. (2017) Paleosalinity and Water Body Type of Eocene Pinghu Formation, Xihu Depression, East China Sea Basin. Journal of Petroleum Science and Engineering, 158, 469-478. https://doi.org/10.1016/j.petrol.2017.08.074
- 16. Han, Z.Z., Yan, H.X., Zhou, S.X., Zhao, H., Zhang, Y., Zhang, N.N., Yao, C.K., Zhao, L. and Han, C.Y. (2013) Precipitation of Calcite Induced by Synechocystis sp. PCC6803. World Journal of Microbiology and Biotechnology, 29, 1801-1811. https://doi.org/10.1007/s11274-013-1341-1
- 17. Han, Z.Z., Yan, H.X., Zhao, H., Zhou, S.X., Han, M. and Meng, X.Q. (2014) Bio-precipitation of Calcite with Preferential Orientation Induced by Synechocystis sp. PCC6803. Geomicrobiology Journal, 31, 884-899. https://doi.org/10.1080/01490451.2014.907379
- 18. Yan, H.X., Han, Z.Z., Zhao, H., Zhou, S.X., Chi, N.J., Han, M. and Kou, X.Y. (2014) Characterization of Calcium Deposition Induced by Synechocystis sp. PCC6803 in BG11 Culture Medium. Chinese Journal of Oceanology and Limnology, 32, 503-510. https://doi.org/10.1007/s00343-014-3150-2
- 19. Sobolev, N.V., Schertl, H.P., Neuser, R.D., et al. (2017) Formation and Evolution of Hypabyssal Kimberlites from the Siberian Craton: Part 1—New Insights from Cathodoluminescence of the Carbonates. Journal of Asian Earth Sciences, 145, 670-678. https://doi.org/10.1016/j.jseaes.2017.06.009
- 20. Han, Z.Z., Li, D., Zhao, H., Yan, H.X. and Li, P.Y. (2017) Biomineralization of Carbonate Minerals Induced by the Halophilic Chromohalobacter israelensis under High Salt Concentrations: Implications for Natural Environments. Minerals, 2017, 2017030043. https://doi.org/10.20944/preprints201703.0043.v2
- 21. Sherman, G.D., Kanehiro, Y. and Fujimoto, C.K. (1947) Dolomitization in Semi-Arid Hawaiian Soils. Pacific Science, 38-44.
- 22. Peterson, M.N.A., Bien, G.S. and Berner, R.A. (1963) Radiocarbon Studies of Recent Dolomite from Deep Spring Lake, California. Journal of Geophysical Research, 68, 6493-6505. https://doi.org/10.1029/JZ068i024p06493
- 23. Mckenzie, J.A. (1981) Holocene Dolomitization of Calcium Carbonate Sediments from the Coastal Sabkhas of Abu Dhabi, UAE: A Stable Isotope Study. The Journal of Geology, 89, 185-198. https://doi.org/10.1086/628579
- 24. Han, Z., Wang, J., Zhao, H., et al. (2019) Mechanism of Biomineralization Induced by Bacillus subtilis J2 and Characteristics of the Biominerals. Minerals, 9, 218. https://doi.org/10.3390/min9040218
- 25. Zhuang, D., Yan, H., Tucker, M.E., et al. (2018) Calcite Precipitation Induced by Bacillus cereus MRR2 Cultured at Different Ca2+ Concentrations: Further Insights into Biotic and Abiotic Calcite. Chemical Geology, 500, 64-87. https://doi.org/10.1016/j.chemgeo.2018.09.018
NOTES
*第一作者。
#通讯作者。
