Open Journal of Natural Science
Vol.
09
No.
03
(
2021
), Article ID:
42737
,
10
pages
10.12677/OJNS.2021.93039
蜡质降解微生物的筛选、表征及其秸秆降解作用
王天凤1,范定成1,王琦1,王馨曼1,赵琼阁1,曲湲1,王金玲1,2*,王瑞俭1,2*
1北华大学林学院,吉林 吉林
2吉林省林业生物技术工程研究中心,吉林 吉林

收稿日期:2021年4月15日;录用日期:2021年5月21日;发布日期:2021年5月28日

摘要
我国秸秆资源丰富,但其降解速率慢,仍缺乏高效降解菌剂,表面蜡质层破坏是秸秆降解的第一步。本文从林下腐殖土、腐根等材料中筛选蜡质降解菌,分析菌株对叶表蜡质层的破坏作用,并对其秸秆降解作用进行研究。最终筛选出一种降解蜡质效果较好的菌株(L1-1),核酸分类学鉴定该菌株为金黄杆菌(Chryseobacterium)。菌株L1-1的蜡质相对降解率为39%,对叶表面具有较强的破坏作用。单一菌种降解秸秆的能力有限,蜡质降解菌与木质素降解菌或纤维素降解菌组合可提高秸秆降解率,木质素与纤维素降解菌组合相对降解率可达30.4%。本研究结果表明,在秸秆降解中宜采用复合菌群,蜡质降解菌株在其中可能起到先导作用,木质素降解菌与纤维素降解菌共同使用秸秆降解效果较好。
关键词
秸秆降解,蜡质降解,微生物筛选,先导作用
Screening, Characterization and Straw Degradation of Wax Degradation Microorganism
Tianfeng Wang1, Dingcheng Fan1, Qi Wang1, Xinman Wang1, Qiongge Zhao1, Yuan Qu1, Jinling Wang1,2*, Ruijian Wang1,2*
1Forestry College of Beihua University, Jilin Jilin
2Engineering Research Centre of Forestry Biotechnology of Jilin Province, Jilin Jilin

Received: Apr. 15th, 2021; accepted: May 21st, 2021; published: May 28th, 2021

ABSTRACT
Straw resources is rich in China, and for the lower degrading rate, the degradation of straw is lack of the efficient degrading bacteria. The destruction of surface waxy is the first step in the degradation of straw. In this paper, wax-degrading bacteria were screened from understory, humus soil, rotten root and other materials, and their damage to the waxy layer of leaf surface was analyzed. At last, the straw degradation of waxy-degrading strain was determined. Experimental results were as follows: the strain (L1-1) with the higher wax degradation rate was screened, which was identified as Chryseobacterium sp. by nucleic acid taxonomy technology. The relative wax-degrading rate of L1-1 is about 39%. And the waxy layer on the surface leaf could be disrupted distinctly by L1-1. The straw-degrading ability of L1-1 is limited, while combined with lignin-degrading or cellulose-degrading bacteria could increase degradation rate. And the relative degradation rate of multibacterial species of lignin-degrading combined with cellulose-degrading bacteria was 30.36%. The results indicated that, compound strains should be used in the degradation of straw, and wax-degrading strains might play a leading role in this process. The straw degradation was outstanding when lignin-degrading combined with cellulose-degrading strains.
Keywords:Straw Degradation, Wax Degradation, Microbial Screening, Leading Roles

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
秸秆是可再生资源,秸秆还田能够培肥土壤、改善土壤结构、提高土壤速效养分、促进作物增产 [1],秸秆还可用作饲料、肥料、工业原料、能源 [2],可利用潜力巨大,但缺乏科学的处理方法,浪费宝贵的生物资源 [3]。秸秆的高效利用存在迫切的社会需求,如吉林省发布秸秆综合利用政策32条 [4],并将其列入2019年国家自然基金区域合作项目指南。
当前秸秆的降解机制研究主要围绕降解纤维素、木质素的微生物展开。研究表明,多种微生物对秸秆有较强的降解作用,如芽孢杆菌(Bacillus) [5]、热杆菌(Caldibacillus) [6]、生胞噬纤维菌(Sporacytophg) [7]、黄杆菌(Flavobacterium) [8] 等细菌;木霉(Trichderma) [9]、青霉(Penicillium) [10]、根霉(Rhizopus) [11]、白腐菌(Phanerochaete) [12] 等真菌。秸秆微生物降解前期主要是真菌作用,而后期主要是细菌作用 [13],一般认为单一菌种的降解作用有限,秸秆的降解是多菌种协同作用的结果 [14] [15] [16]。植物蜡质层是植物抵御外界伤害的第一层保护屏障,具有保水、保温、抗辐射的作用 [17]。对于植物来说这是一种防御机制,但它的存在大大降低了秸秆的降解速率。因此,在秸秆降解机制中应考虑到蜡质降解的因素,并且应该体现出蜡质降解的先导作用。目前对于蜡质降解微生物的研究主要针对含烷烃的石油等材料 [18] [19] [20],对于叶表面蜡质降解微生物的研究较少。
本文以林下表层土、倒木、腐根为实验材料,从中筛选高效降解蜡质的微生物,分析其对叶表蜡质的腐蚀作用,并与纤维素、木质素等降解菌制成复合菌剂,探讨其对秸秆的降解作用,对揭示秸秆微生物降解过程有一定理论及实际价值。
2. 实验材料及方法
2.1. 实验材料
5月中旬,于吉林省肇大鸡山采集林下表层土壤,冷杉、色木槭、黄桦等倒木及根的腐烂部分,放入密封袋中,冷藏带回,4℃保存。
2.2. 仪器设备与试剂
2.2.1. 菌株
实验所用纤维素、木质素降解菌株均为本课题组筛选。
2.2.2. 试剂
EB (溴化乙锭),SDS (十二烷基磺酸钠),蛋白胨,葡萄糖,琼脂,氯霉素,甘露醇,酵母粉,琼脂糖等为生化试剂,其他为分析纯试剂。
2.2.3. 仪器设备
本文所用仪器设备见表1。
Table 1. List of instruments
表1. 仪器设备
2.2.4. 溶液及培养基的配制
盐溶液:NH4NO3 2 g,K2HPO4 1.5 g,KH2PO4 3 g,CaCl2 0.01 g,MgSO4∙7H2O 0.1 g,0.5 mol/L Na2EDTA (pH 8.0) 54 μL,H2O 1000 mL,完全溶解后,121℃湿热灭菌30 min。
石蜡培养基:将固体石蜡或液体石蜡用盐溶液配制成所需浓度,121℃湿热灭菌30 min。
YMA培养基:酵母粉1 g,甘露醇10 g,K2HPO4 0.5 g,CaCl2∙H2O 0.05 g,NaCl 0.1 g,MgSO4∙H2O 0.2 g,搅拌至完全溶解,121℃湿热灭菌30 min。
2.3. 实验方法
2.3.1. 蜡质降解菌的富集
(1) 取土壤类样本(不过筛) 10 g,倒木类、腐根类样品剪成长度为约2 cm的小段后取10 g,加入100 ml盐溶液中,25℃,190 rpm震荡孵育20 min。
(2) 室温放置5 min,取上层混悬液10 mL,加入1%石蜡–盐溶液培养基中,25℃,200 rpm培养2~3 d。
2.3.2. 蜡质降解菌株的筛选与纯化
取富集液在以石蜡为唯一碳源的培养基上划线分离,25℃培养1~2 d。选取长势良好的单菌落,在YMA固体培养基上划线分离,25℃培养1~2 d,重复3次后,得到纯化的蜡质降解菌株。
2.3.3. 蜡质降解菌株的表征
(1) 蜡质降解能力的测定
取蜡质降解菌培养液(YMA),按1%接菌量加入1% (v/v)石蜡–盐培养液中,25℃、200 rpm培养3~5 d。待培养液出现明显混浊后,加入4 ml正己烷,涡旋振荡30 s后,转入离心管中,8000 rpm离心5 min。将上清液移至称重的烧杯中,50℃水浴约10 min至正己烷挥发完全,称取烧杯重量,以灭菌水作空白对照,采用失重法计算降解率。
石蜡降解率 = (空白组烧杯重量 − 降解组烧杯重量)/空白组烧杯重量 × 100%。
(2) 对叶表面的腐蚀作用
秸秆表面不平整,且蜡质不明显,本文选择山梨的叶片进行试验。取新鲜山梨叶片,灭菌水清洗表面,吸去水份。将1 μL蜡质降解菌、纤维素降解菌的菌液分别接种于叶表面,在相邻处以等量灭菌水作为空白对照。叶片置于湿润的密封容器中,25℃避光培养7 d,在超景深显微系统中观察结果。
(3) 菌剂对秸秆的降解作用
称取7.5 g玉米秸秆粉于50 ml锥形瓶中,按表2将蜡质降解菌、纤维素降解菌、木质素降解菌的菌液(YMA, 2.5 × 106 CFU)及空白YMA培养基加入秸秆粉中混匀,25℃避光培养7 d后,按如下方法测定秸秆降解率。
秸秆降解产物中加入150 mL蒸馏水,105℃灭菌180 min,趁热抽滤。沉淀依次用无水乙醇、正己烷各提取两次。残渣经60℃干燥4 h后精确称重。采用失重法计算秸秆的降解率及相对降解率:
秸秆降解率 = (降解前秸秆重量 − 降解后秸秆重量)/降解前秸秆重量 × 100%;
秸秆相对降解率 = (实验组降解率 − 空白组降解率)/空白组降解率 × 100%。
Table 2. Proportion of straw-degrading bacteria agents
表2. 秸秆降解菌剂配比表
2.3.4. 蜡质降解菌株的核酸分类学鉴定
(1) DNA提取:将蜡质降解菌加入0.2% SDS缓冲液中,100℃处理10 min,上清中含菌体DNA。
(2) PCR扩增:以菌体DNA为模板,用细菌16S rDNA通用引物(27F:AGAGTTTGATCCTGGCTCAG,1492R:GGTTACCTTGTTACGACTT),进行PCR扩增。反应体系(20 μL):2 × UTaq master mix 10 μL,ddH2O 8.5 μL,上、下游引物(10 mmol/L)各0.5 μL,模板DNA 0.5 μL。
按如下程序进行PCR反应:95℃ 5 min;95℃ 20 s,55℃ 20 s,72℃ 1 min 40 s (30个循环);72℃5 min。
(3) 电泳检测:取PCR扩增产物3 μL,于1%琼脂糖凝胶中电泳,在凝胶成像仪中拍照、记录。
(4) DNA序列测定:将扩增效果良好的PCR产物送至美吉生物科技有限公司进行DNA序列测定,测序引物为PCR扩增所用引物。
(5) 数据处理与分析
① 测序结果经DNA MAN软件对位排列,用Editseq软件手动编辑,去除无效序列后,递交NCBI数据库进行BLAST分析,以同源性高的原则(>97%)对菌株进行鉴定。
② 根据鉴定结果查阅该类微生物的特点、分布、致病性、应用价值等信息,分析其生物学特性,探讨该蜡质降解菌的安全性及可能的应用方向。
3. 实验结果及分析
3.1. 降解菌的分离与纯化
以蜡质为唯一碳源从土壤、倒木及腐根中分离出28株具有蜡质降解能力的菌株。菌落多为淡黄色,较小,表面平滑,边缘整齐(图1)。在秸秆降解菌的研究中,常用刚果红染色法和滤纸条崩解法筛选具有纤维素降解能力菌株 [21] [22],采用PDA-愈创木酚选择性培养基筛选具有木质素降解活性的菌株 [23]。而对于蜡质降解的微生物研究较少,本文采用蜡质为唯一碳源的培养基对蜡质降解微生物进行筛选。
Figure 1. Isolation and purification of wax-degrading bacteria
图1. 蜡质降解菌的分离与纯化
3.2. 蜡质降解菌株的表征
3.2.1. 菌株对蜡质的降解能力的测定
将筛选出的菌株接种于含有蜡质的液体培养基中,失重法测定各菌株的蜡质降解率。实验结果表明,28株蜡质降解菌中,降解率最高可达80% (表3)。其中可大量培养的降解率较高的菌株为L1-1,后续的研究均以此菌株进行。
3.2.2. 菌株对叶表面的破坏作用
将蜡质降解菌L1-1接种于山梨叶表面,7 d后观察对叶表蜡质的破坏作用。实验结果显示,空白对照组的叶脉清晰,叶表蜡质无明显破坏。纤维素降解菌区域叶脉较清晰,降解区域与其他区域稍有差异有轻微的破坏。蜡质降解菌组的降解范围内叶片颜色明显变暗,叶脉模糊,叶表被严重破坏,与空白组及纤维素降解菌组有明显差别,说明蜡质降解菌对叶表面有较强的破坏作用(图2)。
Table 3. Determination of degradation rate of wax degrading bacteria
表3. 蜡质降解菌的降解率测定
3.2.3. 菌株对玉米秸秆的降解作用
将蜡质降解菌、纤维素降解菌、木质素降解菌制成单一或复合菌剂,进行秸秆降解试验,降解率测定结果见图3。研究显示,各组中的秸秆均有一定降解,多数菌剂的降解率在50%~60%间,木质素与纤维素降解菌组合的降解率可达70%以上。以YMA培养基为空白的相对降解率测定结果见表4。研究表明,

Figure 2. Degradation effect of leaf surface by wax degrading bacteria
图2. 蜡质降解菌对叶表面降解作用
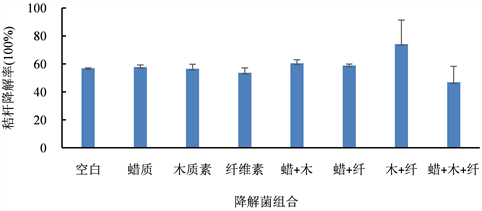
Figure 3. Straw degradation rate of strains
图3. 菌株的秸秆降解率
Table 4. Straw relative degradation of strains
表4. 菌株的秸秆相对降解率
单一菌株对秸秆的降解率提升效果不明显,木质素降解菌与纤维素降解菌混合菌剂的秸秆降解效果最好,较空白组高30.4%,其次为蜡质降解菌与木质素降解菌组合。菌株混合后,菌种类型多样、菌群产酶体系更全面,菌系间通过协同作用而提高秸秆降解效果,如李静等用纤维素降解菌构建复合菌系,其降解能力高于单一菌株 [14]。段杰等人研究证实,高效降解菌系对玉米秸秆的降解失重率可达34.5%,高于各单菌株 [21]。
本文采用的降解率测定方法与文献报道的显著不同,首先在高温条件下用,通过水、乙醇、正己烷提取等一系列处理,将秸秆降解产物中水溶性、脂溶性物质除去,这些物质可以被其他生物体所利用,即为土壤提供有机质等营养物质,剩余的秸秆残渣主要为难溶解、难降解的物质。我们认为,这些难分解物质是否能充分利用才是秸秆微生物降解要解决的根本问题。
3.3. 蜡质降解菌株的鉴定
以27F/1492R为引物扩增蜡质降解菌株的16S rDNA片段,PCR扩增产物的琼脂糖凝胶电泳结果见图4,可见扩增产物条带清晰,大小1500 bp左右。
PCR扩增产物经DNA序列测定、整理后,进行 BLAST 检索,结果显示,蜡质降解菌株L1-1与金黄杆菌(Chryseobacterium sp)同源性高达99%。金黄杆菌属为革兰阴性、短小杆菌,无芽胞,无鞭毛,呈黄色或橙色菌落,为专性需氧菌,可以降解邻苯二甲酸二丁酯(DBP) [24]、甲烷 [25] 等,还具有促进植物生长等作用 [26]。
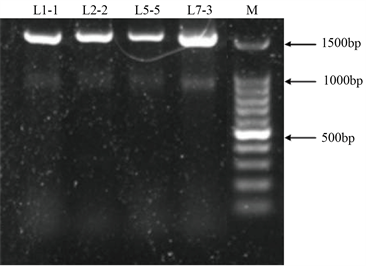
Figure 4. PCR amplification of 16S rDNA of wax degrading bacteria
图4. 蜡质降解菌的16S rDNA的PCR扩增
目前关于蜡质降解微生物特别是植物体表蜡质降解的研究较少,以富含长链烷烃的石油等为降解对象的研究较多 [18] [19] [27] [28]。在秸秆降解方面,主要集中于纤维素降解菌株的筛选,较早报道的纤维素降解菌是白腐菌 [29],噬纤维菌、梭菌属、微球菌、纤维杆菌、假单胞菌、芽孢杆菌 [30] 等对秸秆也有降解作用。本文筛选出的蜡质降解菌单独应用,对秸秆降解作用有限,但与木质素或纤维素降解菌配合使用,可增强其秸秆降解效果,蜡质、木质素、纤维素混合菌剂的秸秆降解效果反而下降,我们推测可能是三种菌相互拮抗从而抑制了降解作用。
4. 结论
从林下腐殖土、倒木、腐根等材料中筛选筛选出28株蜡质降解菌,其中可大量培养菌株L1-1的蜡质降解率达39%,该菌株对新鲜叶表面蜡质层有较强的破坏作用,经核酸分类学鉴定为金黄杆菌属(Chryseobacterium),具有邻苯二甲酸二丁酯(DBP)降解及促进植物生长作用。蜡质降解菌与木质素或纤维素降解菌组合应用,可提高其秸秆降解作用。
基金项目
本文为北华大学大学生创新创业训练计划项目(201910201160),受吉林省重点科技研发项目(20180201006NY)资助。
文章引用
王天凤,范定成,王 琦,王馨曼,赵琼阁,曲 湲,王金玲,王瑞俭. 蜡质降解微生物的筛选、表征及其秸秆降解作用
Screening, Characterization and Straw Degradation of Wax Degradation Microorganism[J]. 自然科学, 2021, 09(03): 348-357. https://doi.org/10.12677/OJNS.2021.93039
参考文献
- 1. 江高飞, 杨天杰, 郑海平, 等. 降解玉米秸秆真菌复合菌系的构建及其降解效果评价[J]. 植物营养与肥料学报, 2021, 27(2): 284-292.
- 2. 张婷, 张一新, 向洪勇. 农作物秸秆综合利用措施研究进展[J]. 安徽农业科学. 2017, 45(2): 80-85.
- 3. 邹利. 浅谈秸秆综合利用[J]. 四川农业科技. 2018(6): 75-77.
- 4. 吉林省人民政府研究室等13部门印发《吉林省秸杆综合利用政策32条》的通知[J]. 吉林省人民政府公报, 2019(17): 22-27.
- 5. 江高飞, 暴彦灼, 杨天杰, 等. 高温秸秆降解菌的筛选及其纤维素酶活性研究[J]. 农业环境科学学报, 2020, 39(10): 2465-2472.
- 6. Rosa, A.B., Ivo, A.N., et al. (2014) Impact of Bioaugmentation on Biochemical Methane Potential for Wheat Straw with Addition of Clostridium cellulolyticum. Bioresource Technology, 152, 567-571. https://doi.org/10.1016/j.biortech.2013.11.067
- 7. 温佳慧, 晏煜煜, 谭韩涵, 等. 生孢噬纤维菌研究进展[J]. 山东化工. 2019, 48(1): 46-48.
- 8. 孙玲. 秸秆降解菌的筛选及促腐菌剂的应用探究[D]: [硕士学位论文]. 长春: 吉林农业大学, 2018.
- 9. 黄亚丽, 黄媛媛, 马慧媛, 等. 低温秸秆降解真菌的筛选及在秸秆还田中的应用[J]. 中国农学通报, 2020, 36(21): 53-60.
- 10. 王金昌, 靳亮, 占智高, 等. 一株高效降解天然水稻秸秆的Penicillium oxalicum T_1的筛选与鉴定[J]. 江西科学, 2020, 38(6): 843-845.
- 11. 王珊珊. 玉米秸秆高效降解菌的筛选及混合菌株降解能力测定[D]: [硕士学位论文]. 哈尔滨: 黑龙江大学, 2016.
- 12. 代广辉. 白腐真菌降解农业废弃物秸秆的研究进展[J]. 辽宁科技学院学报. 2020, 22(3): 17-19.
- 13. Wardle, D.A., Bardgett, R.D., Klironomos, J.N., et al. (2004) Ecological Linkages between Aboveground and Belowground Biota. Science, 304, 1629-1633. https://doi.org/10.1126/science.1094875
- 14. 李静, 张瀚能, 赵翀, 等. 高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J]. 应用与环境生物学报, 2016, 22(4): 689-696.
- 15. 沈大春. 秸秆堆肥降解菌株分离及降解稻秆效果研究[D]: [硕士学位论文]. 南京: 南京农业大学, 2016.
- 16. 裴宇航. 降解秸秆微生物菌种的筛选及高效菌群的构建[D]: [硕士学位论文]. 天津: 天津理工大学, 2012.
- 17. 倪郁, 宋超, 王小清. 低温胁迫下拟南芥表皮蜡质的响应机制[J]. 中国农业科学, 2014, 47(2): 252-261.
- 18. Liu, J., Zhao, B., Lan, Y., et al. (2021) En-hanced Degradation of Different Crude Oils by Defined Engineered Consortia of Acinetobacter venetianus RAG-1 Mutants Based on Their Alkane Metabolism. Bioresource Technology, 327, Article ID: 124787. https://doi.org/10.1016/j.biortech.2021.124787
- 19. Xie, Y., Chen, G., May, A.L., et al. (2020) Pseudomonas sp. Strain 273 Degrades Fluorinated Alkanes. Environmental Science & Technology, 54, 14994-15003. https://doi.org/10.1021/acs.est.0c04029
- 20. Rodrigues, C. and de Carvalho, C. (2019) Phenotypic Adaptations Help Rhodococcus erythropolis Cells during the Degradation of Paraffin Wax. Biotechnology Journal, 14, e1800598. https://doi.org/10.1002/biot.201800598
- 21. 段杰. 东北地区秸秆纤维素降解菌的筛选及高效降解菌系的构建[D]: [硕士学位论文]. 长春: 吉林农业大学, 2015.
- 22. 胡海红. 玉米秸秆低温高效降解复合菌系发酵条件优化及其制剂的初步研究[D]: [硕士学位论文]. 呼和浩特: 内蒙古农业大学, 2016.
- 23. 姜雪. 降解汉麻木质素真菌的筛选及复合菌群的构建[D]: [硕士学位论文]. 哈尔滨: 哈尔滨工业大学, 2018.
- 24. 范思艺, 陈芳艳, 唐玉斌, 等. 1株金黄杆菌的分离鉴定及其对DBP的降解特性[J]. 环境科学与技术, 2018, 41(S1): 41-46.
- 25. 赵天涛, 何成明, 张丽杰, 等. 矿化垃圾中金黄杆菌甲烷亲和氧化动力学[J]. 化工学报, 2011, 62(7): 1915-1921.
- 26. Kim, H. and Yu, S.M. (2020) Chryseobacterium salivictor sp. nov., a Plant-Growth-Promoting Bacterium Isolated from Freshwater. Antonie van Leeuwenhoek, 113, 989-995. https://doi.org/10.1007/s10482-020-01411-8
- 27. Li, H., et al. (2020) Directional Culture of Petroleum Hydrocarbon Degrading Bacteria for Enhancing Crude Oil Recovery. Journal of Hazardous Materials, 390, Article ID: 122160. https://doi.org/10.1016/j.jhazmat.2020.122160
- 28. Wang, R., Wang, D., Yan, S., et al. (2012) Isolation, Identification and Characterization of Four Oil Degrading Strains.
- 29. 邰瓞生, 王佩卿. 白腐菌Phanerochaete chrysosporium对木材中木素的微生物降解[J]. 国际造纸, 1985(4): 17-25.
- 30. 张斯童, 兰雪, 李哲, 等. 微生物降解玉米秸秆的研究进展[J]. 吉林农业大学学报, 2016, 38(5): 517-522.
NOTES
*通讯作者。
