Journal of Organic Chemistry Research
Vol.05 No.01(2017), Article ID:20144,19
pages
10.12677/JOCR.2017.51008
Progress on Asymmetric C-O Bond Formation with Phenols
Jian Zhang, Yi-Fei Wei, Ren-Shi Luo*
Gannan Medical University, Ganzhou Jiangxi

Received: Mar. 15th, 2017; accepted: Mar. 28th, 2017; published: Mar. 31st, 2017

ABSTRACT
Chiral aryl oxa-compounds are extremely important in medicinal chemistry and clinical therapies. The asymmetric reactions of phenols with different substrates are important methodologies to synthesize such species. With phenols as nucleophilic reagents, the chiral catalysts-catalyzed asymmetric reactions, such as substitution, Oxa-Michael addition, ring-opening, Wacker-Type cyclization, O-H insertion, can be developed by reacting with different substrates to obtain such compounds. Recently, the asymmetric C-O bond formation with phenols has made a great progress. This paper will focus on the progress of the asymmetric C-O bond formation with phenols.
Keywords:Phenol, Asymmetric, C-O Bond, Study Progress
酚参与的不对称C-O键形成研究进展
张剑, 魏一飞, 罗人仕*
赣南医学院,江西 赣州
收稿日期:2017年3月15日;录用日期:2017年3月28日;发布日期:2017年3月31日

摘 要
手性芳基氧杂化合物在药物化学和临床治疗上有着及其重要的作用。酚与不同的反应底物发生不对称反应是获得此类化合物的重要途径。在手性催化剂的作用下,以酚为亲核试剂,与不同的反应底物可发生不对称取代、Oxa-Michael加成、开环、Wacker-Type环化、O-H插入等获得手性芳基氧杂化合物。近年来,酚参与不对称C-O键形成取得了较大的进展,本文将对该进展做重点介绍。
关键词 :酚,不对称,C-O键,研究进展

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
手性芳基氧杂化合物是一类重要的杂原子化合物,在药物化学和临床治疗上有着及其重要的作用。这类芳基氧杂原子化合物骨架存在于许多与人类生活休戚相关的药物中,如:用作抗抑郁的手性药物氟西汀[(R)-Fluoxetine]、度洛西汀[(R)-Duloxetine]、治疗高血脂药物MBX-102及内皮素拮抗剂 [1] [2] [3] [4] (反应式1)。因此,对这类化合物的合成进行研究,不仅会推动相关药学领域的进步,还关乎国计民生,具有极其重要的意义。
由于上述化合物对人类生活的重要性,因此如何简易高效合成该类化合物的研究就显得非常重要。酚与不同的反应底物发生不对称反应是获得此类化合物的重要途径。在手性催化剂的作用下,以酚为亲核试剂,与不同的反应底物可发生不对称烯丙基芳基氧化、Oxa-Michael加成、开环、Wacker-Type环化、O-H插入等获得手性芳基氧杂化合物。近年来,酚参与不对称C-O键形成取得了一定进展,本文将对该进展做重点介绍。
2. 酚参与的不对称C-O键形成反应
2.1. 取代反应
与醇相比,酚具有较弱的亲核性,故在一般情况酚的亲核取代反应较难发生。但当在催化剂作用下,酚也可与活性较高的反应底物发生取代反应,如吸电子烯丙基取代化合物。此外,在手性催化剂的作用
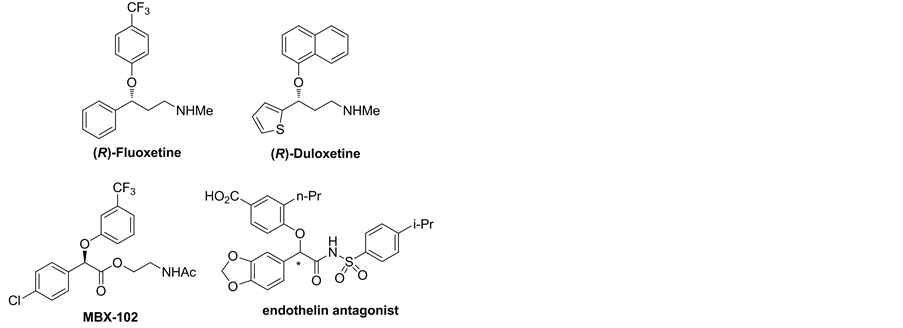
Scheme 1. Typical chiral aryloxy-drugs
反应式 1. 代表性手性芳氧杂药物
下,酚与烯丙基化合物发生取代反应还可获得手性氧杂化合物。因此该取代目前也有许多课题组对该类反应进行研究。从目前报道来看,不对称酚取代反应主要使用Pd、Rh、Ru、Ir为手性催化剂进行转化。此外,小分子催化的不对称取代反应也有报道。
2.1.1. Pd催化取代反应
早在1997年,Sinou小组 [5] 报道使用钯与手性氮膦配体(R,R)-1催化苯酚与环己烯醇碳酸酯发生不对称取代反应,获得95%的收率与85% ee (Equation (1))。与碳酸酯相比较,乙酸酯的反应活性及对映选择性均不理想。

随后,Trost课题组 [6] [7] 与Hoberg研究小组 [8] 则使用(S, S)-1 或 (S, S)-6对酚与3-环戊烯醇碳酸酯或烯丙基碳酸酯的不对取代进行了较为系统的研究,可获得较好的化学选择性与对映选择性(Equation (2))。如使用1 mol%的Pd2dba3与3 mol% (S, S)-6反应可获得高达大于20:1的区域选择性及91% ee。此外,Trost课题组还应用Pd催化分子内不对称取代反应应用到手性苯并二氢吡喃化合物的合成中 [9] 。

除了以碳酸酯作为高活性反应底物,2007年Overman课题组 [10] 则报道使用三氯乙酰亚胺酯作为反应底物与酚发生不对称取代反应(Equation (3)),同样取得了不错的研究结果。研究表明:使用1 mol% 8为手性催化剂,反应可获得高达97%的收率与97% ee (表1). 从表1可以看出,使用不同取代的三氯乙酰亚胺酯及酚对反应的对映选择性影响不大,但反应的收率有较大的影响。如当使用脂肪族取代的三氯乙酰亚胺酯为反应底物时,反应可获得较好的收率,而当使用芳基取代的三氯乙酰亚胺酯为反应底物时,反应只获得了30%的收率(表1, entry 15)。因此该催化体系对芳基取代的三氯乙酰亚胺酯的酚取代不对称反应具有一定的局限性。

Table 1. Scope of the [(S)-COP-OAc]2-Catalyzed Asymmetric Synthesis of Allylic Aryl Ethers with Precursors Containing Additional Functionality
表1. [(S)-COP-OAc]2催化不同官能团前体不对称合成烯丙基芳基醚
加兰他敏(Galanthamine),吗啡(Morphine),可待因(Codeine)及蒂巴因(Thebaine)是一类重要的手性氧杂药物 [11] 。由于其天然来源有限,因此不对称合成该类手性药物则具有重要的现实意义。2013年,Ojima小组 [12] 报道使用钯与DPPBA (S)-14催化酚与环己烯醇碳酸酯的氧杂不对称取代反应合成了用于制备上述重要手性药物的关键中间体(Equation (4))。

2.1.2. Ir催化取代反应
除钯外,铱也用于酚的不对称取代反应。2003年,Hartwig课题组 [13] 报道使用铱与手性联萘酚衍生的氮膦配体催化酚与碳酸酯的不对称取代反应(Equation (5))。为了增加酚的亲核能力,在该研究中作者使用酚的金属盐作为亲核试剂,研究结果表明,使用1.0 mol% [Ir(COD)Cl]2以及2.0 mol% (Ra, Rc, Rc)-16,反应可获得99/1的区域选择性及97% ee (表2).
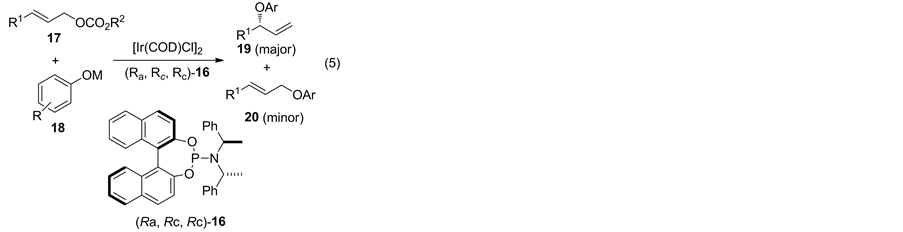
Table 2. Enantioselective Allylic Etherification with Aryloxides Catalyzed by Ir-16
表2. Ir-16 催化芳氧基化合物不对称烯丙基醚化
2004年,Carreria小组 [14] 则以手性香芹酮为原料,通过成环与偶联简易步骤合成手性双烯配体21 (反应式2),用于催化酚与烯丙基碳酸酯的不对称研究取代反应,可获得45%~92% ee。有趣的是,Uozumi课题组 [15] 研究发现使用位阻不同的手性氮膦配体22或23 (反应式2) 用于酚与烯丙基碳酸酯的氧杂不对称取代反应,可获得不同构型的取代产物。
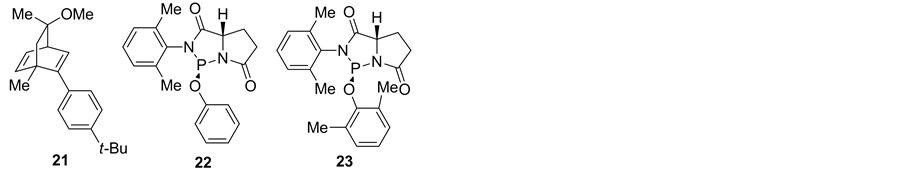
Scheme 2. Chiral diene and N, P ligands
反应式2. 手性双烯配体与氮膦配体
2.1.3. Ru催化取代反应
钌催化的不对称取代反应也有报道。2008年,Onitsuka小组 [16] 报道使用氯代烯作为反应底物,以酚为亲核试剂的不对称取代反应(Equation (6))。以手性环化钌为催化剂,反应可获得大于20/1的区域选择性及80%~95% ee.

在该反应中,作者获得了该催化反应的反应前体并通过单晶结构进行了确认,在此基础上提出了可能的反应机理。作者认为反应首先是催化剂24与化合物25作用获得烯丙基正离子与手性钌的反应前体28,然后酚作为亲核试剂选择性进攻该手性反应中间体29,从而获得手性取代产物27 (反应式3).
2013年,Trost课题组 [17] 则报道了使用手性薄荷醇与磺酰氯为原料,合成了与Onitsuka小组报道手性钌催化剂结构类似的新型手性环化亚峰环戊二烯钌催化剂30 (Equation (6)) 催化该反应,获得了68%~ 94% ee.
2.1.4. Rh催化取代反应
与钯铱钌相比较,铑催化酚不对取代反应报道则相对较少。2016年,Breit小组报道使用2.5 mol% [Rh(cod)Cl]2与5.0 mol% (R,R)-Quinoxp催化酚与碳酸酯的不对称取代反应 [18] (Equation (7)).

研究表明反应可在室温下进行,反应可获得高达99%收率与99% ee,不足的是催化体系对大位阻如叔丁基取代碳酸酯催化活性不高。此外,该催化体系所需的催化剂量也较大(反应式4)。
2.1.5. 小分子催化取代反应
与金属催化相比较,小分子催化的发展相对滞后,但发展迅速,从2000年后成为研究的热点。β-内酰胺是一类重要的抗生素,不仅可用于治疗细菌感染 [19] ,同时也可以用于非细菌感染 [20] 。因此该类化合物的化学合成具有重要的现实意义。2009年,Chemielewski课题组 [21] 报道使用金鸡纳碱催化酚36与4-甲醛基氮杂环丁酮35的不对称取代反应合成吖丁啶化合物37。遗憾的是反应只获得了中等的收率及对映选择性(Equation (8))。


Scheme 3. Possible mechanism
反应式3. 可能的反应机理

Scheme 4. Rhodium-catalyzed asymmetric oxygen-allylation of phenols
反应式4. 铑催化酚不对称氧烯丙化反应
2.2. Oxa-Michael加成
由于小分子催化剂的发展,Oxa-Michael加成是近来研究较多的不对称催化反应类型之一。从目前报道看来,目前Oxa-Michael不对称加成反应主要使用有机小分子催化剂发生分子间或分子内串联反应合成手性苯并二氢吡喃化合物。
2.2.1. 分子间Oxa-Michael加成
许多天然产物及具有药物活性化合物均具有苯并二氢吡喃骨架 [22] ,同时有些苯并二氢吡喃化合物具有光致变色或热致变色性质 [23] ,近年来成为研究的热点。2006年,Arvidsson课题组 [24] 报道使用硅醚化合物(S)-38催化分子间水杨醛与不饱和醛的不对称Oxa-Michael加成反应,遗憾的是反应的收率及对映选择性均不理想(Equation (9))。
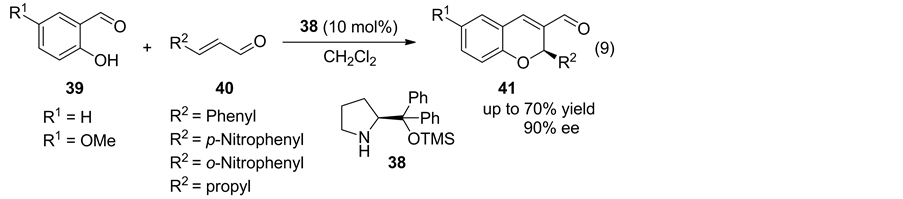
随后有不同课题组使用添加剂如邻硝基苯甲酸或(R)-Mosher acid [25] [26] 或不同有机小分子催化剂 [27] [28] [29] [30] [31] (反应式5) 用于该反应的以提高该反应的活性与对映选择性。
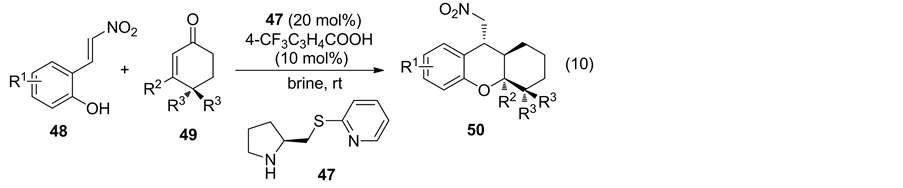
除了不饱和醛为反应底物,其他不饱和化合物的不对称Oxa-Michael加成反应也有报道。2014年,Xu课题组 [32] 报道使用手性硫醚化合物47催化邻羟基苯基硝基烯烃与环不饱和酮的不对称加成反应(Equation (10)),获得了极好的催化结果(表3)。此外,反应可以盐水为溶剂,绿色环保。
同在2014年,Ramachary课题组 [33] 则报道了使用(R)-38催化邻羟基取代苯基硝基烯烃与乙醛发生多组分串联的Oxa-Michael加成反应。如以乙醛与邻羟基苯基硝基烯烃为反应底物,以20 mol% (R)-38为催化剂,获得了光学纯的手性苯并二氢吡喃化合物(Equation (11)).
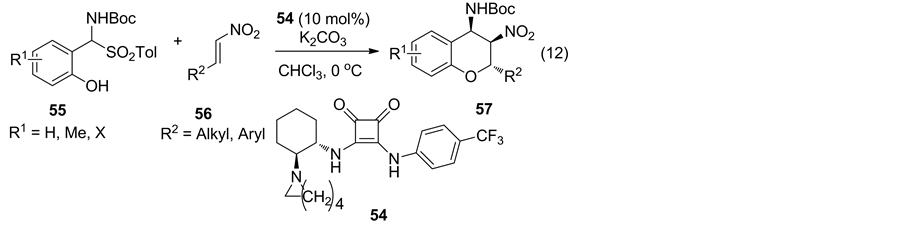
2014年,Peng研究小组 [34] 则使用手性方酰胺催化氨基砜类化合物与硝基烯烃的多组分串联Oxa-Michael加成反应,反应可获得92%~96% ee (Equation (12)).
Scheme 5. Organocatalyst-catalyzed asymmetric Oxa-Michael reaction of unsaturated aldehydes
反应式5. 小分子催化剂用于不饱和醛的不对称Oxa-Michael加成反应
Table 3. Scope of the cascade reaction of 48 with 49 promoted by catalyst 47 in brine
表3. 盐水中催化剂47催化48与49串联反应
2015年,Jørgensen课题组 [35] 则使用大位阻硅醚化合物催化1-萘酚或芝麻酚与不饱和醛发生1, 6-傅克反应与1, 4-Oxa-Michael串联反应合成手性苯并二氢吡喃化合物,获得了不错的催化反应结果。如,以20 mol%化合物58为催化剂,5 mol% DABCO为添加剂,反应获得了94%~99% ee (反应式6).
2.2.2. 分子内Oxa-Michael加成
除了分之间的串联Oxa-Michael加成反应,分子内的Oxa-Michael加成反应也有报道。(+)-Erythrococcamide B是一类具有杀虫活性的药物 [36] 。2014年,Takemoto课题组 [37] 报道使用手性硫脲催化剂61催化不饱和酸62合成手性苯并氧杂环酸化合物63,反应可获得93% - 96% ee (Equation (13))。

Scheme 6. Organocatalyst-catalyzed asymmetric cascade reaction of unsaturated aldehydes with naphthol or sesamol
反应式6. 小分子催化剂催化不饱和醛与萘酚或芝麻酚的不对称串联反应
同时作者利用该有效不对称方法学合成了(+)-Erythrococcamide B。需要指出的是,在该报道中除了获得手性六元氧杂环酸,该催化体系同样可合成五元杂环酸,但产物的对映选择性稍有降低。

随后的2015年,该课题组 [38] 还报道使用手性苯并噻二嗪64催化不饱和酰胺的不对称分子内Oxa-Michael加成反应成功合成了制备贝前列素的反应中间体(Equation (14))。

4-取代芳基苯并二氢吡喃化合物是许多具有生物活性天然产物或药物的结构骨架 [39] [40] 。该类化合物往往具有多手性中心,因此如何简易合成该类化合物的研究具有重要的意义。2016年,Enders课题组 [41] 报道使用手性硫脲催化剂67不对称催化醌与靛红衍生的烯酮发生串联Oxa-Michael加成反应与1,6-加成反应合成具有吲哚骨架的手性苯并吡喃化合物。如以化合物68为反应底物,与不同取代的吲哚烯酮化合物反应均获得了不错的反应结果(表4)。

Table 4. Evaluation of the substrate scope
表4. 底物范围筛选
2.3. 开环
酚与环状化合物开环反应是一类重要的有机合成反应。如酚与氧杂环的不对称开环反应可获得氧杂芳基醇化合物,该类化合物是合成许多药物的中间体 [42] 。目前报道较多是酚与环氧丙烷和氧杂降冰片烯的不对称开环反应。
2.3.1. 酚与环氧丙环的不对称开环
早在199年,Jacobsen研究小组 [43] 报道使用手性钴化合物不对称催化酚与环氧丙烷的开环反应 (Equation (16)),在较温和条件下可获得91%~99% ee。不足的是使用邻取代苯酚如2-甲氧基苯酚或芳基取代环氧丙烷如苯基环氧丙烷反应不能发生。

2.3.2. 酚与氧杂降冰片烯的不对称开环
酚与氧杂降冰片烯的不对称开环可获得手性二氢萘酚化合物,许多具有生物活性化合物都具有该结构骨架 [44] [45] [46] [47] 。早在2000年,Lautens课题组报道铑与(R)-(S)-PPF-Pt-Bu2催化酚与降冰片烯的不对称开环反应 [48] ,反应在回流条件下可在较短时间内获得大于90% ee的开环产物(Equation (17))。研究结果表明酚的量对开环反应的收率有着较大的影响,当酚的当量大少于5.0 equiv时,反应在8 h左右基本可转化完全,而当酚的当量少于5.0 equiv时,反应进行5d后反应的收率也较低。随后作者研究发现加入适当添加剂如Bu4NI可增加反应的活性而不影响产物对映选择性 [49] 。

上述反应的报道引起了许多化学家们的研究兴趣。除了铑催化氧杂降冰片烯与苯酚的不对称开环反应外,使用Ir [50] [51] [52] 、Pt [53] 及Pd [54] 与不同的手性配体(反应式7)催化该反应也有相关报道。与Rh相比较,Ir与Pt催化的酚与降冰片烯的不对称开环反应反应活性较低,反应时间较长,反应往往也不能完全转化。但在路易斯酸如Zn(OTf)2作用下,Pd催化的不对称开环反应可在室温下发生,获得高收率与高对映选择性的开环产物 [54] ,因此该催化体系具有其优势。
2.4. Wacker-Type环化
不对称Wacker-Type环化反应一般通过羟基与烯烃发生分子内环化获得手性氧杂环化合物,因此该反应在有机合成中具有重要的实用价值。1997年,Hayashi课题组 [55] 成功报道了使用Pd与手性配体78不对称催化Wacker-Type环化反应(Equation (18)),获得了90%~97% ee。2004年,Yamamoto课题组则应用手性Sn化合物不对称催化Wacker-Type环化反应合成天然产物如(+)-8-epi-Puupehedione [56] 。

2.5. O-H插入
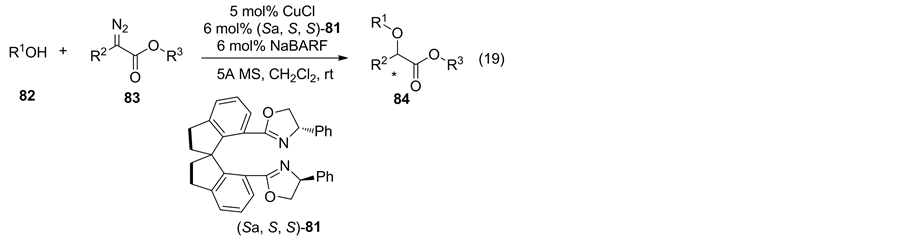
酚与重氮羰基化合物的不对称插入反应是用来构建手性氧杂化合物的有效方法之一。2007年,Zhou课题组 [57] 报道使用Cu与手性螺环配体催化酚不对称O-H插入烷基重氮酸酯获得手性氧杂化合物 (Equation (19))。研究结果表明:使用5 mol% CuCl与6 mol% (Sa, S, S)-81,室温条件下,酚与烷基重氮酸酯可获得光学纯的插入产物,遗憾的是当使用芳基重氮酸酯或醇作为反应底物时,反应的收率与对映选择性均不理想(表5)。
为解决上述催化体系的不足,2014年该课题组 [58] 研究发现使用Pd催化体系可很好的催化酚与芳基重氮酸酯的不对称插入反应(Equation (20))。使用不同的酚与芳基重氮酸酯,反应可获得96%~99% ee.


Scheme 7. Chiral ligands used in asymmetric Ring-Opening reaction
反应式7. 用于不对称开环反应的手性配体
Table 5. Asymmetric Catalytic Carbenoid Insertion into O-H Bonds of Phenols
表5. 不对称催化酚与卡宾O-H键插入
2.6. 氢烷氧基化
光学纯环状与非环状手性缩醛化合物是一类重要的反应中间体 [59] 。2015年,Cao课题组 [60] 报道使用Pd2dba3·CHCl3与Trost手性配体(S, S)-88催化酚与烷氧丙二烯的不对称氢烷氧基化反应(Equation (21))。以2.0 mol% Pd2dba3∙CHCl3与5.0 mol% (S, S)-88为催化剂,在温和条件下,反应获得了高收率(高达98%)与高对映选择性(高达94% ee)的手性缩醛产物。
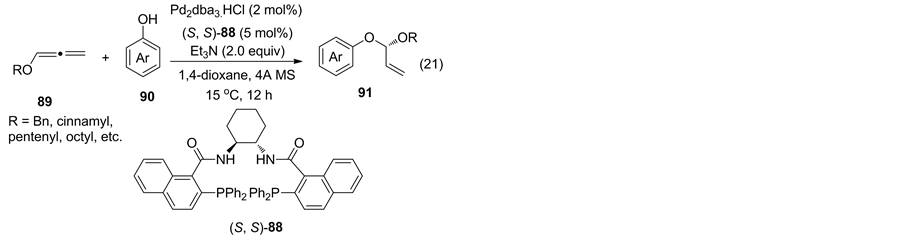
作者还对所得手性缩醛产物进行了单晶培养,确定了产物的绝对构型,在此基础上,提出了相应可能的反应机理:首先酚与Pd(0)L I发生氧化加成形成二价钯II;接着二价钯II与丙二烯作用经历反应过渡态III形成优势反式中间体IV;最后苯酚氧负离子从外部进攻获得手性目标产物(S)-91(反应式8).
2.7. 偶联
酚与烯烃化合物的不对称偶联反应是一项具有挑战性的研究。2016年,Sigman课题组 [61] 报道了Pd与手性吡啶噁唑啉催化酚与烯丙基醇不对称偶联反应,获得手性芳基氧羰基化合物(Equation (22))。
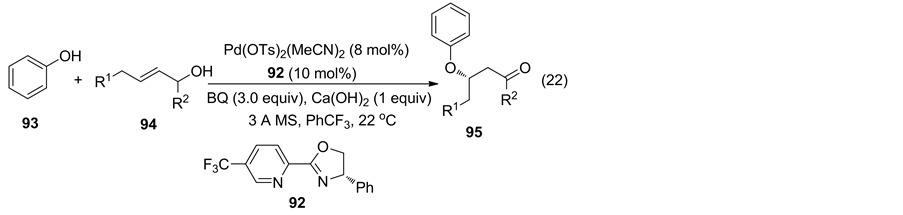
以苯酚为亲核试剂,作者对不同取代的烯丙基醇进行了底物通用性研究。研究表明吸电子取代或大位阻烯丙基醇反应活性较低,给电子或小位阻取代烯丙基醇活性较高,但不同取代或位阻烯丙醇对反应的对映选择性影响不明显(反应式9)。
此外,作者还以戊烯醇为底物,研究了不同取代酚在该催化体系中的通用性,研究表明电子效应对反应的收率与对映选择影响较小,而取代基位阻对反应的活性有一定的影响。
3. 展望
在手性催化剂的作用下,酚参与的不对称C-O键形成取得了一定的进展。但从目前报道的研究来看,该领域还有许多问题需进一步解决。如,(1)尽管目前开发了一些优秀的手性配体或催化剂用于酚的不对称C-O键形成反应,但往往所需催化剂的量较大,他们的工业应用受到了极大的限制,因此进一步研发新型骨架的手性配体或催化剂以实现高效不对称酚的不对称C-O键形成反应;(2)目前有机小分子催化剂
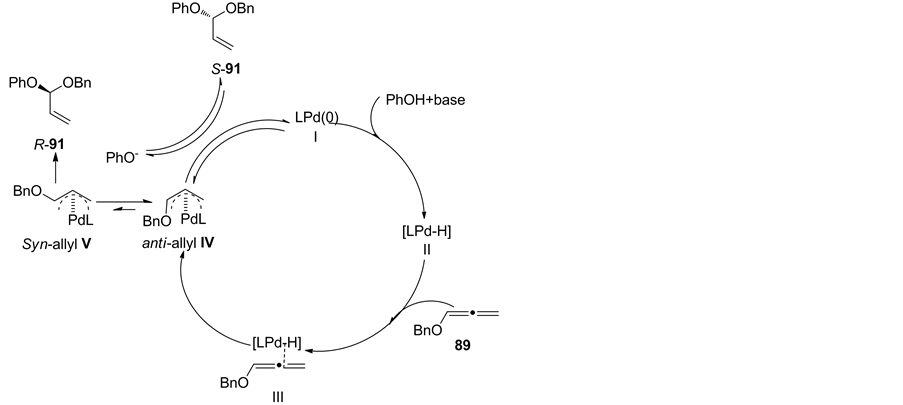
Scheme 8. Possible mechanism
反应式8. 可能的反应机理

Scheme 9. Asymmetric coupling reaction of phenol with allylic alcohol
反应式9. 酚与烯丙基醇的不对称偶联
用于酚的不对称C-O键形成反应有相应的报道,但催化效率较低,目前应用的反应类型也较有限,因此发展新型高效的有机小分子催化剂用于酚的不对称C-O键形成反应仍是一项具有巨大挑战性研究。
根据上述所存在的问题,作者认为今后酚的不对称C-O键形成反应的研究可以从以下几个方面展开:(1)虽然目前已有大量优秀手性配体或催化剂已经报道,但目前许多手性配体或催化剂的设计合成往往具有盲目性、随机性,因此下一步的研究工作作者认为可以从认识手性诱导、传递及放大的基本规律出发,进一步在原理、概念或方法上进行创新,设计合成新型高效的手性配体或催化剂;(2)目前金属催化酚的不对称C-O键形成反应往往具有催化载量高,催化效率低等问题,因此,进一步发展新型高效的金属催化剂以提高催化反应效率的研究具有重要的理论与现实意义;(3)有机小分子催化剂目前主要存有难工业化、高催化载量等缺点,因此作者认为可以通过有机小分子催化剂负载以解决其高载量、难回收等缺点。总之,由于手性氧杂化合物在手性药物及国计民生中的重要性,因此,在原有基础上进一步进行概念或方法上的创新,设计合成更多新型高效的手性配体或催化剂用于酚参与的不对称C-O键形成反应是一项非常有价值的研究工作,具有重要的现实意义。
致谢
感谢国家自然科学地区基金(21562004)。
文章引用
张 剑,魏一飞,罗人仕. 酚参与的不对称C-O键形成研究进展
Progress on Asymmetric C-O Bond Formation with Phenols[J]. 有机化学研究, 2017, 05(01): 51-69. http://dx.doi.org/10.12677/JOCR.2017.51008
参考文献 (References)
- 1. Rej, R.K., Das, T., Hazra, S. and Nanda, S. (2013) Chemoenzymatic Asymmetric Synthesis of Fluoxetine, Atomoxetine, Nisoxetine, and Duloxetine. Tetrahedron: Asymmetry, 24, 913.
- 2. Wenthur, C.J., Bennett, M.R. and Lindsley, C.W. (2014) Classics in Chemical Neuroscience: Fluoxetine (Prozac). ACS Chemical Neuroscience, 5, 14-23. https://doi.org/10.1021/cn400186j
- 3. Calow, A.D.J., Fernández, E. and Whiting, A. (2014) Total Synthesis of Fluoxetine and Duloxetine through an in Situ Imine Formation/Borylation/Transimination and Reduction Approach. Organic & Biomolecular Chemistry, 12, 6121- 6127. https://doi.org/10.1039/C4OB01142B
- 4. Motloch, P., Valterov, I. and Kotora, M. (2014) Enantioselective Allylation of Thiophene-2-Carbaldehyde: Formal Total Synthesis of Duloxetine. Advanced Synthesis & Catalysis, 356, 199-204. https://doi.org/10.1002/adsc.201300849
- 5. Iourtchenko, A. and Sinou, D. (1997) Asymmetric Palladium(0)-Catalyzed Synthesis of allylic Ethers. Journal of Molecular Catalysis A: Chemical, 122, 91.
- 6. Trost, B.M. and Toste, F.D. (1998) Asymmetric O- and C-Alkylation of Phenols. Journal of the American Chemical Society, 120, 815-816. https://doi.org/10.1021/ja972453i
- 7. Trost, B.M. and Brennan, M.K. (2007) Palladium-Catalyzed Regio- and Enantioselective Allylic Alkylation of Bis Allylic Carbonates Derived from Morita-Baylis-Hillman Adducts. Organic Letters, 9, 3961-3964. https://doi.org/10.1021/ol701585b
- 8. Dong, Y., Teesdale-Spittle, P. and Hoberg, J.O. (2005) Regioselective Palladium-Catalyzed Allylic Alkylations. Tetrahedron Letters, 46, 353.
- 9. Trost, B.M., Shen, H.C., Dong, L., Surivet, J.-P. and Sylvain, C. (2004) Synthesis of Chiral Chromans by the Pd-Cat- alyzed Asymmetric Allylic Alkylation (AAA): Scope, Mechanism, and Applications. Journal of the American Chemical Society, 126, 11966-11983. https://doi.org/10.1021/ja048078t
- 10. Kirsch, S.F., Overman, L.E. and White, N.S. (2007) Catalytic Asymmetric Synthesis of Allylic Aryl Ethers. Organic Letters, 9, 911-913. https://doi.org/10.1021/ol070110b
- 11. Marco-Contelles, J., Carreiras, M.C., Rodriguez, C., Villarroya, M. and Garcia, A.G. (2006) Synthesis and Pharmacology of Galantamine. Chemical Reviews, 106, 116-133. https://doi.org/10.1021/cr040415t
- 12. Zang, Y. and Ojima, I. (2013) Pd-Catalyzed Asymmetric Allylic Etherification Using Chiral Biphenol-Based Diphosphinite Ligands and Its Application for The Formal Total Synthesis of (−)-Galanthamine. The Journal of Organic Chemistry, 78, 4013-4018. https://doi.org/10.1021/jo400355j
- 13. Lopez, F., Ohmura, T. and Hartwig, J.F. (2003) Regio- and Enantioselective Iridium-Catalyzed Intermolecular Allylic Etherification of Achiral Allylic Carbonates with Phenoxides. Journal of the American Chemical Society, 125, 3426- 3427. https://doi.org/10.1021/ja029790y
- 14. Fischer, C., Defieber, C., Suzuki, T. and Carreira, E.M. (2004) Readily Available [2.2.2]-Bicyclooctadienes as New Chiral Ligands for Ir(I): Catalytic, Kinetic Resolution of Allyl Carbonates. Journal of the American Chemical Society, 126, 1628-1629. https://doi.org/10.1021/ja0390707
- 15. Kimura, M. and Uozumi, Y. (2007) Development of New P-Chiral Phosphorodiamidite Ligands Having a Pyrrolo[1,2-c]diazaphosphol-1-one Unit and Their Application to Regio- and Enantioselective Iridium-Catalyzed Allylic Etherification. The Journal of Organic Chemistry, 72, 707-714. https://doi.org/10.1021/jo0615403
- 16. Onitsuka, K., Okuda, H. and Sasai, H. (2008) Regio- and Enantioselective O-Allylation of Phenol and Alcohol Catalyzed by a Planar-Chiral Cyclopentadienyl Ruthenium Complex. Angewandte Chemie International Edition, 47, 1454. https://doi.org/10.1021/jo0615403
- 17. Trost, B.M., Rao, M. and Dieskau, A.P. (2013) A Chiral Sulfoxide-Ligated Ruthenium Complex for Asymmetric Catalysis: Enantio- and Regioselective Allylic Substitution. Journal of the American Chemical Society, 135, 18697-18704. https://doi.org/10.1021/ja411310w
- 18. Li, C. and Breit, B. (2016) Rhodium-Catalyzed Dynamic Kinetic Asymmetric Allylation of Phenols and 2-Hydrox- ypyridines. Chemistry: A European Journal, 22, 14655-14663. https://doi.org/10.1002/chem.201603532
- 19. Lysek, R., Borsuk, K., Furman, B., Kaluza, Z., Kazimierski, A. and Chmielewski, M. (2004) Strategies for the Stereocontrolled Formation of Oxygen Analogues of Penicillins and Cephalosporins. Current Medicinal Chemistry, 11, 1813- 1835. https://doi.org/10.2174/0929867043364883
- 20. Veinberg, G., Vorona, M., Shestakova, I., Kanepe, I. and Lukevics, E. (2003) article title. Current Medicinal Chemistry, 10, 1741-1757. https://doi.org/10.2174/0929867033457089
- 21. Koziol, A., Furman, B., Frelek, J., Znica, M.W., Altieri, E. and Chmielewski, M. (2009) Chiral Base-Catalyzed Enantioselective Synthesis of 4-Aryloxyazetidinones and 3,4-Benzo-5-oxacephams. The Journal of Organic Chemistry, 74, 5687-5690. https://doi.org/10.1021/jo900821b
- 22. Nicolaou, K.C., Pfefferkorn, J.A., Roecker, A.J., Cao, G.-Q., Barluenga, S. and Mitchell, H.J. (2000) Natural Product-Like Libraries Based on Privileged Structures I: General Principles and Solid Phase Synthesis of Benzopyrans. Journal of the American Chemical Society, 122, 9939-9953. https://doi.org/10.1021/ja002033k
- 23. Van Gemert, B. (1999) Benzo and Naphthopyrans (Chromenes). In: Crano, J.C. and Guglielmetti, R.J., Eds., Organic Photochromic and Thermochromic Compounds, Vol. 1, Chapter 3, Plenum, New York, 111-140.
- 24. Govender, T., Hojabri, L., Moghaddam, F.M. and Arvidsson, P.I. (2006) Organocatalytic Synthesis of Chiral Benzopyrans. Tetrahedron: Asymmetry, 17, 1763.
- 25. Sund, H., Ibrahem, I., Zhao, G.-L., Eriksson, L. and Cordova, A. (2007) Catalytic Enantioselective Domino Oxa‐Michael/Aldol Condensations: Asymmetric Synthesis of Benzopyran Derivatives. Chemistry: A European Journal, 13, 574-581. https://doi.org/10.1002/chem.200600572
- 26. Luo, S.-P., Li, Z.-B., Wang, L.-P., Guo, Y., Xia, A.-B. and Xu, D.-Q. (2009) Chiral Amine/Chiral Acid as an Excellent Organocatalytic System for the Enantioselective Tandem Oxa-Michael-Aldol Reaction. Organic & Biomolecular Chemistry, 7, 4539-4546. https://doi.org/10.1039/b910835a
- 27. Li, H., Wang, J., E-Nunu, T., Zu, L., Jiang, W., Wei, S. and Wang, W. (2007) One-Pot Approach to Chiral Chromenes via Enantioselective Organocatalytic Domino Oxa-Michael-Aldol Reaction. Chemical Communications, 38, 507. https://doi.org/10.1002/chin.200721117
- 28. Shen, H., Yang, K.-F., Shi, Z.-H., Jiang, J.-X., Lai, G.-Q. and Xu, L.-W. (2011) Recyclable Tertiary Amine Modified Diarylprolinol Ether as Aminocatalyst for the Sequential Asymmetric Synthesis of Functionalized Cyclohexanes and Chromenes. European Journal of Organic Chemistry, 2011, 5031-5038. https://doi.org/10.1002/ejoc.201100613
- 29. Zhao, H.-W., Yang, Z., Yue, Y.-Y., Li, H.-L., Song, X.-Q., Sheng, Z.-H., Meng, W. and Guo, X.-Y. (2014) Asymmetric Direct Michael Reactions of Cyclohexanone with Aromatic Nitroolefins in Water Catalyzed by Novel Axially Unfixed Biaryl-Based Bifunctional Organocatalysts. Synlett, 25, 293-297. https://doi.org/10.1055/s-0033-1340289
- 30. Feng, Y.-H., Luo, R.-S., Nie, L., Weng, J. and Lu, G. (2014) Chiral Diphenylperhydroindolinol Silyl Ether Catalyzed Domino Oxa-Michael-Aldol Condensations for the Asymmetric Synthesis of Benzopyrans. Tetrahedron: Asymmetry, 25, 523.
- 31. Liu, K. and Jiang, X. (2015) Regioselective and Enantioselective Domino Aldol-Oxa-Michael Reactions to Construct Quaternary (Chroman) Stereocenters. European Journal of Organic Chemistry, 2015, 6423-6428. https://doi.org/10.1002/ejoc.201501065
- 32. Xia, A.-B., Wu, C., Wang, T., Zhang, Y.-P., Du, X.-H., Zhong, A.-G., Xu, D.-Q. and Xu, Z.-Y. (2014) Enantioselective Cascade Oxa-Michael-Michael Reactions of 2-Hydroxynitrostyrenes with Enones Using a Prolinol Thioether Catalyst. Advanced Synthesis & Catalysis, 356, 1753-1760. https://doi.org/10.1002/adsc.201301114
- 33. Ramachary, D.B., Reddy, P.S. and Prasad, M.S. (2014) Neighboring Ortho-Hydroxy Group Directed Catalytic Asymmetric Triple Domino Reactions of Acetaldehyde with (E)-2-(2-Nitrovinyl)phenols. European Journal of Organic Chemistry, 2014, 3076-3081. https://doi.org/10.1002/ejoc.201402182
- 34. Zheng, B., Hou, W. and Peng, Y. (2014) Asymmetric Oxa-Michael-Aza-Henry Cascade Reaction of 2-Hydroxyaryl- Substituted α-Amido Sulfones and Nitroolefins Mediated by Chiral Squaramides. ChemCatChem, 6, 2527-2530. https://doi.org/10.1002/cctc.201402236
- 35. Poulsen, P.H., Feu, K.S., Paz, B.M., Jensen, F. and Jørgensen, K.A. (2015) Organocatalytic Asymmetric 1,6-Addi- tion/1,4-Addition Sequence to 2,4-Dienals for the Synthesis of Chiral Chromans. Angewandte Chemie International Edition, 54, 8203-8207. https://doi.org/10.1002/anie.201503370
- 36. Latif, Z., Hartley, T.G., Rice, M.J., Waigh, R.D. and Waterman, P.G. (1998) Novel and Insecticidal Isobutylamides from Dinosperma-Erythrococca. Journal of Natural Products, 61, 614-619. https://doi.org/10.1021/np9705569
- 37. Azuma, T., Murata, A., Kobayashi, Y., Inokuma, T. and Takemoto, Y. (2014) A Dual Arylboronic Acid-Amino- thiourea Catalytic System for the Asymmetric Intramolecular Hetero-Michael Reaction of α,β-Unsaturated Carboxylic Acids. Organic Letters, 16, 4256-4259. https://doi.org/10.1021/ol501954r
- 38. Kobayashi, Y., Kuramoto, R. and Takemoto, Y. (2015) Catalytic Asymmetric Formal Synthesis of Beraprost. Beilstein Journal of Organic Chemistry, 11, 2654-2660. https://doi.org/10.3762/bjoc.11.285
- 39. Sawadjoon, S., Kittakoop, P., Kirtikara, K., Vichai, V., Tanticharoen, M. and Thebtaranonth, Y. (2002) Atropisomeric Myristinins: Selective COX-2 Inhibitors and Antifungal Agents from Myristica cinnamomea. The Journal of Organic Chemistry, 67, 5470-5475. https://doi.org/10.1021/jo020045d
- 40. Maloney, D.J., Deng, J.-Z., Starck, S.R., Gao, Z. and Hecht, S.M. (2005) (+)-Myristinin A, a Naturally Occurring DNA Polymerase Beta Inhibitor and Potent DNA-Damaging Agent. Journal of the American Chemical Society, 127, 4140- 4141. https://doi.org/10.1021/ja042727j
- 41. Zhao, K., Zhi, Y., Shu, T., Valkonen, A., Rissanen, K. and Enders, D. (2016) Organocatalytic Domino Oxa-Michael/1,6-Addition Reactions: Asymmetric Synthesis of Chromans Bearing Oxindole Scaffolds. Angewandte Chemie International Edition, 55, 12104-12108. https://doi.org/10.1002/anie.201606947
- 42. Wright, J.L., Gregory, T.F., Heffner, T.G., MacKenzie, R.G., Pugsley, T.A., Meulen, S.V. and Wise, L.D. (1997) Discovery of Selective Dopamine D4 Receptor Antagonists-1-Aryloxy-3-(4-Aryloxypiperidinyl)-2-Propanols. Bioorganic & Medicinal Chemistry Letters, 7, 1377-1380. https://doi.org/10.1016/S0960-894X(97)00233-3
- 43. Ready, J.M. and Jacobsen, E.N. (1999) Asymmetric Catalytic Synthesis of α-Aryloxy Alcohols: Kinetic Resolution of Terminal Epoxides via Highly Enantioselective Ring-Opening with Phenols. Journal of the American Chemical Society, 121, 6086-6087. https://doi.org/10.1016/S0960-894X(97)00233-3
- 44. Snyder, S.E. (1995) Synthesis and Evaluation of 6,7-Dihydroxy-2,3,4,8,9,13b-hexahydro-1H-benzo[6,7]cyclohepta [1,2,3-ef]benzazepine,6,7-dihydroxy-1,2,3,4,8,12b-hexahydroanthr[10,4a,4-cd]azepine, and 10-(aminomethyl)- 9,10-dihydro-1,2-Dihydroxyanthracene as Conformationally Restricted Analogs of Beta-Phenyldopamine. Journal of Medicinal Chemistry, 38, 2395-2409. https://doi.org/10.1021/jm00013a015
- 45. Kamal, A. and Gayatri, L. (1996) An Efficient Method for 4β-Anilino-4’-Demethylepipodophyllotoxins: Synthesis of NPF and W-68. Tetrahedron Letters, 37, 3359.
- 46. Kim, K., Guo, Y. and Sulikowski, G.A. (1995) Synthetic Studies of the Angucycline Antibiotics. Stereocontrolled Assembly of the SF 2315B Ring System. The Journal of Organic Chemistry, 60, 6866-6871. https://doi.org/10.1021/jo00126a043
- 47. Perrone, R. (1995) High Affinity and Selectivity on 5-HT1A Receptor of 1-Aryl-4-[(1-tetralin)alkyl]piperazines. Journal of Medicinal Chemistry, 38, 942-949. https://doi.org/10.1021/jm00006a013
- 48. Lautens, M., Fagnou, K. and Taylor, M. (2000) Regioselective Palladium-Catalyzed Arylation of 2-Furaldehyde. Organic Letters, 2, 1677-1680. https://doi.org/10.1021/ol005729r
- 49. Lautens, M., Fagnou, K. and Yang, D. (2003) Rhodium-Catalyzed Asymmetric Ring Opening Reactions of Oxabicyclic Alkenes: Application of Halide Effects in the Development of a General Process. Journal of the American Chemical Society, 125, 14884-14892. https://doi.org/10.1021/ja034845x
- 50. Fang, S., Liang, X., Long, Y., Li, X., Yang, D., Wang, S. and Li, C. (2012) Iridium-Catalyzed Asymmetric Ring- Opening of Azabicyclic Alkenes with Phenols. Organometallics, 31, 3113-3118. https://doi.org/10.1021/om3000295
- 51. Cheng, H. and Yang, D. (2012) Iridium-Catalyzed Asymmetric Ring-Opening of Oxabenzonorbornadienes with Phenols. The Journal of Organic Chemistry, 77, 9756-9765. https://doi.org/10.1021/jo3018507
- 52. Li, S., Chen, H., Yang, Q., Yu, L., Fan, C., Zhou, Y., Wang, J. and Fan, B. (2013) Iridium/NMDPP Catalyzed Asymmetric Ring-Opening Reaction of Oxabenzonorbornadienes with Phenolic or Naphtholic Nucleophiles. Asian Journal of Organic Chemistry, 2, 494-497. https://doi.org/10.1002/ajoc.201300077
- 53. Meng, L., Yang, W., Pan, X., Tao, M., Cheng, G., Wang, S., Zeng, H., Long, Y. and Yang, D. (2015) Platinum-Cata- lyzed Asymmetric Ring-Opening Reactions of Oxabenzonorbornadienes with Phenols. The Journal of Organic Chemistry, 80, 2503-2512. https://doi.org/10.1021/acs.joc.5b00065
- 54. Li, S., Xu, J., Fan, B., Lu, Z., Zeng, C., Bian, Z., Zhou, Y. and Wang, J. (2015) Palladium/Zinc Co-Catalyzed Syn- Stereoselectively Asymmetric Ring-Opening Reaction of Oxabenzonorbornadienes with Phenols. Chemistry: A European Journal, 21, 9003-9007. https://doi.org/10.1002/chem.201500816
- 55. Uozumi, Y., Kato, K. and Hayashi, T. (1997) Catalytic Asymmetric Wacker-Type Cyclization. Journal of the American Chemical Society, 119, 5063-5064. https://doi.org/10.1021/ja9701366
- 56. Ishibashi, H., Ishihara, K. and Yamamoto, H. (2004) A New Artificial Cyclase for Polyprenoids: Enantioselective Total Synthesis of (−)-Chromazonarol, (+)-8-epi-Puupehedione, and (−)-11’-Deoxytaondiol Methyl Ether. Journal of the American Chemical Society, 126, 11122-11123. https://doi.org/10.1021/ja0472026
- 57. Chen, C., Zhu, S.-F., Liu, B., Wang, L.-X. and Zhou, Q.-L. (2007) Highly Enantioselective Insertion of Carbenoids into O-H Bonds of Phenols: An Efficient Approach to Chiral α-Aryloxycarboxylic Esters. Journal of the American Chemical Society, 129, 12616-12617. https://doi.org/10.1021/ja074729k
- 58. Xie, X.-L., Zhu, S.-F., Guo, J.-X., Cai, Y. and Zhou, Q.-L. (2014) Enantioselective Palladium-Catalyzed Insertion of α-Aryl-α-diazoacetates into the O[BOND]H Bonds of Phenols. Angewandte Chemie International Edition, 53, 2978- 2981. https://doi.org/10.1002/anie.201309820
- 59. Graham, T.J.A. and Doyle, A.G. (2012) Nickel-Catalyzed Cross-Coupling of Chromene Acetals and Boronic Acids. Organic Letters, 14, 1616-1619. https://doi.org/10.1021/ol300364s
- 60. Jiang, L., Jia, T., Wang, M., Liao, J. and Cao, P. (2015) Pd-Catalyzed Enantioselective Hydroalkoxylation of Alkoxyallenes with Phenol for Construction of Acyclic O,O-Acetals. Organic Letters, 17, 1070-1073. https://doi.org/10.1021/acs.orglett.5b00146
- 61. Race, N.J., Schwalm, C.S., Nakamuro, T. and Sigman, M.S. (2016) Palladium-Catalyzed Enantioselective Intermolecular Coupling of Phenols and Allylic Alcohols. Journal of the American Chemical Society, 138, 15881-15884. https://doi.org/10.1021/jacs.6b11486
NOTES
*通讯作者。
