Hans Journal of Medicinal Chemistry
Vol.
09
No.
02
(
2021
), Article ID:
42778
,
11
pages
10.12677/HJMCe.2021.92009
3,5-取代-1,2,4-恶二唑类化合物的研究进展
孟祥东,Rajendran Satheeshkumar,王文龙
江南大学药学院,江苏 无锡

收稿日期:2021年3月16日;录用日期:2021年5月21日;发布日期:2021年5月28日

摘要
3,5-取代-1,2,4-恶二唑是一类重要的杂环化合物,作为脂键、酰胺键等常见化学键的生物电子等排体在药物化学领域有着重要应用价值,因此其合成方法也受到广泛关注。本文归纳总结了3,5-取代-1,2,4-恶二唑类化合物的合成研究进展,主要介绍了以氰基、酮醛、酰胺肟、酮肟、炔烃等为起始原料合成3,5-取代-1,2,4-恶二唑类化合物的研究进展及其反应机理。最后对该类化合物的合成研究进展进行了总结和展望。
关键词
1,2,4-恶二唑,合成,含氮杂环,酰胺肟
Research Progress of 3,5-Substituted-1,2,4-Oxadiazole Compounds
Xiangdong Meng, Rajendran Satheeshkumar, Wenlong Wang
School of Pharmacy, Jiangnan University, Wuxi Jiangsu

Received: Mar. 16th, 2021; accepted: May 21st, 2021; published: May 28th, 2021

ABSTRACT
3,5-Substituted-1,2,4-oxadiazole is an important class of heterocyclic compounds. As the bio-isostere of common chemical bonds such as lipid bonds and amide bonds, it has important application value in the field of medicinal chemistry. Synthetic methods have also received widespread attention. This article summarizes the progress in the synthesis of 3,5-substituted-1,2,4-oxadiazole compounds, and mainly introduces the synthesis of starting materials with cyano groups, ketone aldehydes, amide oximes, ketoximes, alkynes, etc. research progress and reaction mechanism of 3,5-substituted-1,2,4-oxadiazole compounds. Finally, the research progress of the synthesis of these compounds is summarized and prospected.
Keywords:1,2,4-Oxadiazole, Synthesis, Nitrogen-Containing Heterocycle, Amide Oxime

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
1,2,4-恶二唑的首次合成于1884年由Tiemann和Krüger完成 [1],最初名为呋喃[ab1]二唑(furo[ab1]diazoles)。1,2,4-恶二唑作为药物的早期应用促进了它们的研究。奥索拉明(Oxolamine,图1)是第一种上市的3,5-取代-1,2,4-恶二唑的药物,证明了1,2,4-恶二唑基团在药物化学领域的价值。随后将1,2,4-恶二唑环做为酯键和酰胺键的生物电子等排体应用于药物研究中 [2] [3],增加了这类化合物在药物化学研究中的作用。
1,2,4-恶二唑化合物是一种有这广泛研究的药学支架,已成为毒蕈碱受体激动剂 [4],苯二氮卓受体部分激动剂 [5],多巴胺转运蛋白 [6],促生长激素分泌物 [7] 和5-HT激动剂 [8]。同时1,2,4-恶二唑显示出很大的药学应用潜力,如也已被用作β3肾上腺素能受体激动剂中的尿素生物甾体 [9],S1P1激动剂 [10] 和mGlu5受体激动剂 [11]。同时1,2,4-恶二唑类化合物在材料学上也有这广泛的应用,如:液晶材料 [12],离子液体 [13],金属离子传感器 [14],发光材料 [15],含能材料 [16] 和气体储存材料 [17]。

Figure 1. The structure of Oxolamine
图1. 奥索拉明结构式
由于3,5-取代-1,2,4-恶二唑类化合物具有广泛的药物活性及材料学价值,其合成方法也自然引起了人们的极大兴趣和关注。本文根据国内外的研究现状,对最新研究进行概述以及对未来发展进行展望。
2. O-乙酰氨基肟中间体脱水合成
2.1. 酰胺肟和羧酸的合成
大部分羧酸和酰胺肟偶联是使用EDC,HATU,DCC等偶联剂,此类方法需要12小时以上的反应时间,并且在某些情况下收率不是很高。为了改进这些情况,Porcheddu等人 [18] 和Ramu等人 [19],将羧酸化合物的无水四氢呋喃或无水二氧六环中溶解,后加入CDMT (2-氯-4,6-二甲氧基-1,3,5-三嗪)和N-甲基吗啉搅拌混合物。30分钟后完全转化为中间体加入酰胺肟以甲苯为溶剂微波5分钟或二氧六环回流,可得到1,2,4-恶二唑化合物。该方法的特点是反应时间短,通用性强,产率高,并且手性构型不会反转(图2)。
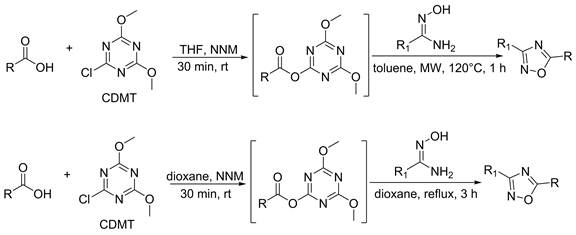
Figure 2. CDMT catalyzed coupling dehydration ring synthesis
图2. CDMT催化偶联脱水合环合成
水作为自然界最为常见的无毒溶剂有着廉价和环保的特点。在2010年Duchet等人 [20],使用DCC作为偶联剂,乙腈为溶剂得到O-乙酰氨基肟中间体。但将中间体O-乙酰氨基肟转化为1,2,4-恶二唑化合物的溶剂换为水,降低了此方法的环境污染(图3)。
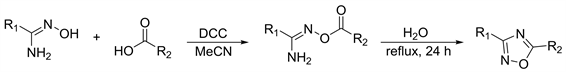
Figure 3. Dehydration and ring closure with H2O as solvent
图3. 以水为溶剂脱水合环
离子液体由于其低挥发性、不燃性和潜在的可回收特性而受到广泛关注。基于此2014年Nowrouzi等人 [21],开发简单,绿色的基于离子液体一锅法合成1,2,4-恶二唑化合物。将腈类化合物,羧酸化合物和羟胺添加到4-(二甲基-氨基)吡啶鎓乙酸盐中。在100℃下搅拌。6小时后,将离子液体溶解在水中并过滤以分离产物,重结晶就可得到纯净的1,2,4-恶二唑化合物,收率为83%~93% (图4)。
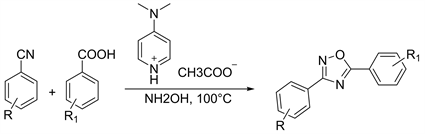
Figure 4. Dehydration and ring closure with ionic liquid as solvent
图4. 以离子液体为溶剂脱水合环
2.2. 酰胺肟和酰氯的合成
微波能加速有机反应的应用日益引起人们的兴趣,并且比传统技术具有节约节耗、加快反应速率、减少反应时间、环境污染小等优点。而且,微波反应可以避免使用溶剂,这使得合成的污染被减小。在2007年Kaboudin等人 [22],使用氧化镁负载的盐酸羟胺和碳酸钠的混合物中加入腈类化合物,研磨成均匀固体后。将反应混合物在180 W的微波下照射3分钟。然后加入酰氯化合物后振摇5分钟,在600 W的微波下照射2到5分钟。经后处理可以以40%~70%的收率得到1,2,4-恶二唑(图5,Scheme a)。由于其产率低在2010年Rostamizadeh等人 [23],将腈类化合物,盐酸羟胺,氟化钾混合,研磨5分钟后将混合物在微波辐射下于100℃辐射5分钟。然后将酰氯化合物加入到混合物中,振摇5分钟,在130℃下于450 W再次照射10分钟可得1,2,4-恶二唑,收率在89%~95%之间(图5,Scheme b)。
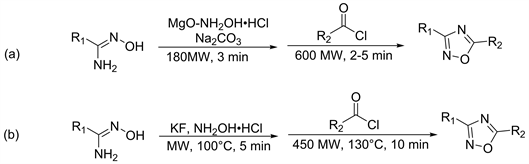
Figure 5. Dehydration and ring closure using amide oxime and acid chloride by microwave method
图5. 用微波法使酰胺肟和酰氯脱水合环
2.3. 酰胺肟和酸酐的合成
水是一种廉价且环保的溶剂,使用水为溶剂可以有效地提高反应的应用。因此Kaboudin等人 [24] 在2011年使用水为溶剂回流下使用酸酐和酰胺肟为原料合成1,2,4-恶二唑,收率为35%~92% (图6)。且酸酐和酰胺肟无论是芳香族还是脂肪族均可适用于反应,应用范围广。
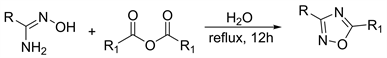
Figure 6. Use water as a solvent to dehydrate and combine amide oxime and acid anhydride
图6. 用水为溶剂使酰胺肟和酸酐脱水合环
2.4. 酰胺肟和脂类的合成
在2017年Baykov等人 [25],向酰胺肟和酯类的DMSO溶液中快速加入NaOH粉末。将反应混合物在室温下搅拌4小时。反应混合物加入冷水稀释。滤出所得沉淀物,用水洗涤。就可得到1,2,4-恶二唑化合物。此反应时间短、条件温和并且后处理简便,但是在有强供电子基团的芳族酯搅拌24小时后未反应,并且带有较弱的给电子取代基需要反应时间延长至16小时同时收率不会下降(图7)。

Figure 7. Amide oxime and lipid ring
图7. 酰胺肟和脂类合环
2.5. 酰胺肟和原羧酸的合成
Al3+-K10粘土等金属交换粘土有这可重复使用的,无毒,廉价的特点。故在2014年Suresh等人 [26],将酰胺肟和原羧酸在Al3+-K10粘土上,微波55℃下保持15分钟可以以91%~94%产率得到1,2,4-恶二唑化合物。此反应一锅无溶剂地合成目标产物大大减少了反应对于环境的污染,且催化剂可重复利用(图8)。
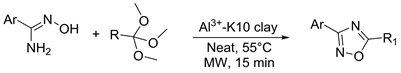
Figure 8. Amide oxime and ortho carboxylic acid ring
图8. 酰胺肟和原羧酸合环
3. 氰基和氧化氰的[3+2]环化加成
3.1. 氰基和醛肟生成1,2,4-恶二唑
近年来,有机高价碘化合物已成为环境友好,有效的试剂,可用于各种合成上有用的氧化转化反应,2-碘代苯甲酸就是之一。2015年和2016年Yoshimura课题组发表两篇文章 [27] [28] 发现可以使用2-碘代苯甲酸氧化醛肟得到1,2,4-恶二唑。在三氟甲磺酸存在室温下,用催化计量的2-碘代苯甲酸和化学计量的CPBA处理醛肟化合物,腈类化合物直接作为溶剂24小时,收率在62%~84%。这种氧化方法产率稳定,同时与常见的高价碘试剂相比,2-碘代苯甲酸可以从反应混合物中高效回收并循环使用。通过简单的酸碱液–液两相方案,可以轻松地从反应混合物中以97%的产率回收2-碘苯甲酸,以达到绿色经济的目的(图9)。
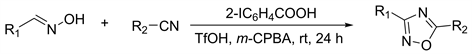
Figure 9. Iodide-catalyzed [3+2] cycloaddition
图9. 碘化物催化[3+2]环化加成
此类反应的机理经过多个反应研究发现,反应过程中可以检测到氧化氰中间体,故此方案为较为认可的反应机理:为把酮肟加入氧化剂或者加热脱氢转化为氧化氰中间体,随后氧化氰和氰基化合物进行[3+2]环化加成,可得目标化合物(图10)。

Figure 10. [3+2] Cyclization Addition Reaction Mechanism of 1,2,4-oxadiazole Compounds
图10. 1,2,4-恶二唑化合物的[3+2]环化加成反应机理
3.2. 亚硝酸甲硅烷基酯合成1,2,4-恶二唑
2017年Nikodemiak等人 [29],在研究亚硝酸甲硅烷基酯与苯乙醛和Yb(OTf)3在乙腈中的反应虽然目标产物收率低,出乎意料的分离出副产品1,2,4-恶二唑。1,2,4-恶二唑是由亚硝酸甲硅烷基酯与溶剂乙腈反应生成的。这一现象使作者将注意力转移到这种副反应上,并将其发展为一种新颖的1,2,4-恶二唑合成方法。向氰基化合物和AgOTf的氯苯溶液中分批加入亚硝酸甲硅烷基酯。在100℃下搅拌1小时,可得到得到1,2,4-恶二唑产物收率在25%~83%。这种方法底物范围广,反应速率高。但是亚硝酸甲硅烷基酯不稳定,不可长时间放置需低温保存或现用现制。作者根据酮肟和氰基化合物的反应机理,猜测机理如下:是将亚硝酸甲硅烷基酯消除得到氧化氰中间体,并且随后银离子催化[3+2]环化加成反应(图11)。
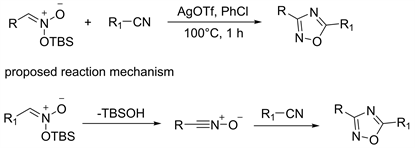
Figure 11. Synthesis and reaction mechanism of 1,2,4-oxadiazole from silyl nitrite
图11. 亚硝酸甲硅烷基酯合成1,2,4-恶二唑及其反应机理
3.3. 氰基与醛类的合成
2012年Vale等人 [30],使用催化剂Yb(NO3)3,同时优化了投料顺序,先将酮类化合物、Yb(NO3)3和HNO3搅拌十分钟,后加入氰基化合物,混合均匀后在80℃反应,收率在50%~87%。反应时间缩短到1~5小时。因为在后续的研究中检测出了α-硝基酮中间体。较为公认的反应机理为:酮烯醇化时被硝化得到α-硝基酮中间体,通过对α-硝基酮催化脱水而形成腈氧化物,并通过和腈类化合物[3+2]环化合成得到酰基-1,2,4-恶二唑衍生物(图12)。
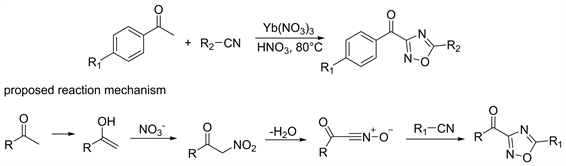
Figure 12. Synthesis and reaction mechanism of 1,2,4-oxadiazole from cyanos and aldehydes
图12. 氰基与醛类合成1,2,4-恶二唑及其反应机理
4. 以席夫碱为中间体的合成
Tka等人 [31] 在2010年,将手性酰胺肟和醛溶于甲苯中,后加入催化量的对甲苯磺酸,回流3~4小时,就可以得到1,2,4-恶二唑。产率在50%~93%。反应时可以保持反应底物的手型结构,且同时适用于脂族和芳族醛(图13)。
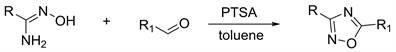
Figure 13. Synthesis of 1,2,4-oxadiazole under acidic conditions using Schiff base as intermediate
图13. 酸性条件下以席夫碱为中间体合成1,2,4-恶二唑
当使用醛和酰胺肟作为底物来制备1,2,4-恶二唑时,通常需要使用氧化剂而且反应在酸性条件,不耐酸底物不适用。因为作为底物的醛是弱氧化剂,所以在2016年Wang等人 [32],开发出来在碱性条件下以底物醛类化合物为氧化剂合成1,2,4-恶二唑的方法。将腈、盐酸羟胺和三乙胺溶于叔丁醇中,在80℃下搅拌18 h得到中间体酰胺肟。后将醛、Cs2CO3和DMSO加入到酰胺肟反应液进行混合,在N2保护下100℃再搅拌24小时。得到所需的1,2,4-恶二唑,产率在50%~93% (图14)。

Figure 14. Synthesis of 1,2,4-oxadiazole using Schiff base as an intermediate under alkaline conditions
图14. 碱性条件下以席夫碱为中间体合成1,2,4-恶二唑
较为认可的机理是,首先将酰胺肟和醛基化合物脱水形成席夫碱,然后环化为4,5-二氢-1,2,4-恶二唑化合物,随后连续氧化芳构化反应可得到1,2,4-恶二唑(图15)。
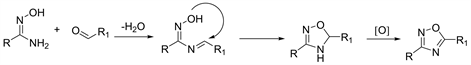
Figure 15. The reaction mechanism for the synthesis of 1,2,4-oxadiazole using Schiff base as an intermediate
图15. 以席夫碱为中间体合成1,2,4-恶二唑的反应机理
5. N-苄基酰胺肟为中间体的合成
N-苄基酰胺肟类似物通常需要原料自制,得到N-苄基酰胺肟类似物的制备方法一般为,在0℃下加入羧酰亚胺基氯化合物和苄胺在DMF中,然后加入三乙胺等有机碱并将混合物搅拌2小时。可得到N-苄基酰胺肟类似物,产率在60%~80%左右(图16)。

Figure 16. Synthesis of N-benzyl amidoximes
图16. N-苄基酰胺肟的合成
在2013年Zhang等人 [33],在DMF中加入K3PO4和N-苄基酰胺肟,在O2氛围下,在60℃加热,可得到1,2,4-恶二唑收率达53%~94% (图17,Scheme a)。在2016年Parker等人 [34],向反应瓶加入N-苄基酰胺肟和DDQ (2,3-二氯-5,6-二氰对苯醌)的DMF溶液中,并用氮气保护将混合物在150℃下搅拌30分钟可得到1,2,4-恶二唑(图17,Scheme b)。这两种方法类似均是使用氧化剂(O2或DDQ)将N-苄基酰胺肟氧化为席夫碱中间体,进而环化为4,5-二氢-1,2,4-恶二唑化合物,随后连续氧化芳构化反应可得到1,2,4-恶二唑(图17)。
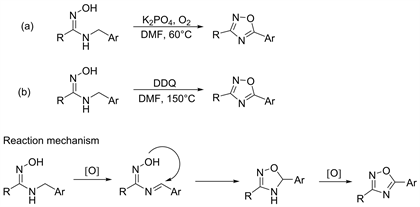
Figure 17. Synthesis and reaction mechanism of 1,2,4-oxadiazole by oxidation of N-benzyl amidoximes
图17. N-苄基酰胺肟氧化合成1,2,4-恶二唑及其反应机理
在2017年Lade等人 [35],报道了通过室温下使用NBS (N-溴琥珀酰亚胺)和DBU (1,8-二氮杂二环十一碳-7-烯)或者使用I2和K2CO3合成1,2,4-恶二唑的方案。就是将N-苄基酰胺肟类似物的DCM溶液中加入NBS和DBU室温下搅拌1小时就可得到1,2,4-恶二唑。另一种方案是将N-苄基酰胺肟类似物的甲苯溶液中加入I2和K2CO3室温下搅拌4小时就可得到1,2,4-恶二唑。产率均在50%~80%之间。此类可能在反应中是卤素化合物是通过在N-苄基酰胺肟的亚胺基团上发生卤代反应,随后在碱性条件下进行脱氢而形成中间体,继续环化为4,5-二氢-1,2,4-恶二唑化合物,随后连续氧化芳构化反应可得到1,2,4-恶二唑(图18)。

Figure 18. Synthesis and reaction mechanism of 1,2,4-oxadiazole catalyzed by N-benzyl amidoximes halide
图18. N-苄基酰胺肟卤化物催化合成1,2,4-恶二唑及其反应机理
6. 酰胺肟和炔基醛(酮)的合成
在2014年Kivrak等人 [36],预测酰胺肟与炔醛(酮)的反应可通过缩合反应合成1,2,4-氧杂二氮杂卓,但实际上通过一锅法却直接合成了1,2,4-恶二唑。向相应的炔基醛(酮)在无水甲醇中的搅拌溶液中加入酰胺肟化合物,并将所得混合物加热回流2小时,可以得到中间产物。从中间体c合成1,2,4-恶二唑作者提供了两种合成方法:第一种在氩气下加入NaH到相应的中间产物的乙腈溶液中在室温下搅拌可得到1,2,4-恶二唑。第二种在氩气下加入KOH到相应的中间产物在二氧六环的溶液中100℃下搅拌可得到1,2,4-恶二唑。但是炔基醛(酮)和酰胺肟化合物使用第二种方法可以直接合成1,2,4-恶二唑。产率在48%~80%之间(图19)。
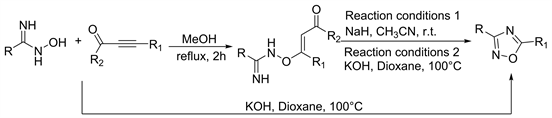
Figure 19. Synthesis and reaction mechanism of 1,2,4-oxadiazole from amide oxime and alkynyl aldehyde (ketone)
图19. 酰胺肟和炔基醛(酮)合成1,2,4-恶二唑及其反应机理
7. 氰基和炔烃合成1,2,4-恶二唑
以前没有报道从容易获得的炔烃直接构建1,2,4-恶二唑骨架,同时在硝酸离子氧化炔烃已经证明可以转化为α-硝基酮中间体。在2020年Bian等人 [37],将腈类化合物,Fe(NO3)3∙9H2O,t-BuCN和硝基苯混合,在氮气保护100℃下将炔烃化合物在硝基苯的溶液缓慢滴加反应中。反应混合物再搅拌24小时。反应完成后,经后处理可得酰基-1,2,4-恶二唑,产率在48%~80%。此反应机理是炔烃硝化氧化后得到α-硝基酮中间体,通过对α-硝基酮催化脱水而形成氧化腈中间体,并通过和腈类化合物[3+2]环化合成得到酰基-1,2,4-恶二唑衍生物(图20)。
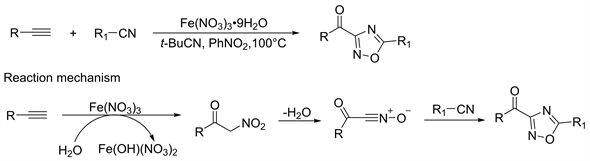
Figure 20. Synthesis and reaction mechanism of 1,2,4-oxadiazole from cyanos and alkynes
图20. 氰基和炔烃合成1,2,4-恶二唑及其反应机理
8. 总结与展望
由于3,5-取代-1,2,4-恶二唑化合物拥有广泛的生物活性,及其重要的应用价值,该类化合物的合成研究已取得长足的发展。本文归纳总结该类化合物的主要合成方法,尽管各有利弊,但近些年,随着3,5-取代-1,2,4-恶二唑化合物应用研究的发展的不断推进,极大地促进了3,5-取代-1,2,4-恶二唑化合物的合成研究。但研究出一种具有原料廉价易得、反应原子利用率高、反应条件温和、操作简单、后处理简便、收率良好等诸多优点的合成方法,将是今后研究工作者继续努力的方向。
基金项目
本文为江苏省自然科学基金BK20190608资助。
文章引用
孟祥东,RajendranSatheeshkumar,王文龙. 3,5-取代-1,2,4-恶二唑类化合物的研究进展
Research Progress of 3,5-Substituted-1,2,4-Oxadiazole Compounds[J]. 药物化学, 2021, 09(02): 67-77. https://doi.org/10.12677/HJMCe.2021.92009
参考文献
- 1. Tiemann, F. and Krüger, P. (1884) Ueber Amidoxime und Azoxime. European Journal of Inorganic Chemistry, 17, 1685-1698. https://doi.org/10.1002/cber.18840170230
- 2. Diana, G.D., Volkots, D.L., Nitz, T.J., et al. (1994) Oxadiazoles as Ester Bioisosteric Replacements in Compounds Related to Disoxaril. Antirhinovirus Activity. Journal of Medicinal Chemistry, 37, 2421-2436. https://doi.org/10.1021/jm00041a022
- 3. Borg, S., Vollinga, R.C., Labarre, M., et al. (1999) Design, Synthesis, and Evaluation of Phe-Gly Mimetics: Heterocyclic Building Blocks for Pseudopeptides. Journal of Medicinal Chemistry, 42, 4331-4342. https://doi.org/10.1021/jm990197+
- 4. Orlek, B.S., Blaney, F.E., Brown, F., et al. (1991) Comparison of Azabi-cyclic Esters and Oxadiazoles as Ligands for the Muscarinic Receptor. Journal of Medicinal Chemistry, 34, 2726-2735. https://doi.org/10.1021/jm00113a009
- 5. Watjen, F., Baker, R., Engelstoff, M., et al.(1989) Novel Benzodiazepine Receptor Partial Agonists: Oxadiazolylimidazobenzodiazepines. Journal of Medicinal Chemistry, 32, 2282-2291. https://doi.org/10.1021/jm00130a010
- 6. Carroll, F.I., Gray, J.L., Abraham, P., et al. (1993) 3-Aryl-2-(3'-substituted-1',2',4'-oxadiazol-5'-yl)tropane Analogs of Cocaine: Affinities at the Cocaine Binding Site at the Dopamine, Serotonin, and Norepinephrine Transporters. Journal of Medicinal Chemistry, 36, 2886-2890. https://doi.org/10.1021/jm00072a007
- 7. Ankersen, M., Peschke, B., Hansen, B.S. and Hansen, T.K. (1997) In-vestigation of Bioisosters of the Growth Hormone Secretagogue l-692,429. Bioorganic & Medicinal Chemistry Letters, 7, 1293-1298. https://doi.org/10.1016/S0960-894X(97)00216-3
- 8. Chen, C., Senanayake, C.H., Bill, T.J., Larsen, R.D., et al. (1994) Improved Fischer Indole Reaction for the Preparation of N,N-Dimethyltryptamines: Synthesis of L-695,894, a Potent 5-HT1D Receptor Agonist. The Journal of Organic Chemistry, 59, 3738-3741. https://doi.org/10.1021/jo00092a046
- 9. Robert, J.M., Anna, M.B., Mari, R.C., et al. (1999) Potent, Selective Human β3 Adrenergic Receptor Agonists Containing a Substituted Indoline-5-Sulfonamide Pharmacophore. Bioorganic & Medicinal Chemistry Letters, 9, 1869-1874. https://doi.org/10.1016/S0960-894X(99)00277-2
- 10. Li, Z., Chen, W., Hale, J.J., Lynch, C.L., et al. (2005) Dis-covery of Potent 3,5-Diphenyl-1,2,4-Oxadiazole Sphingosine-1-Phosphate-1 (S1P1) Receptor Agonists with Exceptional Selectivity against S1P2 and S1P3. Journal of Medicinal Chemistry, 48, 6169-6173. https://doi.org/10.1021/jm0503244
- 11. Roppe, J., Smith, N.D., Huang, D., et al. (2004) Discovery of Novel Het-eroarylazoles That Are Metabotropic Glutamate Subtype 5 Receptor Antagonists with Anxiolytic Activity. Journal of Medicinal Chemistry, 47, 4645-4648. https://doi.org/10.1021/jm049828c
- 12. Frizon, T.E., Rampon, D.S., Gallardo, H., et al. (2012) Selenides and Diselenides Containing Oxadiazoles: A New Class of Functionalised Materials. Liquid Crystals, 39, 769-777. https://doi.org/10.1080/02678292.2012.680505
- 13. Pace, A., Pibiri, I., Piccionello, A.P., et al. (2006) Synthesis and Characterization of a Series of Alkyloxadiazolylpyridinium Salts as Perspective Ionic Liquids. Heterocycles, 68, 2653-2661. https://doi.org/10.3987/COM-06-10895
- 14. Pibiri, I., Piccionello, A.P., Calabrese, A., et al. (2010) Fluorescent Hg2+ Sensors: Synthesis and Evaluation of a Tren-Based Starburst Molecule Containing Fluorinated 1,2,4-Oxadiazoles. European Journal of Organic Chemistry, 2010, 4549-4553. https://doi.org/10.1002/ejoc.201000763
- 15. Li, Q., Cui, L., Zhong, C., et al. (2014) Synthesis of New Bipolar Host Materials Based on 1,2,4-Oxadiazole for Blue Phosphorescent OLEDs. Dyes and Pigments, 101, 142-149. https://doi.org/10.1016/j.dyepig.2013.09.029
- 16. Fu, Z., He, C. and Chen, F. (2012) Synthesis and Characteristics of a Novel, High-Nitrogen, Heat-Resistant, Insensitive Material (NOG2Tz). Journal of Materials Chemistry, 22, 60-63. https://doi.org/10.1039/C1JM14232A
- 17. Ko, D., Patel, H.A. and Yavuz, C.T. (2015) Synthesis of Nanoporous 1,2,4-Oxadiazole Networks with High CO2 Capture Capacity. Chemical Communications, 51, 2915-2917. https://doi.org/10.1039/C4CC08649J
- 18. Porcheddu, A., Cadoni, R. and De Luca, L. (2011) A Fast and Efficient One-Pot Microwave Assisted Synthesis of Variously Disubstituted 1,2,4-Oxadiazoles. Organic & Biomolecular Chem-istry, 9, 7539-7546. https://doi.org/10.1039/c1ob06055d
- 19. Ramu, T., Prasanthi, S., Mangarao, N., et al. (2013) A Simple and Straightforward Protocol to 3,5-Disubstituted 1,2,4-Oxadiazoles from Carboxylic Acids. Chemistry Letters, 42, 722-724. https://doi.org/10.1246/cl.130187
- 20. Laetitia, D., Jean, C.L., Daniel, C., et al. (2010) Synthesis of 3,5-Disubstituted 1,2,4-Oxadiazoles Using Ionic Liquid-Phase Organic Synthesis (IoLiPOS) Methodology. Tetrahedron, 66, 986-994. https://doi.org/10.1016/j.tet.2009.11.079
- 21. Nowrouzi, N., Khalili, D. and Irajzadeh, M. (2015) One-Pot Synthe-sis of 1,2,4-Oxadiazoles from Carboxylic Acids Using 4-(dimethylamino)pyridinium Acetate as Efficient, Regenerable, and Green Catalyst with Ionic Liquid Character. Journal of the Iranian Chemical Society, 12, 801-806. https://doi.org/10.1007/s13738-014-0542-3
- 22. Babak, K. and Fariba, S. (2007) Magnesia-Supported Hydroxyl-amine Hydrochloride in the Presence of Sodium Carbonate as an Efficient Reagent for the Synthesis of 1,2,4-Oxadiazoles from Nitriles. Tetrahedron Letters, 48, 2829-2832. https://doi.org/10.1016/j.tetlet.2007.02.105
- 23. Rostamizadeh, S., Ghaieni, H.R., Aryan, R. and Amani, A.M. (2010) Clean One-Pot Synthesis of 1,2,4-Oxadiazoles under Solvent-Free Conditions Using Microwave Irradiation and Potassium Fluoride as Catalyst and Solid Support. Tetrahedron, 66, 494-497. https://doi.org/10.1016/j.tet.2009.11.063
- 24. Kaboudin, B. and Malekzadeh, L. (2011) Organic Reactions in Water: An Efficient Method for the Synthesis of 1,2,4-Oxadiazoles in Water. Tetrahedron Letters, 52, 6424-6426. https://doi.org/10.1016/j.tetlet.2011.09.081
- 25. Baykov, S., Sharonova, T., Shetnev, A., Rozhkov, S., et al. (2017) The First One-Pot Ambient-Temperature Synthesis of 1,2,4-Oxadiazoles from Amidoximes and Carboxylic Acid Esters. Tetrahedron, 73, 945-951. https://doi.org/10.1016/j.tet.2017.01.007
- 26. Suresh, D., Kanagaraj, K. and Pitchumani, K. (2014) Microwave Promoted One-Pot Synthesis of 2-Aryl Substituted 1,3,4-Oxadiazoles and 1,2,4-Oxadiazole Derivatives Using Al3+-K10 Clay as a Heterogeneous Catalyst. Tetrahedron Letters, 55, 3678-3682. https://doi.org/10.1016/j.tetlet.2014.05.004
- 27. Yoshimura, A., Nguyen, K.C., Klasen, S.C., et al. (2015) Prepara-tion, Structure, and Versatile Reactivity of Pseudocyclic Benziodoxole Triflate, New Hypervalent Iodine Reagent. Chem-ical Communications, 51, 7835-7838. https://doi.org/10.1039/C5CC02009C
- 28. Yoshimura, A., Nguyen, K.C., Klasen, S.C., Postnikov, P.S., et al. (2016) Hypervalent Iodine-Catalyzed Synthesis of 1,2,4-Oxadiazoles from Aldoximes and Nitriles. Asian Journal of Organic Chemistry, 5, 1128-1133. https://doi.org/10.1002/ajoc.201600247
- 29. Nikodemiak, P. and Koert, U. (2017) Metal-Catalyzed Synthesis of Functionalized 1,2,4-Oxadiazoles from Silyl Nitronates and Nitriles. Advanced Synthesis & Catalysis, 359, 1708-1716. https://doi.org/10.1002/adsc.201601378
- 30. Vale, J.A., Faustino, W.M., Zampieri, D.S., et al. (2012) Lanthanide Nitrates as Lewis Acids in the One-Pot Synthesis of 1,2,4-Oxadiazole Derivatives. Journal of the Brazilian Chemical Society, 23, 1437-1440. https://doi.org/10.1590/S0103-50532012005000002
- 31. Tka, N. and Hassine, B.B. (2010) One-Pot Synthesis of New, Biologically Active 3,5-Disubstituted-1,2,4-Oxadiazoles. Synthetic Communications, 40, 3168-3176. https://doi.org/10.1080/00397910903370717
- 32. Wang, W., Xu, H., Xu, Y., et al. (2016) Base-Mediated One-Pot Synthesis of 1,2,4-Oxadiazoles from Nitriles, Aldehydes and Hydroxylamine Hydrochloride without Addition of Extra Oxidant. Organic and Biomolecular Chemistry, 14, 9814-9822. https://doi.org/10.1039/C6OB01794K
- 33. Zhang, F.-L., Wang, Y.-F. and Chiba, S. (2013) Orthogonal Aerobic Conversion of N-Benzyl Amidoximes to 1,2,4-Oxadiazoles or Quinazolinones. Organic & Biomolecular Chemistry, 11, 6003-6006. https://doi.org/10.1039/c3ob41393d
- 34. Parker, P.D. and Pierce, J.G. (2016) Synthesis of 1,2,4-Oxadiazoles via DDQ-Mediated Oxidative Cyclization of Amidoximes. Synthesis, 48, 1902-1909. https://doi.org/10.1055/s-0035-1561597
- 35. Lade, J.J., Patil, B.N., Vadagaonkar, K.S. and Chaskar, A.C. (2017) Oxidative Cyclization of Amidoximes and Thiohydroximic Acids: A Facile and Efficient Strategy for Accessing 3,5-Disubstituted 1,2,4-Oxadiazoles and 1,4,2-Oxathiazoles. Tetrahedron Letters, 58, 2103-2108. https://doi.org/10.1016/j.tetlet.2017.04.045
- 36. Kivrak, A. and Zora, M. (2014) A Novel Synthesis of 1,2,4-Oxadiazoles and Isoxazoles. Tetrahedron, 70, 817-831. https://doi.org/10.1016/j.tet.2013.12.043
- 37. Bian, Q., Wu, C., Yuan, J., et al. (2020) Iron Nitrate-Mediated Selec-tive Synthesis of 3-Acyl-1,2,4-Oxadiazoles from Alkynes and Nitriles: The Dual Roles of Iron Nitrate. The Journal of Organic Chemistry, 85, 4058-4066. https://doi.org/10.1021/acs.joc.9b03070