Metallurgical Engineering
Vol.04 No.01(2017), Article ID:20142,9
pages
10.12677/MEng.2017.41009
Study on Kinetics of Acid Leaching of Zinc Ferrite and Leaching of Zinc Ferrite Waste Material
Boyun Huang1, Wenbin Yan1,2,3*, Zaixing Zhou1
1College of Chemistry and Chemical Engineering, Jishou University, Jishou Hunan
2Key Laboratory of Mineral Cleaner Production and Exploit of Green Functional Materials in Hunan Province, Jishou Hunan
3Hunan Provincial Engineering Laboratory of Control and Remediation of Heavy Metal Pollution from Mn-Zn Mining, Jishou Hunan

Received: Mar. 19th, 2017; accepted: Mar. 28th, 2017; published: Mar. 31st, 2017

ABSTRACT
In order to determine the optimal control parameters for leaching zinc ferrite and efficiently extract zinc and iron from zinc ferrite materials, the effects of temperature and sulfuric acid initial concentration on the kinetics of leaching reaction were investigated with prepared zinc ferrite as raw material and sulfuric acid as leaching agent. The macroscopic reaction kinetic equation was obtained. The results show that the leaching kinetics of zinc is suitable for the reduction of nuclear kinetics model under the condition that temperature is from 50˚C to 90˚C and sulfuric acid and zinc ferrite initial molar ratio is 6. The apparent activation energy is calculated to be 63.50 kJ/mol. The leaching reaction process is controlled by surface chemical reaction steps. With zinc ferrite waste material as the research object, effects of leaching conditions on the leaching rate of zinc and iron were investigated. The leaching rate of zinc and iron from zinc ferrite waste are 90.52% and 90.14% under the condition of sulfuric acid to zinc and iron molar ratio of 1.2:1, leaching temperature of 95˚C, mineral particle size of 0.048 mm, leaching time of 4 h.
Keywords:Zinc Ferrite, Acid Leaching, Kinetics, Activation Energy
铁酸锌的酸浸动力学及含铁酸锌废料浸出研究
黄博云1,颜文斌1,2,3*,周再兴1
1吉首大学化学化工学院,湖南 吉首
2矿物清洁生产与绿色功能材料开发湖南省重点实验室,湖南 吉首
3锰锌矿业重金属污染综合防治技术湖南省工程实验室,湖南 吉首
收稿日期:2017年3月19日;录用日期:2017年3月28日;发布日期:2017年3月31日

摘 要
为确定铁酸锌浸出过程中的最优控制参数,高效浸出含铁酸锌物料中的锌和铁,以制备的铁酸锌为原料,硫酸作浸取剂,考察了浸出温度、硫酸初始浓度对锌浸出效果的影响,得到了浸出反应动力学方程式。结果表明,在温度为50℃~90℃,硫酸与铁酸锌初始物质的量之比为6时,浸出过程符合减缩核动力学模型,表观反应活化能为63.50 kJ/mol,浸出反应受表面化学反应步骤控制。以含铁酸锌废料为原料,考察了浸出条件对锌、铁浸出率的影响。在硫酸与锌和铁物质的量之比为1.2:1,浸出温度为95℃,矿物粒径为0.048 mm,浸出时间为4 h的条件下,含铁酸锌废料中锌、铁浸出率分别为90.52%、90.14%。
关键词 :铁酸锌,酸浸,动力学,活化能

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
铁酸锌是具有尖晶石结构的复合氧化物,其骨架或主体由氧离子组成 [1] 。铁酸锌中三价铁离子位于八面体间隙,与氧离子之间为较强的离子键,而锌离子位于四面体间隙,与氧离子之间在一定程度上属于共价键。锌离子的配位数为4,提供1个4 s轨道和3个4 p轨道,易与氧离子的2 p电子结合,形成稳定的配价键 [2] [3] 。由于四面体内部存在着百分率较高的共价键,铁酸锌结构非常稳定,不溶于水且不溶于稀的硫酸溶液 [4] 。因此,如何改善含铁酸锌物料中锌的浸出效果,是锌湿法冶金的主要难题之一。
为了提高铁酸锌物料中锌的浸出率,国内外学者进行了大量的研究工作,获得了许多浸出方法,如高温酸溶法 [5] [6] ,高温碱溶法 [7] ,机械活化法 [8] [9] 等。研究结果表明,高温酸溶法和高温碱溶法存在设备要求高、能耗高、投资费用高等缺点;机械活化法需要耐酸磨矿设备,且存在磨矿能耗大的缺点。以硫酸为浸取剂对铁酸锌进行热酸浸出,可以大幅提高锌的浸出率且操作简单,过程易控。浸出操作是该工艺中的关键环节,直接影响到产品的回收率,而浸出动力学的研究是优化浸出操作的基础。
本实验以共沉淀法合成的铁酸锌为原料,硫酸为浸取剂,研究了其酸浸过程中锌的浸出动力学,从浸出温度和硫酸初始浓度两个方面探讨了锌浸出过程的控制步骤,以便确定控制浸出反应速率的关键因素。在此基础上探索了含铁酸锌废料酸性浸出的最佳条件。
2. 实验
2.1. 实验原料
2.1.1. 铁酸锌的合成与表征
采用共沉淀法合成铁酸锌 [10] ,其主要过程为:按摩尔比Fe:Zn = 2:1的比例分别称取一定量的硫酸铁和硫酸锌,溶解于一定体积的水中,配制成总金属离子浓度为1 mol/L的混合溶液;在不断搅拌的条件下,按金属离子完全沉淀理论量的2倍加入2 mol/L的碳酸氢铵溶液,用氨水调节终点pH值为7;于30℃下反应30 min,过滤,洗涤,得铁酸锌前驱体;前驱体于105℃干燥2 h,研磨,900℃焙烧12 h,得铁酸锌。对产品进行X射线衍射分析,结果见图1。
从图1可以看出,图中所出现的衍射峰与PDF标准谱图卡号79-1150-ZnFe2O4对照相吻合,无其它杂峰,由此可以判定本实验的合成产物为铁酸锌,且纯度高。
2.1.2. 含铁酸锌废料的化学成分分析
含铁酸锌废料取自湘西保靖某地的高铁氧化锌矿浸出渣,其主要化学成分见表1。
2.2. 实验方法
铁酸锌硫酸浸出:取一定量的铁酸锌与硫酸溶液,置于三口圆底烧瓶中,放入电热恒温水浴锅中,控制一定的温度搅拌浸出,实验中定时取一定体积的反应液,迅速放入容量瓶中,定容,采用EDTA滴定分析反应液中的锌浓度,计算锌的浸出率。预实验表明,当搅拌速度大于100 r/min,搅拌足以消除外扩散对浸出反应速率的影响 [11] [12] [13] 。综合考虑实验设备及能耗,本实验选择搅拌速度为300 r/min。
含铁酸锌废料硫酸浸出:取一定量的铁酸锌废料和硫酸溶液,置于三口圆底烧瓶中,放入电热恒温水浴锅中,控制一定的温度搅拌浸出。待达到指定浸出时间,对料液进行液固分离,采用原子吸收分光光度法测定溶液中的锌浓度,重铬酸钾滴定分析溶液中的铁浓度,计算锌与铁的浸出率。

Figure 1. XRD pattern of product
图1. 产品的XRD图
Table 1. Main chemical composition of mineral /%
表1. 矿物的主要化学成分/%
3. 结果与讨论
3.1. 硫酸与铁酸锌初始物质的量之比的确定
控制硫酸初始浓度2 mol/L,浸出温度90℃,搅拌速度300 r/min,浸出时间4 h,考察不同硫酸与铁酸锌初始物质的量之比对锌浸出率的影响,结果见图2。
从图2可知,硫酸与铁酸锌初始物质的量之比对锌浸出率的影响很大。当物质的量之比为大于6时,锌浸出率提高不明显,因此控制硫酸与铁酸锌初始物质的量之比为6。
3.2. 浸出动力学模型
铁酸锌硫酸浸出,属于液–固反应过程,浸出反应发生在两相的界面上。在浸出过程中,颗粒逐渐缩小,反应无固态产物生成,与减缩核模型的特征相符 [14] 。铁酸锌硫酸浸出包括以下过程:1) 硫酸从溶液中向反应物表面扩散;2) 硫酸在反应物表面与铁酸锌发生化学反应,其化学反应方程式为:4H2SO4 + ZnFe2O4 = Fe2(SO4)3 + ZnSO4 + 4H2O;3) 反应产物硫酸锌、硫酸铁从反应物表面向溶液中扩散。
控制硫酸初始浓度2 mol/L,搅拌速度300 r/min,硫酸与铁酸锌的初始物质的量之比为6,考察不同浸出温度对浸出反应速率的影响。不同浸出温度下锌浸出率与浸出时间的变化关系见图3。
从图3可知,浸出温度对反应速率的影响较大,当温度为90℃时,反应速率最快,浸出90 min后,延长时间对锌浸出率的影响不大。
设浸出时间为t,硫酸初始浓度为C0,硫酸浓度为C,锌浸出率为n,硫酸与铁酸锌初始物质的量之比为a,定义浸出率函数为:
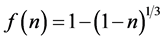 (1)
(1)
动力学时间b [15] 为:
 (2)
(2)
对不同的浸出温度T,保持C0为2 mol/L, a为6,以f(n)对b作图,结果见图4,各曲线的线性相关

Figure 2. Effects of molar ratio on leaching rate of zinc
图2. 物质的量之比对锌浸出率的影响
系数R2均大于0.99,故可得该浸出反应的动力学方程式为:
 (3)
(3)
式中k为表观反应速率常数,与物料性质及反应条件参数有关,如物料粒度、传质扩散系数、硫酸浓度等。该方程式与减缩核模型的动力学方程形式一致 [14] 。
利用曲线拟合法得到的各直线斜率,即不同温度下的表观反应速率常数k1,结果见表2。
3.3. 表观反应活化能
由Arrhenius方程式 [16] 推导得:

Figure 3. Leaching rate of zinc vs. time at different temperatures
图3. 不同温度下锌浸出率与时间的变化关系

Figure 4. f(n) vs. b at different temperatures
图4. 不同温度下f(n)与时间b的关系曲线
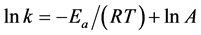 (4)
(4)
式中k为反应速率常数,Ea为表观反应活化能(kJ/mol),R为气体常数[J/(mol·K)],T为绝对温度(K),A为频率因子。根据表2数据,以lnk对1/T作图,得到Arrhenius线性图,结果见图5,由直线的斜率求得Ea = 63.50 kJ/mol,Ea大于42 kJ/mol,表明该浸出反应过程受表面化学反应步骤控制 [14] 。
3.4. 硫酸初始浓度对反应速率的影响
温度为90℃,搅拌速度为300 r/min,a为6,考察不同硫酸初始浓度对浸出反应速率的影响。以f(n)对b作图,结果见图6,各曲线的线性相关系数R2均大于0.99,说明C0在1.0 mol/L~3.0 mol/L范围内变化时,浸出反应动力学方式程式符合减缩核模型。
利用曲线拟合法得到的直线斜率,即不同硫酸初始浓度下的表观反应速率常数k2,结果见表3。
从表3可以看出,保持a为6,当C0大于2.5 mol/L时,反应速率变小。这是因为a不变,铁酸锌的量越大,悬浮的固体颗粒物越不容易分散,固液反应物之间的有效接触面积越小,因而限制了表面化学反应,导致反应速率减小。
Table 2. The value of k1 at different temperature
表2. 不同温度下的k1值
Table 3. The value of k2 at different sulfuric acid concentration
表3. 不同硫酸初始浓度下的k2值

Figure 5. Arrhenius diagram for the leaching system
图5. 浸出体系反应的Arrhenius图
3.5. 含铁酸锌废料浸出的影响因素分析
根据铁酸锌酸浸过程动力学的研究结果,在温度为90℃,硫酸浓度为2.5 mol/L时,铁酸锌浸出速率最快,故以此作为含铁酸锌废料的初始浸出条件,考察硫酸与锌和铁的物质的量之比、浸出温度、矿物粒径及浸出时间对锌、铁浸出率的影响。
3.5.1. 硫酸与锌和铁的物质的量之比对锌、铁浸出率的影响
控制浸出温度90℃,硫酸浓度为2.5 mol/L,浸出时间为2 h,矿物粒径0.074 mm,考察了硫酸与锌和铁物质的量之比对锌、铁浸出率的影响,实验结果见图7。由图可知,锌、铁浸出率随着物质的量之比的增大而提高,当物质的量之比达到1.2:1时,继续增大物质的量之比,对锌、铁浸出率的影响不明显。故实验选择硫酸与锌和铁的物质的量之比为1.2:1。

Figure 6. f(n) vs. b at different sulfuric acid concentration
图6. 不同硫酸浓度下f(n)与时间b的关系曲线

Figure 7. Effect of sulfate to zinc and iron molar ratio on leaching rate
图7. 硫酸与锌和铁的物质的量之比对锌、铁浸出率的影响
3.5.2. 浸出温度对锌、铁浸出率的影响
控制硫酸与锌和铁的物质的量之比为1.2:1,硫酸浓度为2.5 mol/L,浸出时间2 h,矿物粒径0.074 mm,考察了浸出温度对锌、铁浸出率的影响,实验结果见图8。
在常压下进行浸出实验,温度很难达到100℃,所以在浸出温度小于95℃的条件下进行实验。由图可知,在温度低于80℃时,锌浸出率增加很快,在温度为80℃时,浸出率大于80%,继续升高温度,对浸出率的影响不明显;铁浸出率随着浸出温度的升高而一直增大。故实验选择浸出温度为95℃。
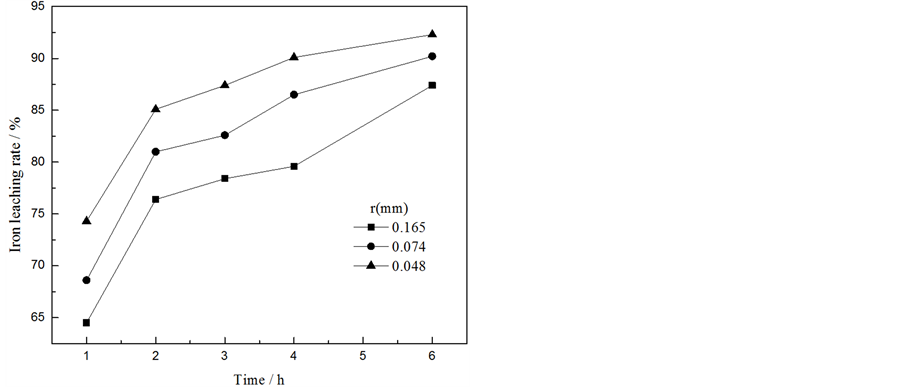
3.5.3. 矿物粒径及浸出时间比对锌、铁浸出率的影响
控制硫酸与锌和铁的物质的量之比为1.2:1,硫酸浓度为2.5 mol/L,浸出温度为95℃,考察了矿物粒径及浸出时间对锌、铁浸出率的影响,实验结果见图9。铁酸锌浸出反应过程符合减缩核动力学模型,

Figure 8. Effect of leaching temperature on leaching rate of zinc and iron
图8. 浸出温度对锌、铁浸出率的影响
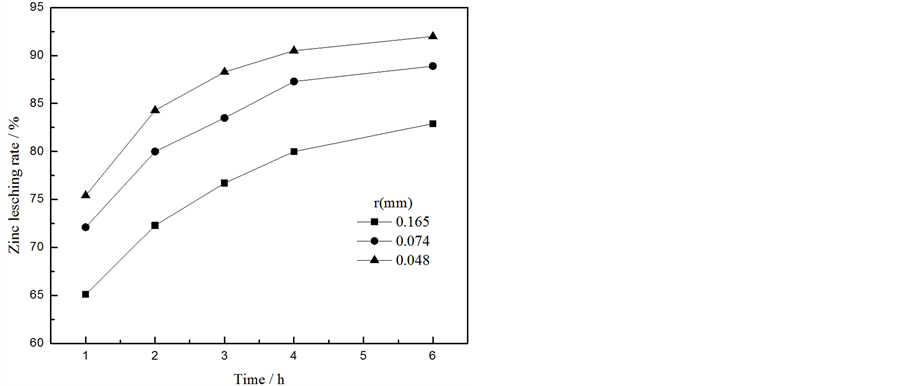 (a) (b)
(a) (b)
Figure 9. Effect of mineral particle size and leaching time on zinc (a) iron (b) leaching rate
图9. 矿物粒径及浸出时间对锌(a)、铁(b)浸出率的影响
受表面化学反应控制,表明矿物粒径会对铁酸锌浸出反应速率产生较大影响。由图可知,矿物粒径越小,浸出速率越快。当矿物粒径为0.048 mm,浸出时间为4 h时,锌、铁的浸出率分别为90.52%、90.14%。继续延长浸出时间,对浸出率的影响不明显,故选择浸出时间为4 h。
4. 结论
本文采用共沉淀法合成铁酸锌,对其进行硫酸浸出,硫酸与铁酸锌初始物质的量之比为6,硫酸浓度为2 mol/L,反应温度为50℃~90℃时,浸出反应动力学符合“减缩核动力学模型”,表观反应活化能为63.50 kJ/mol,浸出反应过程受表面化学反应步骤控制。硫酸与铁酸锌初始物质的量之比一定时,硫酸初始浓度不同,浸出反应动力学仍符合“减缩核动力学模型”。
对含铁酸锌废料进行硫酸浸出,单因素实验结果表明,硫酸与铁和锌的物质的量之比为1.2:1,浸出
温度为95℃,矿物粒径为0.048 mm,浸出时间为4 h的条件下,锌和铁的浸出率分别可达到90.52%、90.14%。
基金项目
湖南省高校科技创新团队支持计划资助;吉首大学校级科研课题(Jdy16014)。
文章引用
黄博云,颜文斌,周再兴. 铁酸锌的酸浸动力学及含铁酸锌废料浸出研究
Study on Kinetics of Acid Leaching of Zinc Ferrite and Leaching of Zinc Ferrite Waste Material[J]. 冶金工程, 2017, 04(01): 61-69. http://dx.doi.org/10.12677/MEng.2017.41009
参考文献 (References)
- 1. 彭海良. 常规湿法炼锌中铁酸锌的行为研究[J]. 湖南有色金属, 2004, 20(5): 20-22.
- 2. 侯栋科, 彭兵, 柴立元, 等. 铁酸锌选择性还原的反应机理[J]. 中国有色金属学报, 2014, 24(10): 2634-2641.
- 3. Yu, G., Peng, N., Zhou, L., et al. (2015) Selective Reduction Process of Zinc Ferrite and Its Application in Treatment of Zinc Leaching Residues. Transactions of Nonferrous Metals Society of China, 25, 2744-2752. https://doi.org/10.1016/S1003-6326(15)63899-7
- 4. 张纯, 闵小波, 张建强, 等. 锌冶炼中浸渣锌还原浸出机制与动力学[J]. 中国有色金属学报, 2016, 26(1): 197- 203.
- 5. 王 侃, 周廷熙, 方锦. 酸浸渣强化冶炼工艺研究[J]. 云南冶金, 2008, 27(3): 29-31.
- 6. Šárka, L., Juraj, L. and Dalibor, M. (2009) Selective Leaching of Zinc from Zinc Ferrite with Hydrochloric Acid. Hydrometallurgy, 95, 179-182. https://doi.org/10.1016/j.hydromet.2008.05.040
- 7. Zhao, Y.C. and Stanforth, R. (2000) Tech-nical Note Extraction of Zinc from Zinc Ferrites by Fusion with Caustic Soda. Minerals Engineering, 13, 1417-1421. https://doi.org/10.1016/S0892-6875(00)00123-0
- 8. 姚金环. 从铟铁酸锌中用机械活化方法强化浸出铟、锌的机理研究[D]: [博士学位论文]. 南宁: 广西大学, 2013.
- 9. 张燕娟, 黎铉海, 潘柳萍, 等. 机械活化对铟铁酸锌溶解动力学及物化性质的影响[J]. 中国有色金属学报, 2012, 22(1): 315-323.
- 10. 周再兴. 高铁低品位氧化锌矿湿法浸取提锌制备纳米氧化锌的研究[D]: [硕士学位论文]. 吉首: 吉首大学, 2010.
- 11. 夏志华, 唐谟堂, 李仕庆, 等. 锌焙砂中浸渣高温高酸浸出动力学研究[J]. 矿冶工程, 2005, 25(2): 53-57.
- 12. Qiu, H.D., Zhang, H., Zhao, B., et al. (2013) Dynamics Study on Vanadium Extraction Technology from Chloride Leaching Steel Slag. Rare Metal Materials and Engineering, 4, 696-699. https://doi.org/10.1016/S1875-5372(13)60059-4
- 13. 曾科, 何名飞, 覃文庆, 等. 含铟氧化锌提取铟的浸出动力学研究[J]. 矿冶工程, 2016, 36(1): 76-79, 82.
- 14. 李洪桂, 郑清远, 张启修. 湿法冶金学[M]. 长沙: 中南大学出版社, 2002.
- 15. 张焕军, 朱国才, 胡熙恩. (NH4)2SO4浸取轻烧氧化镁的动力学[J]. 清华大学学报自然科学版, 2003, 43(10): 1321-1323.
- 16. 华一新. 冶金过程动力学导论[M]. 北京: 冶金工业出版社, 2004.
