Material Sciences
Vol.07 No.03(2017), Article ID:20679,9
pages
10.12677/MS.2017.73042
Preparation of Three-Dimensional Porous Copper Oxide Nanoflakes and Its Non-Enzymatic Detection of Glucose
Changxu Shao, Shougang Chen*
Department of Materials Science and Engineering, Ocean University of China, Qingdao Shandong
*通讯作者。

Received: May 3rd, 2017; accepted: May 23rd, 2017; published: May 26th, 2017

ABSTRACT
In this paper, three-dimensional porous copper oxide nanoflakes were successfully synthesized on the copper substrate without the use of organic reagents and stabilizers by the combination of liquid-solid reaction and high-temperature annealing. The three-dimensional porous structure of copper oxide has a large specific surface area, and the mesopores and micropores on the nanosheets are conducive to the transmission of electron. Using good biocompatibility, conductivity and film of chitosan are used to prepare chitosan copper oxide organic-inorganic composite electrode for nonenzymatic glucose electrochemical sensor. This electrode has the advantages of simple preparation, fast response and low detection line and the sensor is almost insensitive to common interference, such as dopamine, uric acid and ascorbic acid.
Keywords:Porous Copper Oxide Nanoflakes, Non-Enzymatic Sensor, Glucose
三维交错多孔氧化铜纳米片的制备及其对葡萄糖的无酶检测
邵长旭,陈守刚*
中国海洋大学材料科学与工程研究院,山东 青岛
收稿日期:2017年5月3日;录用日期:2017年5月23日;发布日期:2017年5月26日

摘 要
本文采用液固反应与高温退火相结合的方法,在不使用有机试剂及稳定剂的条件下在铜基体上成功的合成了三维交错多孔氧化铜纳米片。氧化铜的三维多孔结构,使其具有大的比表面积并且纳米片上的介孔和微孔有利于电子的传递。利用壳聚糖良好的生物兼容性,导电性和成膜性制备壳聚糖氧化铜有机–无机复合材料电极用于葡萄糖的无酶电化学检测。此电极具有制备简单、响应快速检测线低的优点,并且在常见干扰物尿酸,抗坏血酸,多巴胺等共存条件下对葡萄糖检测具有良好的选择性。
关键词 :多孔氧化铜纳米片,无酶传感,葡萄糖

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在世界范围内,糖尿病是导致死亡和残疾的主要原因之一,并且还与心脏病、肾衰竭、失明等疾病密切相关,在全球范围内大约有1.7亿糖尿病人。经常检测机体的血糖水平是预防糖尿病的重要措施 [1] 。而且,葡萄糖液也广泛应用于食品和制药行业。因此,准确的检测葡萄糖的含量在医学诊断,食品生产,制药行业及其他领域具有重要的意义 [2] 。电化学检测因其具有操作简单,检测灵敏度高,响应快速,性价比高而被广泛发展和运用。到目前为止,葡萄糖传感器已经经历过了3代。第一代的检测依靠耗氧量或者H2O2的生成量,但是这种检测受缺氧的限制。为了去克服那些问题,第二代传感器基于介体做出了发展,例如非生物学的电子受体和纳米材料电气连接。之后,第三代传感器被制作出来,不含有介体。由于电子直接从葡萄糖传递到电极,所以需要的工作电压很低,就导致了具有很高的灵敏度和响应快速的优点 [3] 。大多数第三代葡萄糖传感器依赖于固定的高选择性和高灵敏性的酶 [4] 。但是酶的生物活性很容易受固定方法和实验条件的影响,导致低的稳定性和可再现性 [5] [6] [7] 。为了解决那些弊端,开发灵敏度高稳定性好的无机纳米材料基的第三代无酶葡萄糖传感器成为研究的热点问题 [8] [9] [10] 。
CuO是一种p型半导体材料,禁带宽度约1.2 eV,外层电子轨道排布为3d9,具有很好的化学稳定性和电化学活性,被广泛应用于催化,半导体,气体传感,生物传感及晶体管领域 [11] 。纳米结构的CuO具有大的比表面积和潜在的尺寸效应使其拥有优于其他同类型材料的物理和化学性质。利用纳米结构的CuO作为电极材料制备无酶葡萄糖传感器吸引了大量的研究兴趣。
本文通过温和的方法利用液固反应与高温退火相结合,以过硫酸铵为氧化剂,调节溶液的pH及随后的热处理在铜基体上成功的合成了三维多孔氧化铜纳米片。方法简单,性价比高,并通过XRD SEM等手段对其成分及形貌进行了表征。CuO的三维多孔结构,使其具有大的比表面积并且纳米片上的无数介孔和微孔有利于电子的传递,使其表现出良好的电催化活性,高的选择性和稳定性。作为天然高分子多糖,壳聚糖具有良好的生物兼容性,导电性和成膜性,基于此特性,制备了壳聚糖氧化铜有机-无机复合材料电极,并研究了此电极对葡萄糖的无酶传感性能。
2. 实验过程
2.1. 试剂与仪器
葡萄糖、抗坏血酸、氢氧化钠、过硫酸铵、无水乙醇购于国药集团化学试剂有限公司;尿酸(UA),多巴胺(DA),壳聚糖购于Sigma公司;所有其他试剂均为分析纯直接使用不需要进一步的提纯处理,所有水溶液均由Milli-Q (18.2MΩcm)制备。电化学测试采用上海辰华的电化学工作站(CHI 650D,上海辰华),所有实验均在室温下进行。
2.2. 氧化铜纳米片的制备
首先对铜基体(铜片)进行预处理,将大小1 cm × 1 cm铜片浸泡在丙酮溶液里,放入超声波清洗器里超声5分钟,以去掉铜片表面的油污及其他污渍。随后取出铜片浸泡于无水乙醇溶液里,再次超声5分钟,然后取出放入无水乙醇溶液里保存,备用。
用超纯水配置氢氧化钠溶液(NaOH 10 M)、过硫酸铵溶液((NH4)S2O8 1M)。铜基体用丙酮乙醇处理去除表面杂质,放入超纯水中备用。取4 mL氢氧化钠溶液2 mL过硫酸铵溶液9 mL超纯水放入烧杯里。然后放入处理过的铜基体。反应4小时后,取出铜基体,用超纯水冲洗,室温下自然干燥。然后把干燥后的铜基体放入马弗炉里,在氩气氛围下,500℃保温5小时,自然冷却后既得到三维多孔氧化铜纳米片。
2.3. 材料表征
将制备的纳米材料分别通过扫描电子显微镜SEM、XRD等仪器进行表征。
2.4. 电化学传感器的构建
在电极修饰之前,首先把直径3 mm的玻碳电极(GCE)在绒布上用0.3 um 0.05 um的氧化铝粉末作抛光处理,冲洗干净后在铁氰化钾溶液里用循环伏安法检测电极的可逆性,用乙醇、水交叉完全冲洗干净,室温下晾干备用。将4 mg壳聚糖溶于醋酸-醋酸钠缓冲溶液里,在室温下充分搅拌2小时,在构建多孔氧化铜纳米片传感器时,将5 uL壳聚糖溶液滴在干净的倒置的玻碳电极上,随后把2 mm × 2 mm左右的纳米片放在壳聚糖溶液里,室温下干燥,利用其吸附成膜特性将纳米材料固定在电极表面,命名为CuO/Chitosan/GCE。在使用之前,用超纯水轻轻冲洗电极以除去连接不稳定的修饰物。修饰电极在4℃冰箱里保存备用。
2.5. 电化学测试
电化学测试使用电化学工作站CHI660D,在室温下进行。测试使用传统的三电极体系:Ag/AgCl电极为参比电极,铂丝电极为对电极和氧化铜纳米片修饰的玻碳电极作为工作电极。电化学测试均在0.1 M的氢氧化钠溶液里进行。在进行循环伏安法测试时,电位窗为−0.2~0.6 V。在电解质溶液加入被分析物葡萄糖后,先搅拌均匀然后再进行电化学测试。在进行计时电位法测量实验时,加入被分析物后电解质溶液体积的改变对浓度的影响被考虑。
3. 结果与讨论
3.1. 纳米片的合成与表征
图1是多孔氧化铜纳米片的扫描电镜图。由图可以看出,氧化铜为多孔的片状,片的长度在10 um左右,厚度为纳米级。纳米片呈不规则的排列互相交织,片上具有许多大小不一的孔洞,既有纳米级孔洞也有微米级孔洞。利用XRD对合成的材料进行表征,结果如图2所示。

Figure 1. SEM image of porous CuO nanoflakes
图1. 多孔CuO纳米片的扫描电镜图
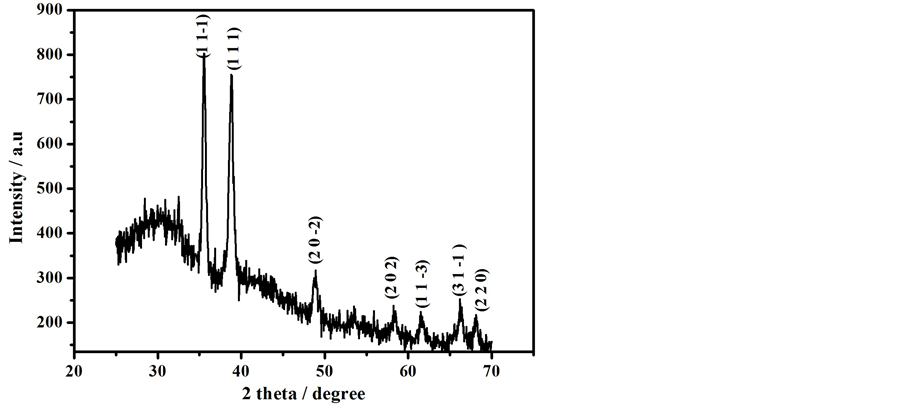
Figure 2. XRD patterns of porous CuO nanoflakes
图2. 多孔CuO纳米片的X射线衍射图谱
与标准氧化铜谱图对比,无其他杂峰,表明合成的材料纯度较高。
在制备过程中主要发生了如下反应:
把铜基体放入由4 mL氢氧化钠、2 mL过硫酸铵和9 mL水组成的混合溶液里,几分钟后,蓝色出现在铜基体的表面,随后淡蓝色的薄膜覆盖在铜基体的表面,在随后的1小时里,颜色逐渐加深成为深蓝色,在2小时后铜基体表面被黑色的氢氧化铜覆盖。在这个过程中,主要发生了如下反应:

在碱性溶液里,铜基体的表面被(NH4)2S2O8迅速的氧化生成Cu2+,随后此碱性环境促进Cu2+与OH−的结合,生成Cu(OH)2。将铜片从溶液中取出,用水和酒精清洗干净,在空气中自然干燥。随后将表面覆盖有Cu(OH)2的铜基体放入马弗炉里,500℃保温4小时,随后就生成了三维多孔氧化铜纳米片。在保温过程中主要发生了如下反应:

3.2. 纳米片的电化学行为研究
电化学实验采用三电极体系,多孔氧化铜纳米片玻碳电极为工作电极,铂丝电极为对电极,Ag/Agcl电极为参比电极。分析实验在含有30 mL 0.1 M氢氧化钠溶液(电解质)的烧杯里进行,反应温度为室温。首先利用循环伏安法研究了CuO/Chitosan/GCE在碱性条件下对葡萄糖的电催化性能,和裸电极对比结果图3所示:
在裸电极上,在加入0.5 mM葡萄糖和未加葡萄糖时电流响应没有变化(曲线重合)只显示出较小的背景电流,都没有明显的氧化还原峰,表明在碱性条件下裸电极没有催化葡萄糖氧化的能力。在CuO/Chitosan/GCE电极上,加入0.5 mM葡萄糖后在+0.45 V左右出现了明显的氧化峰,并且随着葡萄糖浓度的升高氧化峰电流也随之升高,表明多孔CuO纳米片对葡萄糖的直接氧化反应具有非常高的电催化活性。碱性条件下葡萄糖在CuO纳米片上的氧化一般认为是Cu(II)/Cu(III)参与反应过程:

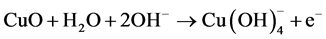

首先氧化铜在碱性条件下被电化学氧化成Cu(III)如CuOOH或Cu(OH)4,如循环伏安曲线所示,裸电极的背景电流明显小于CuO/Chitosan/GCE电极的背景电流,表明在氧化铜电极上发生了氧化反应。在加入葡萄糖后,葡萄糖分子被Cu(III)氧化成葡萄糖酸,Cu(III)变价为Cu(II),然而并产生明显的还原峰,表明葡萄糖的电化学氧化是不可逆的。随着葡萄糖分子的加入,葡萄糖分子不断氧化生成葡萄糖酸,更多的Cu(III)被消耗,CuO生成CuOOH或Cu(OH)4的反应被促进,导致反应向生成Cu(II)的反向进行,CuO被氧化成Cu(III)产生氧化电流,由循环伏安曲线宏观表现出随着葡萄糖浓度的增加,氧化峰电流不断增加。

Figure 3. CV curves obtained at bare GCE(a, b), CuO/Chitosan/GCE in NaOH containing 0 (c) and 0.5 mM glucose (d). Scan rate, 25 mV∙s−1
图3. 在0.1 M氢氧化钠溶液里裸电极(a, b)、多孔CuO纳米片修饰电极(c, d)的循环伏安曲线及对比图
3.3. 基于纳米片的电化学葡萄糖传感器
三维多孔CuO纳米片电极对葡萄糖的电流响应,是通过在电极上持续加入不同浓度的葡萄糖观测电流的变化来研究的。将30 mL反应体系放于磁力搅拌器上,使其快速稳定的搅拌。在+0.45 V处进行计时电流法测定,向上述反应体系里持续滴加葡萄糖,溶液体积表化对浓度的影响被考虑,保证其终浓度为0~4 mM。在加入10 uM葡萄糖后,电流显示出典型的安培响应如图4所示,并且响应电流在小于2 s的时间内就达到了稳态电流,表明三维多孔CuO纳米片电极对葡萄糖具有响应速度快催化活性高的特点。
此响应时间2 s明显低于其他已报道的材料,如M13-MnO2 (5 s),GOx/Pt NPs/介孔碳(15 s)及GOx/ MnO2/晶体管(140 s)。随着葡萄糖浓度的持续增加,氧化电流呈现出阶梯状增长,绘制响应电流与葡萄糖浓度之间的工作曲线,如图5所示。在0~1 mM浓度范围内,氧化电流与葡萄糖浓度有两段线性范围,在0~0.5 mM范围内氧化电流与葡萄糖浓度成线性关系,线性方程为y = 39.282x + 1.041 (R2 = 0.992),式中的y表示响应电流,x表示葡萄糖浓度。在S/N = 3计算得此电极的检测限LOD值为1.7 uM,明显低于其他已报道的材料。在0~1 mM浓度范围内,氧化电流与葡萄糖浓度有两段线性范围,在0.5~1 mM范围内氧化电流与葡萄糖浓度成线性关系,线性方程为y = 14.41x + 9.442 (R2 = 0.9923),式中的x、y表示意义同上。
除此之外从图中可以看出,在葡萄糖浓度 > 1 mM时随着葡萄糖浓度的增加氧化电流逐渐成饱和的趋势,直至达到平台电流不在增加,这种变化趋势符合酶催化机理动力学特征,这是由于电极材料上活性位点的不足或者电极的表面被反应产物所覆盖导致。三维多孔CuO纳米片所具有的检测限低,选择性高,响应快速的特点可能与其独特的纳米结构有关。在此结构中有无数的超薄纳米片互相交错,在其表面及边缘提供了很多的活性位点。另外,在纳米片上存在着的无数介孔和微孔可以为葡萄糖的扩散和运输提供通道,同时三维多孔CuO纳米片还可以促进电极与葡萄糖之间的电子转移。
3.4. 葡萄糖检测的抗干扰性研究
在进行葡萄糖检测时,多巴胺、抗坏血酸、尿酸等一些电活性物质通常会对葡萄糖检测产生干扰。因为在大多数固体电极上,这四种物质的氧化电位相近,在进行检测时会导致信号的叠加。因此,本实验对三维多孔CuO纳米片电极的抗干扰性进行了研究。在含有30 mL 0.1 M氢氧化钠溶液(电解质)的烧杯里加入转子,使其在磁力搅拌器上快速稳定的搅拌。在+0.45 V处进行计时电流法测定,向30 mL 0.1 M氢氧化钠溶液里依次加入0.5 mM的葡萄糖多巴胺抗坏血酸和尿酸(体积变化对浓度的影响被考虑)。实验结果如图6所示:
由时间-电流曲线可以看出,在加入相同浓度的葡萄糖、多巴胺、抗坏血酸和尿酸的条件下,葡萄糖的电流响应最高,多巴胺、抗坏血酸和尿酸基本没有电流响应,显示出三维多孔氧化铜纳米片电极良好的选择性,这种良好的抗干扰性可能是由于较低的工作电压+0.45 v。并且,此在三维多孔氧化铜纳米片电极的选择性明显高于其他已报道的CuO基的传感器,如花状的CuO薄膜,CuO纳米颗粒及三明治结构的CuO等。在实际检测中,葡萄糖浓度大约是多巴胺抗坏血酸尿酸浓度的30倍,因此在该电极上干扰物的电流响应会更小,表明此电极完全可以用于检测实际样本。三维多孔CuO纳米片基的无酶葡萄糖传感器与之前已报道的葡萄糖传感器性能比较表1所示。
4. 小结
本文通过温和的方法利用液固反应与高温退火相结合,在不使用有机试剂及其他稳定剂的前提下成功的制备了三维多孔氧化铜纳米片。制备的此材料是由无数错综交错的纳米片构成,并且纳米片上具有无数的介孔和微孔,这些独特的结构赋予了它优异的性能。以壳聚糖作为固定剂将此材料固定于玻碳电

Figure 4. Typical i-t curve obtained at CuO/Chitosan/GCE on the successive injection of glucose in 0.1 M NaOH solution, on which the concentration denoted the glucose concentration (final concentration). Inset shows the response time of the CuO electrode toward 10 uM glucose
图4. 多孔CuO纳米片修饰电极对葡萄糖检测的i-t曲线及电极对葡萄糖的响应时间
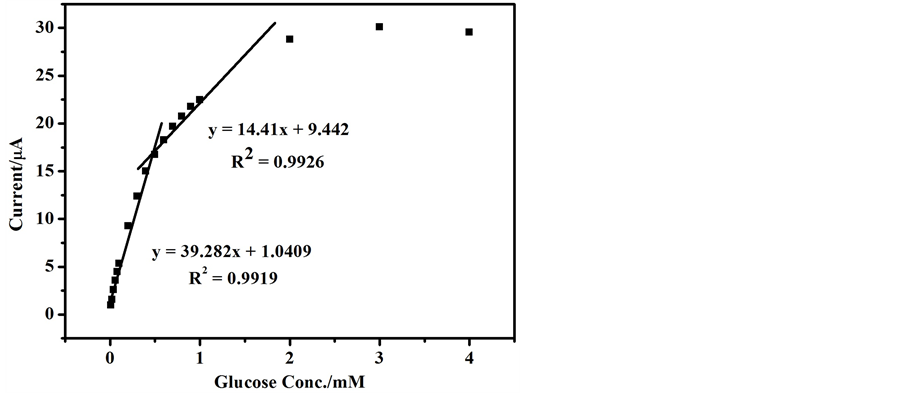
Figure 5. The typical calibration graph of the detection for glucose
图5. 多孔CuO纳米片修饰电极对葡萄糖检测的标准工作曲线
极表面,构建了无酶葡萄糖传感器。利用此传感器采用循环伏安法研究了其对葡萄糖的电催化活性,在0~1 mM范围内其响应电流与葡萄糖浓度有良好的线性关系,表明了对葡萄糖具有良好的电催化活性。利用其对葡萄糖高的电催化活性,通过计时电流法检测葡萄糖,此电极展现出响应速度快,检测限低的优点,LOD = 1.7 uM (S/N = 3)。除此之外,我们探索了该电极的抗干扰性能,在常见干扰物如多巴胺、抗坏血酸、尿酸存在条件下可有效的避免其干扰检测葡萄糖。这些优异的性能使三维多孔氧化铜纳米片在生物分析,医学诊断等领域具有良好的应用前景。

Figure 6. Effects of interferents on the amperometric response of the CuO electrode
图6. 多孔CuO纳米片修饰电极对葡萄糖及干扰物的i-t 响应曲线
Table 1. Three-dimensional porous CuO nanoflake-based enzyme-free glucose sensor and previously reported glucose sensor performance comparison
表1. 三维多孔CuO纳米片基的无酶葡萄糖传感器与之前已报道的葡萄糖传感器性能比较
致谢
本研究论文由中国海洋大学国家自然科学基金资助完成,特此感谢。
文章引用
邵长旭,陈守刚. 三维交错多孔氧化铜纳米片的制备及其对葡萄糖的无酶检测
Preparation of Three-Dimensional Porous Copper Oxide Nanoflakes and Its Non-Enzymatic Detection of Glucose[J]. 材料科学, 2017, 07(03): 309-317. http://dx.doi.org/10.12677/MS.2017.73042
参考文献 (References)
- 1. Wild, S., Roglic, G., Green, A., Sicree, R. and King, H. (2004) Global Prevalence of Diabetes: Estimates for the Year 2000 and Projections for 2030. Diabetes Care, 27, 1047-1053. https://doi.org/10.2337/diacare.27.5.1047
- 2. Kurniawan, F., Tsakova, V. and Mirsky, V.M. (2006) Gold Nano-particles in Nonenzymatic Electrochemical Detection of Sugars. Electroanalysis, 18, 1937-1942. https://doi.org/10.1002/elan.200603607
- 3. Wang, J. (2008) Electrochemical Glucose Biosensors. Chemistry Review, 108, 814.
- 4. Wang, Z., Liu, S., Wu, P. and Cai, C. (2009) Detection of Glucose Based on Direct Electron Transfer Reaction of Glucose Oxidase Immobilized on Highly Ordered Polyaniline Nanotubes. Analytical Chemistry, 81, 1638-1645. https://doi.org/10.1021/ac802421h
- 5. Wang, J. and Pamidi, P.V.A. (1997) Sol−Gel-Derived Gold Composite Electrodes. Analytical Chemistry, 69, 4490- 4494. https://doi.org/10.1021/ac970680x
- 6. Salimi, A. and Roushani, M. (2005) Non-Enzymatic Glucose Detection Free of Ascorbic Acid Interference Using Nickel Powder and Nafion Sol–Gel Dispersed Renewable Carbon Ceramic Electrode. Electrochemistry Communications, 7, 879-887. https://doi.org/10.1016/j.elecom.2005.05.009
- 7. Meng, L., Jin, J., Yang, G., Lu, T., Zhang, H. and Cai, C. (2009) Nonenzymatic Electrochemical Detection of Glucose Based on Palladium−Single-Walled Carbon Nanotube Hybrid Nanostructures. Analytical Chemistry, 81, 7271-7280. https://doi.org/10.1021/ac901005p
- 8. Song, Y.-Y., Zhang, D., Gao, W. and Xia, X.-H. (2005) Nonenzymatic Glucose Detection by Using a Three-Dimen- sionally Ordered, Macroporous Platinum Template. Chemistry—A Euro-pean Journal, 11, 2177-2182. https://doi.org/10.1002/chem.200400981
- 9. Zhang, X., Chan, K.-Y., You, J.-K., Lin, Z.-G. and Tseung, A.C.C. (1997) Partial Oxidation of Glucose by a Pt|WO3 Electrode. Journal of Electroanalytical Chemistry, 430, 147-153. https://doi.org/10.1016/S0022-0728(97)00138-1
- 10. Yuan, J.H., Wang, K. and Xia, X.H. (2005) Highly Ordered Platinum-Nanotubule Arrays for Amperometric Glucose Sensing. Advanced Functional Materials, 15, 803-809. https://doi.org/10.1002/adfm.200400321
- 11. Yu, X.-Y., Xu, R.-X., Gao, C., Luo, T., Jia, Y., Liu, J.-H., et al. (2012) Novel 3D Hierarchical Cotton-Candy-Like CuO: Surfactant-Free Solvothermal Synthesis and Application in As(III) Removal. ACS Applied Materials & Interfaces, 4, 1954-1962. https://doi.org/10.1021/am201663d
- 12. Huang, J., Zhu, Y., Yang, X., Chen, W., Zhou, Y. and Li, C. (2015) Flexible 3D Porous CuO Nanowire Arrays for Enzymeless Glucose Sensing: In Situ Engineered versus Ex Situ Piled. Nanoscale, 7, 559-569. https://doi.org/10.1039/C4NR05620E
- 13. Xiao, X., Wang, M., Li, H., Pan, Y. and Si, P. (2014) Non-Enzymatic Glucose Sensors Based on Controllable Nanoporous Gold/Copper Oxide Nanohybrids. Talanta, 125, 366-371. https://doi.org/10.1016/j.talanta.2014.03.030
- 14. Niu, X., Lan, M., Zhao, H. and Chen, C. (2013) Highly Sensitive and Selective Nonenzymatic Detection of Glucose Using Three-Dimensional Porous Nickel Nanostructures. Analytical Chemistry, 85, 3561-3569. https://doi.org/10.1021/ac3030976
- 15. Zhang, Y., Liu, Y., Su, L., Zhang, Z., Huo, D., Hou, C., et al. (2014) CuO Nanowires Based Sensitive and Selective Non-Enzymatic Glucose Detection. Sensors and Actuators B: Chemical, 191, 86-93. https://doi.org/10.1016/j.snb.2013.08.096
- 16. Sun, S., Zhang, X., Sun, Y., Yang, S., Song, X. and Yang, Z. (2013) Hierarchical CuO Nanoflowers: Water-Required Synthesis and Their Application in a Nonenzymatic Glucose Biosensor. Physical Chemistry Chemical Physics, 15, 10904-10913. https://doi.org/10.1039/c3cp50922b
