Hans Journal of Chemical Engineering and Technology
Vol.08 No.02(2018), Article ID:24225,14
pages
10.12677/HJCET.2018.82017
Study on SEI Reaction of Lithium-Ion Batteries Based on the Electrochemical Degradation Model
Xiang Wang1,2, Jianqiang Kang1,2, Zuxian Tan3
1Hubei Key Laboratory of Advanced Technology for Automotive Components, Wuhan University of Technology, Wuhan Hubei
2Hubei Collaborative Innovation Center for Automotive Components Technology, Wuhan University of Technology, Wuhan Hubei
3Shenzhen Pengcheng New Energy Technology Co., Ltd., Shenzhen Guangdong

Received: Mar. 11th, 2018; accepted: Mar. 21st, 2018; published: Mar. 28th, 2018

ABSTRACT
The SEI reaction in the lithium-ion battery is the crucial factor that makes the battery degradation. It is hard to study the influence of environmental factors on the characteristic of SEI reaction with the conventional electrochemical experiment since the SEI reaction occurs simultaneously with the battery reactions. In this study, the electrochemical degradation model of Li-ion battery was established based on the SEI reaction. The influence of ambient temperature on the growth of SEI film was studied. It was found that the thickness of SEI membrane increased with the elevated temperature. The high temperature (338.15 K < T > 378.15 K) causes, to some extent the increase of the rate of SEI reaction, but its effect on the speed of the increase of SEI film thickness is limited. The growth rate of SEI film increases with the increase of charging rate. In the case of high rates discharge, the rate has little effect on the growth of SEI film. In the case of low rates discharge, the lower the discharge rate is, the thicker the SEI film thickness is. In addition, the effects of different electrode thicknesses on the growth of SEI films were analyzed. The thicker the negative electrode thickness is, the smaller the SEI film thickness is, while the positive electrode thickness had no direct effect on the SEI film growth.
Keywords:Lithium-Ion Battery, SEI Film, Electrochemical Degradation Model, Charge-Discharge Rate, Electrode Thickness
基于电化学衰退模型研究锂离子电池SEI反应
王 祥1,2,康健强1,2,谭祖宪3
1武汉理工大学现代汽车零部件技术湖北省重点实验室,湖北 武汉
2武汉理工大学 汽车零部件技术湖北省协同创新中心,湖北 武汉
3深圳市鹏诚新能源科技有限公司,广东 深圳

收稿日期:2018年3月11日;录用日期:2018年3月21日;发布日期:2018年3月28日

摘 要
锂离子电池内部的SEI反应是导致电池衰退的重要因素,而SEI反应与电池反应是同时进行的,因此很难用常规的电化学实验方法研究环境因素对其反应的影响。本文基于SEI副反应建立了锂离子电池电化学衰退模型,研究了环境温度对SEI膜生长的影响,得出了SEI膜厚度增长会随着温度升高而增加,高温在一定程度上增加了SEI反应的速率,但温度的提高对SEI膜厚度增长率的影响是有限的。通过分析不同充电、放电倍率所获得的SEI膜厚度增长曲线,得出了SEI膜生长速度随充电倍率增加而加快的结论,但在高倍率放电情况下倍率大小对SEI膜生长影响不大,在低倍率放电情况下,放电倍率越低,SEI膜厚度越厚。另外,分析了不同电极厚度对SEI膜生长的影响,得出了负极厚度越厚SEI膜厚度增加越小,正极对SEI膜生长无直接影响的结论。
关键词 :锂离子电池,SEI膜,电化学衰退模型,充放电倍率,电极厚度

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
锂离子电池是新能源汽车的主要动力来源,它的技术突破对新能源汽车的发展起关键性作用。作为圆柱形电池的代表,18650型锂离子电池尽管具有比能量高、一致性好、生产成本低等突出的优势,但它也存在散热能力差等劣势,不仅导致电池在工作中温度过高,也使电池在循环过程中的容量损失加快。
国内外学者大量研究表明,锂离子电池容量衰减的主要机制包括 [1] :金属锂的沉积,电解液的阳极氧化及阴极还原,正负极表面钝化膜的形成,电极活性材料的溶解、相变化以及结构变化,集流体的腐蚀等。尽管导致电池衰退的因素繁多,但通常认为在负极表面形成的SEI膜是电池衰退的主要原因 [2] 。在充放电过程中石墨负极表面会生成SEI膜并在长期的循环过程中继续生长,而SEI膜的形成和生长是由于电解液在负极表面分解产生的,这一过程会使电解液与活性锂的减少和锂离子电池内阻增加,进而造成锂离子电池容量衰减。
尽管众所周知SEI膜的形成会使电池容量减少,但SEI反应特性缺乏研究,主要因为SEI反应与锂离子的嵌入/脱出反应同时发生,常规的电化学实验方法不能将二者区分或剥离。为了研究影响SEI膜的形成和生长的内外部因素,本文基于SEI膜副反应建立了电化学衰退模型,分析了环境温度、充放电倍率和内部电极参数对SEI反应特性的影响。
2. 锂离子电池电化学衰退模型
2.1. 电化学模型
本文建立了三元型动力18650锂离子电池的一维电化学模型。该模型的电池结构简化为三个部分:正极为三元型Li[Ni1/3Co1/3Mn1/3]O2 (NCM)、负极为石墨LixC6和隔膜(PP/PE/PP),电解液的溶质为1.1 mol∙L−1的LiPF6,溶剂为EC:EMC:DEC (1:1:1)。如图1所示,该模型认为锂离子电池的充放过程包含主反应和发生在石墨负极的副反应。锂离子的嵌入和脱出主要如下几个过程:负极脱锂时,负极固相活性材料粒子LixC6内部的锂离子迁移至表面并在固-液接触相界面发生电荷转移过程完成锂离子的脱出,并通过SEI膜进入液相活性固体颗粒间隙的电解液中,通过扩散和迁移穿过隔膜并再次穿过SEI膜到正极颗粒表面,在活性物质颗粒颗粒表面的固-液接触界面完成电荷转移过程嵌入到正极颗粒内;锂离子的迁移从而导致电子在电极在固相活性材料粒子中反向迁移并通过外电路运输到正极。充电时,正极固相活性材料NCM粒子内部的锂离子迁移至表面并在固-液两相界面发生电荷转移过程锂离子的脱出,并穿过SEI膜进入多孔电极间隙电解液中,经扩散和迁移递通过隔膜到负极,并再次穿过SEI膜在负极活性材料LixC6粒子的两相界面发生电荷转移完成锂离子的嵌入到负极颗粒LixC6内,锂离子的迁移同样会引起电子在固相中反向迁移,电子同样经过外电路进行反向的迁移。
锂离子电池电化学模型Newman及他的同事在上世纪90年代建立的多孔电极理论的锂离子电池数学模型,该模型对锂离子电池实际工作过程作了一些假设,忽略了锂离子电池内部的副反应,将活性物质粒子假设为大小单一球形颗粒,锂离子的嵌入和脱出发生在活性材料粒子表面 [3] [4] [5] 。本文中所建立的模型在此基础上添加了锂离子电池内部副反应过程,以获得锂离子的容量衰退情况。
用Fick第二定律描述锂离子在正负电极固相活性材料粒子内的扩散和迁移,表示为公式2-1。
(1)
 为锂离子在球形活性材料粒子内的扩散系数,
为固相锂离子浓度,r为球形活性材料粒子的半径,t为锂离子嵌入或脱出反应时间。
为锂离子在球形活性材料粒子内的扩散系数,
为固相锂离子浓度,r为球形活性材料粒子的半径,t为锂离子嵌入或脱出反应时间。
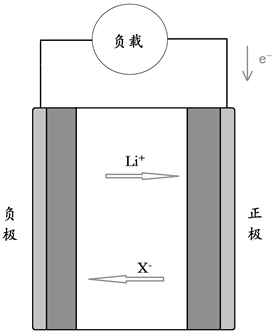
Figure 1. Lithium-ion battery discharge reaction process
图1. 锂离子电池放电反应过程
其球形活性材料粒子内部中心浓度变化梯度的为零,表示为公式2-2。
(2)
正负电极活性材料粒子内的锂离子扩散系数和活性材料粒子与电解质的接触表面处的锂离子浓度差异决定反应离子电流,表示为公式2-3。
(3)
其中As为电极单位体积有效反应面积即活性物质颗粒表面面积,其中r表示正负极活性物质颗粒子半径大小,j为嵌入和脱嵌反应电流,F为法拉第常数。
固相电势分布变化依照欧姆定律,
(4)
(5)
(6)
(7)
方程4阐述锂离子电池正负电极层法向上的电势分布情况。其中固相电子电流is为在电极与集流体界面与外部应用电流I相等,而在电极与隔膜的边界由于隔膜阻止电子自由通过,因此电极和隔膜界面电子电流为零, 和 为正负极有效电导率,多孔电 极中的导电率,服从Bruggeman修正, 和 为正负极材料固相活性物质颗粒的电导率, 为活性物质体质体积分数, 为负极厚度, 为隔膜厚度。
活性材料粒子与电解液接触的表面发生电荷转移,该过程采用Bulter-Volmer方程描述:
(8)
其中 电极反应交换电流密度。
(9)
(10)
其中为 电极动力学过电势, 为固相活性物质电势, 为电解液液相电势,U开路电势, 为SEI膜电势, 和 为正负极反应常数, 为表示正负极活性物质最大嵌入锂离子浓度, 为活性材料粒子表面浓度, 电解液锂离子参考浓度, 电解液锂离子浓度。
由于锂离子从活性材料粒子表面嵌入或脱出,从而造成活性材料粒子粒表面接触的电解液中锂离子浓度发生变化并形成浓度梯度,并导致锂离子在电解液中扩散和迁移,电解液中锂离子的质量守恒控制方程:
(11)
(12)
(13)
由于锂离子在多孔电极电解液内曲折迁移,因此采用Bruggman理论对液相动力学传输性能参数离子电导率和电解液扩散系数进行修正,其中 为锂离子迁移数, 为电解液体积分数, 为电解液导电率, 为电解液有效电导率。
正负电极内电解液与集流体接触界面的浓度梯度为零,因此边界条件为:
(14)
电解液电势变化一部是由于电解液的离子电阻导致的电解液相欧姆电压降,另一部分是由于由锂离子在电解液中的浓度分布不均匀而引起的浓差极化过电势。
(15)
(16)
以及由于锂离子只能在电极和隔膜中迁移,因此集流体与电极的界面电解液中离子电流下降至零。其中 为液相电流,由于锂离子电池内部服从电荷守恒,因此液相离子电流与固相相电流的和应等于外部负载电流。
2.2. 电化学衰退模型
上述锂离子电池电化学模型仅仅考虑了电池充放电过程中电池内部的主反应,也就是锂离子嵌入和脱嵌反应,而忽略了电池内部的副反应情况,在考虑电池副反应的情况下,则需要对相应的方程进行修正。由于本文所关注的副反应为SEI 膜增厚副反应,因此这里主要列出负极区域的相关方程。
寄生锂、溶剂还原反应:
其中,S是溶剂(碳酸亚乙酯,EC),PSEI是反应中形成的产物。PSEI的产生导致电池中可循环锂的损耗,还引起SEI层的电阻增加 [6] [7] ,以及负极中电解质体积分数的降低。
SEI膜形成反应的动力学表达式基于Ekström和Lindbergh发表的论文 [8] 。在该论文中,假设SEI形成受限于通过所形成的SEI膜的扩散过程,结果随着膜的厚度增加,老化减缓。此外,如果石墨电极粒子在插入负极期间发生膨胀,由于SEI膜的“破裂”,还将加速老化。石墨膨胀率取决于荷电状态和插层电流。寄生反应的动力学通过石墨负极上粒子表面局部电流密度iloc,SEI (单位:A/m2)的以下动力学表达式来描述:
(17)
iloc,1C,ref是对应于1C放电速率的局部电流密度,单位为A/m2;HK是无量纲石墨膨胀因子函数(取决于石墨荷电状态)。HK在脱嵌过程中为零;J是寄生反应的无量纲交换电流密度;a是电化学还原反应的传递系数;ηSEI是过电位,单位为V,假定与锂相比的平衡电位为0 V;qSEI是形成SEI引起的局部累积电荷,单位为C/m2;f是基于SEI膜属性的集总无量纲参数。
多孔电极中形成的SEI浓度 ,单位为mol/m3,根据以下公式:
(18)
其中, 是反应中SEI物质的化学当量系数。
根据以下方程,上面的 与 成正比:
(19)
其中,Av是电极表面积。
根据SEI浓度将SEI层的厚度 计算为:
(20)
其中,Mp (0.1 kg/mol)是摩尔质量, (2100 kg/m3)是副反应形成的产物密度。假设t = 0时初始膜厚 为1 nm。
则可以根据以下表达式计算负极使用的SEI层的电阻Rfilm:
(21)
2.3. 模型建立
锂离子电池内部的电化学反应过程包含了多种相态间、多个反应间且连续的化学反应行为,在长期的循环试验过程中,难以对封闭的电池内部各科组分的状态进行即时的监测,其内部的实时参数难以获取。因此,本文借助软件COMSOL Multiphysics 5.3针对锂离子电池进行建模仿真分析。本文所建立的锂离子电池容量衰减模型是以Ramadass等 [9] 考虑了充电阶段电解液发生还原反应,溶剂在石墨负极表面分解并形成SEI膜,发展了以第一性原理为基础的容量衰减模型,基本假设为 [10] :1) 电池副反应在循环过程不断发生,表面电阻随循环次数的增加而增大;2) 电解液在充电阶段发生还原反应;3) 副反应的产物为无机锂盐和有机锂盐的混合物;4) 副反应为不可逆反应;5) SEI层的起始电阻为100 Ω∙cm2。本模型增加了SEI副反应的动力学方程,考虑负极表面溶解–沉积物质的电阻,并假定电解液电导率和扩散系数与电解液浓度有关,相关建模参数如表1。
3. 结果与讨论
3.1. 锂离子电池电化学模型的验证
为了验证模型的有效性,针对锂离子电池所建立电化学仿真模型进行循环测试并每隔50次循环进行一次以1C倍率的放电性能测试,并与相同条件下的Li[Ni1/3Co1/3Mn1/3]O2/石墨(NCM/石墨)电池试验所得结果作比较。图2是在1C条件下模拟得到的电压-容量曲线和试验所得曲线。对于每次充放电循环,整个放电过程中大致可分为三个阶段,在第一个阶段中,电池从满电状态开始放电时会有一个短暂的电压降;第二个阶段中,电池的端电压随放出电量增加而缓慢下降,这个阶段放电较稳定;第三个阶段中,当电池电量在低于600 mA时,端电压下降速度开始增加,且很快达到放电截止电压。另外,随着循环次数的增加,电压–容量曲线整体呈下降趋势。结合试验所获得的电压–容量曲线进行对比,在第一个循环内,仿真结果和实验结果误差低于0.3%;在50个循环内,仿真结果和试验结果误差低于2.7%;在100
Table 1. Ternary material 18650 lithium-ion battery electrochemical model parameters
表1. 三元材料18650锂离子电池电化学模型参数
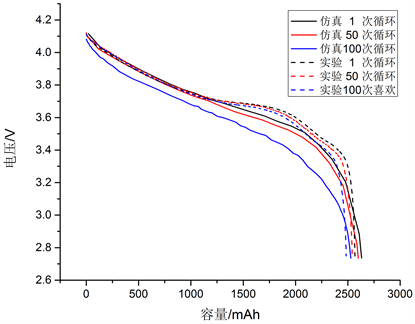
Figure 2. Comparison of simulation results and experimental results under constant current 1C discharge conditions
图2. 循环测试中恒流1C放电工况下仿真结果与试验结果对比
个循环内误差低于5%。因此,可以认为该电化学模型能获得与试验结果吻合度较高的仿真数据,表明该模型可以有效地仿真NCM/石墨电池循环测试过程。
本文所建立的一维电化学衰退模型结合了锂离子电池的主反应过程和SEI膜副反应过程,其优点在于能较准确地仿真电池的工作过程而且能较好地反映电池内部的实际情况。根据模型仿真所获得的数据,可以对锂离子电池内部各项参数以及不同工况条件进行分析,进而确定不同因素对电池容量衰退的影响。从试验数据分析可以看出,在锂离子电池的工作过程中,锂离子电池循环工况下的容量损失与SEI膜的形成和发展有着密切的关系。因此,探究NCM/石墨锂离子电池内外部因素对于SEI膜增长的关系可以作为研究锂离子电池容量衰退的关键因素。
本文所研究的锂离子电池影响因素包括不同环境温度、不同充、放电倍率和电极厚度三种。
3.2. 温度的影响
图3所示曲线为常温298.15 K下、高温338.15 K、358.15 K和378.15 K下SEI膜随循环次数增长曲线。SEI膜在循环前期急剧增长,随后增长放缓。常温298.15 K下SEI膜厚度500次循环后为190.33 nm,在高温338.15 K、358.15 K和378.15 K温度条件下,SEI膜在500次循环后厚度在常温298.15 K的基础上增长了9.57 nm、14.37 nm、17.64 nm和19.07 nm,增长率分别为5.02%、7.55%、9.27%和10.02%。由此可见,SEI膜厚度增长会随着温度升高而增加,高温在一定程度上增加了SEI反应的速率,但温度的提高对SEI膜厚度的增长率的影响是有限的。
为了进一步研究温度对于SEI膜厚度增长的影响,取温度作为变量,298.15 K至378.15 K (10 K为一个间隔)温度区间,前10个循环的平均SEI膜厚度增长为自变量作曲线,可见图4。
利用阿累尼乌斯公式的指数形式进行拟合,9个温度点均匀地分布在所获得的拟合曲线上,仿真结果与拟合结果相吻合。SEI膜厚度的增长是SEI反应的表象,SEI膜厚度增长代表着SEI反应过程,而温度影响化学反应速率,故SEI膜厚度增长曲线符合阿累尼乌斯经验公式。阿累尼乌斯公式是由瑞典的阿累尼乌斯所创立的化学反应速率常数随温度变化关系的经验公式。该公式形式为:

Figure 3. SEI film growth curve at 25˚C, 65˚C, 85˚C and 105˚C
图3. 298.15 K、338.15 K、358.15 K和378.15 K温度下SEI膜增长曲线

Figure 4. Within a single cycle, SEI film thickness growth curve at different temperatures
图4. 单个循环内不同温度下SEI膜厚度增长曲线
式中k为温度T时的反应速度常数;A为指前因子,也称为阿伦尼乌斯常数,与化学反应速率具有相同的量纲;Ea为活化能,一般可视为与温度无关的常数;T为绝对温度,量纲为K;R为摩尔气体常数,一般取为8.31441 J/(mol∙K);e为自然对数的底。经拟合,阿累尼乌斯常数A = A,取4.02689 m/s,拟合误差为0.08815 m/s;活化能与摩尔气体常数之比E = Ea/R取值117.5222 K,拟合误差为2.53235 K;k1为273.15 K时化学反应速率,取值为2.1366 m/s,拟合误差为0.01013 m/s。
3.3. 充、放电倍率的影响
为了探究充电倍率对SEI膜生长的影响,以仿真模型计算结果绘制如图5所示曲线。在循环测试中,分别取0.1C、0.3C、0.5C、1C、1.5C和2C充电倍率下前10次循环的平均SEI膜厚度,其在单个充电-放电过程中的变化曲线。
以图5中1C充电、1C放电曲线为例,可以看出,在整个充电-放电过程中,SEI膜在充电阶段前期急剧生长了0.54 nm,在经历一个阶段放缓后,这期间SEI膜厚度仅增长了0.18 nm,随后SEI膜厚度又急剧上升至2.09 nm,直到充电阶段完成。因为在充电阶段,嵌在正极上的锂在正极接收外电路的电子后脱出进入液相,以锂离子的形式经过隔膜向负极移动,在外部充电电流的驱动下,负极锂离子浓度逐渐增加,同时一部分电解液在负极表面发生还原反应分解后在石墨表面形成SEI膜。尤其在循环前期,在充电阶段发生电解液所发生的还原反应消耗了大量的锂离子并在石墨表面上形成了初始的SEI膜,这个阶段是SEI膜形成和生长最为迅速的时期。但在整个放电阶段,SEI膜厚度增加不明显,仅增长了0.01 nm,可以认为在放电阶段SEI膜副反应基本不发生,膜厚度随着充电倍率增加而增加。因为在更高倍率充电条件下,锂离子在负极附近聚集,在负极厚度方向上形成了更高的浓度梯度导致极化效应增大,电解液传质阻力随之增大,但锂离子进入电极的多孔结构的速度是有限的,因此负极活性粒子表面更高的锂离子浓度加快了SEI副反应速率,SEI膜随倍率增加生长速度加快。SEI膜厚度见表2。
在放电阶段,锂离子从负极材料中脱出并向正极移动,正极附近锂离子浓度逐渐增加,并形成一定的浓度梯度,而负极处的锂离子浓度极低,SEI反应较少,故SEI膜在放电阶段增长较少。为了更准确地确定放电倍率对于SEI膜生长的影响,在1C充电条件下对电化学模型进行以不同高倍率和不同低倍率放电工况进行循环测试。图6为1C、1.5C和2C放电倍率下,前10次循环平均SEI膜厚度生长曲线。其中,1C、1.5C和2C倍率放电前10次循环SEI膜平均厚度分别增长了2.16 nm、2.12 nm和2.10 nm,放电倍率确实未对SEI膜的生长产生显著的影响。
缩小放电倍率至0.1C、0.15C、0.2C、0.3C和0.5C,从图7可以看出SEI膜随放电倍率增加也有较大的变化,且呈现出放电倍率越小,SEI膜厚度生长越厚的特点。康健强 [19] 等人的研究对于锂离子负极是否发生SEI膜反应的有了定量的分析。SEI膜反应发生在其膜附近过电位大于或等于0.1 V区域;当SEI膜附近过电位低于0.1 V,一般认为SEI反应没有发生。基于以上研究结果,对不同放电倍率下过电位进行对比分析如图8。当高倍率(1C、1.5C和2C)放电时,放电阶段负极附近过电位整体处于0.1 V以上,且随着放电深度的增加,过电位上升明显。但横向比较三种倍率过电位曲线,变化较小,这一特点验证了高倍率放电时,放电倍率对SEI膜反应无较大影响的结论;当低倍率(0.1C、0.2C、0.3C和0.5C)放电时,放电阶段负极附近过电位分布在0.1 V两侧,随着放电倍率的降低,处于0.1 V以上的时间越长。由于更长的副反应时间和变化相对不大的过电位曲线,造成了在低倍率时呈现出放电倍率越低,SEI膜厚度增长越多的情况。
以上述结果作为依据,本文认为SEI膜作为锂离子和石墨化学反应后的产物,其反应受锂离子浓度和石墨负极状态的影响。锂离子电池放电倍率逐渐降低时,沿正极至负极的电解液锂离子浓度梯度也随之降低,导致正极附近锂离子浓度与负极附近锂离子浓度差距缩小,即负极附近能保持一定的锂离子浓度。因此,在低倍率放电条件下,SEI反应虽有所减缓,但由于持续时间更长,SEI膜厚度增加更多。
3.4. 电极厚度的影响
电极厚度的增加会增加电极阻抗和降低锂离子在电解液中的传导速率 [20] 。电极阻抗的增加会导致电子传导阻力增大,影响电极中固相锂的脱出,而锂离子在电解液中的传到速率降低会增加电解液阻抗,
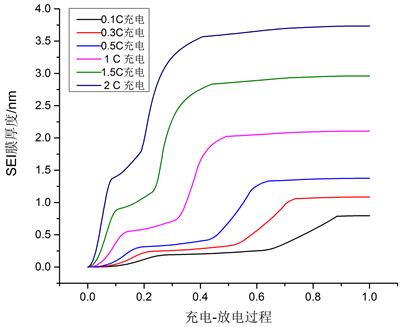
Figure 5. Charge rates at 0.1C, 0.3C, 0.5C, 1C, 1.5C, and 2C SEI membrane growth curve
图5. 0.1C、0.3C、0.5C、1C、1.5C和2C充电倍率下SEI膜增长曲线
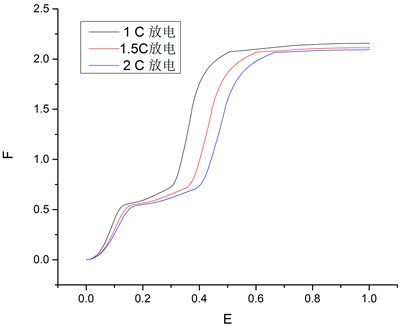
Figure 6. Growth curve of SEI film under 1 C, 1.5C and 2C discharge rate
图6. 1C、1.5C和2C放电倍率下SEI膜增长曲线
Table 2. SEI film thickness within a single cycle growth table
表2. 单个循环内SEI膜厚度增长表

Figure 7. SEI film thickness growth curve at 0.1C, 0.15C, 0.2C, 0.3C, and 0.5C discharge rate
图7. 0.1C、0.15C、0.2C、0.3C和0.5C放电倍率下SEI膜厚度增长曲线
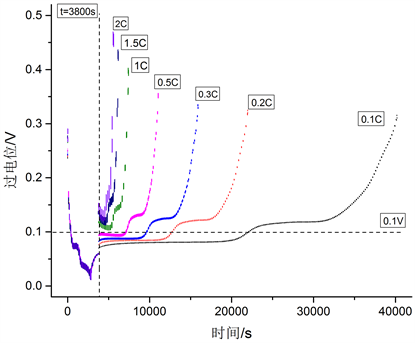
Figure 8. Negative over potential curve under various discharge rates
图8. 各放电倍率下负极过电位曲线
降低电极处锂离子浓度梯度和固液相界面间的化学反应速率。因此研究电极厚度对于SEI副反应的影响有重要作用。
1) 负极厚度的影响
从图9可以看出SEI膜厚度随负极厚度增加而减少,因为随着负极厚度的增加,电极阻抗增加和锂离子在电解液中的传导速率降低,导致负极附近锂离子浓度下降,同时又降低了SEI反应速率,由此可见,SEI膜厚度随负极厚度增大而减小。
2) 正极厚度的影响
为了研究正极厚度对于SEI膜生长的影响,选择厚度为40 um、65 um和90 um的正极模型作为仿真对象。图10所示正极厚度40 um、65 um和90 um条件下,SEI膜厚度分别为190.33 nm、192.45 nm和195.38 nm,可以看出正极厚度对于SEI膜厚度的增长无明显影响。因为SEI反应大部分发生于负极,因此正极对于SEI膜的影响并无直接关系。
4. 结论
本文建立了基于SEI膜副反应的锂离子电池电化学衰退模型,进行循环工况仿真,证明基于SEI膜副反应的锂离子电池电化学模型可以有效地仿真NCM/石墨电池循环测试过程,并得出了如下结论:
1) SEI膜厚度增长会随着温度升高而增加,高温(338.15 K < T > 378.15 K)在一定程度上增加了SEI反应的速率,但温度的提高对SEI膜厚度的增长率的影响是有限。
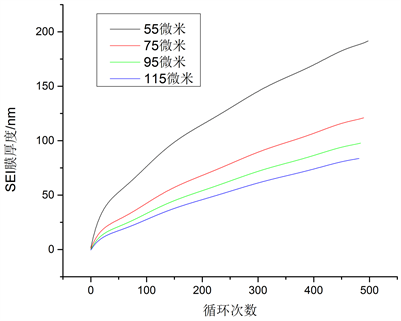
Figure 9. SEI film thickness growth curve at 55 um, 75 um, 95 um and 115 um cathode
图9. 55 um、75 um、95 um和115 um负极下SEI膜厚度增长曲线

Figure 10. SEI film thickness growth curve at 40 um, 65 um and 90 um anode
图10. 40 um、65 um和90 um正极下SEI膜厚度增长曲线
2) 通过分析不同充电、放电倍率所获得的SEI膜厚度增长曲线,得出了SEI膜生长速度随充电倍率增加而加快,但在高倍率情况下放电倍率对与SEI膜生长影响不大,在低倍率放电情况下,放电倍率越低,SEI膜厚度越厚。
3) 分析了不同电极厚度对SEI膜生长的影响,得出了负极厚度越厚SEI膜厚度越小,正极对SEI膜生长无直接影响的结论。
文章引用
王 祥,康健强,谭祖宪. 基于电化学衰退模型研究锂离子电池SEI反应
Study on SEI Reaction of Lithium-Ion Batteries Based on the Electrochemical Degradation Model[J]. 化学工程与技术, 2018, 08(02): 137-150. https://doi.org/10.12677/HJCET.2018.82017
参考文献
- 1. 刘文刚, 高俊奎, 刘兴江, 等. 18650型锂离子电池的循环容量衰减研究[J]. 电源技术, 2012, 36(3): 306-309.
- 2. Prasadgk, R. (2013) Model Based Identification of Aging Parameters in Lithium Ion Batteries. Journal of Power Sources, 232, 79-85. https://doi.org/10.1016/j.jpowsour.2013.01.041
- 3. Doyle, M., Fuller, T.F. and Newman, J. (1993) Modeling of Galvanostatic Charge and Discharge of the Lithium/Polymer/Insertion Cell. Journal of the Electrochemical Society, 140, 1526-1533. https://doi.org/10.1149/1.2221597
- 4. Fuller, T.F., Doyle, M. and Newman, J. (1994) Simulation and Optimization of the Dual Lithium Ion Insertion Cell. Journal of the Electrochemical Society, 141, A1-A10. https://doi.org/10.1149/1.2054684
- 5. Doyle, M., Newman, J., Gozdz, A.S., Schmutz, C.N. and Tarascon, J.M. (1996) Comparison of Modeling Predictions with Experimental Data from Plastic Lithium Ion Cells. Journal of the Electrochemical Society, 143, A1890-A1903. https://doi.org/10.1149/1.1836921
- 6. Ramadass, P., Haran, B., Gomadam, P., White, R. and Popov, B. (2004) Development of First Principles Capacity Fade Model for Li-Ion Cells. Electrochemical Society, 151, A196-A203. https://doi.org/10.1149/1.1634273
- 7. Ning, G., White, R. and Popov, B. (2006) A Generalized Cycle Life Model of Rechargeable Li-Ion Batteries. Electrochimica Acta, 51, 2012-2022. https://doi.org/10.1016/j.electacta.2005.06.033
- 8. Ekströmand, H. and Lindbergh, G. (2015) A Model for Predicting Capacity Fade Due to SEI Formation in a Commercial Graphite/LiFePO4 Cell. Electrochemical Society, 162, A1003-A1007. https://doi.org/10.1149/2.0641506jes
- 9. Ramadass, P., Haran, B., Gomadam, P.M., et al. (2004) Development of First Principles Capacity Fade Model for Li-Ion Cells. Journal of the Electrochemical Society, 151, A196-A203. https://doi.org/10.1149/1.1634273
- 10. 王大为, 李东江, 李军, 杨勇. 锂离子电池电化学反应模型研究进展浅析[J]. 电化学, 2011, 17(4): 1006-3471.
- 11. Tanim, T.R., Rahn, C.D. and Wang, C.Y. (2015) State of Charge Estimation of a Lithium Ion Cell Based on a Temperature Dependent and Electrolyte Enhanced Single Particle Model. Energy, 80, 731-739. https://doi.org/10.1016/j.energy.2014.12.031
- 12. Fang, W., Kwon, O.J. and Wang, C.Y. (2010) Electrochemical Thermal Modeling of Automotive Li-Ion Batteries and Experimental Validation using a Three-Electrode Cell. International Journal of Energy Research, 34, 107-115. https://doi.org/10.1002/er.1652
- 13. Kindermann Frank, M., Andreas, N., Erhard, S.V., et al. (2015) Long-Term Equalization Effects in Li-Ion Batteries Due to Local State of Charge in Homogeneities and Their Impact on Impedance Measurements. Electrochimica Acta, 185, 107-116. https://doi.org/10.1016/j.electacta.2015.10.108
- 14. Valfen, L.O. and Reimers, J.N. (2005) Transport Properties of LiPF6-Based Li-Ion Battery Electrolytes. Journal of the Electrochemical Society, 152, 882-891. https://doi.org/10.1149/1.1872737
- 15. Tippmann, S., Walper, D., Balboa, L., et al. (2014) Low-Temperature Charging of Lithium-Ion Cells Part I: Electrochemical Modeling and Experimental Investigation of Degradation Behavior. Journal of Power Sources, 252, 305-316. https://doi.org/10.1016/j.jpowsour.2013.12.022
- 16. Verbrugge, M.W. and Koch, B.J. (2003) Electrochemical Analysis of Lithiated Graphite Anodes. Journal of the Electrochemical Society, 150, A374-A384. https://doi.org/10.1149/1.1553788
- 17. Yabuuchi, N., Makimura, Y. and Ohzuku, T. (2007) Solid-State Chemistry and Electrochemistry of LiCo1∕3Ni1∕3Mn1∕3O2 for Advanced Lithium-Ion Batteries III Rechargeable Capacity and Cycleability. Journal of The Electrochemical Society, 154, A314-A321. https://doi.org/10.1149/1.2455585
- 18. Viswanathan, V.V., Choi, D., Wang, D., et al. (2010) Effect of Entropy Changes of Lithium Intercalation in Cathodes and Anodes on Li-Ion Battery Thermal Management. Journal of Power Sources, 195, 3720-3729. https://doi.org/10.1016/j.jpowsour.2009.11.103
- 19. Kang, J., Conlisk, A.T. and Rizzo, G. (2014) Integration of Capacity Fading in an Electrochemical Model of Li-Ion Batteries. Solid State Electrochem, 18, 2425-2434. https://doi.org/10.1007/s10008-014-2479-y
- 20. 虢放, 薛明喆, 张存满. 电极厚度对锂离子电池电化学性能的影响[J]. 电源技术, 2017, 41(8): 1002-1087.
