Hans Journal of Chemical Engineering and Technology
Vol.
10
No.
03
(
2020
), Article ID:
35567
,
7
pages
10.12677/HJCET.2020.103026
Effect of Supports on CO2 Adsorption Behavior of Potassium-Based Adsorbents
Jiahao Zhang, Hua Pan*, Yu Mei
College of Biology and Environmental Engineering, Zhejiang Shuren University, Hangzhou Zhejiang

Received: Apr. 22nd, 2020; accepted: May 7th, 2020; published: May 14th, 2020

ABSTRACT
Effect of the supports on CO2 adsorption by potassium-based adsorbents was investigated. Both K2CO3/Attapulgite and K2CO3/TiO2 adsorbents were prepared by impregnation method. The results indicated that the capacity for CO2 adsorption of K2CO3/Attapulgite adsorbents is higher than that of K2CO3/TiO2. CO2 adsorption capacity of K2CO3/Attapulgite and K2CO3/TiO2 was 74.4 mg/g and 51.2 mg/g at 333 K, respectively. No direct correlation between the surface area, pore volume and capture capacity was observed on potassium-based adsorbents. The nature of support plays an important role for CO2 adsorption on potassium-based adsorbents. CO2 adsorption capacity of Attapulgite supports was 21 mg/g. However, CO2 adsorption capacity of TiO2 supports was only 12.8 mg/g. The formation of potassium phase is an important factor for CO2 adsorption on potassium-based adsorbents. Not only K2CO3 but also K2Ca(CO3)2 was detect on K2CO3/Attapulgite. Both K2CO3 and K1.6Ti1.6O3 were detected on K2CO3/TiO2. During the CO2 adsorption process on K2CO3/Attapulgite, K2CO3 and part of K2Ca(CO3)2 transformed into KHCO3. In the case of CO2 adsorption process on K2CO3/TiO2, only K2CO3 could be transformed into KHCO3. CO2 could not adsorbed by K1.6Ti1.6O3.
Keywords:K2CO3, Support, CO2, Adsorbents

载体对钾基吸附剂脱除CO2的影响
张嘉豪,潘华*,梅瑜
浙江树人大学,生物与环境工程学院,浙江 杭州

收稿日期:2020年4月22日;录用日期:2020年5月7日;发布日期:2020年5月14日

摘 要
采用浸渍法制备了K2CO3/凹凸棒石和K2CO3/TiO2吸附剂,研究了载体对钾基吸附剂脱除CO2的影响。研究表明:K2CO3/凹凸棒石的CO2吸附容量大于K2CO3/TiO2的CO2吸附容量,在333 K时,K2CO3/凹凸棒石和K2CO3/TiO2的吸附容量分别为74.4 mg/g和51.2 mg/g。钾基吸附剂的比表面积和比孔容对CO2吸附性能无明显的正相关性。载体是钾基吸附剂吸附CO2性能差异的一方面原因,凹凸棒石载体的CO2吸附容量为21 mg/g,TiO2载体的CO2吸附容量为12.8 mg/g。碱金属钾在不同载体中的物相差异是造成CO2吸附性能差别的另一原因,在K2CO3/凹凸棒石中,不仅有K2CO3物相,还检测出K2Ca(CO3)2,而在K2CO3/TiO2中,则有K2CO3和K1.6Ti1.6O3物相。在K2CO3/凹凸棒石吸附CO2过程中,K2CO3和部分K2Ca(CO3)2转化成KHCO3。在K2CO3/TiO2吸附CO2过程中,K2CO3转化成KHCO3,而K1.6Ti1.6O3未参与CO2的吸附。
关键词 :碳酸钾,载体,二氧化碳,吸附剂

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
化石燃料燃烧排放的大量CO2是造成温室效应的主要原因,经济高效的捕集和分离CO2是目前研究的热点。液态胺溶液吸附CO2是工业生产中脱除CO2的常见方法 [1] [2] [3],该技术比较成熟,吸附效果好,但是却存在设备容易腐蚀、吸附剂再生能耗大和容易被氧化降解等问题 [4] [5]。
近年来,可再生的碱金属吸附剂脱除CO2技术操作相对简单,对设备的腐蚀性小,吸附剂再生温度低,能耗小,被认为是一种极具前景的捕集回收CO2技术 [6] - [13]。该技术中碱金属吸附剂理论吸附CO2的反应方程式为M2CO3 + H2O + CO2 ↔ 2MHCO3 (M = Na, K)。其中碱金属钾吸附剂由于具有较好的CO2吸附性能而受到广泛研究 [6] [7] [8] [9] [10]。Sharonov等 [6] 研究了K2CO3/Al2O3吸附剂在295 K时吸附CO2的动力学,研究得到反应速率中CO2浓度的反应级数为n = 1.04 ± 0.07。Lee等 [7] 报道了K2CO3/MgO吸附剂具有很好吸附和再生特性,在323 K,11%H2O条件下,其CO2的最大吸附容量可达197.6 mg/g吸附剂。此外,K2CO3/ZrO2 [8]、K2CO3/vermiculite [9] 和K2CO3/TiO2 [10] 等吸附剂也具有较好的CO2吸附性能。
虽然上述不同载体负载K2O3的吸附剂均显示了较好的CO2吸附性能,然而,现有的文献报道中由于吸附剂的制备方法和反应条件不同,难以比较不同载体对碱金属吸附剂吸附CO2性能的影响。为探明载体对碱金属吸附剂吸附CO2性能的影响,本文选取TiO2和凹凸棒石(Attapulgite)作为载体,采用浸渍法制备了含有30% K2CO3 (质量百分比)的吸附剂,在固定床反应中比较了钾基吸附剂的吸附容量,采用BET和XRD表征分析了载体对钾基吸附剂脱除CO2的影响。
2. 实验部分
2.1. 钾基吸附剂的制备
采用浸渍法将K2CO3 (Aldrich, ≥99%)负载在TiO2 (杭州万景新材料有限公司,99%)和凹凸棒石(安徽明光)等载体上,制备钾基吸附剂。将7 g载体加入到20 ml含有3 g无水K2CO3的溶液中,在室温下采用磁力搅拌器混合24 h后,在353 K下采用旋转式蒸发器烘干,最后将烘干的样品在空气气氛下置于马弗炉中673 K下煅烧4 h。
2.2. CO2吸附实验
将1.5 g的钾基吸附剂装入内径为1 cm,长度为25 cm的固定床石英管反应器中。在吸附实验中,水汽浓度的控制通过注射泵注射后高温气化进入反应器。实验模拟气成分为CO2 (2.0 vol.%)-H2O (10 vol.%)-N2(载气),气体流量120 cm3/min,反应温度333 K。CO2浓度采用气相色谱(TCD检测器)测定,采样时间间隔为1 min。
CO2的平衡吸附容量通过方程(1)计算:
(1)
方程(1)中qe为单位质量吸附剂的CO2平衡吸附容量,mg/g;P为实验的操作压力,1.0135 × 105 Pa;C0为CO2的平衡浓度,2%;F为实验的气体流量,120 ml/min; 为CO2的分子量,44 g/mol;R为气体常量,8.314 J/(mol·K);T0为室温,25℃;S为吸附曲线的积分面积,min;W为吸附剂的重量,1.5 g。
吸附曲线的积分面积S通过方程(2)计算得到:
(2)
方程(2)中Cout为吸附后CO2的浓度,%;t为吸附平衡时间,min。
2.3. 吸附剂表征
2.3.1. 比表面积和孔容积
样品的比表面积和孔容积测定采用BET法(美国,Coulter Omnisorp100CX型孔隙分析仪)。以高纯氮气作为样品的吸附气体,压力为300 KPa。将装有样品的样品管在电炉上373 K加热,抽真空处理2小时,差量法得到样品的真实重量。由吸附数据求得BET比表面积。样品的孔结构数据采用液氮温度(77 K)下的N2吸附法测定。
2.3.2. X射线衍射(XRD)
XRD衍射数据用阶梯扫描方式。在RIGAKU D/MAX 2550/PC多晶衍射仪上采集,Cu/Kα辐射源,功率40 kV × 40 mA,衍射束置石墨单色器除去Kβ辐射,入射波长为0.15405 nm,阶宽0.02˚,2θ = 5~80˚,每步计数时间4 s。
3. 结果与讨论
3.1. CO2吸附性能
图1为钾基吸附剂的CO2吸附曲线。从图1可以看出,K2CO3/凹凸棒石显示出较好的CO2吸附性能,其穿透时间为21 min,而K2CO3/TiO2的穿透时间为13 min。说明K2CO3/凹凸棒石吸附剂的吸附性能优于K2CO3/TiO2。图2考察了不同载体吸附CO2的性能。TiO2的吸附穿透时间较短,仅为2 min,而凹凸棒石的吸附性能较好,穿透时间为4 min。可见,载体吸附CO2性能不同是造成钾基吸附剂吸附CO2的性能差异的原因之一。

Figure 1. Adsorption curve of CO2 on potassium-based adsorbents. (a) K2CO3/Attapulgite; (b) K2CO3/TiO2
图1. 钾基吸附剂的CO2吸附曲线。(a) K2CO3/凹凸棒石;(b) K2CO3/TiO2
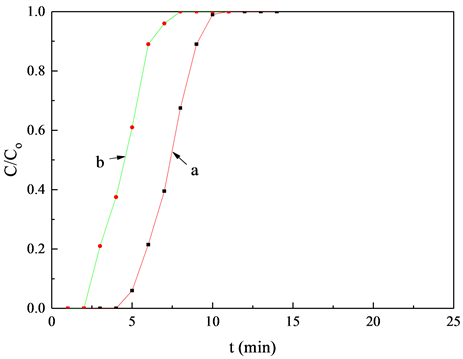
Figure 2. Adsorption curve of CO2 on support. (a) Attapulgite; (b) TiO2
图2. 载体的CO2吸附曲线。(a) 凹凸棒石;(b) TiO2
依据图1和图2的吸附曲线,通过方程(1)和(2)计算得到钾基吸附剂和载体的CO2吸附容量(见图3)。K2CO3/凹凸棒石吸附剂的CO2吸附容量为74.4 mg/g,K2CO3/TiO2吸附剂的CO2吸附容量为51.2 mg/g。载体的CO2吸附容量与钾基吸附剂相一致:凹凸棒石(21 mg/g) > TiO2 (12.8 mg/g)。虽然载体本身是造成钾基吸附剂吸附CO2的性能差异的原因之一。但是,通过比较钾基吸附剂与相应载体的CO2吸附容量差,我们发现不同的钾基吸附剂中相同质量分数的K2CO3 (30%)的CO2吸附性能存在差异。K2CO3/凹凸棒石与载体凹凸棒石的CO2吸附容量差为53.4 mg/g, K2CO3/TiO2与载体TiO2的CO2吸附容量差为38.4 mg/g。这可能由于① 钾基吸附剂的比表面积和比孔容的差异造成K2CO3在载体上分布存在差异;② 在制备钾基吸附剂时K2CO3与载体发生相互作用,改变了碱金属钾在不同吸附剂中的存在形式,造成CO2吸附性能的不同。通过BET和XRD表征,分别考察钾基吸附剂的比表面积和比孔容,以及钾基吸附剂中的物相尤其是碱金属钾的物相对CO2吸附性能的影响。

Figure 3. Comparison of adsorption capacity between potassium based adsorbent and support. (A) K2CO3/Attapulgite; (a) Attapulgite; (B) K2CO3/TiO2 and (b) (b) TiO2
图3. 钾基吸附剂与载体吸附容量的比较。(A) K2CO3/凹凸棒石;(a) 凹凸棒石;(B) K2CO3/TiO2和(b) TiO2
3.2. BET
表1比较了钾基吸附剂的比表面积及孔容积,表面积和比孔容的大小为K2CO3/TiO2 > K2CO3/凹凸棒石。结合钾基吸附剂的CO2吸附容量(图3),可见钾基吸附剂的比表面积和比孔容对CO2吸附容量无明显的正相关性。
Table 1. Physical and chemical properties of potassium based adsorbents
表1. 钾基吸附剂的理化性质
3.3. XRD
通过XRD表征了钾基吸附剂中碱金属钾的物相。图4为K2CO3/凹凸棒石吸附CO2前后的XRD谱图。从图4中可见,在未吸附CO2时,K2CO3/凹凸棒石中不仅检测到K2CO3物相,还分别检测出K2Ca(CO3)2、MgO、CaCO3和SiO2。由于K2Ca(CO3)2物相的存在,表明在K2CO3/凹凸棒石制备中,K2CO3与载体凹凸棒石发生了化学反应,部分K2CO3分别转化成K2Ca(CO3)2。当K2CO3/凹凸棒石吸附CO2后,其XRD谱图中K2CO3物相消失并出现了KHCO3新物相,对比吸附CO2前后K2Ca(CO3)2物相衍射峰及其强度发现部分K2Ca(CO3)2衍射峰消失,且其衍射峰的强度降低,说明部分K2Ca(CO3)2吸附CO2后转化成KHCO3。此外,对比吸附CO2前后K2Ca(CO3)2物相衍射峰及其强度发现MgO的衍射峰变化与K2Ca(CO3)2衍射峰变化相似,说明部分CO2可被凹凸棒石中MgO吸附。

Figure 4. XRD spectrum of K2CO3/attapulgite adsorbent during before and after CO2 adsorption. (△)MgO, (○)K2CO3, (▽) K2Ca(CO3)2, (*)CaCO3, (▼)KHCO3, (♀)SiO2
图4. K2CO3/凹凸棒石吸附剂吸附CO2前后的XRD谱图。(△) MgO,(○) K2CO3,(▽) K2Ca(CO3)2,(*) CaCO3,(▼) KHCO3,(♀) SiO2
图5为K2CO3/TiO2吸附CO2前后的XRD谱图。在未吸附CO2时,K2CO3/TiO2中不仅检测到K2CO3物相,还分别检测出K2CO3、TiO2和K1.6Ti1.6O3。由于K1.6Ti1.6O3物相的存在,表明在K2CO3/TiO2制备中,K2CO3与载体TiO2发生了化学反应,部分K2CO3分别转化成K1.6Ti1.6O3。当K2CO3/TiO2吸附CO2后,其XRD谱图中K2CO3物相消失并出现了KHCO3新物相,说明CO2与K2CO3反应生成了KHCO3。对比吸附CO2前后K1.6Ti1.6O3和TiO2物相衍射峰及其强度发现这些物相衍射峰及其强度基本未发生变化,说明K1.6Ti1.6O3和TiO2未与CO2发生反应。因此,K2CO3/TiO2的吸附性能低于K2CO3/凹凸棒石。
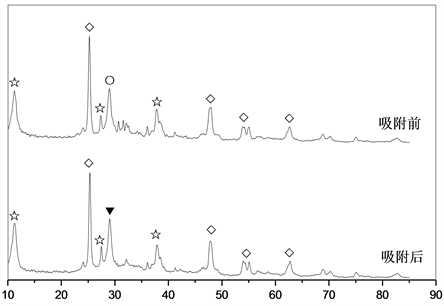
Figure 5. XRD spectrum of K2CO3/TiO2 adsorbent during before and after CO2 adsorption. (○) K2CO3, (▼) KHCO3, (◇) TiO2, (☆) K1.6Ti1.6O3
图5. K2CO3/ TiO2吸附剂吸附CO2前后的XRD谱图。(○) K2CO3,(▼) KHCO3,(◇) TiO2,(☆) K1.6Ti1.6O3
4. 结论
采用浸渍法制备了K2CO3/凹凸棒石和K2CO3/TiO2吸附剂,在常压、333 K、CO2 (2%)和H2O (10%)条件下,钾基吸附剂的CO2吸附容量顺序为K2CO3/凹凸棒石(74.4 mg/g) > K2CO3/TiO2 (51.2 mg/g),载体的CO2吸附容量为凹凸棒石(21 mg/g) > TiO2 (12.8 mg/g)。
钾基吸附剂载体的比表面积和比孔容与CO2吸附容量无明显的正相关性。碱金属钾在不同载体中的物相差异是造成CO2吸附性能差别的原因,在K2CO3/凹凸棒石吸附剂中,不仅有K2CO3物相,还分别检测出K2Ca(CO3)2和MgO。当K2CO3/凹凸棒石吸附CO2时,不仅K2CO3可与CO2反应生成KHCO3,而且K2Ca(CO3)2和MgO也可吸附CO2。在K2CO3/TiO2吸附剂中,除了检测到K2CO3物相,还分别检测出K2CO3、TiO2和K1.6Ti1.6O3。当K2CO3/TiO2吸附CO2时,CO2与K2CO3反应生成了KHCO3,而K1.6Ti1.6O3和TiO2未与CO2发生反应。因此,K2CO3/TiO2的吸附性能低于K2CO3/凹凸棒石。
基金项目
浙江省自然科学基金(LY19E080023);浙江树人大学省属高校基本科研业务费专项资金项目资助(2020XZ012)。
文章引用
张嘉豪,潘 华,梅 瑜. 载体对钾基吸附剂脱除CO2的影响
Effect of Supports on CO2 Adsorption Behavior of Potassium-Based Adsorbents[J]. 化学工程与技术, 2020, 10(03): 208-214. https://doi.org/10.12677/HJCET.2020.103026
参考文献
- 1. 薛全民, 周亚平, 苏伟. 甲基二乙醇胺水溶液吸收CO2的研究[J]. 化学工程, 2009, 37(9): 1-4.
- 2. 陈春宜, 王祖武, 魏文龙, 程诚, 王骏星, 周家勇, 车垚. 有机胺对CO2吸收解吸的研究[J]. 中国环境科学, 2011, 31(7): 1109-1114.
- 3. 施耀, 项菲, 李伟, 钟战铁. 混合有机胺吸收烟道气中CO2的交互作用机理[J]. 中国环境科学, 2003, 23(2): 201-205.
- 4. Askanksha, P.K.K. and Srivastava, V.K. (2007) Carbon Dioxide Absorption into Monethanolamine in a Continous Film Contactor. Chemical Engineering Journal, 133, 229-237. https://doi.org/10.1016/j.cej.2007.02.001
- 5. Mandal, B.P., Guha, M., Biswas, A.K. and Bandyopadhyay, S.S. (2001) Removal of Carbon Dioxide by Absorption in Mixed Amines: Modeling of Absorption in Aqueous MDEA/MEA and AMP/MEA Solutions. Chemical Engineering Science, 56, 6217-6224. https://doi.org/10.1016/S0009-2509(01)00279-2
- 6. Sharonov, V.E., Okunev, A.G. and Aristov, Y.I. (2004) Kinetics of Carbon Dioxide Sorption by the Composite Material K2CO3 in Al2O3. Reaction Kinetics and Catalysis Letters, 83, 363-369. https://doi.org/10.1023/B:REAC.0000034849.15412.d2
- 7. Lee, S.C., Chae, H.J., Lee, S.J., Choi, B.Y., Lee, C.K., Lee, J.B., Ryu, C.K. and Kim, J.C. (2008) Development of Regenerable MgO-Based Sorbent Promoted with K2CO3 for CO2 Capture at Low Temperatures. Environmental Science & Technology, 42, 2736-2741. https://doi.org/10.1021/es702693c
- 8. Lee, S.C., Chae, H.J., Lee, S.J., Park, Y.H., Ryu, C.K., Yi, C.K. and Kim, J.C. (2009) Novel Regenerable Potassium-Based Dry Sorbents for CO2 Capture at Low Temperatures. Journal of Molecular Catalysis B: Enzymatic, 56, 179-184. https://doi.org/10.1016/j.molcatb.2008.07.007
- 9. Okunev, A.G., Sharonov, V.E., Aistov, Y.I. and Parmon, V.N. (2000) Sorption of Carbon Dioxide from Wet Gases by K2CO3-In-Porous Matrix: Influence of the Matrix Nature. Reaction Kinetics and Catalysis Letters, 71, 355-362. https://doi.org/10.1023/A:1010395630719
- 10. Lee, S.C., Kwon, Y.M., Park, Y.H., Lee, W.S., Park, J.J., Ryu, C.K., Yi, C.K. and Kim, J.C. (2010) Structure Effects of Potassium-Based TiO2 Sorbents on the CO2 Capture Capacity. Topics in Catalysis, 53, 641-647. https://doi.org/10.1007/s11244-010-9499-3
- 11. Lee, J.B., Ryu, C.K., Baek, J.I., Lee, J.H., Eom, T.H. and Kim, S.H. (2008) Sodium-Based Dry Regenerable Sorbent for Carbon Dioxide Capture from Power Plant Flue Gas. Industrial & Engineering Chemistry Research, 47, 4465-4472. https://doi.org/10.1021/ie0709638
- 12. Shin, D.H., Cheigh, H.S. and Lee, D.S. (2002) The Use of Na2CO3-Based CO2 Absorbent Systems to Alleviate Pressure Buildup and Volume Expansion of Kimchi Packages. Journal of Food Engineering, 53, 229-235. https://doi.org/10.1016/S0260-8774(01)00161-3
- 13. Siriwardane, R.V., Robinson, C., Shen, M. and Simonyi, T. (2007) Novel Regenerable Sodium-Based Sorbents for CO2 Capture at Warm Gas Temperatures. Energy Fuels, 21, 2088-2097. https://doi.org/10.1021/ef070008v
NOTES
*通讯作者。
