Hans Journal of Food and Nutrition Science
Vol.07 No.02(2018), Article ID:25154,8
pages
10.12677/HJFNS.2018.72016
Effect of Heating on Phytosterol Content in Peanut Oil
Yanfang Ma, Zhixin Zhu*, Zihao Liang, Yongwei Liang, Junhong Chen, Yefen Ma
Guangdong Provincial Public Laboratory of Analysis and Testing Technology, China National Analytical Center, Guangzhou Guangdong

Received: May 11th, 2018; accepted: May 22nd, 2018; published: May 29th, 2018

ABSTRACT
The effect of heating temperatures and time on the contents of three phytosterols (campesterol, stigmasterol and β-sitosterol), which were determinated by gas chromatography-mass spectrum (GC-MS), was investigated in this paper. The results showed that the contents of the three phytosterols were relatively stable when heating temperature was low (100˚C), while the contents decreased significantly when heating temperature was high (220˚C). The prolonged treating of peanut oil at high temperatures had a marked effect on the contents of phytosterols in peanut oil, and the contents can be regarded as reference index for the identification of waste edible oil.
Keywords:Phytosterols, Peanut Oil, Oxidation Mechanism, Gas Chromatography/Mass Spectrometry
加热对花生油中植物甾醇含量影响研究
马艳芳,朱志鑫*,梁梓豪,梁永威,陈俊宏,马叶芬
中国广州分析测试中心,广东省分析测试技术公共实验室,广东 广州

收稿日期:2018年5月11日;录用日期:2018年5月22日;发布日期:2018年5月29日

摘 要
采用不同加热温度和时间对花生油进行处理,气相色谱–质谱法(GC-MS)测试其三种重要植物甾醇(β-谷甾醇、菜油甾醇、豆甾醇)含量变化。结果表明:在加热温度较低时(100℃),植物甾醇相对稳定,含量下降趋势缓慢,而在较高温度(220℃)条件下植物甾醇含量显著降低。长时间高温加热对花生油中植物甾醇含量有显著影响,其含量可以作为餐饮废油判定的参考指标。
关键词 :植物甾醇,花生油,氧化机理,气相色谱–质谱

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
食用植物油是人们日常生活必不可少的烹饪材料,也是人类膳食中脂肪的主要来源 [1] 。植物甾醇和维生素E为食用植物油的重要营养成分,其中植物甾醇是一类以环戊烷全氢菲为骨架的天然醇类化合物,主要包括β-谷甾醇、菜油甾醇、豆甾醇、菜籽甾醇等四种无甲基甾醇。现代药理学研究证明, 植物甾醇具有降低血液中胆固醇浓度 [2] [3]、抗癌 [4]、抗氧化作用 [5] [6] 以及类激素功能 [7]、抗炎和退热等作用。
近年来,食用油的安全受到来自“地沟油”、掺假油等劣质餐饮废油的威胁,针对中餐食用油主要以高温加热为主的使用习惯,这些油脂经过多次使用且经“脱色、精炼”等回收加工过程从而其品质受到影响 [8] 。天然甾醇在高温环境或光、氧、金属污染物等催化条件下,甾醇易发生氧化反应 [9] [10] [11] [12] ,衍生出多种甾醇氧化物(phytosterol oxidation products, POPs),甾醇氧化物被证明具有和丙烯酰胺、杂环胺、亚硝胺、多环芳烃相类似的致癌、致突变等毒副作用 [13] [14] [15] [16] ,从而造成了食用安全隐患。
植物油中甾醇的测定方法已有较多报道,常见方法有薄层色谱–分光光度法 [17]、高效液相色谱法 [18]、气相色谱法 [19]、及气相色谱–质谱法 [20] 等,其中气相色谱–质谱法可以实现对各种植物甾醇的精确定性而得到广泛使用。本研究通过对花生油进行加热处理,采用气相色谱–质谱法(GC-MS)测试其三种重要甾醇(β-谷甾醇、菜油甾醇、豆甾醇)含量变化,并进行比较和分析,为更全面反映油脂受热过程中品质变化提高参考依据,同时为劣质餐饮废油判定提供新的研究思路。
2. 实验部分
2.1. 仪器与试剂
2.1.1. 主要仪器
GC 6890气相色谱-MS5973i质谱联用仪:美国安捷伦公司;RE-5220旋转蒸发仪:上海亚荣旋转蒸发仪厂;太古TZC-0502E/F家用榨油机。
2.1.2. 试剂和材料
甲醇、吡啶、氢氧化钾、三氯甲烷:分析纯,广州化学试剂厂,BSTFA/TMCS硅烷化试剂(99%N,O-双(三甲基硅基)三氟乙酰胺 + 1% 三甲基氯硅烷的混合试剂):美国Supelco公司。β-谷甾醇,纯度99.1%,成都普菲德生物技术有限公司。
花生油:家用榨油机自己榨取。
2.1.3. 标准物质
准确称取20 mg(精确到0.1 mg)的β-谷甾醇标准品于10 mL容量瓶中,用甲醇溶解并定容到刻度,该溶液质量浓度为2.0 mg/mL,然后吸取该标准溶液,用甲醇逐级稀释,分别得到β-谷甾醇质量浓度为1.0、0.5、0.1、0.05 mg /mL的系列标准工作液。
2.2. 样品预处理
2.2.1. 样品提取
精确称取0.5 g样品于50 mL烧瓶中,加10 mL (
2.2.2. 样品衍生
取旋转蒸发仪减压蒸干的样品,放入烘箱,在
2.3. 实验条件
2.3.1. 气相色谱条件
色谱柱:DB-5MS(
2.3.2. 质谱条件
EI离子源,电子能量70 eV,电子倍增器电压2000 V,四极杆温度150℃,离子源温度230℃,GC/MS接口温度280℃,质量扫描范围35 u~550 u,标准质谱图库Wiley7n. L和NIST11.L。
2.4. 油样处理
以自己榨取纯正花生油为原料,分别在100℃、140℃、180℃和220℃条件下加热0.5、1、2、4、6、8 h,冷却至室温,测定油样中三种甾醇(β-谷甾醇、菜油甾醇、豆甾醇)含量。
2.5. 定性和定量分析方法
豆甾醇、β-谷甾醇、菜油甾醇三种植物甾醇具有极其相似的结构,其结构分别图1。
三种植物甾醇差别主要表现在:1) β-谷甾醇(分子式:C29H50O)与豆甾醇(分子式:C29H48O)仅在支链上相差一个双键,结构其他部分完全一致;2) β-谷甾醇(分子式:C29H50O)与菜油甾醇(分子式:C28H48O)仅在支链上相差一个CH2基团,结构其他部分完全一致;参考GB/T 25223-2010 [19] 中甾醇总量的测定方

Figure 1. Structure of campesterol, stigmasterol and β-sitosterol
图1. 豆甾醇、β-谷甾醇及菜油甾醇的结构
法中假定所有甾醇的响应因子是相等的,故可使用外标法检测出β-谷甾醇具体含量,再用面积归一化法测定出各植物甾醇的相对含量,然后通过折算,得到出其他各植物甾醇具体含量 [20] 。
3. 结果与讨论
3.1. 花生油样品总离子流图
如图2。
3.2. 加热温度和加热时间对植物甾醇含量的影响
在不同温度加热条件下,花生油中3种植物甾醇变化情况如图3~图5所示。
从图2~图5可以看出,在同一加热温度下,植物甾醇含量随加热时间的延长而逐渐降低,当加热时间相同,加热温度越高,植物甾醇含量减少速率越快。在加热温度为100℃时,随加热时间的延长,3种植物甾醇含量下降趋势缓慢,经过8个小时加热,菜油甾醇、豆甾醇和β-谷甾醇含量下降率分别20.2%,19.8%和22.3%,而当加热温度达到220℃时,3种植物甾醇含量下降明显,下降率分别83.6%,82.9%和91.1%。
研究结果分析可知,正常家庭对食用油的高温煎炸过程,由于加热时间相对较短,甾醇发生氧化反应的可能性小,基本不会造成甾醇含量改变。而餐厨废油等在加工生产过程需要经历一些高温精炼环节,由于加热温度高且时间长,除脂质基质发生严重氧化失去营养价值外,甾醇发生裂变并产生有毒的甾醇氧化物的概率也大大提高,容易形成食用安全威胁。
3.3. 植物甾醇热氧化机理
植物甾醇热氧化是一种三线态氧(3O2)诱发的自由基反应,最后能形成一系列的植物甾醇氧化物。其主要反应机理如下:反应初期植物甾醇的C7或C25失去1个H原子形成的自由基与3O2反应生成过氧自由基,过氧自由基又从其他C7或C25位点上夺取氢形成7α/β-氢过氧化甾醇。7α/β-氢过氧化甾醇不稳定,

Figure 2. The GC-MS total ion chromatogram of peanut oil sample (1. campestanol 2. brassicasterol 3. stigmasterol 4. β-sitosterol)
图2. 花生样品总离子流图(1. 菜籽甾醇;2. 菜油甾醇;3. 豆甾醇;4. β-谷甾醇)
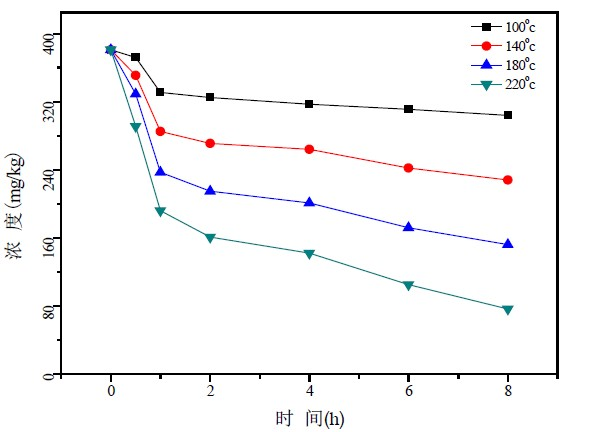
Figure 3. Content of campesterol heated at different temperatures of various periods of time for peanut oil
图3. 不同加热温度、加热时间下菜油甾醇含量

Figure 4. Content of stigmasterol heated at different temperatures of various periods of time for peanut oil
图4. 不同加热温度、加热时间下豆甾醇含量变化情况

Figure 5. Content of β-sitosterol heated at different temperatures of various periods of time for peanut oil
图5. 不同加热温度、加热时间下β-谷甾醇含量变化情况
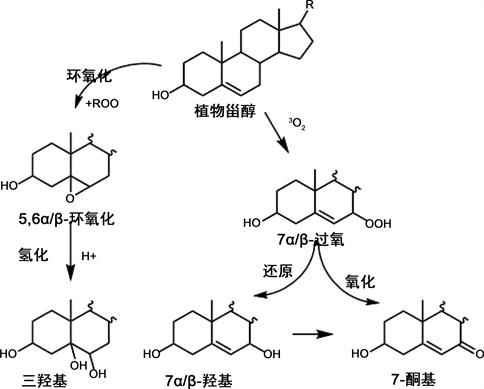
Figure 6. Cleavage process of phytosterol
图6. 植物甾醇裂变途径
在加热条件下会分解形成相对稳定的7α/β-羟基甾醇,7α/β-羟基甾醇又会进一步脱氢氧化成7-酮基甾醇。此外,甾醇和过氧化物之间相互作用会产生另一种重要的氧化产物5/6-环氧甾醇,5/6-环氧甾醇在酸性环境下还能进一步加氢转变为3β,5α,6β-三羟基甾醇,其裂变方式见图6。
4. 结论
本文通过对花生油进行不同温度加热处理,然后利用气相色谱-质谱法测定其甾醇含量变化。实验结果表明:随着加热时间的延长和加热温度的提高,花生油中的甾醇含量不断下降。过长时间的高温加热会影响植物油的品质,可以通过对植物油中甾醇含量的检测推论该植物油是否经过长时间高温处理,为劣质餐饮废油判定提供新的参考方法。
基金项目
佛山市食品安全检测与评价科技创新平台项目( 2014AG10007)。
文章引用
马艳芳,朱志鑫,梁梓豪,梁永威,陈俊宏,马叶芬. 加热对花生油中植物甾醇含量影响研究
Effect of Heating on Phytosterol Content in Peanut Oil[J]. 食品与营养科学, 2018, 07(02): 137-144. https://doi.org/10.12677/HJFNS.2018.72016
参考文献
- 1. 李晓英, 彭德伟. 餐饮废油与食用植物油品质的GC-MS检测[J]. 中国油脂, 2011, 36(4): 74-77.
- 2. De, J.A., Plat, J., Mensink, R.P., et al. (2003) Metabolic Effects of Plant Sterols and Stanols (Review). The Journal of Nutritional Biochemistry, 14, 362-369. https://doi.org/10.1016/S0955-2863(03)00002-0
- 3. Ras, R.T., Geleijnse, J.M. and Trautwein, E.A. (2014) LDL-Cholesterol-Lowering Effect of Plant Sterols and Stanols across Different Dose Ranges: A Meta-Analysis of Randomised Controlled Studies. British Journal of Nutrition, 112, 214-219. https://doi.org/10.1017/S0007114514000750
- 4. Suttiarporn, P., Chumpolsri, W., Mahatheeranont, S., et al. (2015) Structures of Phyto-Sterols and Triterpenoids with Potential Anti-Cancer Activity in Bran of Black non-Glutinous Rice. Nutrients, 7, 1672-1687. https://doi.org/10.3390/nu7031672
- 5. Rudzinska, M., Hassanein, M.M.M., Abdel-Razek, A.G., et al. (2016) Blends of Rapeseed Oil with Black Cumin and Rice Bran Oils for Increasing the Oxidative Stability. Journal of Food Science and Technology-Mysore, 53, 1055-1062. https://doi.org/10.1007/s13197-015-2140-5
- 6. Fu, Y.Q., Zhang, Y., Hu, H.Y., et al. (2014) Design and Straightforward Synthesis of Novel Galloyl Phytosterols with Excellent Antioxidant Activity. Food Chemistry, 163, 171-177. https://doi.org/10.1016/j.foodchem.2014.04.093
- 7. Sriraman, S., Ramanujam, G.M., Ramasamy, M.K., et al. (2015) Identification of Beta-Sitosterol and Stigmasterol in Bambusa bambos (L.) Voss Leaf Extract Using HPLC and Its Estrogenic Effect in Vitro. Journal of Pharmaceutical and Biomedical Analysis, 115, 55-61. https://doi.org/10.1016/j.jpba.2015.06.024
- 8. 吴惠勤, 黄晓兰, 陈江韩, 等. SPME/GC-MS鉴别地沟油新方法[J]. 分析测试学报, 2012, 31(1): 1-6.
- 9. Rudzinska, M., Przybylski, R., Zhao, Y.Y., et al. (2010) Sitosterol Thermo-Oxidative Degradation Leads to the Formation of Dimers, Trimers and Oligomers: A Study Using Combined Size Exclusion Chromatography/Mass Spectrometry. Lipids, 45, 549-558. https://doi.org/10.1007/s11745-010-3433-0
- 10. Maerker, G. (1987) Cholesterol Autoxidation-Current Status. Journal of the American Oil Chemists, Society, 64, 388-392. https://doi.org/10.1007/BF02549301
- 11. Porter, N.A., Caldwell, S.E. and Mills, K.A. (1995) Mechanisms of Free Radical Oxidation of Unsaturated Lipids. Lipids, 30, 277-290. https://doi.org/10.1007/BF02536034
- 12. Jagerstad, M. and Skog, K. (2005) Genotoxiciry of Heat-Processed Foods. Mutation Research, 574, 156-172. https://doi.org/10.1016/j.mrfmmm.2005.01.030
- 13. Alemany, L., Barbera, R., Alegria, A., et al. (2014) Plant Sterols from Foods in Inflammation and Risk of Cardiovascular Disease: A Real Threat? Food and Chemical Toxicology, 69, 140-149.
- 14. Garcia-Llatas, G. and Rodriguez-Estrada, M.T. (2011) Current and New Insights on Phytosterol Oxides in Plant Sterol-Enriched Food. Chemistry and Physics of Lipids, 164, 607-624.
- 15. O’Callaghan, Y., Kenny, O., O’Connell, N.M., et al. (2013) Oxidized Derivatives of Dihydrobrassicasterol: Cytotoxic and Apoptotic Potential in U937 and HepG2 Cells. Biochimie, 95, 496-503. https://doi.org/10.1016/j.biochi.2012.04.019
- 16. Schott, H.F. and Lutjohann, D. (2011) Validation of an Isotope Dilution Gas Chromatography-Mass Spectrometry Method for Analysis of 7-Oxygenated Campesterol and Sitosterol in Human Serum. Chemistry and Physics of Lipids, 164, 425-431.
- 17. 刘海霞, 仇农学, 王峰, 等. 苹果籽油中植物甾醇含量的薄层色谱–分光光度法测定[J]. 中国油脂, 2008, 33(10): 76-79.
- 18. Warner, K. and Mounts, T.L. (1990) Analysis of Tocopherols and Phytosterols in Vegetable Oils by HPLC with Evapor Active Light-Scattering Detection. Journal of the American Oil Chemists’ Society, 167, 632-635.
- 19. 国家质量监督检验检疫总局. 动植物油脂甾醇组成和甾醇总量的测定气相色谱法: GB/T 25223-2010 [S]. 北京: 中国标准出版社, 2011: 3.
- 20. 钟巧莉, 朱志鑫, 吴惠勤, 等. 衍生化气相色谱–质谱法测定植物油中植物甾醇[J]. 分析测试学报, 2012, 31(8): 987-991.
NOTES
*通讯作者。