Hans Journal of Food and Nutrition Science
Vol.
13
No.
01
(
2024
), Article ID:
80540
,
11
pages
10.12677/HJFNS.2024.131009
木瓜酒中微生物控制的研究
南立军1*,周慧2*,刘芸荷1,王春艳1,赵新云1,詹国丽3,刘丽媛2#,何坤祖4#
1楚雄师范学院资源环境与化学学院,云南 楚雄
2吐鲁番市葡萄产业发展促进中心,新疆 吐鲁番
3牟定云牛生物科技有限公司,云南 楚雄
4吐鲁番丝路明珠农业生物科技有限公司,新疆 吐鲁番
收稿日期:2023年10月25日;录用日期:2024年1月29日;发布日期:2024年2月6日

摘要
目的:为了提高木瓜酒的稳定性,改善木瓜酒的品质,防止微生物在酒中引起酸败。方法:以木瓜汁为原料,用碳酸钙对木瓜汁进行降酸,以无菌处理的为实验组,未无菌处理的为对照组,从微生物污染途径和木瓜酒存储条件对木瓜酒中的微生物进行控制。利用二氧化硫对发酵过程中各酿造用具进行杀菌,对比不杀菌处理发酵组微生物数量。同时设计单因素实验和正交实验研究不同pH、温度和二氧化硫浓度对木瓜酒存储中微生物的影响。结果:实验表明,经过无菌操作的木瓜酒在各阶段的微生物数量都明显低于未经过无菌操作组的,pH < 3.5时,微生物的活性明显降低;温度 > 35℃时,木瓜酒不稳定;≥40 mg/L的二氧化硫浓度(游离硫)对微生物的抑制效果较明显;正交实验表明,对微生物影响效果从大到小排序为SO2浓度 > 温度 > pH,最佳的条件组合为:25℃,50 mg/L SO2和pH 3.5。结论:对酿造用具进行严格无菌操作,虽然不能完全阻断微生物污染来源,但是可以在实际生产中有效降低微生物数量。对微生物的三个影响因素中,SO2浓度造成的影响最大,其次是温度,控制木瓜酒中微生物最佳的组合条件为25℃,50 mg/L SO2和pH 3.5。
关键词
木瓜酒,微生物,控制,SO2浓度,温度,pH

Study on Microbial Control in Papaya Wine
Lijun Nan1*, Hui Zhou2*, Yunhe Liu1, Chunyan Wang1, Xinyun Zhao1, Guoli Zhan3, Liyuan Liu2#, Kunzu He4#
1School of Resources, Environment and Chemistry, Chuxiong Normal University, Chuxiong Yunnan
2Turpan Grape Industry Development Promotion Center, Turpan Xinjiang
3Muding Yunniu Biotechnology Co., Ltd., Chuxiong Yunnan
4Turpan Silu Mingzhu Agricultural Biotechnology Co., Ltd., Turpan Xinjiang
Received: Oct. 25th, 2023; accepted: Jan. 29th, 2024; published: Feb. 6th, 2024

ABSTRACT
Objective: In order to improve the stability of papaya wine, improve the quality of papaya wine, and prevent microorganisms from causing rancidity in the wine. Method: Taking papaya juice as raw material, calcium carbonate was used to reduce the acid of papaya juice, and the sterile treatment was taken as the experimental group and the non-sterile treatment was used as the control group, and the microorganisms in papaya wine were controlled from the microbial pollution pathway and the storage conditions of papaya wine. Sulfur dioxide was used to sterilize each brewing apparatus in the fermentation process, and the number of microorganisms in the fermentation group was compared with the non-sterile treatment. At the same time, one-way experiments and orthogonal experiments were designed to study the effects of different pH, temperature and sulfur dioxide concentration on microorganisms in papaya wine storage. Results: The experiment showed that the number of microorganisms in the sterile operation of papaya wine at each stage was significantly lower than that of the non-sterile operation group, and the activity of microorganisms was significantly reduced when the pH < 3.5; when the temperature > 35˚C, the papaya wine was unstable; the sulfur dioxide concentration (free sulfur) of ≥ 40 mg/L was more obviously inhibited on microorganisms; orthogonal experiments showed that the effect on microorganisms was ordered from large to small as SO2 concentration > temperature > pH, and the optimal combination of conditions was: 25˚C, 50 mg/L SO2 and pH 3.5. Conclusion: Strict aseptic operation of brewing utensils, although it can not completely block the source of microbial contamination, can effectively reduce the number of microorganisms in actual production. Among the three influencing factors on microorganisms, SO2 concentration had the greatest impact, followed by temperature, and the optimal combination conditions for controlling microorganisms in papaya wine were 25˚C, 50 mg/L SO2 and pH 3.5.
Keywords:Papaya Wine, Microorganisms, Control, SO2 Concentration, Temperature, pH

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
微生物污染是食品变质的主要原因之一,近年来,食品中的微生物安全事件层出不穷,微生物对人体的危害非常突出 [1] 。全世界每年由微生物污染而损失的各类食品逐年增加,我国每年发生微生物性的食物中毒事件也屡见不鲜 [2] 。对即食食品检验显示,生菌数、大肠杆菌群、大肠杆菌、金黄色葡萄球菌、仙人掌杆菌、沙门氏杆菌和病原性大肠杆菌等总不合格率分别为35%、37%、7%、14%、1%、0.3%和1%,不合格情形较严重 [3] 。极大危害了人们健康,降低了食品食用价值。控制微生物数量,保证食品安全已经成为当下的燃眉之急。
酸木瓜(Chaenomeles sinensi),是蔷薇科、木瓜属植物,是云南的一种特产水果,又名番木瓜,外表为金黄色,它散发出诱人的果香,酸木瓜含多种对人体有益物质,其中的木瓜蛋白酶有消食的作用。此外,所含的番木瓜碱具有抗菌和抗肿瘤的功效。其次,酸木瓜中齐墩果酸是一种具有护肝、抗炎和抑菌,降低血脂、软化血管功能的物质 [4] ,具有很高的食用价值。
在木瓜酒的酿造过程中,微生物会分解酒中的物质,疯狂繁殖,给酒带来不愉悦的气味,在生产中极易由生产环境不达标或设备卫生条件差等因素引起 [5] ,微生物污染主要由于木瓜汁液与发酵用具的接触引起,最有效的方法就是消除污染源,即对木瓜原料本身、榨汁设备、木瓜酒的发酵容器、酒液的运输管道、木瓜酒液的储存容器等各种酿造用具和容器 [6] ,以及整个操作过程中操作人员的双手进行严格的亚硫酸消毒处理。虽然不可能完全地阻断消除,但是在实际的生产过程中,可以有效地降低微生物的数量 [7] ,达到控制微生物,提升木瓜酒品质、提高酒的稳定性和防止木瓜酒酸败的目的 [8] 。
其次,微生物的生长发育需要适宜的温度和适宜的pH等环境条件,同时二氧化硫也可以影响到微生物的正常生长发育,可以通过改变其生存环境来控制微生物,即控制储存温度、改变二氧化硫浓度和pH控制微生物 [9] 。随着SO2浓度提高(20、30和50 mg/L),SD-1菌株活性分别为0.556、0.506和0.434;随着pH降低(pH 3.4、3.2和3.0),SD-1菌株活性分别为0.678、0.426和0.1 56。因此,SO2和pH对微生物的抑制效果明显 [8] 。
陶忠良 [7] 对黄酒酿造过程中微生物污染控制的研究表明控制微生物最好的方法就是消除和切断污染源,在实际生产中,可以有效降低微生物的污染程度。
张琴等 [10] 人在研究温度对酒货架期影响中表明,不同温度对酒的货架期质量稳定性的影响存在一定差异,研究表明低温对外观稳定性影响较大,高温对感官品质影响较大。
本文以酸木瓜为原料,碳酸钙作降酸剂,在对酿造用具进行不同处理下进行榨汁,加入活化酵母发酵,研究酿造用具的处理与微生物数量的关系。同时设计单因素实验和正交实验,研究不同温度、pH和二氧化硫浓度对木瓜酒储存阶段微生物的影响,从而得到抑制木瓜酒微生物的最佳组合条件。本研究的局限性是材料主要是云南酸木瓜,酸度极高,但是这也是本研究的特色。
2. 材料和方法
2.1. 实验材料
2.1.1. 实验原料
酸木瓜,产自云南临沧。
2.1.2. 实验辅料
酿酒酵母,型号71B,上海杰兔工贸有限公司。
果胶酶,湖北武汉万荣科技发展有限公司(酶活 50 200 U/g)。
亚硫酸,分析纯,天津市大茂化学试剂厂。
2.2. 实验设备
见表1。
Table 1. Experimental instruments
表1. 实验仪器
2.3. 实验方法
2.3.1. 木瓜酒酿造工艺
如图1。
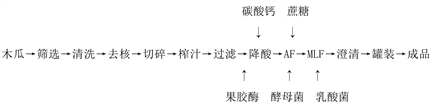
Figure 1. Production process flow chart of papaya wine
图1. 木瓜酒制作工艺流程图
选用成熟度良好,没有病虫害,形状均匀的木瓜,自来水冲洗2~3次,再用亚硫酸清洗。去籽、切碎,压榨过滤,降酸,加糖,发酵,具体步骤如下:
1) 筛选:挑选出色泽、外观匀称且无病虫害的优品质木瓜。
2) 清洗:先用自来水进行清洗,再用30 mg/L亚硫酸对木瓜原料进行清洗。
3) 去核:将清洗过的木瓜对半切开,去核去籽处理。
4) 榨汁:对榨汁机消毒后,将去核之后的木瓜切碎榨汁。
5) 果汁澄清:加入35 mg/L果胶酶,澄清处理24 h,同时加入30 mg/L的亚硫酸防氧化。
6) 降酸:加入17 g/L的碳酸钙进行降酸处理。
7) 加糖:加入17.5 g/L的蔗糖调节木瓜汁的糖分。
8) AF:加入活化酵母进行AF,监测发酵液比重的变化。
9) MLF:加入活化乳酸菌进行MLF。
10) 木瓜酒澄清:放入冰箱使其自然澄清。
11) 灌装。
2.3.2. 实验设备中微生物的控制
木瓜酒发酵中的微生物污染主要由发酵液与酿造用具直接接触引起,最有效的控制方法就是消除污染源,即对木瓜原料本身、榨汁设备、木瓜酒的发酵容器、酒液的运输管道、木瓜酒液的储存容器等各种酿造用具和容器,以及整个操作过程中操作人员的双手进行严格的亚硫酸消毒处理。虽然不可能完全阻断消除,但是在实际生产过程中,可以有效的降低微生物数量 [7] 。
1) 发酵前段微生物的控制
为了预防发酵前段出现的微生物污染,要从微生物的来源进行控制,最重要的就是木瓜的榨汁设备、运输管道和汁液储存罐的无菌处理,同时也要保证木瓜原料、以及辅料无霉变。
将木瓜汁分两种处理,处理一是在对设备、运输管道、存储设备和原料用亚硫酸消毒之后榨汁,处理二组是在没有进行任何消毒处理的情况下榨汁。上述两组,各取3份样品,分别标记为第1组、第2组、第3组,每份1 mL,分别加入到9 mL无菌水中,摇匀,再从中吸取1 mL稀释液加入到9 mL无菌水中,依次进行梯度稀释,吸取10−5、10−6、10−7浓度下的稀释液1 mL于灭菌处理后的培养皿中涂布,25℃的恒温培养3天,统计单个细菌形成的菌落数目,即可计算出样品中的含菌数 [11] ,对比两组样品培养出来的微生物数量差异。如果经消毒后的微生物数量明显低于未经消毒的微生物数量,则说明该方法有效可行。
2) 发酵期间微生物的控制
酒精发酵阶段的微生物污染预防,要从微生物的来源对微生物进行控制,需要对发酵罐以及液料运输管道进行无菌操作 [12] 。
将1)中消毒处理后制成的木瓜汁55~60℃杀菌后分两种处理,处理一是对发酵罐和运输管道彻底消毒之后加入木瓜汁进行发酵,处理二是加入到不消毒处理的发酵罐里面发酵。发酵第四天,上述两组,各取3份样品,每份1 mL,参照1)的方法进行稀释涂布平板,统计菌落数目,对比两组培养出来的微生物数量差异。
3) 储存阶段微生物的控制及其影响因素探究
发酵后期的主要工艺是木瓜酒装瓶,该阶段微生物主要来源于储藏设备及其罐装设备携带的杂菌,需要对酒瓶和木瓜酒的运输管道进行无菌处理,同时对操作人员的双手进行严格消毒 [13] 。
将2)中加入到消毒发酵罐制成的木瓜酒55~60℃杀菌后分两组,一是对酒瓶和运输管道彻底消毒再加入木瓜汁进行瓶储,二是加入到不消毒处理的酒瓶瓶储。各取3份样品,参照1)的方法进行稀释涂布平板,统计菌落数目,对比两组微生物数量的差异。
i) pH对储存阶段微生物的影响
木瓜酒搅拌均匀,平均分成5组,分别调pH为2.5、3.0、3.5、4.0、4.5,密封后在20℃的恒温水浴锅保存5天,分别测定各pH条件下木瓜酒的酒精度、挥发酸和总酸等理化指标,同时以1)的方法计算菌落总数。
ii) 温度对储存阶段微生物的影响
木瓜酒搅拌均匀,平均分成5组,密封后,分别于25℃、30℃、35℃、40℃、45℃恒温水浴锅保存5天,分别测定各温度条件下发酵的木瓜酒的酒精度、挥发酸和总酸等理化指标,同时以1)的方法计算菌落总数。
iii) 二氧化硫浓度对储存阶段微生物的影响
木瓜酒搅拌均匀,平均分成5组,分别加入浓度为20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L的游离硫,密封,在20℃的恒温水浴锅保存5天 [14] [15] ,分别测定各二氧化硫浓度下发酵的木瓜酒的酒精度、挥发酸和总酸等理化指标,同时以1)的方法计算菌落总数。
iv) 正交实验
以单因素实验为基础,挑选出微生物数量控制最好的三个梯度,设计L9(33)正交实验,筛选控制微生物最优的组合(见表2和表3)。
2.4. 指标测定
挥发酸,用水蒸气蒸馏法 [16] 测定;滴定酸,用指示剂法 [16] 测定;总糖,斐林滴定法 [16] 测定;还原糖,用斐林滴定法 [16] 测定;干浸出物,用密度瓶法 [16] 测定;花色苷,用pH示差法 [17] 测定;酒精度,用密度瓶法 [15] 测定。
Table 2. Orthogonal experimental factor level table
表2. 正交实验因素水平表
Table 3. L9(33) orthogonal design table
表3. L9(33)正交设计表
2.5. 统计分析
用office 2019对指标测定数据进行处理,绘制折线图。用E-study进行文献引用。SPSSAU进行正交实验的数据分析,以及方差,均值和拟合度的计算。
3. 结果与分析
3.1. 发酵前段微生物的控制
如图2所示,在三组平行实验中,由于在取样接种的时候未替换移液枪枪头,导致同一组实验中先接种的培养基中微生物数量略高于后接种培养基中微生物的数量,在未消毒处理组中微生物数量高低顺序依次为第2组 = 第3组 > 第1组,数量分别为12、12和10,消毒组中微生物数量高低顺序依次为第2组 > 第3组 > 第1组,微生物数量分别为5、4和3,很明显经过严格消毒处理的这组微生物数量(3个)均远低于未经过消毒处理的微生物数量(11个)。其次,微生物种类也存在一定的差距,经过消毒处理的三个平行实验中微生物种类(1种)都低于未经过消毒处理的微生物种类(4种),在本实验中微生物种类、数量和处理效果呈现出正比例关系,说明对榨汁机和原料的消毒处理可以从源头上很好的控制木瓜汁中的微生物数量。
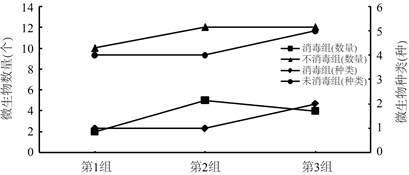
Figure 2. Comparison of microbial population and species before fermentation
图2. 发酵前微生物数量及种类对比
3.2. 酒精发酵过程微生物的控制
如图3所示,在三组平行实验中,由于在取样接种的时候未替换移液枪枪头,导致在同一组实验中先接种的培养基微生物数量略高于后接种的培养基的数量,在未消毒处理组中微生物数量高低顺序依次为第2组 > 第3组 > 第1组,数量分别为905、896和877,消毒组中微生物数量高低顺序依次为第2组 > 第3组 > 第1组,微生物数量分别为213、209和190,对发酵罐进行严格消毒的这组微生物数量(204个)均低于未经过消毒处理的微生物数量(873个)。在微生物种类方面,经过消毒处理租的三个平行实验微生物种类(2种)都明显低于未经过消毒处理的微生物种类(5种),实验中微生物种类、数量和处理效果呈现出正比例关系,说明对发酵罐、运输管道和操作人员双手的消毒处理可以很好的控制发酵液中的微生物数量。
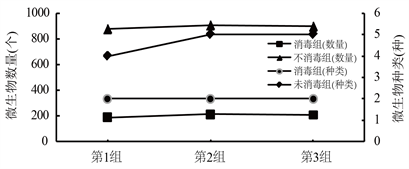
Figure 3. Comparison of microbial numbers and species in fermentation
图3. 发酵中微生物数量和种类的比较
3.3. 木瓜酒储存阶段微生物的控制
如图4所示,在三组平行实验中,由于在取样接种的时候未替换液枪枪头,导致在同一组实验中先接种的培养基微生物数量略高于后接种的培养基的数量。未消毒处理组中的微生物数量第3组 > 第2组 > 第1组,数量分别为563、557和541,消毒组中微生物数量高低顺序依次为第1组 > 第3组 > 第2组,微生物数量为240、236和223,数据表明消毒处理组的微生物数量(233个)明显低于未消毒处理的微生物数量(553个),经过消毒组的三个平行实验微生物种类(2种)都低于未经过消毒处理的微生物种类(4种)。实验数据中,微生物数量、种类和处理效果呈现正比例关系,说明对储存罐以及罐装管道、操作人员双手的消毒处理可以很好的抑制酒液中的微生物数量。
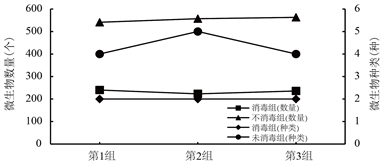
Figure 4. Comparison of the number and species of microorganisms after storage in bottles
图4. 瓶储后微生物数量及种类对比
3.3.1. pH对木瓜酒中微生物的影响
明显,微生物的生长代谢需要适宜的pH环境。低pH是重要的限制因子,pH越小,抑制效果越明显 [9] 。随pH变化,微生物的活性也随之改变。在不同pH环境下,微生物代谢能力不同。表4中,本实验中微生物数量随pH的变化呈正比例关系,pH值在2.5、3.0和3.5条件下酒中的微生物数量相对较低,且残糖含量比其他两组高,挥发酸含量相对较低,酒精度含量也相对较低,说明在pH < 3.5条件下微生物的生长代谢受到了抑制,即该环境不利于微生物的生长发育。
Table 4. Index parameters at different pH
表4. 不同pH储存下各指标参数
3.3.2. 温度对木瓜酒中微生物的影响
低温主要影响酒的外观,高温则影响酒的感官品质 [10] 。表5中,在不同温度的储存实验中,菌落数呈现先上升再下降的趋势,在30℃时最大,然后开始下降,且酒精度保持相对温度,但是由于40℃和45℃木瓜酒颜色出现不稳定现象,同时出现严重的酸败味,严重的损害了木瓜酒的品质。在25℃、30℃、35℃三组中,各项指标出现轻微的上下波动,保存相对稳定,味道方面没有太大的变化,有利于瓶储中酒的稳定。
Table 5. Index parameters under different storage temperatures
表5. 不同温度储存下各指标参数
3.3.3. 二氧化硫浓度对木瓜酒中微生物的影响
游离硫有抑菌的功能,SO2的增加会抑制菌株的生长 [9] ,在木瓜酒中(见表6),二氧化硫对酒中的微生物有抑制作用,微生物数量随二氧化硫的增加而变低,当调节二氧化硫的浓度 > 30 mg/L时,微生物数量明显降低,同时酒中残糖含量较高,挥发酸含量相对较低,酒精度保持相对稳定,还有利于酒中滴定酸的降低,说明当酒中的游离硫含量 > 30 mg/L的时候,木瓜酒中的微生物正常代谢受到抑制。
Table 6. Effects of different SO2 concentrations on lactic acid bacteria activity
表6. 不同SO2浓度对乳酸菌活性影响
3.3.4. 正交实验结果分析
在正交实验中,25℃下的酒精度保持相对稳定。由表7知,温度升高会导致酒精度降低,微生物数量在第7组中最高,其次是第4组,第2组的微生物数量最少,各组挥发酸的含量变化差异不大,第2组中的残糖最高,同时25℃下滴定酸数值稳定,在第4组和第7组中均出现下降趋势,在第7组中残糖降到最低,说明该组中微生物活性较强。通过方差分析,由表8可以看出,三因素对微生物影响显著,二氧化硫浓度、温度和pH的F值依次为3.802、4.317、10.125,对微生物影响程度依次是SO2浓度 > 温度 > pH,从理论上最佳组合为第2组(A1B2C3)即25℃、50 mg/L、pH 3.5。
Table 7. Results of orthogonal experiment
表7. 正交实验结果
Table 8. Analysis of variance results
表8. 方差分析结果
注:**表示差异极显著(p < 0.01),*表示差异显著。
3.4. 三个阶段中微生物数量及种类分析
如图5,在发酵前段,酒精发酵中以及木瓜酒储存三个阶段中,各阶段各组都表现出消毒处理组的微生物数量和种类明显低于未消毒处理组,微生物种类和数量与处理效果呈现出正比例关系,说明对原料、实验设备,发酵容器、运输管道以及存储容器等实验器材的消毒处理可以在一定程度上控制微生物来源,有效抑制酿造过程中微生物的滋生,达到有效控制微生物的目的。
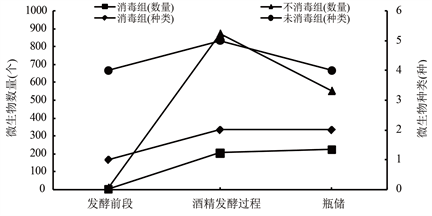
Figure 5. Comparison of the average number of microorganisms and the average species of the three stages
图5. 三个阶段微生物数量平均值及种类平均值对比
4. 结论与讨论
本实验以木瓜为原料,在木瓜酒的酿造过程中,对酿造过程中所用的设备进行不同的处理,研究木瓜汁和木瓜酒中的数量以及种类;在以无菌处理控制微生物实验中,同时研究pH、温度和二氧化硫浓度三个因素对微生物的影响,再做正交实验,确定最好的抑制方案。
实验表明,消毒虽然不能从根源上彻底阻断消除微生物,但是在实际生产中对微生物控制有着明显的效果,正交实验证明,抑制木瓜酒微生物最佳的条件组合为25℃,50 mg/L SO2和pH 3.5。
消毒处理对微生物数量的影响中,各阶段各组乃至各平行实验,均表现出严格的消毒处理可以极大程度上减少酒中微生物的数量,对酒中微生物的控制有着重要的意义。
在三个因素对储存阶段微生物数量影响中,随pH值的升高,导致对微生物的抑制效果变差,微生物数量也随之上升,从而导致酒中的残糖降低,挥发升高,说明酒中微生物的活性上升。
随二氧化硫的浓度升高,同时由于酒精与二氧化硫的相互作用,对微生物的抑制效果也呈现上升的趋势,微生物数量逐步下降,酒中的残糖含量相对较高,挥发酸含量相对较低,酒精度保持相对稳定,说明在二氧化硫浓度升高的同时,酒中微生物的活性下降,减少了微生物对酒中组分的分解代谢。
在温度的梯度实验中,微生物数量呈现出先上升后下降的趋势,在30℃达到顶峰,后出现下降趋势,虽然温度 > 35℃,会抑制部分微生物生长,从而导致酒中微生物的数量降低,但是>35℃时不利于木瓜酒稳定,同时产酸严重,给酒体带来严重的酸败味,所以该条件不适合木瓜酒保存。
基金项目
本研究受“云南省牟定云牛生物科技有限公司南立军专家基层科研工作站”项目支持。
文章引用
南立军,周 慧,刘芸荷,王春艳,赵新云,詹国丽,刘丽媛,何坤祖. 木瓜酒中微生物控制的研究
Study on Microbial Control in Papaya Wine[J]. 食品与营养科学, 2024, 13(01): 58-68. https://doi.org/10.12677/HJFNS.2024.131009
参考文献
- 1. 苗旺, 吴双麒, 孔凡春. 食品加工环境中微生物污染分析及控制措施[J]. 肉类工业, 2022(4): 40-45.
- 2. 王岚, 龙智钢, 刘建琪, 等. 湖南省食品微生物污染状况分析[J]. 中国卫生检验杂志, 2005(12): 1489-1491.
- 3. 李白玉. 即食食品微生物卫生检测研究[J]. 中国食品, 2022(17): 151-153.
- 4. 罗文静, 李燮昕, 张羽晨, 等. 酸木瓜资源利用及加工技术的研究进展[J]. 新农业, 2018(17): 35-39.
- 5. 姜文广, 赵虎, 吴训仑, 等. 葡萄酒微生物污染形成的不良风味物质研究进展[J]. 中外葡萄与葡萄酒, 2021(2): 46-53.
- 6. 张霞. 酿造车间的纯生啤酒微生物管理[J]. 啤酒科技, 2014(5): 55-57.
- 7. 陶忠良. 黄酒酿造过程中微生物污染控制[J]. 中外食品工业(下半月), 2014(1): 9+11.
- 8. 陈敏, 刘新环, 刘冬, 等. 果酒的病害与败坏的原因及其防治方法[J]. 酿酒科技, 2003(3): 75-76.
- 9. 张浩, 莫海珍, 李华. 酒精、SO2和pH值对酒类酒球菌生长特性影响[J]. 中国酿造, 2006(5): 38-40.
- 10. 张琴, 兰余, 曹晓念, 等. 不同温度条件对养生酒货架期质量稳定性的影响研究[J]. 酿酒, 2021, 48(2): 38-42.
- 11. 史迪, 党娜, 武岳, 等. 阿尤恩地区自然发酵牛乳中乳酸菌分离鉴定及多样性研究[J]. 中国乳品工业, 2021, 49(3): 4-9, 41.
- 12. 孙勇, 张芝凤. 加强奶车奶槽清洗, 防止微生物污染[J]. 中国奶牛, 2006(7): 46-47.
- 13. 陈俊芳. 纯生啤酒生产过程中的微生物控制[J]. 啤酒科技, 2013(12): 40-42+34.
- 14. 胡名志. 论述葡萄酒中的二氧化硫[J]. 酿酒, 2016, 43(3): 29-31.
- 15. 张亚洲, 李喜宏, 刘霞, 潘艳芳, 王威. 温度及SO2处理对采后葡萄灰霉菌抑制作用研究[J]. 中国果树, 2016(1): 42-46.
- 16. 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会. GB/T 15038-2006 葡萄酒、果酒通用分析方法[S]. 北京: 中国标准出版社, 2006.
- 17. 孙婧超, 刘玉田, 赵玉平, 等. ph示差法测定蓝莓酒中花色苷条件的优化[J]. 中国酿造, 2011(11): 171-174.
NOTES
*第一作者。
#通讯作者。
