Advances in Environmental Protection
Vol.
10
No.
03
(
2020
), Article ID:
35880
,
7
pages
10.12677/AEP.2020.103041
Retrieving Zinc from Iron-Zinc Slag by EDTA Leaching Method
Maixin Yu1, Hui Luo2, Langbo Yi1,3*
1College of Biology and Environmental Sciences, Jishou University, Jishou Hunan
2College of Chemistry and Chemical Engineering, Jishou University, Jishou Hunan
3Hunan Provincial Engineering Laboratory of Integrated Control and Remediation of Heavy Metal Pollution from Mn-Zn Mining, Jishou Hunan

Received: May 3rd, 2020; accepted: May 25th, 2020; published: Jun. 1st, 2020

ABSTRACT
In order to investigate the leaching efficiency of zinc from iron-zinc slag via EDTA method, the effects of initial concentration of ethylenediaminetetraacetic acid (EDTA), temperature , liquid-solid ratio and reaction time on the leaching rate and selectivity in process of leaching zinc from iron-zinc slag were studied. The results showed that EDTA method exhibited good leaching efficiency and selectivity of zinc, zinc was leached from iron-zinc slag preferentially. When the total EDTA concentration was 0.4 mol/L, the leaching temperature was 20˚C, the ratio of leaching agent volume to zinc dust mass was 6 L/kg and the leaching time was 2 h, the extraction rate of zinc was 99.77%.
Keywords:Iron-Zinc Slag, Ethylenediaminetetraacetic Acid, Leaching, Recovery of Zinc

EDTA浸取法从冶锌铁渣中回收锌
余迈新1,罗晖2,易浪波1,3*
1吉首大学资环学院,湖南 吉首
2吉首大学化学化工学院,湖南 吉首
3锰锌矿业重金属污染综合防治技术湖南省工程实验室,湖南 吉首
收稿日期:2020年5月3日;录用日期:2020年5月25日;发布日期:2020年6月1日

摘 要
为了对冶锌铁渣中锌回收利用,以EDTA为浸取剂,对冶锌铁渣进行浸取实验,考察了EDTA浓度、温度、固液比及反应时间对锌浸出效果及选择性的影响。结果表明:EDTA浸取时对锌有较好的浸出率和选择性,能优先浸取锌。EDTA的浓度和液固比对浸取影响高度显著,浸取时间对结果有一定的影响,浸取温度对结果影响较小。在EDTA浓度为0.4 mol/L,浸出温度为20℃,固液比为6 L/kg的条件下反应浸取2 h,锌的浸出率达99.77%。
关键词 :冶锌铁渣,EDTA,浸取,锌的回收

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
我国锌资源丰富,多年来锌的产量一直位居世界首位。我国电解锌生产多以闪锌矿为原料,因矿中所含铁在酸解浸取时也会溶出进入溶液中,在后序除铁工序,经氧化中和沉淀去除 [1]。目前我国主流的除铁方法主要有黄钾铁矾法、针铁矿法两种 [2],无论哪种方法,每吨产品将产生铁渣0.3~0.6吨,因铁渣的比表面积较大,表面会吸附硫酸锌,因限于水平衡,吸附态硫酸锌无法全部洗去,另外,在调pH时也会产生枸溶性的碱式硫酸锌 [3],经检测,铁渣中水溶性锌和枸溶锌约10%~15%,还有少量镉、铅和铜等有害元素。以前,铁渣并不单独分离出来,这就使得整个浸出渣按照我国标准HJT299-2007对铁渣进行浸出,按照GB5085.3-2007进行鉴别,都属于危险固废。随着环保要求的提高,开始把铁渣分离出来,外卖给火法提锌企业,但现在火法提锌企业已被大量关停,加上危废跨境运输从严管理,铁渣已成制约冶锌企业的重要问题。
含锌废渣资源化回收技术已有一些报导,如王福生等 [4] 以及姚芝茂等 [5] 进行了锌回收分析与评价,闵小波等 [6] 的以硫酸作为浸出剂,以硫酸肼作为还原剂的还原酸浸法,可需要还原剂,成本较高;张亚平等 [7] 的以氢氧化钠溶液作为浸出剂,以铁粉为还原剂的还原碱浸法,不仅需还原剂,还需要在高压下进行,成本亦很高;王江伟等 [8] 采用添加碳酸氢铵的氨水作为浸取剂的氨浸取法,浸出选择性好浸出率高,但需要配套活性氧化锌生产装置,适应性不好,同时氨易外泄影响生产环境。本文以湘西泸溪县某冶锌企业的铁渣为原料,采用乙二胺四乙酸盐(EDTA)浸取锌,并用硫化氢沉淀锌,实现EDTA循环利用,利用冶锌企业自有的阳极液酸解硫化锌使硫化氢循环,从而实现废物的二次利用。
2. 实验部分
2.1. 实验材料与仪器
实验材料与试剂:含锌铁渣来源于湘西自治州泸溪县某冶锌厂,呈棕褐色块状,含水率为36.7%,干基含锌13.61%。将铁渣原料置于鼓风干燥箱中于105℃下烘干至恒重,经研磨粉碎过100目后,存放于干燥器内备用;闪锌矿、熟石灰、电解阳极液(含硫酸150 g/L)取自同一企业。乙二胺四乙酸二钠(EDTA二钠盐)、乙酸钠、冰乙酸、二甲酚橙、盐酸、硝酸等试剂均为分析纯。
实验仪器:D/max-γA型X-射线衍射仪(日本Rigaku公司);iCAP6300型电感耦合等离子体发射光谱仪(ThermoFisher Scientific, USA);S2400-N型热重-差热分析仪(美国Mettler-Toledo公司);GZX-9070 MBE型数显鼓风干燥箱(上海博讯实业有限公司);NHWY-100D型台式恒温摇床(常州诺基仪器有限公司);FA2104N型电子分析天平(上海民桥精密科学仪器有限公司);PHS-3C型pH计(上海精密仪器有限公司)。
2.2. 实验方法
本文采用EDTA为浸取剂对冶锌铁渣中锌进行选择性浸取,简称EDTA浸取法。辅以硫化氢沉淀锌使EDTA循环和酸解回收锌及使硫化氢循环,形成从铁渣中回收锌的工艺,流程见图1。主要工序有三道,即浸取、沉淀和酸解,EDTA水溶液用熟石灰调pH后加入铁渣,进行选择性浸取,这道工序是整个工艺的关键。第二道是用硫化氢沉淀,让锌转化为硫化锌,使EDTA游历出来进而循环使用。第三道是用含酸的阳极液分解硫化锌,生成的硫化氢再用于沉淀锌。
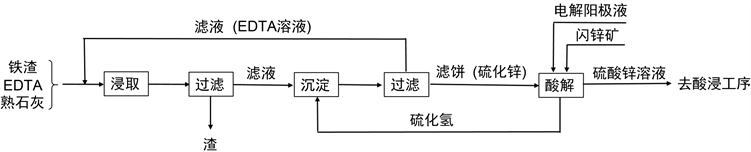
Figure 1. Technological process of recovering zinc from iron slag
图1. 冶锌铁渣回收锌的工艺流程
2.2.1. EDTA浓度对浸取率及选择性的影响
取250 mL的锥形瓶,分别加入0.1、0.2、0.3和0.4 mol/L的EDTA二钠盐水溶液120 mL,用熟石灰调pH值至9,并在另一个250 mL的锥形瓶中加入120 mL水做对照,再分别放入20 g干燥后的铁渣原料粉末,置于温度为40℃的恒温摇床里反应浸取2 h。浸取完成后过滤并用60 mL去离子水分3次洗涤,合并滤液和洗涤液,并量取体积。取样测定其中锌、钙和铁元素的含量。并对浸取前后的渣用XRD扫描,根据MDI Jade6.5中的标准卡片对照进行物相分析,采用S3400-N型扫描电子显微镜(日本日立高新技术公司)进行外形分析比较。
2.2.2. 浸取液初始pH对浸出率及选择性的影响
取多份120 mL浓度为0.4 mol/L的EDTA二钠盐水溶液,分别置于250 mL的锥形瓶中,然后用熟石灰分别调pH为5、6、7、8、9和10。再加入20 g干燥后的铁渣原料粉末,置于温度为40℃的恒温摇床里反应浸取2 h。浸取完成后过滤并用60 mL去离子水分3次洗涤,合并滤液和洗涤液,并量取体积,然后取样测定其中锌、钙和铁元素的含量。
2.2.3. 正交实验优化实验
根据经验与初步实验得知,影响浸出率的主要因素有浸出温度、浸出时间、液固比、浸出剂浓度等,因此分别以温度(A)、时间(B)、液固比(C)以及EDTA浓度(D)为考察因素,每个因素各选择3个考察水平,每份试验铁渣原料用量为20 g,浸取液调pH到9,选用L9(34)正交表安排试验,因素水平见表1。浸取完成后过滤并用60 mL去离子水分3次洗涤,合并滤液和洗涤液,并量取体积,取样测定其中锌的含量,计算锌的浸出率(以质量百分比表示)。
Table 1. Factors of the test for leaching zinc from iron-zinc slag by orthogonal experiment
表1. 正交实验浸取铁渣中锌因素水平表
2.2.4. EDTA与H2S的循环实验
取浸出实验所得浸出液100 mL放入250 mL的锥形瓶中,再加适量硫化锌(闪锌矿或实验所产硫化锌),放入具塞锥形瓶中,加入电解阳极液,并鼓入空气,产生的硫化氢引入盛有浸取液的锥形瓶中沉淀锌,当锌沉淀完成后停止,过滤,滤渣为硫化锌,用于下次产生硫化氢,滤液为EDTA溶液,循环用于浸取。
3. 结果与讨论
3.1. EDTA浓度对浸取率及选择性的影响
从原铁渣、水浸铁渣及EDTA浸取后铁渣的XRD图谱(图2)可见,铁渣中锌是以硫酸锌和碱式硫酸锌两种形式存在,水浸时只能溶出硫酸锌,而不能使碱式硫酸锌浸出,而用EDTA浸取,可把锌全部浸出。EDTA的配合能力很强,能与许多金属离子配合,铁渣中含量大的金属主要是锌、铁和钙,在考虑选择性时只需考察这三种离子。
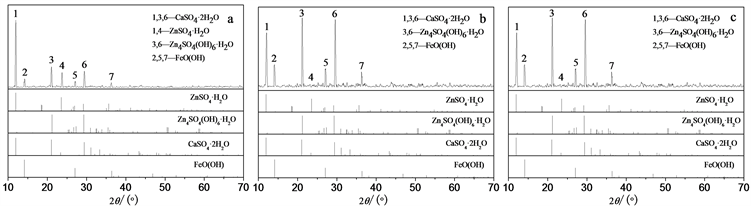 注:a:原铁渣;b:水浸铁渣;c:EDTA浸取铁渣
注:a:原铁渣;b:水浸铁渣;c:EDTA浸取铁渣
Figure 2. XRD patterns of iron-zinc slag leached by different methods
图2. 铁渣浸取前后的XRD图谱
不同EDTA浓度浸取时锌、铁、钙离子浸出量见表2。从表2可见,当EDTA浓度较小时,只有锌浸出,铁和钙基本不进入液相,当EDTA达0.4 mol/L时,锌几乎全部浸出,且有铁浸出而钙几乎不进入液相。从铁渣含锌13.61%可知,20 g铁渣中含锌0.042 mol,可见,EDTA浸取时有较好的选择性,优先选择浸出锌,只有当EDTA与锌配位过量后,才会浸出铁。
Table 2. Effect of EDTA concentration on the extraction amount of zinc, iron and calcium
表2. EDTA浓度对锌、铁、钙离子浸出量的影响
从铁渣浸取前、水浸后以及EDTA充分浸取后的铁渣化学组成见表3。经EDTA浸取后,铁渣中Zn的含量仅为0.075% (质量比),绝大部分Zn被浸出进入液相,Fe仅有少量浸出,而钙几乎不被浸出。
Table 3. Main chemical compositions of iron slag by pre/post-leaching
表3. 铁渣浸取前后主要元素的质量分数(%)
浸取前后的扫描电镜结果如图3所示。从图3可见,EDTA浸取时不破坏铁渣的晶型结构,有利于过滤。

Figure 3. The scanning electron micrographs of iron slag (a) and leaching residue (b)
图3. 原料铁渣(a)与EDTA浸出渣(b)扫描电镜图
3.2. 浸取液初始pH对浸出率及选择性的影响
浸取液初始pH对锌浸出率及选择性的影响见表4,从表4可见,不同初始pH条件下锌基本都能完全浸出,不随pH而变;而随着pH值的增大,铁的浸出量逐渐减小,pH到9时钙开始有浸出,之后钙讯速增大而铁不再进入液相。这与EDTA和金属离子的配位反应有关 [9],可认为EDTA首先与水溶性锌反应,反应式(以Y代表EDTA):
(1)
生成的氢离子再与碱式硫酸锌及羟基氧化铁反应,使它们进入溶液,进而与EDTA配位,反应式:
(2)
(3)
(4)
因氢氧化铁的溶度积远小于氢氧化锌的溶度积,故生成的氢离子会优先与Zn4SO4(OH)6反应,只有当Zn4SO4(OH)6反应完了后才会与FeO(OH)反应。而EDTA在不同的pH时主要存在形式不同,pH为5时,主要存在形式为H2Y2−,随着pH的增大,主要存在形式由H2Y2−逐渐转变为HY3−,pH到9时HY3−比例达最大,再增大pH值,则开始转变为Y4−。可见,随着初始pH值的增大,反应中生成的氢离子会减少,当少到生成的氢离子不足以完全溶解Zn4SO4(OH)6时EDTA也可直接与Zn4SO4(OH)6反应。此时,与锌配位后过量的EDTA也会与其它金属离子配位,因氢氧化铁的溶度积(4 × 10−38)远远小于硫酸钙的溶度积(9.1 × 10−6),在碱性时过量的EDTA只会与硫酸钙反应而使钙进入溶液中,而不会浸出铁,这就是pH高于9后,钙能进入溶液而铁不再溶出的原因。从反应式(1)和(2)可见,能使钙溶出的浸取液初始pH值与渣中水溶性锌与碱式硫酸锌的比例有关,因此,适合的浸取液初始pH值决定于原料,此实验适合的初始pH为9到10。
Table 4. Effect of pH on leaching rate and selectivity of zinc from iron slag
表4. 浸取液初始pH对浸出率及选择性的影响
3.3. 正交实验优化
以铁渣中锌的提取率为指标,用直观分析法对试验结果进行分析,实验结果及数据处理见表5。由表5可知,各因素对结果影响的显著性次序为D > C > B > A,可见,EDTA浓度和液固比对浸取有显著影响,生产中需严格控制。最优浸取条件为:温度60℃,固液比6 L/kg,EDTA浓度为0.4 mol/L,浸取时间2 h。最优条件在正交表中没有出现,用最优条件对铁渣进行浸取,锌的浸出率为99.81%,与正交表中出现的在温度20℃,固液比6 L/kg,EDTA浓度为0.4 mol/L,浸取时间2 h条件下的结果(99.77%)相比提高不明显,而提高温度不仅增加设备还要消耗能源,故而在实际生产中可采用常温浸取。
Table 5. Effect of different leaching conditions on zinc extraction by EDTA method
表5. 不同条件对EDTA浸锌率的影响
3.4. EDTA与H2S的循环
实验表明,浸出液中通入硫化氢,可很好的使锌沉淀,见反应式:
(5)
这也可根据质量作用定律 [10] 计算得出,由文献 [11] 查得氢硫酸的离解常数、EDTA的离解常数、EDTA与锌的稳定常数、硫化锌溶度积,代入热力学计算式有:
可见,平衡常数较大,可较好的使锌沉淀为硫化锌。通过用阳极液酸解硫化锌,产生的硫化氢沉淀锌生成硫化锌,从而实现EDTA的循环和硫化氢的循环。
4. 结论
EDTA是很好的选择性浸取锌的浸取剂,浸取时要根据原料中水溶性锌和酸溶性锌的比例调节浸取液的初始pH值。通过正交实验优化显示EDTA的浓度和液固比对浸取影响高度显著,浸取时间对结果有一定的影响,浸取温度对结果影响较小,研究所得最佳浸取条件为EDTA浓度为0.4 mol/L、温度为20℃,固液比6 L/kg的条件下反应2 h,此时,锌的浸出率为99.77%。
基金项目
锰锌矿业重金属污染综合防治技术湖南省工程实验室开放项目(MXKF201906)。
文章引用
余迈新,罗 晖,易浪波. EDTA浸取法从冶锌铁渣中回收锌
Retrieving Zinc from Iron-Zinc Slag by EDTA Leaching Method[J]. 环境保护前沿, 2020, 10(03): 355-361. https://doi.org/10.12677/AEP.2020.103041
参考文献
- 1. 魏昶, 李存兄. 锌提取冶金学[M]. 北京: 冶金工业出版社, 2013: 8.
- 2. 邹晓勇, 彭清静, 吴贤文, 等. 锌产业技术及应用[M]. 北京: 化学工业出版社, 2019: 7.
- 3. Masambi, S., Dorfling, C. and Bradshaw, S. (2016) Comparing Iron Phosphate and Hematite Precipitation Processes for Iron Removal from Chloride Leach Solutions. Mineral Engi-neering, 98, 14-21. https://doi.org/10.1016/j.mineng.2016.07.001
- 4. 王福生, 车欣. 浸锌渣综合利用现状及发展趋势[J]. 天津化工, 2010, 24(3): 1-3.
- 5. 姚芝茂, 赵丽娜, 徐成. 锌治炼工业有价金属回收潜力与现状分析[J]. 中国有色冶金, 2011(1): 49-54.
- 6. 闵小波, 张建强, 张纯, 等. 锌冶炼中浸渣锌还原浸出行为研究[J]. 有色金属科学与工程, 2015, 6(5): 1-6.
- 7. 张亚平. 从浸锌渣还原铁粉中回收镓锗的工艺及机理[D]: [硕士学位论文]. 长沙: 中南大学, 2003.
- 8. 王江伟, 彭清静. 氨浸法从冶锌铁渣中回收锌制备活性氧化锌[J]. 环境工程, 2019, 37(9): 165-170.
- 9. 武汉大学编写组. 分析化学第二版[M]. 北京: 高等教育出版社, 1982: 10.
- 10. 武汉大学编写组. 无机化学第二版[M]. 北京: 高等教育出版社, 1983: 4.
- 11. 张锡瑜. 简明分析化学手册[M]. 北京: 北京大学出版社, 1981: 10.
NOTES
*通讯作者。
