Hans Journal of Agricultural Sciences
Vol.08 No.03(2018), Article ID:24200,9
pages
10.12677/HJAS.2018.83033
Effect of Light Environment on Plant Metabolites
Zhisen Zhang1, Jinghong Xu2, Xinyu Zhang1, Tong Wang1, Wen Liu1,2
1School of Physical Sciences, University of Science and Technology of China, Hefei Anhui
2Institute of Advanced Technology, University of Science and Technology of China, Hefei Anhui
Received: Mar. 9th, 2018; accepted: Mar. 20th, 2018; published: Mar. 27th, 2018

ABSTRACT
Light stimulation significantly enhances or inhibits the production of specific biomolecules in plants, which is of great significance to human understanding of the effects of light on plants. This article reviews the recent representative work in this area which is mainly related to biomolecules such as antioxidants, vitamins, sugars and pigments, and their response to different lighting conditions is studied. Although the mechanism has not been studied clearly, as long as its reproducibility is basically guaranteed, light stimulation can be used to promote the synthesis of some of the materials. These results still have reference value for actual production.
Keywords:Lighting, Antioxidant Ability, Color Development, Vitamins, Edible Quality
光环境对植物次级代谢产物的影响
张智森1,徐景宏2,张昕昱1,王通1,刘文1,2
1中国科学技术大学物理学院,安徽 合肥
2中国科学技术大学先进技术研究院,安徽 合肥
收稿日期:2018年3月9日;录用日期:2018年3月20日;发布日期:2018年3月27日

摘 要
光刺激可以显著促进或抑制植物中特定生物分子的合成,这对于人类认识光照对于植物的影响有重要的意义。本文综述了近期该领域的相关代表性工作,主要涉及到的几种生物分子有抗氧化剂、维生素、糖类以及色素,并对它们在不同光照条件下的响应进行了讨论。虽然一些机理尚未研究清楚,但只要其可重复性能得到基本保证,利用光刺激促进一些物质的合成,这些成果对于实际生产仍然具有参考价值。
关键词 :光照,抗氧化活性,显色,维生素,食用品质

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
植物的生长需要合适的环境,而环境也直接影响着植物的生长。植物的生长是依靠光合作用来提供能量的,所以光照条件的不同会直接影响到植物的形态 [1] 。究其本源是因为光照条件的不同使得植物的代谢产物产生了分布结构的变化,造成有的物质分泌增加,有的则减少。所以研究光照条件对植物代谢产物的影响对于人们理解植物的生长就变得至关重要了。
随着近些年植物工厂相关技术地开发与应用,人工光源植物工厂(Plant factory with artificial lighting, PFAL)使我们可以精确地控制作用于植物的光照条件 [2] ,以及其他环境变量,并允许我们进行严格的定量研究。通过研究发现,提高发光二极管(Light Emitting Diode, LED)的蓝/红光比值能够促进植物中抗氧化剂的合成,例如,红叶生菜(Cichorium intybus Linn.)中的抗坏血酸浓度会在蓝色LED光的照射下合成增大;不同的光照条件还会影响蔬菜内的糖分含量 [3] ,进而影响食用的口感 [4] ;蔬菜的颜色也会受到光照条件的显著影响。近年来亦有书籍对此类研究展开了综述 [5] 。
本文较详细全面地介绍了近期有关光刺激对植物代谢过程的影响的研究,这些研究成果,可能帮助我们在实际生产中,得到营养更丰富、口感更佳的食物。
2. 抗氧化活性
人们对于植物体内的抗氧化物质一直都比较关注,这类物质的主要功能性成分是总酚类物质。目前已经有了很多关于光质与光强对于植物中总酚类物质的影响的研究。其中有许多研究涉及由LED发出的红光、蓝光对于总酚类物质的影响,而对于黄色、绿色光源的研究相对很少。迄今为止,这类实验已经涉及了植物中的新芽(sprout)、幼叶(baby leaf)、嫩青(Microgreen)以及生菜(leafy lettuce)。
2012年Samuoliene等人对幼叶在不同照明条件下体内总酚类物质的浓度情况进行了研究 [6] 。该实验研究了红叶“Multired 4”,绿叶“Multigreen 3”以及浅绿叶“Multiblond 2”三种生菜幼叶,分别处于太阳光下育苗,并在高压钠灯(High-pressure sodium lamp,HPS)和辅助LED照明光源下的情况。其中辅助LED光源使用了455 nm (蓝光),470 nm (蓝光)、505 nm (蓝光)、590 nm (绿光)四种波长,其光合光量子通量密度(Photosynthetic photon flux density, PPFD)为30 μmol∙m−2∙s−1,而HPS的PPFD则为170 μmol∙m−2∙s−1。在HPS与LED照明下,均采用每日16小时的光期及每日8小时的暗期。结果表明生菜幼叶的抗氧化活性由其叶片品种和光质决定。其中红叶“Multired 4”和绿叶“Multigreen 3”中的总酚浓度在590 nm和470 nm的光照下均显著下降,浅绿叶“Multiblond 2”中的该值却在590 nm波长下升高。虽然,在所有品种的生菜幼叶当中,1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl, DPPH)自由基的清除效率均比对照组高,但每个品种在不同波长照明下的表现却有差别。在辅助LED的470 nm光照下的红叶生菜幼叶、455 nm光照下的绿幼叶、505 nm下的浅绿幼叶中的DPPH自由基清除效率均有显著提升。同时也可以看到红叶生菜幼叶中的花青素浓度在455 nm以及470 nm的辅助LED光照下显著升高,而在505 nm和590 nm的光照下降低。
2010年Johkan等人也做过类似的研究,他研究了光谱对红叶生菜幼叶“Banchu Red Fire”中的化合物的合成的影响 [7] 。他们在太阳光及辅助的荧光灯(Fluorescent light, FL)照射下培育幼苗,并研究了光质对植物育秧期的影响。生菜的种子在FL的照射下发芽并生长十天。播种后第10天(Days after sowing, DAS),育苗期的幼苗被分别移栽到蓝光(468 nm),红光(660 nm)和红蓝光(467 nm和655 nm)照射的环境中。播种后17天,幼苗再被移栽到有太阳光照射和辅助FL (1600到1900 h)照射的温室中。在播种后第17天,即育苗期的最后一天,检测发现,在不同光质照射下,幼苗中的总酚、绿原酸以及总抗氧化系统(Total antioxidant system, TAS)的水平已有显著差异,以总酚为例,对照组/蓝/红/红蓝光下测得的相对数值分别为75.7/118.7/47.0/161.6。然而,这些差异却没能维持到育苗期之后。
2013年Son and Oh等人研究发现不同的红蓝光比率会影响生菜幼苗的形态、生长特性以及抗氧化酚类物质的水平 [8] 。其中红叶(Sunmang)和绿叶(Grand Rapid TBR)两种生菜在FL与HPS的共同照射下出芽并生长18天。之后幼苗被移栽到六组红(R)蓝(B)光比率不同的实验组(0B/100R,13B/87R,26B/74R,35B/65R,47B/53R,以及59B/41R),PPFD均为171 μmol∙m−2∙s−1。生长四周之后,再测定它们的抗氧化活性。在47B/53R的光照组中,红叶生菜的总酚浓度显著升高至对照组(0B/100R)的1.4至2.4倍。在26B和59B的两组绿叶生菜中,总酚浓度则分别提高到对照组的2.2和2.7倍。因此,在栽培生菜时,酚类物质聚集程度会随蓝光的增加而升高,调节LED的红蓝光比例就能显著改变总酚的含量。文章同时研究发现抗氧化活性对不同光质的反应与总酚浓度一致。在红叶生菜中,提高LED的蓝/红光比值能够促进抗氧化剂的合成,并在47B/53R时出现最大值。在富含蓝光的照明条件下,绿叶生菜也展现了很高的抗氧化活性。然而,当蓝光比例超过26%时,不再能观察到光质对绿叶生菜的抗氧化活性的显著影响。对比两种生菜,在所有情况的光质作用下,红叶生菜的抗氧化剂浓度均高于绿叶生菜,这体现了不同品种的差异性。
除蓝光和红光之外,也有关于使用黄光(596 nm)的报道。例如,Urbonaviciute等人在2009年研究了在HPS和黄色脉冲LED的组合照明下幼芽生长中抗氧化剂的合成水平。黄光LED以2.9 Hz的频闪(250 ms“开”;100 ms“关”)提供35 μmol∙m−2∙s−1的PPFD,强度接近PPFD总量的一半 [9] 。研究得到,在小萝卜(Raphanus sativus L.)的幼芽中,自由基结合的活性在黄色脉冲LED照射下提高了1.5倍。同样的变化趋势也明显存在于酚类物质中,Urbonaviciute等人假定这些变化是光诱导损伤的结果,即为了对抗光氧化作用的损害而提高自然防御机制中的抗氧化活性。在小萝卜幼芽中能够观察到,黄光照射下酚类化合物水平约增加30%。在幼叶中,可以观察到在光合成期内新的色素的合成以及迅速的适应过程,包括酚类物质的合成,这很有可能是光作用下的生理反应。
除了叶菜之外,其他植物中的抗氧化剂生物合成与光质的关系的研究也见诸报道。例如,有研究人员在红、绿、蓝、白光LED以及荧光灯的照射下培育樱桃番茄(Lycopersicon esculentum Mill.)的幼苗,并对抗氧化酚类物质进行分析 [10] [11] 。在蓝光下,幼苗中的总酚类浓度,类黄酮浓度以及抗氧化剂水平显著高于其它光质的实验组(红光、绿光和荧光灯)。并且,相较于绿光组与对照组,红光组的上述实验参数相更高。
2010年刘晓英等人基于新型LED光源研究了不同光质弱光对樱桃番茄植株形态和光合性能的影响 [11] 。作者在2008年7月25日将刚出苗的幼苗分别置于FL(对照,CK)和由不同光质的LED组合的6个光处理下,分别为:红蓝黄绿紫复合光(Z)、红蓝黄紫复合光(RBYP)、红蓝绿复合光(RBG)、红蓝黄复合光(RBY)、红蓝紫复合光(RBP)与红蓝复合光(RB)。LED光源光通量密度均设为50 μmol∙m−2∙s−1,光周期为昼/夜14 h/10 h。结果显示:除红蓝黄紫复合光(RBYP)和红蓝紫复合光(RBP)处理外,所有处理的光合色素含量都比RB处理高,并以Z处理光合色素含量最高。
此外,Kim等人还通过分析总酚类物质的浓度、抗氧化酶的活性研究了光质(白、蓝、红、绿光LED)对番茄(Lycopersicon esculentum Mill.)的影响 [12] 。当番茄幼苗生长在蓝光之下时,叶与茎中的总酚类物质浓度明显高于白光实验组,其中茎中为白光实验组的1.2倍,叶中则为1.3倍。然而,绿光与红光组幼苗叶中的总酚类物质浓度与白光组相比则未见明显差异。
3. 维生素
关于维生素,目前已见到有关抗环血酸,类胡萝卜素,a-生育酚以及麦角固醇的报道。Samuoliene等人利用生菜幼叶(红叶“Multired 4”,绿叶“Multigreen 3”以及浅绿叶“Multiblond 2)在辅助LED光源(455 nm, 470 nm, 505 nm, and 530 nm, 30 μmol∙m−2∙s−1 PPFD)及HPS(170 μmol∙m−2∙s−1 PPFD)的照射下做了相关实验 [6] 。结果,红叶生菜中的抗坏血酸浓度在蓝色LED光的处理下分别增加了约2倍与1.5倍。
此外,他们还研究了嫩青生菜中的维生素在光照刺激下的变化 [13] 。嫩青生菜(甘蓝(Brassica oleracea var. Gongylodes, “Delicacy Purple”)、芥菜(Brassica juncea L, “Red Lion”)、红白菜(Brassica chinensis, “Rubi F1”)以及塌棵菜(Brassica rapa var. Rosularis))在五种强度(545,440,330,220,以及110 μmol∙m−2∙s−1 PPFD)及四种光质(455 nm,638 nm,660 nm,以及735 nm)的混合光下生长。在低水平PPFD值下,红白菜和塌棵菜中的抗坏血酸水平达到高值,分别是在正常PPFD (220 μmol∙m−2∙s−1)下的3.8倍和3.5倍。考虑到在幼叶的实验中LED是HPS的辅助光源,不能直接比较两次的实验结果;但可以推断高PPFD值对抗坏血酸的聚集有不利的影响,而低PPFD值能促进抗坏血酸的合成。
除此之外,他们还研究了a-生育酚的浓度随PPFD值的变化。当PPFD达到最小值时,在芥菜、红白菜以及嫩青生菜中能观察到显著的a-生育酚聚集。当PPFD增加到220 μmol∙m−2∙s−1及110 μmol∙m−2∙s−1时,塌棵菜中的a-生育酚聚集程度也明显增加。当PPFD达到545-μmol∙m−2∙s−1时,芥菜中的a-生育酚浓度达到220 μmol∙m−2∙s−1时的1.6倍。与之相反,此时红白菜和塌棵菜中的a-生育酚浓度明显低于PPFD处于220 μmol∙m−2∙s−1时的值。
Li与Kubota用远红光做主光源,并用生菜(Lactuca sativa L. “Red Cross”)探究了紫外线A(UV-A)、蓝光、绿光、红光以及远红外光等辅助光源对植物化学成分(总花青素、类胡萝卜素、叶绿素、总酚类化合物和抗坏血酸)以及植物形貌(生物质、辅助光源下茎的长度改变叶子、叶宽、叶长)的影响 [14] 。发现生菜叶中的类胡萝卜素浓度会受到光质的影响。在蓝色辅助光源照射下,叶黄素增加了6%~8%,在远红外光下却下降了12%~16%。在可见光区域可见到叶黄素在446 nm处有一个吸收峰,此时大量合成是为了保护植物在高能量的蓝光下的正常生长。然而,目前β-胡萝卜素含量增加的机制还尚不明确。此外,类胡萝卜素以及叶绿素的浓度在远红光作用下降低12%~16%。
2009年,闻婧等人研究了红蓝LED光照强度对生菜生长的影响,研究中使用了不同的红蓝LED光比例 [15] 。实验结果表明,相较于普通的FL照明,中心波长为660 nm的红光LED与中心波长为450 nm蓝光组合进行照明可以有效提高生菜的光能利用率,促进光合作用。实验发现最合适的红光与蓝光比例为8:1,在这种条件下,生菜的抗坏血酸含量最高,且其硝酸盐含量明显降低,得到了优秀的生理特性与食用品质。
Jang等人研究了光质(无光照,FL以及蓝光、绿光、黄光、红光LED)对蘑菇(Bunashimeji)生长的影响 [16] 。结果表明在蓝光LED下,麦角固醇的浓度达到最大值,而在红光LED下达到最小值。这表明光照强度及光质都能够影响维生素在植物体内的合成。
4. 食用品质的提升
糖分的含量与蔬菜的口味紧密相关,有很多研究已经证实光环境也会影响糖分的浓度。目前已使用红光LED作为辅助光源研究过诸多草本植物,包括白芥菜(Sinapis alba “Yellow mustard”),菠菜(Spinacia oleracea “Geant d’hiver”),芝麻菜(Eruca sativa “Rucola”),莳萝(Anethum graveolens “Mammoth”),欧芹(Petroselinum crispum “Plain Leaved”),青葱(Allium cepa “White Lisbon”)等 [17] 。实验中自然光(约300 μmol∙m−2∙s−1 PPFD)是主要光源。若自然光的PPFD值较低,则再补充提供每天12小时、PPFD强度为130 μmol∙m−2∙s−1的HPS辅助光照。在采样前三天阶段,用红光LED (638 nm)在05:00到10:00以及17:00到00:00的时间段内提供辅助照明。实验结果表明不同植物对红光LED的反应不同。在红光下,蔬菜中的抗坏血酸浓度明显增加;果糖和葡萄糖有显著聚集,蔗糖的变化却与此不同。在红光处理下的莳萝(Anethum graveolens Linn.)和欧芹(Petroselinum crispum (Mill.) Hill)中,能够观察到单糖(尤其是果糖和葡萄糖)含量的显著增加以及硝酸水平的降低。此外,蔬菜中碳水化合物的含量未见明显升高,而硝酸盐浓度或者升高(芥菜,芝麻菜,青葱)或者不变(菠菜)。
2009年张欢等人研究发现在红光处理下,萝卜芽苗菜淀粉含量达到最大值且显著高于FL对照组,其中可溶性糖也显著高于对照组 [18] ;同时还发现在红蓝光组合及蓝光处理下,下胚轴中可溶性蛋白含量高于其他光质处理。这说明光质影响高等植物的碳水化合物和蛋白质代谢,红光有利于碳水化合物形成,而添加蓝光有利于蛋白质形成。
2010年常涛涛等人研究了不同光谱能量分布对番茄幼苗生长发育的影响 [19] 。试验在南京农业大学农学院的AGRI-LED植物培育系统内进行,供试材料为“千禧”樱桃番茄品种。2008年2月6日浸种催芽,至出芽95%以上播种于营养钵(8 cm × 8 cm)中,培养基质为蛭石 + 草炭 + 黑土有机肥(1:2:2)。待长至两叶一心时置于6 种不同光谱能量分布的LED光源和对照镝灯下培养。调节光源与幼苗的距离,使光强均为320 μmol∙m−2∙s−1。每个处理30株,3次重复。处理30天后随机取样测量各项指标。结果表明蓝光处理的幼苗总可溶性糖、总游离氨基酸含量以及干样质量均显著高于其它处理;红蓝绿光组合处理的幼苗根系活力、总淀粉含量最高;红蓝光组合处理的叶片光合速率及可溶性蛋白含量最高而且有利于糖氮物质在叶、茎、根中的均衡分布。所以蓝光、红蓝组合光及红蓝绿组合光有利于樱桃番茄幼苗的生长发育并能降低能耗成本。
Samuoliene等人研究了光照强度对嫩青中蔗糖浓度的影响 [6] 。该实验使用LED提供了一种具有不同波峰(455 nm,638 nm,660 nm,以及735 nm)的混合光照,并和前面一样,在不同的光强下(545,440,330,220,以及110 μmol∙m−2∙s−1 PPFD)进行实验。实验表明,嫩青叶中的蔗糖聚集与PPFD值相关,当PPFD值降低时,蔗糖浓度也随之降低。然而,在不同品种的嫩青中,调节PPFD值造成的蔗糖浓度峰值变化也有所不同。在芥菜中,PPFD值降低,蔗糖的合成进度也放缓。嫩青生菜中的蔗糖浓度在PPFD值为545 μmol∙m−2∙s−1时达到最大值。相比之下,在红白菜中,蔗糖浓度达到峰值时的PPFD值为440 μmol∙m−2∙s−1,而在塌棵菜中为330 μmol∙m−2∙s−1。
在有关光质对植物生长与重要化合物合成的影响的研究中,许多实验使用了红光和蓝光。它们刚好位于叶绿素和光感受器的特定吸收谱内。另一个实验则使用黄光研究了芽菜(麦草(Triticum aestivum L. “Sirvinta”)的幼芽),大麦草(Hordeum vulgare L. “Luoke”)以及绿叶小萝卜(Raphanus sativus L. “Tamina”)) [9] [20] 。Urbonaviciute 等人研究了在用HPS做主光源,并使用黄色脉冲LED辅助照明(596 nm, 2.9 Hz, (250-ms“开”,100-ms“关”))时,生长期幼芽的糖类浓度。实验中光期为18小时,脉冲光的强度约为总PPFD值的一半,大约是35 μmol∙m−2∙s−1。研究表明在大麦草和小萝卜幼芽中,葡萄糖含量是对照组中的2~2.5倍。而在大麦草幼叶中,麦芽糖的含量则略微降低。虽说黄光可以抑制叶绿素的合成和叶绿体的形成,但根据这一实验中记录的单糖浓度数据,这种抑制效应不甚显著。
另一个实验研究了番茄中的脯氨酸浓度在五种不同光源(白光 LED (420~680 nm)作为对照,绿光LED (460 nm),红光LED (635 nm),和绿光LED (520 nm))照射下的变化 [12] 。结果表明光质显著影响了番茄幼苗中的脯氨酸水平。与白光相比,蓝光LED照射下的脯氨酸浓度在叶中和茎中为对照组的296%和127%。
菊苣酸味苦,会影响到植物的口感。Ouzounis等人研究了两种不同生菜(“Batavia”和“Lollo Rossa”)的次级代谢过程 [21] 。生菜生长在由自然光与HPS叠加作为主光源,蓝光LED (45 μmol∙m−2∙s−1 PPFD, 并改变辐射时间段)作为辅助光源的环境中。在06:00到08:00以及21:00至08:00的时间段内使用蓝光照射,可使菊苣酸的水平显著上升,这表明可能存在一种辐射的时间区间效应。
Sirtautas等人研究了生菜“Multigreen 3”中糖类浓度的变化 [22] [23] 。在该实验中,主光源为80~120 μmol∙m−2∙s−1 PPFD的自然光与90 μmol∙m−2∙s−1 PPFD的HPS的组合光源,辅助光源采用了15 μmol∙m−2∙s−1 PPFD的蓝光(455 nm与470 nm),蓝绿光(505 nm)以及绿光(535 nm) LED。蓝光(455 nm)照射下生菜中的水溶性单糖浓度高于其它组,其中蔗糖、葡萄糖、甘露糖和果糖的浓度分别是对照组的6倍、2.9倍、3.5倍以及1.5倍。虽然470 nm的蓝光与455 nm的蓝光波长差异不大,但在470 nm蓝光的作用下却没有明显的效应。此时,蔗糖、葡萄糖、甘露糖的浓度分别是对照组的1.8倍,2.3倍和3.3倍。换句话说,在蓝光波段内波长的微小变化就能够对蔗糖、葡萄糖、甘露糖和果糖的生物合成产生显著影响。绿光(535 nm)对蔗糖的合成没有影响。然而在绿光(535 nm)之下,葡萄糖和甘露糖的浓度却高于蓝光组(455 nm)。相比之下,蓝绿光(505 nm)对单糖浓度显然只有微小的影响。
5. 显色
蔬菜的颜色与其营养价值相关,研究表明颜色也受光质的影响 [7] 。生菜的种子在FL下发芽并生长十天,再用不同光质的光照射幼苗至第17天。之后生长期幼苗被移栽到温室中,并用太阳光和辅助荧光灯照射生长至第45天。实验发现第17天时蓝光下生菜幼苗中的花青素含量高于第10天时荧光灯下的幼苗(相对数值分别达到0.15和0.07)。这表明蓝光成分能显著增加生菜幼苗中的花青素浓度,该浓度在红蓝混合光下生长的幼苗中达到最大值(相对数值达到0.27)。然而,第45天时幼苗的花青素浓度(相对数值下降到0.10左右)低于第17天时。总得来说,在第45天时,FL对照组与任何光质的实验组相比,幼苗中的花青素浓度并无显著差别。这表明在第17天时观察到的光质效应难以维系。
2009年陈强等人研究了不同LED光源对番茄果实转色期品质的影响 [24] 。实验使用的光源为红(650 ± 5 nm)、蓝(440 ± 5 nm)、红蓝组合(红光:蓝光 = 3:1,灯的数量比)色制成的LED均匀分布的宽60 cm、长150 cm的平面光源,发白光的为普通日光灯。结果表明,红光处理下番茄果实番茄红素含量最高,显著高于对照和其他处理,但抗坏血酸含量最低。蓝光处理下番茄果实抗坏血酸含量、可溶性蛋白含量均显著提高。
Li与Kubota使用FL作为主光源,并以长波紫外线(373 nm)、蓝光(476 nm)、绿光(526 nm)、红光(658 nm)以及远红光(734 nm) LED为辅助光源,研究了红叶生菜在整个生长期中的颜色反应 [14] 。在长波紫外线和蓝光LED照射下,生菜中的花青素含量分别增长了11%和13%,而在远红光照射下则降低40%。类胡萝卜素(叶黄素与β-胡萝卜素)的浓度在蓝光下增长6%~8%,而在远红光下则降低12%~16%。辅助远红光LED照射下的生菜中,叶绿素浓度降低12%,而苯酚浓度在红光照射下则比对照组提升了6%。先前,Ninu等人证实了光质对花青素浓度有很大的影响,并且在番茄中,由于隐花色素蓝/紫外光感受器的反应,蓝光是调控花青素生物合成的最有效的波段之一。
除了以红叶生菜为实验对象,还有人研究了绿色卷心菜(Brassica oleracea Linnaeus) [25] 。具体来说,他们研究了不同的LED单色光(蓝色(470 nm),蓝绿光(500 nm),绿光(525 nm)以及红光(660 nm))作用下的绿色和红色卷心菜(“Kinshun”(绿叶品种)和“Red Rookie”(红叶品种))中的色素沉淀。在红色卷心菜中,叶内花青素的浓度大于等于全光质作用下的0.6 g∙m−2,同时红光照射下的卷心菜中该浓度达到最大值。一般来说,生物合成花青素的前体——查尔酮合成酶会在蓝光或短波紫外线的作用下减少。而目前并没有证据证明红光能促进花青素的合成。Miura和Iwata在1981年证实了在红光照射下,Polygonum hydropiper中的花青素浓度高于其处于其他波长的光照射时。并且,植物色素作为一种红光感受器可能在红色卷心菜内的花青素生物合成中发挥作用。
在一个对水果和蔬菜幼苗的研究中,实验人员用HPS作为主光源,并辅助以波长为455 nm、470 nm、505 nm和530 nm的LED照明,研究了杂交番茄“Manus”子一代、甜椒变种“Reda”子一代以及杂交黄瓜“Mirabelle”子一代中的叶绿素水平 [6] 。实验组的光照强度是,在自然光的基础上,加上总PPFD值为15 μmol∙m−2∙s−1的LED和总PPFD值为90 μmol∙m−2∙s−1的HPS照明,光期为18小时;对照组中则是在自然光的基础上,加上总PPFD值为110 μmol∙m−2∙s−1的HPS照明。实验结果表明,使用470 nm和530 nm的辅助光源时,黄瓜(Cucumis sativus Linn.)叶中的叶绿素水平显著提高 [26] 。此外,虽然在所有光质的试验组中,叶绿素水平均有所提升,然而辅助LED光源对叶绿素a与叶绿素b的相对比例并没有影响。在番茄幼苗中,叶绿素a与叶绿素b的浓度在470 nm LED的照射下均明显升高,这一波长的光也能显著增加辣椒(Capsicum annuum Linn.)叶中的光合色素水平。另外,在455 nm的光照组,叶绿素a和类胡萝卜素的浓度均显著升高。
与此相似,有人用太阳光(约80~120 μmol∙m−2∙s−1)与HPS(约90 μmol∙m−2∙s−1)作为主光源,并辅助以LED照明(约15 μmol∙m−2∙s−1):蓝光(455 nm和470 nm)、蓝绿光(505 nm)和绿光(535 nm),研究了“Multigreen 3”生菜幼叶中的叶绿素浓度 [22] 。大体上说,光合成能力随着叶绿素a与叶绿素b的比例的增加而提升。然而,在455 nm波长的蓝光下,这一比例有所下降,与此同时单糖浓度升高。对比之下,在470 nm波长的蓝光下,叶绿素a与叶绿素b的比例显著增加。但这是由叶绿素b浓度的降低而非叶绿素a浓度的升高造成的。用505 nm的蓝绿光照射能对光合色素造成明显影响,其中叶绿素a-叶绿素b和类胡萝卜素的浓度升高至对照组的1.2倍。
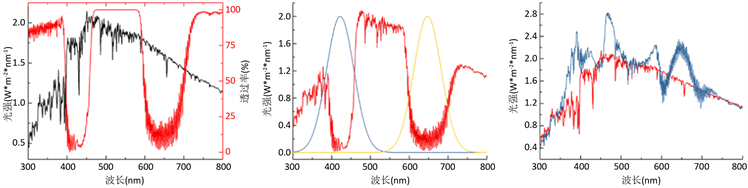 (a) (b) (c)
(a) (b) (c)
Figure 1. Quantitative lighting scheme using spectral filter film. (a) Actual solar curve and spectral filter characteristics. Black for the sun spectrum, the red for the Chinese University of Science and Technology Professor Liu team design and production of the spectral filter film. (b) Filtered sunlight curve and compensation LED light curve. The red line is the auxiliary LED light source illumination modeled by the sunlight, blue line and yellow line after passing through the spectral filter film. (c) The lighting environment designed for this paper. The blue line is the light environment line under this scheme. As the original control, the red line is the solar spectrum
图1. 使用分光膜的定量补光照明方案。其中(a)为实际太阳光曲线与分光膜滤波特性。黑色为太阳光谱(数据取自NASA官方),红色为中国科大刘文课题组设计制作的分光膜的光透过率。(b)为滤波后的太阳光曲线与补偿LED光曲线。红色线为通过分光膜之后的太阳光,蓝色线和黄色线为模拟的辅助LED光源照明光。(c)为本文设计下的光照环境。蓝色线为本文方案下的光照环境谱线,红色线则为太阳光谱作为原始对照。
6. 展望
本文讨论了有关光环境对植物次级代谢过程影响的最新研究。众所周知,特定分子的生物合成对一定波长的光激励敏感。由于这些实验中所用到的光刺激的波长、PPFD以及光期均有所不同,所以结果不能直接互相比较。即便使用了完全相同的光,植物的反应也将因其品种而异。尽管如此,如果能保证可重复性,光刺激仍有望在农业生产中帮助提高生产效率。
然而,这些研究并没有说明光刺激造成这些影响的原因,以及针对作物生长目标的代谢产物最优需求组合。以后的研究应着重于揭示种种差异背后的机理,并提出一套高效的光激励方法;在方法上有所突破以后,过去大自然中罕见甚至无法种出的高附加值作物都有望在人工植物工厂中生产出来。
从实验手段和方法上来看,这些研究普遍采用了主要光源(又称背景光源,例如日光、HPS等)配合辅助光源(又称对照光源,例如特定波长的LED)联合照明的解决方案,中科大刘文教授等人最近提出一种分光对照实验方案。采用特定光谱的滤波器(分光膜),将主要光源中的特定成分阻隔,然后配合该波段内的辅助光源照明,这种方法能去除主要光源对辅助光源的影响。在这种实验方案下,我们可明确主要光源的目的,即提供充分的背景光,保证植物生长的整体光环境;以及可明确辅助光源的目的,即提供特定波长照明,作为差异化的对照。
以太阳光做主光源,红蓝光做辅助光源为例,图1(a)描述了太阳光光谱和分光膜的滤光特性,图1(b)则描述了滤波后的太阳光曲线与补偿LED光曲线,图1(c)描述了此方案最终光环境。
基金项目
安徽省科技重大专项计划项目(16030701093)。
文章引用
张智森,徐景宏,张昕昱,王 通,刘 文. 光环境对植物次级代谢产物的影响
Effect of Light Environment on Plant Metabolites[J]. 农业科学, 2018, 08(03): 203-211. https://doi.org/10.12677/HJAS.2018.83033
参考文献
- 1. 高荣孚, 张鸿明. 植物光调控的研究进展[J]. 北京林业大学学报, 2002, 24(5): 235-243.
- 2. 刘江, 范广涵, 刘承宜. 改进实用型LED生物光源系列[J]. 应用激光, 2003, 23(3): 147-151.
- 3. 陈祥伟, 刘世琦, 王越, 刘景凯, 冯磊. 不同LED光源对乌塌菜生长, 光合特性及营养品质的影响[J]. 应用生态学报, 2014, 25(7): 1955-1962.
- 4. 陈娴, 等. 不同光质对韭菜营养品质的影响[J]. 山东农业大学学报(自然科学版), 2012, 43(3): 361-366.
- 5. Kozai, T., Fujiwara, K. and Runkle, E.S. (2016) LED Light-ing for Urban Agriculture. Springer, Singapore. https://doi.org/10.1007/978-981-10-1848-0
- 6. Samuolienė, G., Brazaitytė, A., Sirtautas, R., Novičkovas, A. and Duchovskis, P. (2011) The Effect of Supplementary LED Lighting on the Antioxidant and Nutritional Properties of Lettuce. International Symposi-um on Advanced Technologies and Management towards Sustainable Greenhouse Ecosystems: Greensys, 952, 835-841.
- 7. Johkan, M., Shoji, K., Goto, F., Hashida, S.-N. and Yoshihara, T. (2010) Blue Light-Emitting Diode Light Irradiation of Seedlings Improves Seedling Quality and Growth after Transplanting in Red Leaf Lettuce. HortScience, 45, 1809-1814.
- 8. Son, K.-H. and Oh, M.-M. (2013) Leaf Shape, Growth, and Antioxidant Phenolic Compounds of Two Lettuce Cultivars Grown under Various Combinations of Blue and Red Light-Emitting Diodes. HortScience, 48, 988-995.
- 9. Urbonavičiūtė, A., et al. (2009) Effect of Flashing Amber Light on the Nutritional Quality of Green Sprouts. Agronomy Research, 7, 761-767.
- 10. Kim, E.-Y., Park, S.-A., Park, B.-J., Lee, Y. and Oh, M.-M. (2015) Growth and Antioxidant Phenolic Compounds in Cherry Tomato Seedlings Grown under Monochromatic Light-Emitting Diodes. Horticulture, Environment and Biotechnology, 55, 506-513. https://doi.org/10.1007/s13580-014-0121-7
- 11. 刘晓英, 徐志刚, 常涛涛, 郭世荣. 不同光质LED弱光对樱桃番茄植株形态和光合性能的影响[J]. 西北植物学报, 2010, 30(4): 725-732.
- 12. Kim, K., et al. (2013) The Effect of Blue-Light-Emitting Di-odes on Antioxidant Properties and Resistance to Botrytis Cinerea in Tomato. Journal of Plant Pathology & Microbiology, 4, 203.
- 13. Samuolienė, G., et al. (2013) LED Irradiance Level Affects Growth and Nutritional Quality of Brassica microgreens. Cen-tral European Journal of Biology, 8, 1241-1249. https://doi.org/10.2478/s11535-013-0246-1
- 14. Li, Q. and Kubota, C. (2009) Effects of Supplemental Light Quality on Growth and Phytochemicals of Baby Leaf Lettuce. Environmental and Experimental Botany, 67, 59-64. https://doi.org/10.1016/j.envexpbot.2009.06.011
- 15. Jing, W., et al. (2011) Influence of Combined Lighting with Different Red and Blue LED on Photosynthetic Characteristics and Quality of Lettuce and Evaluation of Energy Consumption. Acta Horticulturae Sinica, 38, 761-769.
- 16. Jang, M.-J., Lee, Y.-H., Ju, Y.-C., Kim, S.-M. and Koo, H.-M. (2013) Effect of Color of Light Emitting Diode on Development of Fruit Body in Hypsizygus marmoreus. Mycobiology, 41, 63-66.
- 17. Bliznikas, Z., et al. (2012) Effect of Supplementary Pre-Harvest LED Lighting on the Antioxidant and Nutritional Properties of Green Vegetables. Acta Horticulturae, 939, 85-91. https://doi.org/10.17660/ActaHortic.2012.939.10
- 18. 张欢, 徐志刚, 崔瑾, 郭银生, 谷艾素. 不同光质对萝卜芽苗菜生长和营养品质的影响[J]. 中國蔬菜, 2009, 1(10): 28-32.
- 19. 常涛涛, 刘晓英, 徐志刚, 杨杨. 不同光谱能量分布对番茄幼苗生长发育的影响[J]. 中国农业科学, 2010, 43(8): 1748-1756.
- 20. 陈文昊, 等. LED光源对不同品种生菜生长和品质的影响[J]. 西北植物学报, 2011, 31(7): 1434-1440.
- 21. Ouzounis, T., Parjikolaei, B.R., Fretté, X., Rosenqvist, E. and Ottosen, C.-O. (2015) Predawn and High Intensity Application of Supplemental Blue Light Decreases the Quantum Yield of PSII and Enhances the Amount of Phenolic Acids, Flavonoids, and Pigments in Lactuca sativa. Frontiers in Plant Science, 6, 19. https://doi.org/10.3389/fpls.2015.00019
- 22. Sirtautas, R., et al. (2014) Growing of Leaf Lettuce (Lactuca sativa L.) under High-Pressure Sodium Lamps with Supplemental Blue, Cyan and Green LEDs. Zemdirbyste-Agriculture, 101, 75-78.
- 23. 王志敏, 宋非非, 徐志刚, 刘晓英, 杨杨. 不同红蓝LED光照强度对叶用莴苣生长和品质的影响[J]. 中國蔬菜, 2011, 1(16): 44-49.
- 24. 陈强, 等. 不同LED光源对番茄果实转色期品质的影响[J]. 农业工程学报, 25(5): 156-161.
- 25. Mizuno, T., Amaki, W. and Watanabe, H. (2009) Effects of Monochromatic Light Irradiation by LED on the Growth and Anthocyanin Contents in Leaves of Cab-bage Seedlings. 6th International Symposium on Light in Horticulture 907, Tsukuba, 15-19 November 2009, 179-184. https://www.actahort.org/books/907/907_25.htm
- 26. 段奇珍, 曲梅, 高丽红. 不同LED光源对黄瓜幼苗质量的影响[J]. 北方园艺, 2010(15): 125-128.