Hans Journal of Agricultural Sciences
Vol.
09
No.
07
(
2019
), Article ID:
31437
,
7
pages
10.12677/HJAS.2019.97084
Advances in Research on Chilling Stress Response and Molecular Mechanism of Cassava
Tuo Yi1, Juan Huang1, Wei Zhang1, Yong Song1,2*
1Horticulture and Landscape College of Hunan Agricultural University, Changsha Hunan
2Engineering Research Center of Potato, Changsha Hunan
Received: July 4th, 2019; accepted: July 19th, 2019; published: July 26th, 2019

ABSTRACT
Cassava is a tropical and subtropical plant. The low temperature seriously affects the geographical distribution, growth and yield of cassava. Temperature below 15˚C will inhibit the normal growth of cassava. The research and identification of chilled low temperature resistance of cassava are an important basis for the selection, breeding and cultivation of cold tolerance of cassava. 1) The mechanism of cassava response to low temperature stress was observed; 2) Molecular response of plants under low temperature stress; 3) The molecular biology research on cassava low temperature tolerance was summarized in recent years, aiming to provide reference for the research on low temperature tolerance of cassava.
Keywords:Cassava, Cold Tolerance, Molecular Mechanism, Research Progress
木薯低温胁迫响应及分子响应研究进展
易拓1,黄娟1,张玮1,宋勇1,2*
1湖南农业大学园艺园林学院,湖南 长沙
2湖南省马铃薯工程技术研究中心,湖南 长沙
收稿日期:2019年7月4日;录用日期:2019年7月19日;发布日期:2019年7月26日

摘 要
木薯是热带亚热带植物,低温严重影响木薯的地理分布、生长发育及产量,温度低于15℃就会抑制木薯的正常生长。木薯耐低温性研究与鉴定是木薯耐寒性选(育)种、引种和栽培的重要基础,本文从1) 木薯响应低温胁迫机理;2) 低温胁迫下植物的分子响应;3) 对近年来木薯低温耐性方面的分子生物学研究进行总结,旨在为木薯的低温耐性研究提供参考。
关键词 :木薯,低温胁迫,分子机理,研究进展

Copyright © 2019 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
木薯(Manihot esculenta Crantz)起源于非洲和南美洲的热带气候区。它是木薯属100多个种中唯一具有经济栽培价值的物种,它具有优良的生物学特性,可以在贫瘠土地上生长良好,光合作用效率高,淀粉含量丰富(鲜薯中的淀粉含量为30%,干薯片中淀粉含量为70%)。木薯以多种方式使用,为全世界7亿人提供生存的粮食,被称为“地下粮仓”,缓解了全球的粮食危机。木薯具有耐旱、耐贫瘠、抗病虫害、种植成本低廉,种植技术简单等特点 [1] 。木薯主要分布在华南地区,总面积约60万hm2,特别在广西、广东、海南和云南四省,同时在贵州、福建、湖南、江西等省(区)也有一定的种植面积,我国年产鲜薯约800万吨左右,然而,由于中国对木薯的需求强劲,目前的产量远远不能满足需求,每年需要大量进口木薯来满足需求,进口总数量高达1056万吨达到30亿美元(2014年) [2] 。木薯生长在年平均气温 > 20℃的区域,最合适在25℃~28℃的高地。当生长温度小于15℃时,木薯的正常生长受到抑制,持续低温将会导致木薯异常死亡。只有在海南、广西和广东等温暖的热带地区才能较好地生长。在中国广大的亚热带和温带地区,低温胁迫是抑制木薯生长发育的重要因素之一 [3] 。同时由于中国热带地区处于世界热带地区的北边缘,春季和冬季的低温对其正常生长有很大的负面影响,当木薯正常生长所需的条件得不到满足时,就会导致作物的生长抑制,木薯减产,严重的还会造成木薯死亡。在中国的热带和亚热带地区,共有100万hm2左右的土地适合开展木薯种植工作。但是,这些土地上正在种植着其他作物,木薯种植不可能有多余的土地。为了增加中国木薯栽培面积,提高其对低温天气的适应性,选育耐低温的木薯品种,使其适合在我国偏北地区种植,扩大适宜的木薯种类,增加木薯的经济效益,对发展我国木薯产业具有深远的意义。
2. 木薯响应低温胁迫机理
2.1. 木薯低温胁迫下的形态特征
在低温胁迫下,形态特征的变化是植物受到低温伤害最直观的表现,轻则植物生长缓慢、萎焉、黄化、产量下降等问题 [4],重则使植株叶片明显褐变,出现脱水现象,组织柔软并萎焉皱缩 [5] 。木薯通常在每年11月~12月左右收获,而此时部分木薯栽培地区温度较低(3℃~12℃)如:江西省、湖南省等。植物受到低温伤害部位最先在叶片、茎杆部位表现,广西木薯所俞奔驰等 [6] 根据茎杆上芽眼死亡率和叶片受害状况划分级:0级:木薯正常生长不受影响;1级:木薯的上部有黄化,四分之一的芽眼腐烂坏死;2级:四分之一~二分之一的芽眼腐烂坏死,大部分的叶片发黄:3级:二分之一~四分之三的芽眼腐烂坏死,全部叶片变枯;4级:大于四分之三的芽眼都坏死,叶片全部死亡掉落。
2.2. 木薯在低温胁迫下的生理生化变化
低温胁迫下植物的生理生化变化主要体现在:叶绿素合成受阻、光合酶活性收到抑制,使得光合速率下降 [7]、细胞膜系统受损、体内的各种代谢发生紊乱,体内的渗透物质和水含量发生改变等。与植物低温胁迫有关的生理生化指标一般分为三类:一是与光合能力相关的叶绿素含量 [8]、PSII的结构和功能 [9] 等;二是与细胞膜相关指标,如低温半致死温度 [10]、相对电导率、MDA [11]、SOD等保护酶活性 [12];第三种是渗透调节相关物质,如可溶性糖、Pro、无机离子等 [13] 。
2.2.1. 木薯光合能力与木薯耐寒性的关系
叶绿素是光合作用中最重要的光合色素之一,主要参与光能的吸收和转换。虽然植物光合能力与植物对低温的耐性没有直接联系,但光合作用中的酶促反应对温度要求很高,低于4℃或高于40℃ [14] 均会抑制光合作用的正常运行。广西大学黄秋凤等 [15] 等发现两个木薯品种的幼苗中叶绿素含量随着温度的下降和时间的延长而下降。周玉飞 [16] 同样在木薯品种SC124中得到类似的结果,发现通过低温适应的木薯可延缓叶绿素的降解。
随着叶绿素荧光测定技术的发展,各种叶绿素荧光参数作为判断植株耐寒强弱的指标,其中PSII最大光能转效率(Fv/Fm)和实际光能转化效率(ΦPSII)最常见。在木薯叶绿素荧光参数研究中,中国热带农科院安飞飞等 [17] 发现木薯在5℃低温胁迫下,叶绿素荧光参数如ΦSPII,Fv/Fm显著下降,由于低温胁迫使PSII反应中心失活进而天线色素原初捕光和传递电子的能力减弱, 最终导致木薯叶片光合效率的降低。
2.2.2. 木薯细胞膜相关生理指标与木薯耐寒性的关系
植物细胞膜能较快地表现植物在低温胁迫下各种生理代谢变化,温度下降,细胞膜从液相转变成凝胶相,导致膜的形状和膜厚度改变以及膜的选择透过性变差,膜上相关酶结构及酶系统发生改变,最终导致膜系统代谢发生紊乱。
丙二醛(MDA)是一种膜脂过氧化产物,对膜系统危害很大,同时具有降低抗氧化物含量、抑制细胞保护酶活性等不利影响。南昌大学的梁荣 [18] 表明,与25℃ (CK)相比,不同低温胁迫下木薯幼苗的MDA含量发生了变化,15℃、10℃、5℃胁迫下,MDA含量分别增加11.4%、25.3%、35.19%,表明木薯叶片膜系统在5℃胁迫处理下受损较大。
具有清除多余自由基功能的活性酶如过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)等。海南大学康冬鸽等 [19] 等对两个木薯品种组培苗在不同低温胁迫下保护酶活性变化。结果表明:随着温度降低,其SOD酶活性都在减少,但POD酶与CAT酶活性表现为先增强后减弱的情况。
2.2.3. 渗透调节物质与木薯耐寒性的关系
植物处于极端环境时,植物会发生不同程度的脱水反应。渗透调节物质对防止植物脱水起到很大的作用,其中以可溶性蛋白和脯氨酸二者研究较多。可溶性蛋白含量的增加可以促进结合水的产生,从而减少逆境造成的损害。脯氨酸是一种亲水性有机溶剂,与细胞水势呈负相关,与植物耐寒能力成正相关。仲恺农业工程学院尹彩霞等 [20] 通过对研究5个木薯品种对低温的响应,认为木薯各生理指标随着冷胁迫程度加剧而变得愈发严重,其中脯氨酸含量在低温处理前两天小范围波动,变化趋势不明显,从第三天开始,脯氨酸变化呈一定规律。
3. 低温胁迫下植物的分子响应
暴露于低温胁迫之后,植物产生一套感知和传导信号的途径,同时产生响应变化以增强自身的抗低温的能力。植物低温耐性是分子水平上对低温环境所产生的应答、转导低温信号,调控应答和抵御基因的表达综合作用的结果 [5] 。
3.1. 低温传导信号途径
低温反应途径主要由低温信号、低温信号的传递、胞内第二传递信使、转录因子、功能基因等成分组成。植物中抗逆转录因子,包括CBF、bZIP、MYC/MYB、WRKY和NAC等。目前对低温信号转导途径的研究可分为:ABA非依赖和ABA依赖信号通路。
3.1.1. ABA非依赖途径
目前,CBF (C-repet (CRT)-binding factors)/DREB依赖性信号传导途径是主要的传递途径,属ABA非依赖途径。CBF1、CBF2、CBF3和CBF4是目前的研究热点。CBF1、CBF2和CBF3同属于一小蛋白家族,且CBF2对CBF1、CBF3负调控。在拟南芥CBF调控路径中,ICE1 (inducer of CBF expression 1)位于CBF途径的上游,属于bHLH类转录激活因子,与CBF成员特异性结合之后,将信号传递到下游,调控低温相关基因。
转录因子CBF1/DREB1B或CBF3/DREB1A通过与靶基因启动子区CRT/DRE顺式作用元件作用,调节下游相关基因,如COR15a、COR78a等,来提高植物对低温的耐性及抗性,即(图1-①)中的ICEs-CBF-COR通路。除了CBF通路外,还存在ROS-Bzip-CRT/DRE和Dehydration-MYC/MYB-MYCRE/ MYCRB两条通路(图1-②③)。
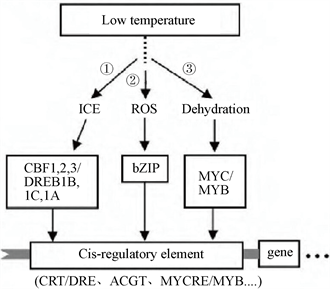
Figure 1. ABA-independent low-temperature signal transduction pathway [24]
图1. ABA非依赖型低温信号转导途径 [24]
3.1.2. ABA依赖途径
植物激素ABA不仅在种子萌发、休眠、气孔开闭等生理过程中起重要作用,而且还对植物应对逆境条件起重要的调节作用,主要表现是,ABA可以在逆境下促进大多数应激反应基因的表达 [21] 。植物体ABA依赖型的信号途径(图2)中,bZIP类及DREB2B、DREB2A对ABA信号产生响应。CBF家族中,CBF4的表达和功能受ABA调控,通过与CBF调节子中CRT/DRE元件的结合,启动下游基因的表达(图2-④)。在小麦、胡杨和玉米等植物中均发现了类似的COR基因及信号转导机制 [22] 。其中bZIP类转录因子可识别一些ABA诱导基因的启动子区中ACGT序列(图2-⑤)。NAC类转录因子也参与依赖型低温信号转导途径。
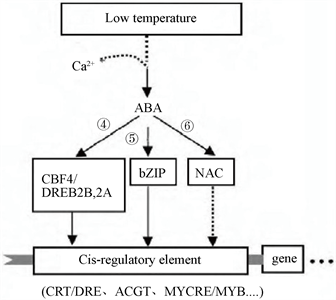
Figure 2. ABA-dependent low-temperature signaling pathway [24]
图2. ABA依赖型低温信号传导途径 [24]
3.2. 低温相关基因的表达产物
植物在冷胁迫下,直接参与抗逆性反应的基因被诱导表达,它们的表达产物主要为调控蛋白和功能蛋白两类。
调节蛋白与下游低温基因互作,调控基因的表达及其产物的量。主要包括各种蛋白激酶:如MAP激酶、SOS激酶、PLC激酶,以及bZIP类、MYB类、CBF类、NAC类和WRKY类等多种转录因子。
功能蛋白可以直接参与植物对逆境的反应,包括各类渗透调节分子、脱水素和抗性相关蛋白等。渗透调节分子通过积累代谢物质,从而增加植物的保水能力,如水稻的OsTPP1基因和OsTPP2基因等 [23] 。脱水素是其中的最大一类多肽家族,主要包括COR15a、COR47、COR6.6、COR78/RD29和LED蛋白等,其中COR15a的表达产物可通过减少膜结构的损害程度,使植物对低温的耐性提高。
除了调节蛋白和功能蛋白外,植物体中还有其他蛋白可以参与低温响应过程,例如膜结构上的通道蛋白、离子转运的载体和氧自由基清除的蛋白等,两者都可以直接或间接地增加植物对低温的耐受性 [24] 。
4. 木薯低温耐性在分子生物学方向的研究进展
近年来,随着分子生物学技术和测序技术的发展,木薯耐寒性研究在分子水平取得了重要进展。国内外研究人员逐渐将木薯耐低温性研究从常规的生理生化研究转向基因组学研究,如转录组学研究、蛋白组学研究等,对木薯低温信号传递网络、基因调控、耐性蛋白合成等进行较多研究,为发现木薯耐寒性相关基因和分子标记辅助育种 [25] 等提供低温耐性的研究基础。
在木薯转录组学研究中,南昌大学施超富 [26] 通过高通量测序技术研究木薯品种SC8和其同源四倍体在低温胁迫下的全基因组转录组图谱,筛选出木薯铁蛋白基因(MeFer)等多个可能与木薯耐寒相关基因,并将MeFer基因从木薯中克隆出来。中国热带农业科学院曾长英 [27] 等通过实时定量PCR分析了四种低温胁迫下miR395abcd与其靶基因ATRX在木薯品种C4和SC124上的差异表达情况,同时靶基因引物设计在上游、结合区、结合区边缘三个不同位置,结果显示:不同低温处理和引物位置的表达量都不相同,并且miR395abcd的表达量在两个品种中完全相反,且其上调表达有利于减轻低温伤害。海南大学杨子等 [28] 在曾长英的基础上,通过miRNA测序和生物信息学找到其靶基因,找到miRNA-novel4并作为研究对象,运用荧光定量PCR技术,验证了miRNA-novel4与靶基因mRNA之间互相抵抗的关系,用5’RACE技术进一步验证了两者的负调控关系和启动子克隆技术对其表达和剪切模式和启动子区的序列特征进行了分析。证明大幅度响应调控干旱和低温,说明miRNA-novel4可能参与响应并调控干旱和低温胁迫的生理过程。海南大学周玉飞 [29] 等,以木薯品种SC124和C4为材料,低温处理下四个靶基因和七个低温相关miRNA进行定量和功能分析。低温处理后,七个miRNA均表达,其中miRNA10455125和miRNA3747522两个小RNA的靶基因在二者间具有差异表达,将两个miRNA和他们的靶基因进行定量表达发现:靶基因和miRNA之间是明显的负调控。
在蛋白组学研究中,沈婕等 [30] 以木薯主栽品种为材料,低温处理24 h后对幼嫩叶片及顶端提取蛋白质后进行非标记定量蛋白组学分析(Label free),鉴定分析了在低温胁迫和正常处理下的木薯生理表型以及对差异蛋白质的影响。结果发现,与对照相比,低温处理下的木薯叶片呈现微卷,褶皱的状态。此外,差异表达的蛋白质共计1140个,其中上调蛋白81个,下调蛋白1059个,用GO分析和KEGG分析发现差异蛋白质主要涉及能量代谢、RNA代谢、氨基酸代谢、信号调节和糖代谢等代谢途径。与此同时,黏着连接、烟碱和烟酰胺代谢、ABC转运蛋白等重要通路也发生了显著变化,表明了它们在木薯抗寒过程中发挥了重要作用。在基因方面,MeHDS09 [31]、MeSnRK2-1 [32]、MeTCP4 [33]、MeTPS1 [34]、MeTPS7 [35]、CBF1和CBF2 [36] 等基因基于全基因组数据库,采用RT-PCR获得基因,对其进行qRT-PCR验证,判断其可能对低温等逆境起作用。
基金项目
现代农业产业技术体系建设专项资金资助项目(CARS-11-HNSY)。
文章引用
易 拓,黄 娟,张 玮,宋 勇. 木薯低温胁迫响应及分子响应研究进展
Advances in Research on Chilling Stress Response and Molecular Mechanism of Cassava[J]. 农业科学, 2019, 09(07): 569-575. https://doi.org/10.12677/HJAS.2019.97084
参考文献
- 1. 王惠君, 王文泉, 李文彬, 等. 木薯的抗寒性及北移栽培技术研究进展综述[J]. 热带作物学报, 2016, 37(7): 1437-1443.
- 2. 张玮, 易拓, 唐维, 等. 木薯耐寒性种质资源及其鉴定指标的筛选与综合评价[J]. 热带作物学报, 2019, 40(1): 1-10.
- 3. 张玮, 易拓, 宋勇. 木薯抗寒性响应机制的研究进展[J]. 中国园艺文摘, 2017, 33(9): 70-76.
- 4. 乌凤章, 王贺新, 徐国辉, 等. 木本植物低温胁迫生理及分子机制研究进展[J]. 林业科学, 2015, 51(7): 116-128.
- 5. 许英, 陈建华, 朱爱国, 等. 低温胁迫下植物响应机理的研究进展[J]. 中国麻业科学, 2015, 37(1): 40-49.
- 6. 俞奔驰, 李军, 盘欢, 等. 木薯寒冻害等级划分指标研究[J]. 安徽农业科学, 2011, 39(15): 9026-9028.
- 7. 郁万文. 银杏抗寒机理及种质资源抗寒性评定的初步研究[D]: [博士学位论文]. 南京: 南京林业大学, 2008.
- 8. 王晶, 徐志英, 盛云燕. 低温对绿萝幼苗叶片氮素及叶绿素含量的影响[J]. 现代农业科技, 2011(15): 208-209.
- 9. 孙鲁龙, 耿庆伟, 邢浩, 等. 低温处理葡萄根系对叶片PSII活性的影响[J]. 植物学报, 2017, 52(2): 159-166.
- 10. 李吉涛, 谢伟玲, 柴胜丰, 等. 三种金花茶低温半致死温度研究[J]. 北方园艺, 2016(6): 59-63.
- 11. 史红梅, 张海燕, 杨彬, 等. 低温胁迫对高粱幼苗MDA含量、SOD和POD活性的影响[J]. 中国农学通报, 2015, 31(18): 74-79.
- 12. 刘伟, 曲凌慧, 刘洪庆, 等. 低温胁迫对葡萄保护酶和氧自由基的影响[J]. 北方园艺, 2008(5): 21-24.
- 13. 王立梅. 不同品种白掌对低温胁迫的生理响应及抗寒性评价[D]: [硕士学位论文]. 重庆: 西南大学, 2015.
- 14. Liu, X.G., Xu, H., Zhang, J.Y., et al. (2012) Effect of Low Temperature on Chlorophyll Biosynthesis in Albinism Line of Wheat (Triticum aestivum) FA85. Physiologia Plantarum, 145, 384-394. https://doi.org/10.1111/j.1399-3054.2012.01604.x
- 15. 黄秋凤, 罗兴录, 王春莲, 等. 低温胁迫对木薯幼苗生理特性的影响[J]. 中国农学通报, 2010, 26(17): 172-177.
- 16. 周玉飞, 曾长英, 陈新, 等. 低温驯化对木薯耐寒性形态、生理特性的影响[J]. 热带农业科学, 2011, 31(6): 31-36.
- 17. 安飞飞, 李庚虎, 陈霆, 等. 低温胁迫对木薯叶片叶绿素荧光参数及PSII相关蛋白表达水平的影响[J]. 湖南农业大学学报(自然科学版), 2014, 40(2): 148-152.
- 18. 梁荣. 华南205木薯组织培养及低温抗性研究[D]: [硕士学位论文]. 南昌: 南昌大学, 2013.
- 19. 康冬鸽, 李瑞梅, 胡新文, 等. 低温胁迫下木薯几种保护酶活性变化及其与耐寒性的关系[J]. 热带作物学报, 2009, 30(7): 908-911.
- 20. 尹彩霞, 尧瑞霞, 乔爱民. 5个木薯品种对低温胁迫的响应及其抗寒性评价[J]. 广东农业科学, 2012, 39(11): 30-33.
- 21. Vishwakarma, K., Upadhyay, N., Kumar, N., et al. (2017) Abscisic Acid Signaling and Abiotic Stress Tolerance in Plants: A Review on Current Knowledge and Future Prospects. Frontiers in Plant Science, 8, 161. https://doi.org/10.3389/fpls.2017.00161
- 22. Kobayashi, F., Ishibashi, M. and Takumi, S. (2008) Transcriptional Activation of Cor/Lea Genes and Increase in Abiotic Stress Tolerance through Expression of a Wheat DREB2 Homolog in Transgenic Tobacco. Transgenic Research, 17, 755. https://doi.org/10.1007/s11248-007-9158-z
- 23. Shima, S., Matsui, H., Tahara, S., et al. (2010) Biochemical Characterization of Rice Trehalose-6-Phosphate Phosphatases Supports Distinctive Functions of These Plant Enzymes. Febs Journal, 274, 1192-1201. https://doi.org/10.1111/j.1742-4658.2007.05658.x
- 24. 计淑霞, 戴绍军, 刘炜. 植物应答低温胁迫机制的研究进展[J]. 生命科学, 2010, 22(10): 1013-1019.
- 25. 陈新, 曾长英, 王文泉. 木薯分子标记辅助育种技术研究进展[J]. 分子植物育种, 2015, 13(8): 1890-1894.
- 26. 施富超. 木薯Ferritin基因功能分析[D]: [硕士学位论文]. 南昌: 南昌大学, 2018.
- 27. 曾长英, 周玉飞, 彭明. miR395abcd与其靶基因ATRX在不同耐寒木薯品种中对低温响应的差异性分析[J]. 基因组学与应用生物学, 2015, 34(11): 2441-2447.
- 28. 杨子. 木薯低温和干旱胁迫响应miRNA-novel4的克隆、表达和启动子研究[D]: [硕士学位论文]. 海口: 海南大学, 2013.
- 29. 周玉飞. 木薯低温诱导miRNA及靶基因的功能分析[D]: [硕士学位论文]. 海口: 海南大学, 2011.
- 30. 沈婕, 李淑霞, 彭明. 木薯响应低温胁迫差异蛋白质的功能分析及鉴定[J]. 分子植物育种, 2019(4): 1121-1129.
- 31. 王树昌, 于晓玲, 李淑霞, 等. 木薯MeHDS09基因克隆及其对逆境信号的响应[J]. 热带生物学报, 2017, 8(4): 409-414.
- 32. 颜彦, 丁泽红, 铁韦韦, 等. 木薯MeSnRK2-1基因克隆及表达分析[J]. 分子植物育种, 2018, 16(15): 4839-4844.
- 33. 雷宁, 李淑霞, 彭明. 木薯MeTCP4转录因子的克隆、表达分析及植物表达载体的构建[J]. 分子植物育种, 2018, 16(5): 1517-1523.
- 34. 丁泽红, 付莉莉, 吴春来, 等. 木薯MeTPS1基因克隆、表达及生物信息学分析[J]. 江苏农业科学, 2018, 46(9): 28-33.
- 35. 丁泽红, 付莉莉, 吴春来, 等. 木薯MeTPS7基因克隆及其在非生物胁迫下的表达分析[J]. 分子植物育种, 2018, 16(7): 2085-2093.
- 36. 翟瑞宁. 木薯抗寒基因CBF1、CBF2的克隆和差异表达分析[D]: [硕士学位论文]. 南宁: 广西大学, 2016.
NOTES
*通讯作者。